Hypersementose og endodontiske implikasjoner
Hovedbudskap
Sementpåleiring på rotoverflaten er en normal fysiologisk prosess som tiltar med alder.
Årsaksfaktorene til sementdannelse utover fysiologiske behov er ikke fullstendig kjent.
Hypersementose kan skape utfordringer for endodontisk behandlingsplanlegging og gjennomføring, noe som igjen kan påvirke behandlingsutfall.
Det finnes lite informasjon om endodontisk sykdom og behandlingsresultat på rotfylte tenner med hypersementose.
Hypersementose er forbundet med lokale og systemiske faktorer, men etiologien er ikke godt kartlagt. Vanskeligheter med å bedømme røntgenologisk tykkelse på sementlaget ved hypersementose, vil direkte kunne påvirke beslutning om renselengde og apikalavstand. Endodontisk behandling av hele kanalens lengde blir dermed utfordret. Tenner med hypersementose viser seg å ha varierende grad av forsnevringer i kanalsystemet, apikale resorpsjoner, samt irregulariteter og kompliserte forgreninger i apikalområdet. Rotsementen er også utsatt for bakteriell vekst på grunn av et omfattende nettverk av lakuner, og tenner med hypersementose kan derfor være mer resistente mot endodontisk behandling. Det er lite tilgjengelig informasjon om forekomst av endodontisk sykdom og behandlingsresultat på tenner med hypersementose. Denne artikkelen gir en oversikt over temaet hypersementose, og belyser endodontiske problemstillinger knyttet til dette.
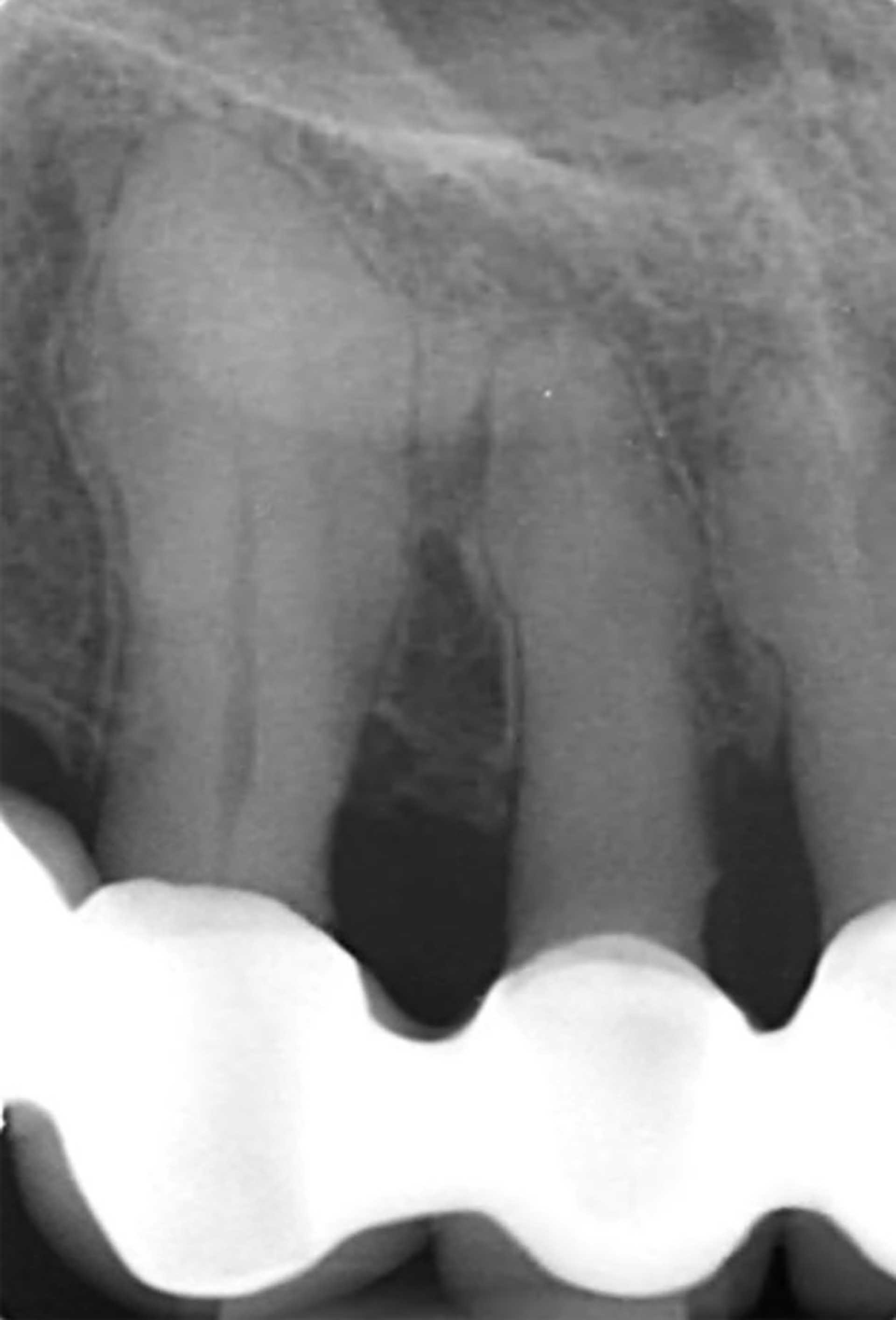
Figur 1. Røntgenbilde som viser ulike grader av hypersementose i overkjevens front.
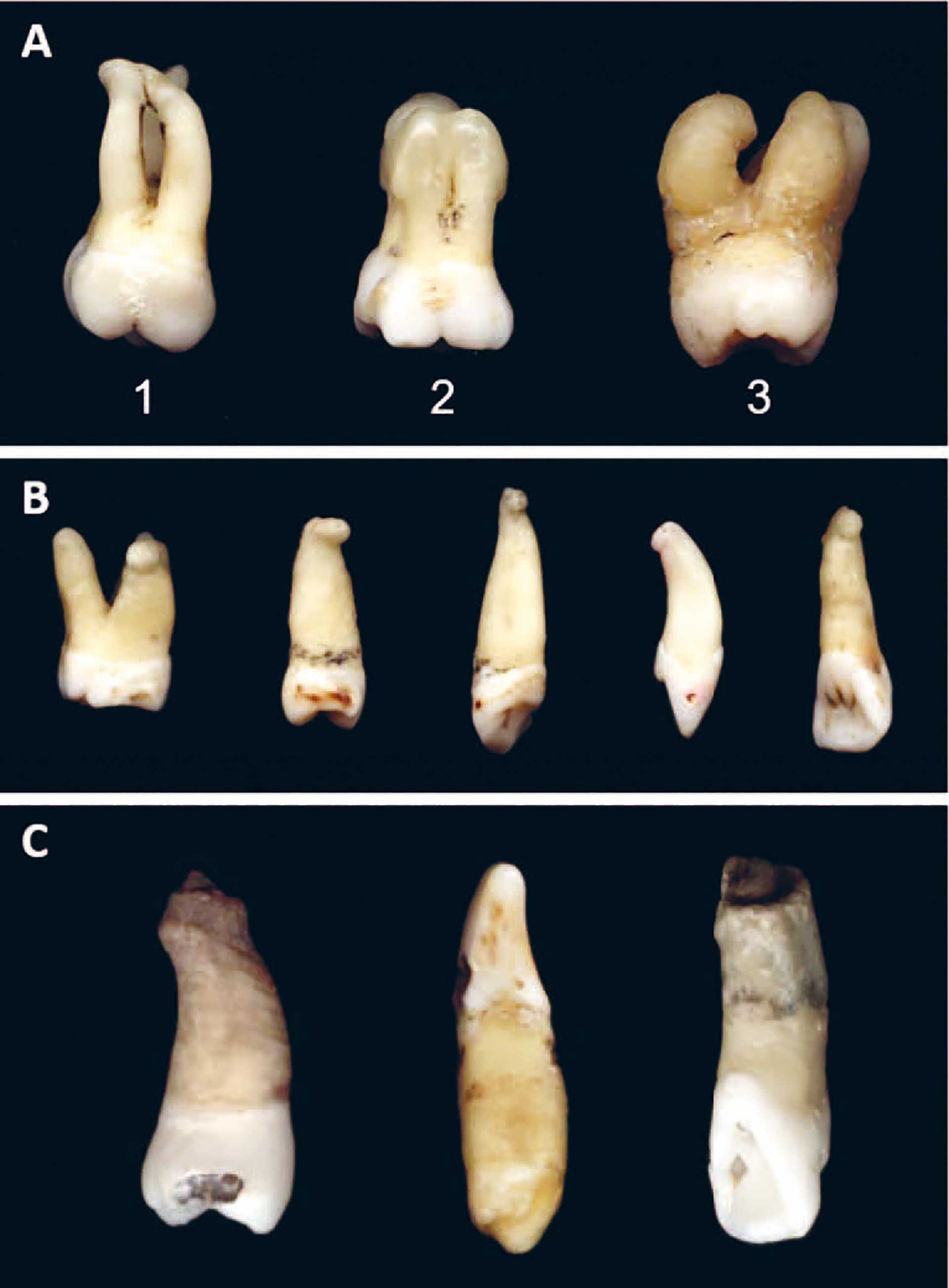
Figur 2. Makroskopiske bilder av tenner med forskjellige former for hypersementose: A: klubbeform hypersementose (1) mild, (2) moderat, (3) alvorlig grad. B: fokal eller lokalisert hypersementose. C: sirkulær hypersementose (gjengitt fra referanse 5, CC BY 4.0 license).
Sement er et mineralisert vev som dekker hele rotoverflaten fra emalje-sementgrensen til rotapeks. Sementens hovedfunksjon er å beskytte roten og binde den til beinet ved hjelp av kollagene fibre. Rotsement skiller seg fra beinvev ved at den er et avaskulært vev som ikke blir remodulert, og som derfor øker i tykkelse med tannens alder [1]. I tillegg er sement en komponent i periodontalligamentet som kan tilpasse seg funksjonelle krav, og tykkelsen på sementen gjenspeiler påleiring gjennom ulike faser av tannens levetid [2].
Hypersementose karakteriseres ved sementdannelse utover fysiologiske behov [3], men det eksisterer ingen kvantitative mål for å skille mellom fysiologisk avsetning av sement og økt avsetning forbundet med hypersementose [4] [5].
Hypersementose, eller sementhyperplasi, er en ikke-neoplastisk tilstand hvor overflødig sement blir avsatt på eksisterende rotsement. Denne tilstanden er av idiopatisk natur, men forbindes med en del lokale og systemiske faktorer [6]. Fortykning av sementlaget kan enten involvere hele rotoverflaten, eller den kan ha en mer nodulær eller oppsvulmet form som ofte er lokalisert til den apikale delen av roten [7] [8] (figur 1 og 2).
Økt sementdannelse på rotoverflaten, utover grensen for normal funksjon, fører til fortykning av rotens anatomi med makroskopiske formforandringer [9]. Forekomsten av hypersementose er ikke beregnet, men er blitt estimert til å ligge mellom 3,8% og 8,4% [10]. Hypersementose forekommer ofte på premolarer, og ofte symmetrisk i kjevene. Det er vist at hypersemetose forekommer oftere i underkjeven (68,2%) enn i overkjeven (31,8%) [7] [8].
Hypersementose – histologi og mekanismer
Hypersementose skyldes økt aktivitet i sementoblastene med påleiring av nye sementlag. Fortykning av sement er en rytmisk prosess. Etter påleiring av et nytt lag blir det forrige umineraliserte laget mineralisert. Presement er det ytterste umineraliserte laget [9]. Dette gir opphavet til den klassiske strukturen med inkrementallinjer som gjenspeiler den rytmiske prosessen (figur 3).
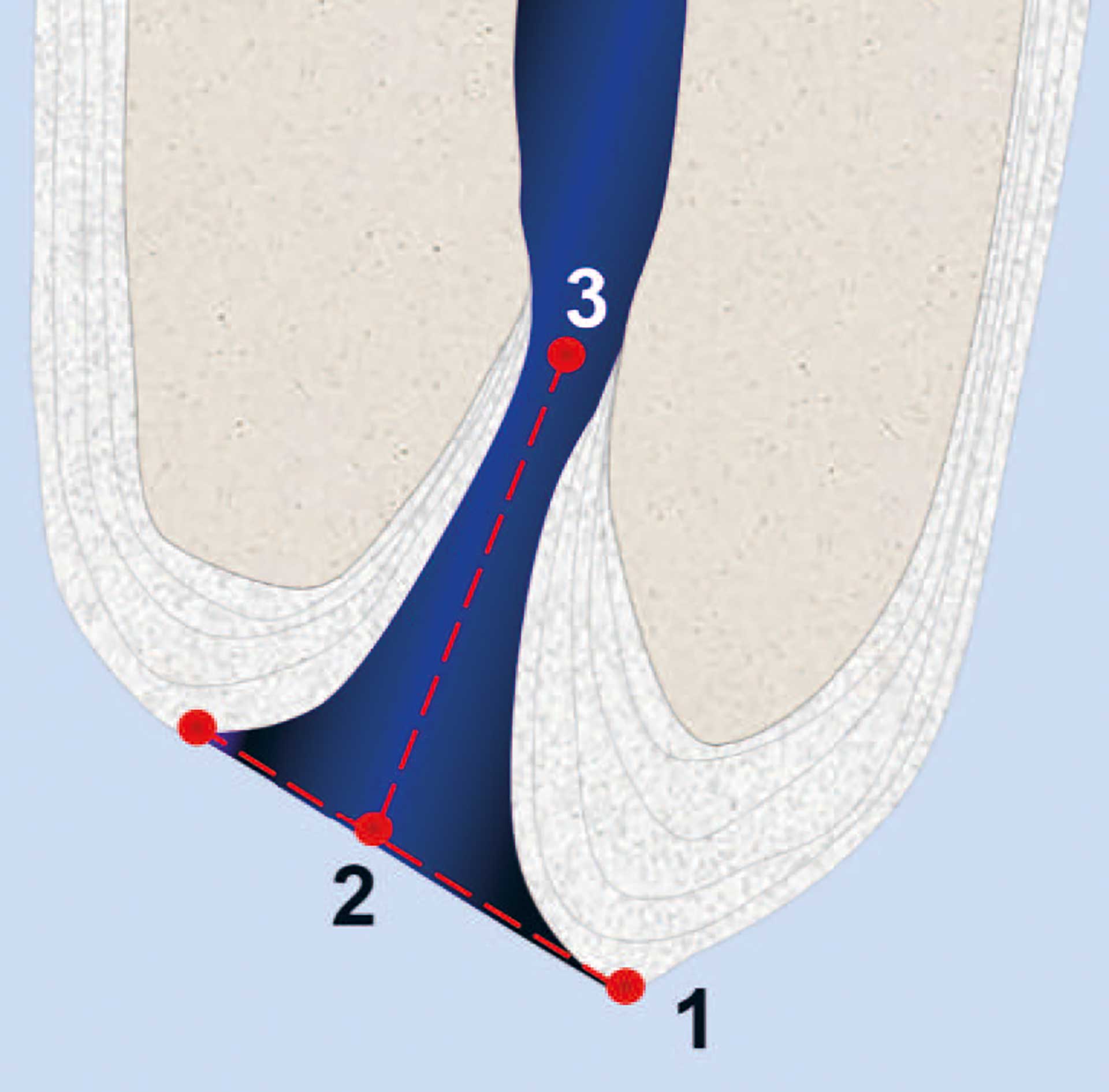
Figur 3. Anatomiske strukturer i apikalområdet: 1: røntgenologisk apeks; 2: foramen apikale (major) og 3: den apikale konstriksjonen (foramen apikale minor) som representerer overgangen hvor pulpavevet slutter og periodontalt vev begynner. Linjen som er trukket gjennom punkt 2 blir ofte betegnet som anatomisk apeks. Sementpåleiringer i apikalområdet, som tiltar ved økende alder, vil endre de anatomiske forholdene.
Membranproteiner på sementoblastenes overflate er koblet til komponenter av ekstracellulær matriks. Transmembrane proteiner, såkalte integriner, er festet på proteiner i cytoskjelettet internt for å gi stabilitet og bevegelighet til cellene. Krefter som fører til bevegelse i periodontale fibre og andre komponenter i den ekstracellulære matriks vil deformere sementoblastenes integriner i cytoskjelettet. Deformasjon av cytoskjelettet kan gi cellulært stress og frigivelse av mediatorer som fører til økt syntese av sementmatriks på rotoverflaten. Hypersementose kan derfor være en funksjonell respons på periodontale krefter (9]. En kan tenke seg at dette er kroppens måte å gi overbelastede tenner større festeareal for bedre distribusjon av okklusale krefter. Økt areal av roten som er omringet av bein spiller en stor rolle i samspillet mellom tann og krefter som påvirker den, selv i tilfeller med manglende antagonist hvor okklusale krefter er små. Disse faktorene kan kanskje forklare hvorfor det er 2 typer sement, nemlig acellulær og cellulær sement. Terminologien acellulær sement benyttes når man refererer til sement uten sementocytter, men både acellulær og cellulær sement er dekket med et sementoblastlag på overflaten (4].
Påleiring av sementmatriks i cervikale og midtre del av roten skjer uten innleiring av sementocytter, og sementen er vanligvis kalsifisert og acellulær. I dette sementlaget finner man ikke lakuner med sementocytter. Sementlaget i den apikale del av roten og i furkasjonsområdet er derimot cellulær og inneholder et nettverk av sementocytt-lakuner (figur 4). Både apikale del av roten og furkasjonsområdet er steder som blir påvirket av mekaniske krefter ved fysiologiske påkjenninger.
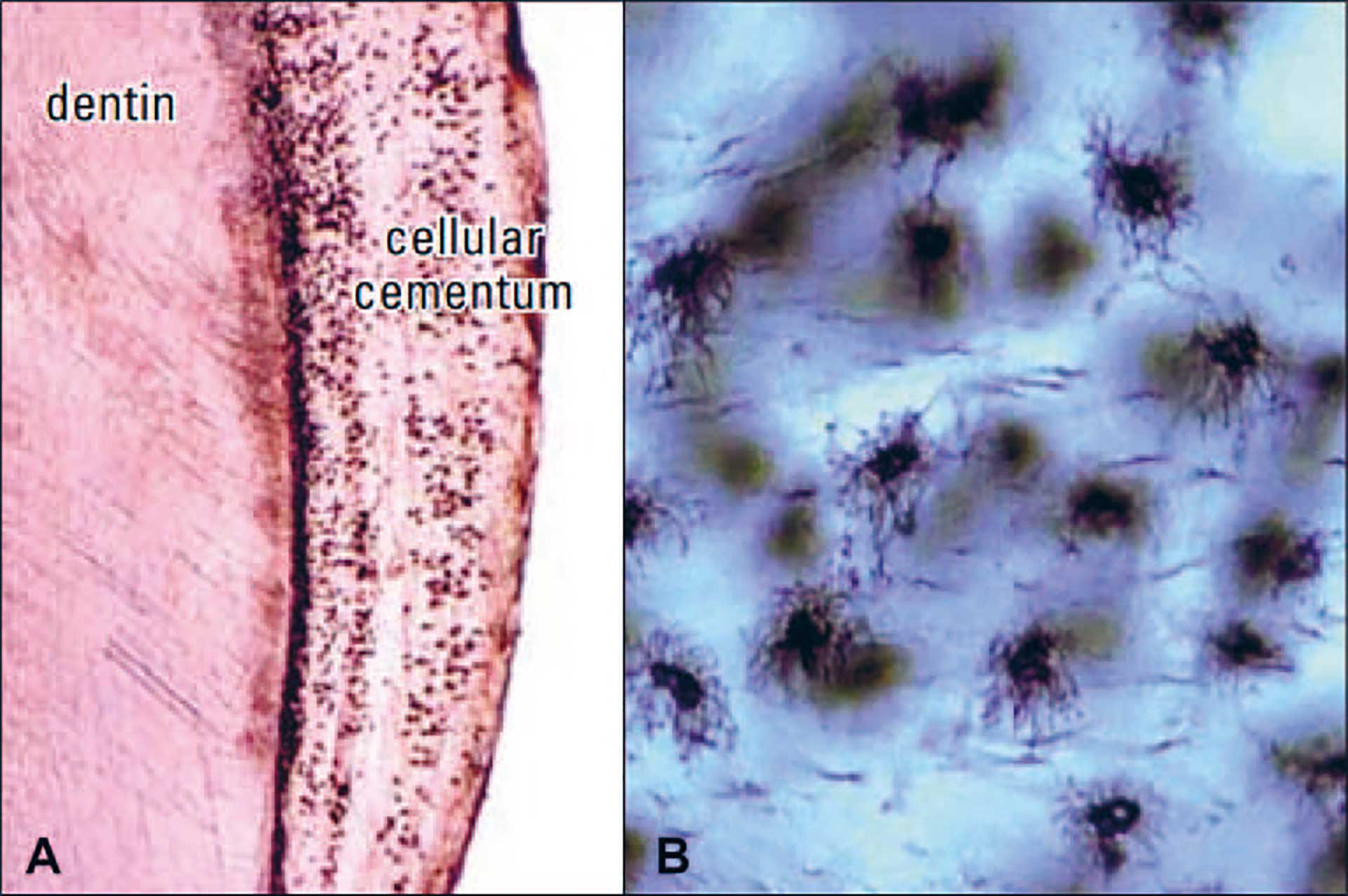
Figur 4. Figuren viser apikal sement i et kasus med hypersementose. A: cellulær sement inneholder et nettverk av sementocytter; B: nærbilde av sementocytter i den cellulære sementen (fra referanse 9, med tillatelse).
Etiologi og differensialdiagnoser
Sementlaget på rotoverflaten er en adaptiv komponent i periodontiet som vil kunne påvirkes av forandringer i funksjonelle krav [11]. Sementtykkelsen blir normalt tredoblet gjennom livet. Dette er vist både for erupterte funksjonelle tenner, og for uerupterte tenner som ikke er funksjonelle [12].
Predisponerende faktorer som forbindes med hypersementose er patologiske og fysiologiske tilstander som periapikale inflammasjonsprosesser [9] [13], traumatisk okklusjon [14], utviklingsforstyrrelser som påvirker fysiologisk sementavsetning [1] og fysiologiske dentale erupsjonsprosesser. Tyggekrefter antas å ha stimulerende effekt på sementavsetning, men uerupterte tenner som ikke er påvirket av funksjonelle krefter er imidlertid rapportert å kunne ha tykkere sementlag [15]. Dette antyder at funksjonelt stress ikke nødvendigvis er en direkte årsak til hypersementose. Det er også rapportert at en økning i sementtykkelse hos ikke-funksjonelle og uerupterte tenner er relatert til alder, muligens grunnet erupsjonskrefter som påvirker tannen [16] [17].
Infeksjon er beskrevet som en mulig etiologisk faktor for hypersementose, siden hypersementose på nekrotiske tenner forekom 4,2 ganger oftere enn på vitale tenner [18]. Men det er vanskelig å fastslå retrospektivt om sementpåleiringen kom før eller etter pulpanekrose.
Parathyroid sykdom, Padgets sykdom, aterosklerose, akromegali, deformerende artritt, hypertrofisk artritt er systemiske sykdommer som forbindes med hypersementose [19]. Kalsinose (kalsiumavleiring i musklene under huden) og vitaminmangel er også blitt nevnt [2]. Padgets sykdom manifesterer seg vanligvis i overkjeven, mens akromegali påvirker oftest vekst i underkjeven [20].
Sementoblastom må tas i betraktning som en differensialdiagnose [6], men har ofte ulikt radiologiskutseende [21]. Sementoblastom er en odontogen tumor hvor proliferasjon av funksjonelle sementoblaster danner en stor masse av sement eller sementlignende vev. Hypersementose og sementoblastom har forskjellig klinisk utvikling, men atypiske varianter kan skape diagnostiske utfordringer. Sementoblastom er en neoplastisk tilstand med ubegrenset vekstpotensial. Eventuell behandling av sementoblastom innebærer fullstendig kirurgisk fjerning, mens hypersementose ikke skal behandles [6]. Kondenserende ostitt og beinhyperplasi er også blitt nevnt som differensialdiagnoser [20], men det er da vanligvis enkelt å skjelne sement og bein basert på røntgentettheten og plassering av periodontalligamentet.
Hypersementose er asymptomatisk og blir diagnostisert ved radiologisk undersøkelse. Hypersementose i seg selv krever ingen behandling, men endodontisk behandling på slike tenner er ofte forbundet med høy vanskelighetsgrad, gjerne i kombinasjon med kirurgisk tilleggsbehandling [22].
Endodontisk behandling av tenner med hypersementose
Det er beskrevet ulike former for hypersementose, og disse er klassifisert som klubbeform, fokal og sirkulær (figur 2, 5) [5] [9], hvor spesielt den sirkulære formen ofte sees på tenner med apikal patologi [9]. I tillegg vil graden av hypersementose kunne være av mild eller alvorlig karakter [5]. Videre er det vist at de fleste rot-apeks på tenner som har mild grad av hypersementose ikke har store morfologisk avvik, bortsett fra flere foramina [5]. Blodkar og nervefilamenter som innkapsles i sementen kan være faktorer som bidrar til dannelse av apikale delta [5] [23] (figur 5B). Moderate tilfeller av hypersementose hadde flere cellulære lakuner med sementocytter, samt irregulariteter forårsaket av resorpsjon. Tenner med alvorlig grad av hypersementose viste i tillegg fortetninger i rotkanalen som kan begrense muligheten for å oppnå full arbeidslengde [5].
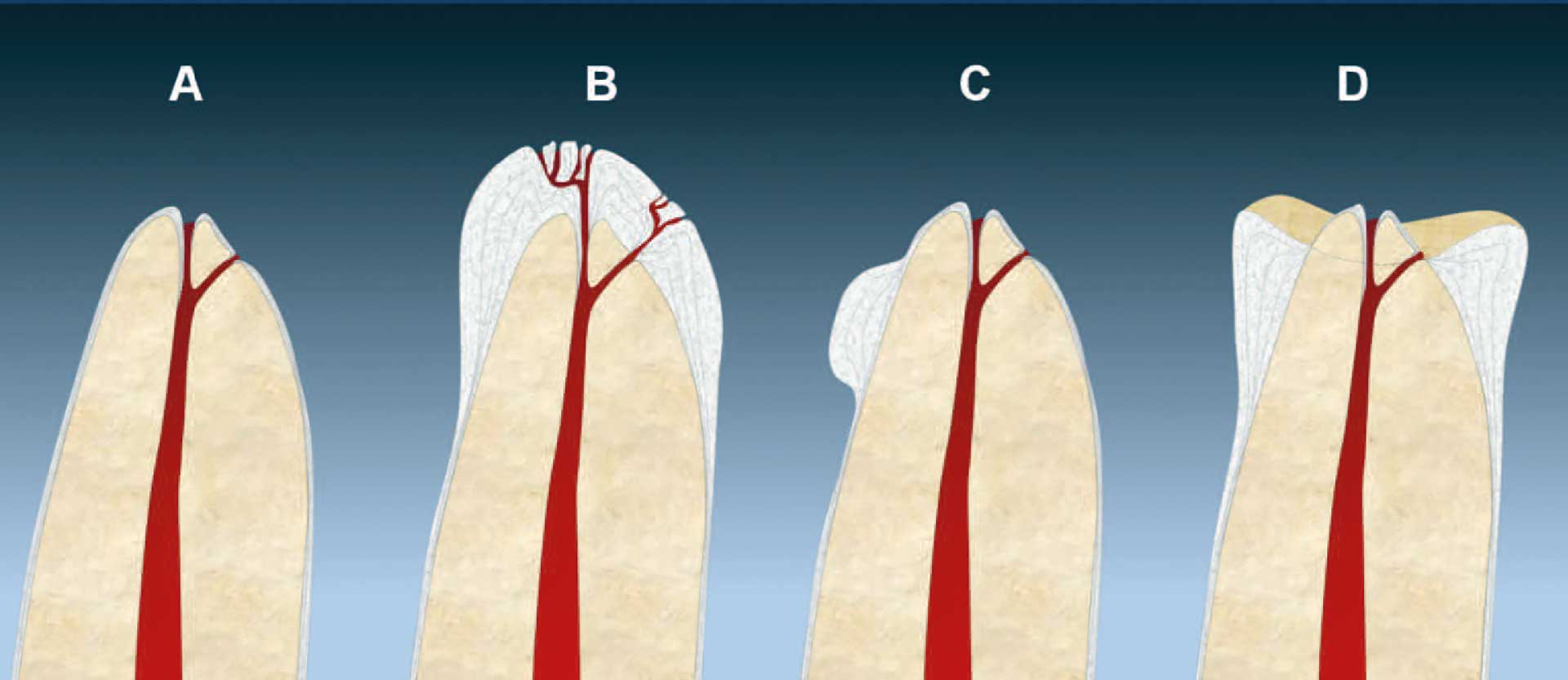
Figur 5. Morfologiske variasjoner av hypersementose: A: normal rot; B: diffus hypersementose/klubbefor; C: fokal eller lokalisert hypersementose; D: sirkulær hypersementose/sementhyperplasi (tegning basert på referanse 9, med tillatelse).
Coolidge var sannsynligvis den første som belyste betydningen av patologisk sementpåleiring for endodontisk behandlingsutfall [24). Endodontisk behandling av tenner med hypersementose kan være utfordrende fordi den radiologiske tettheten til dentin og sement er nokså lik, noe som medfører at tykkelse på sement ikke alltid er mulig å måle på røntgenbilder [25). Også bruken av andre kliniske hjelpemidler, som for eksempel apekslokatorer, kan være utfordrende ved hypersementose. Apekslokatorer vil tolke sementlaget som en del av roten, samtidig som hypersementose kan bidra til flere forgreninger og fortetninger i rotkanalen. Bruk av CBCT-opptak kan i noen tilfeller være til hjelp, men er omdiskutert som rutine ved endodontisk behandling [26). Ifølge anbefalingene til American Association of Endodontists og The American Academy of Oral and Maxillofacial Radiology fra 2018, bør CBCT ikke benyttes for endodontisk diagnostisering eller «screening» ved fravær av symptomer [27).
Hovedmålet med endodontisk behandling av tenner med apikal periodontitt er å skape gunstige forhold for tilheling av apikalt og periapikalt vev. Bestemmelse av lengde på roten og rotkanalen, med påfølgende beslutning om instrumenteringsnivå, er avgjørende for vellykkethet ved konvensjonell endodontisk behandling. Den vanligste årsaken til mislykket endodontisk behandling er gjenværende ubehandlede områder i rotkanalsystemet. Spesielt i nekrosekasus er kjemomekanisk rens av hele rotkanalens lengde, altså maksimal eliminering/fjerning av infeksiøst og nekrotisk vev, avgjørende for behandlingens vellykkethet.
Tenner med apikal periodontitt har varierende grad av apikal inflammatorisk resorpsjon av sement og/eller dentin [28][29). Dette endrer normal apikal anatomi, som igjen kan fremme bakteriell kolonisering. Disse irregularitetene er retensjonsområder som disponerer for dannelse av biofilm. Dette er en av grunnene til at kjemomekanisk rens av hele kanalens lengde er avgjørende for prognosen i kasus med nekrotisk pulpa. Apikal konstriksjon i nekrosekasus er mer konseptuell enn en klinisk virkelighet [30). I kasus med rotresorpsjon og periapikal patologi mangler ofte en distinkt apikal konstriksjon [31). I vitalkasus bør en ha en mer konservativ tilnærming og følge strenge aseptiske prosedyrer siden det ikke foreligger infeksjon i dentin eller sement. Rensing og desinfisering av apikalt foramen i slike kasus kan ikke støttes fra et biologisk synspunkt [32][33].
For tenner med hypersementose kan det være vanskelig å angi riktig instrumenteringslengde i forhold til røntgenologisk apeks. Regelen om at en i nekrosekasus skal plassere renselengden ved den apikale konstriksjon, ofte plassert 0,5 - 1 mm koronalt for røntgenologisk apeks, vil kunne se annerledes ut ved omfattende sementpåleiring apikalt. Sement-dentingrensen indikerer hvor pulpavevet slutter og hvor periodontalt vev begynner. Mens kanaldiameteren reduseres med alderen, vil sementpåleiring øke avstanden mellom den apikale konstriksjonen og foramen apikale. Hos yngre individer er avstanden i snitt 0,5 mm, mens den hos eldre i gjennomsnitt har økt til 0,7 mm [34). Sementpåleiring i apikalområdet ved hypersementose vil øke avstanden mellom den apikale konstriksjonen og røntgenologisk apeks ytterligere. Normalt vil foramen apikale ligge 0,5 - 3,0 mm koronalt for røntgenologisk apeks. Denne avstanden og diameteren på foramen apikale øker ved aldring [35). De anatomiske forandringene som skjer ved hypersementose kan gjøre det vanskeligere å fastsette riktig renselengde. I tillegg vil forsnevringer og omfattende forgreninger apikalt kunne gjøre kanalinstrumenteringen mer komplisert og tidkrevende.
Rotkanalinstrumentering og fylling kort for sement-dentin grensen kan forårsake gjenværende infeksjon og inflammasjon, mens rens og fylling forbi kan forårsake at vevsrester, bakterier og rotfyllingsmasse som fraktes ut av apeks opprettholder apikal inflammasjon. Hypersementose vil direkte kunne påvirke utfallet av endodontisk behandling på grunn av et mer komplisert apikalområde hvor bakterier kan kolonisere områder som er utilgjengelig for mekanisk rensing (figur 4 og 5) [5]. Forekomst av kontaminert sement i apikalområdet i nekrosekasus har ikke blitt studert i detalj, men tilstedeværelse av infeksjon i de mest apikale delene av rotkanalsystemet i nekrosekasus er en kjent problemstilling [36]. Ved hypersementose inneholder den cellulære sementen i apikalområdet sementocytter som inngår i et stort nettverk av lakuner [9]. Nekrose og infeksjon i den cellulære sementen i apikalområdet vil derfor kunne bidra til økte retensjonsområder som vanskeliggjør eliminering av bakterier ved hypersementose. Dette kan igjen bidrar til at kronisk apikal periodontitt ikke tilheler etter endodontisk behandling [5)[37].
Konklusjoner
Det er mangel på studier som viser en sammenheng mellom hypersementose og behandlingsresultat etter endodontisk behandling. Det foreligger heller ikke gode anbefalinger for gjennomføring av behandling på tenner med hypersementose. Det kan være vanskelig å oppnå infeksjonskontroll på nekrotiske tenner med hypersementose. I enkelte tilfeller kan kirurgisk behandling være nødvendig for å eliminere infeksjon i slike tenner.
Referanser
Yamamoto T, Hasegawa T, Yamamoto T, Hongo H, Amizuka N. Histology of human cementum: Its structure, function, and development. Jpn Dent Sci Rev. 2016; 52: 63-74.
Heredia GEI, Morales SHM, Niño JCM, Gutmann JL. Endodontic management of hypercementosis in conjunction with asymptomatic apical periodontitis: A case report. Open Dent J. 2019; 13: 296-300.
Dewey K. Normal and pathological cementum formation. Dent Cosmos. 1926; 68: 560-85.
Leider AS, Garbarino VE. Generalized hypercementosis. Oral Surg Oral Med Oral Pathol. 1987; 63: 375-80.
Pinheiro BC, Pinheiro TN, Capelozza AL, Consolaro A. A scanning electron microscopic study of hypercementosis. J Appl Oral Sci. 2008; 16: 380-4.
Napier Souza L, Monteiro Lima Júnior S, Garcia Santos Pimenta FJ, Rodrigues Antunes Souza AC, Santiago Gomez R. Atypical hypercementosis versus cementoblastoma. Dentomaxillofac Radiol. 2004; 33: 267-70.
Zhou J, Zhao Y, Xia C, Jiang L. Periodontitis with hypercementosis: report of a case and discussion of possible aetiologic factors. Aust Dent J. 2012;5 7: 511-4.
Bürklein S, Jansen S, Schäfer E. Occurrence of hypercementosis in a German population. J Endod. 2012; 38: 1610-2.
Consolaro A, Consolaro R, Francischone L. Cementum, apical morphology and hypercementosis: A probable adaptive response of the periodontal support tissues and potential orthodontic implications. Dental Press J Orthod. 2012; 17: 21-30.
Grzesik WJ, Narayanan AS. Cementum and periodontal wound healing and regeneration. Crit Rev Oral Biol Med. 2002; 13: 474-84.
Schroeder HE. The periodontium: Springer Science & Business Media; 2012.
Zander HA, Hürzeler B. Continuous cementum apposition. J Dent Res. 1958; 37: 1035-44.
Thoma KH, Goldman HM. The pathology of dental cementum. J Am Dent Assoc. 1939; 26: 1943-53.
Comuzzie AG, Steele DG. Enlarged occlusal surfaces on first molars due to severe attrition and hypercementosis: examples from prehistoric coastal populations of Texas. Am J Phys Anthropol. 1989; 78: 9-15.
Israel H. Early hypercementosis and arrested dental eruption: heritable multiple ankylodontia. J Craniofac Genet Dev Biol. 1984; 4: 243-6.
Azaz B, Michaeli Y, Nitzan D. Aging of tissues of the roots of nonfunctional human teeth (impacted canines). Oral Surg Oral Med Oral Pathol. 1977; 43: 572-8.
Azaz B, Ulmansky M, Moshev R, Sela J. Correlation between age and thickness of cementum in impacted teeth. Oral Surg Oral Med Oral Pathol. 1974; 38: 691-4.
Gardner BS, Goldberg H. The significance of hypercementosis. Dent Cosmos. 1931; 73: 1065-9.
Aldred MJ, Cooke BE. Paget’s disease of bone with involvement of the dental pulp. J Oral Pathol Med. 1989; 18: 184-5.
Weinberger A. The clinical significance of hypercementosis. Oral Surg Oral Med Oral Pathol. 1954; 7: 79-87.
Andreasen B.Apical Radiopacities. (lest 08.02.2022].
Vertucci FJ. Root canal anatomy of the human permanent teeth. Oral Surg Oral Med Oral Pathol. 1984; 58: 589-99.
Thomas NG. Formation of the apices of teeth. J Nat Dent Assoc. 1921; 8: 11-7.
Coolidge ED. The reaction of cementum in the presence of injury and infection. J Am Dent Assoc. 1931; 18: 499-525.
Buch B, Matthee MJ. Radiological diagnosis IX. Hypercementosis. J Dent Assoc S Afr. 1985; 40: 23.
Ee J, Fayad MI, Johnson BR. Comparison of endodontic diagnosis and treatment planning decisions using cone-beam volumetric tomography versus periapical radiography. J Endod. 2014; 40: 910-6.
Fayad, MI. The impact of come beam computed tomography in endodontics: A new era in diagnosis and treatment planning. (lest 08.02.2022].
Andreasen JO. External root resorption: its implication in dental traumatology, paedodontics, periodontics, orthodontics and endodontics. Int Endod J. 1985; 18: 109-18.
Hammarström L, Lindskog S. General morphological aspects of resorption of teeth and alveolar bone. Int Endod J. 1985; 18: 93-108.
Dummer PMH, McGinn JH, Rees DG. The position and topography of the apical canal constriction and apical foramen. Int Endod J. 1984; 17: 192-8.
Simon JH. The apex: how critical is it? Gen Dent. 1994; 42: 330-4.
Ricucci D. Apical limit of root canal instrumentation and obturation, part 1. Literature review. Int Endod J. 1998; 31: 384-93.
Ricucci D, Langeland K. Apical limit of root canal instrumentation and obturation, part 2. A histological study. Int Endod J. 1998; 31: 394-409.
Vertucci FJ. Root canal morphology and its relationship to endodontic procedures. Endod Top. 2005; 10: 3-29.
Kuttler Y. Microscopic investigation of root apexes. J Am Dent Assoc. 1955; 50: 544-52.
Baumgartner JC, Falkler WA, Jr. Bacteria in the apical 5 mm of infected root canals. J Endod. 1991; 17: 380-3.
Pappen FG, Fagonde CD, Martos J, Silveira LFM. Hypercementosis: a challenge for endodontic therapy. RSBO. 2011; 8: 321-8.
English summary
Hypercementosis and endodontic implications
Hypercementosis is defined as deposition of radicular cementum beyond physiological limits, and have been associated with several local and systemic factors. However, there is limited knowledge about the incidence of endodontic disease and treatment outcome of teeth with hypercementosis. The radiographic density of dentin and cementum is quite similar, making it difficult to measure the exact thickness of cementum in cases with hypercementosis. Therefore, the determination of working length in teeth with hypercementosis cannot be easily validated by radiographs, affecting endodontic decision making and treatment. Teeth with hypercementosis may also have obliteration of canal lumen, apical resorptions, irregularities, and several apical foramina. In addition, excessive cementum may promote bacterial growth, making the tooth resistant to endodontic treatment. The aim of the present review is to describe characteristics of hypercementosis that may have endodontic implications.
Zakariyya G, Fristad I. Hypersementose og endodontiske implikasjoner. Nor Tannlegeforen Tid. 2022;132:328-33. doi:10.56373/2022-4-4
Korresponderende forfatter: Inge Fristad, E-post: inge.fristad@uib.no
Akseptert for publisering 06.03.2022
Artikkelen er refereevurdert.
Zakariyya G, Fristad I. Hypersementose og endodontiske implikasjoner. Nor Tannlegeforen Tid. 2022; 132: 328-33.
Norsk MeSH: Endodonti; Tannrot; Peroperative komplikasjoner; Oversikt
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Zakariyya G, Fristad I. Hypersementose og endodontiske implikasjoner. Nor Tannlegeforen Tid. 2022;132:328-33. doi:10.56373/2022-4-4
