Aerosol i tannhelseklinikken Del 1: Risiko for smitte
Hovedbudskap
Aerosolutvikling i tannhelseklinikken kan innebære risiko for smitte.
Tannhelsepersonell må vite hva som skaper mikrobielle aerosoler i tannhelseklinikken.
Både tannhelsepersonellets og pasientenes helse må ivaretas ved at smitterisiko vurderes i forbindelse med aerosolgenererende prosedyrer og situasjoner i tannhelseklinikken.
Aerosolutvikling i sammenheng med behandling i munnhulen kan innebære risiko for smitteoverføring mellom pasienter og tannhelsepersonell. Denne artikkelen (Del 1) beskriver hva aerosol er og mulig innvirkning for helse. Hovedfokus i denne artikkelen er mikrobielle aerosoler, og hvilke situasjoner og prosedyrer som forårsaker mikrobielle aerosoler i tannhelseklinikken. Det produseres forskjellige former for mikrobielle aerosoler i en tannhelseklinikk, og mest aerosol blir utviklet ved bruk av roterende instrumenter, treveissprøyte og maskinell scaling. Smitterisiko fra infeksiøs aerosol omtales med eksempler fra noen bakterielle og virus-overførbare sykdommer i tannhelseklinikken. Tannhelsepersonell bør kjenne til mulige helsemessige konsekvenser fra aerosol i tannhelseklinikken for å kunne forebygge luftsmitte. Denne kunnskapen er avgjørende for å ivareta både pasientens og tannhelsepersonellets helse.
Aerosol i sammenheng med pasientbehandling er blitt et aktuelt tema på grunn av regler og anmodninger fra ulike nasjonale og internasjonale helsemyndigheter om å begrense aerosolgenererende prosedyrer (AGP) på grunn av risiko for smitte mens det pågår en covid-19-pandemi. For tannhelsepersonell er temaet svært aktuelt fordi mange prosedyrer i munnhulen danner aerosoler fra materialer, vev og væske.
Aerosol i tannhelseklinikker har vært en kilde til bekymring i mange tiår og beskrevet i utallige publikasjoner, der søkelys på helserisiko har vært knyttet vekselsvis til yrkeshygieniske-, toksikologiske- og allergi-assosierte problemstillinger, samt smitterisiko fra aerosol som inneholder mikroorganismer.
Potensielt infeksiøs aerosol i tannhelseklinikken skyldes ikke bare AGP, det genereres også aerosoler gjennom pusting, tale, hosting og nysing. For å kunne forebygge smitte fra en infeksiøs aerosol må man vite hvilke situasjoner og arbeidsprosedyrer som kan produsere mulig smitteførende aerosol og hvordan smitterisiko kan minimeres.
Hensikten med denne artikkelen er å beskrive aerosoler, oppsummere hva vi vet om utvikling av aerosoler i tannhelseklinikker og omtale hvilke aerosoler i tannhelseklinikken som kan innebære en helserisiko. En parallell artikkel oppsummerer hvilke tiltak som kan gjennomføres for å forhindre og begrense utviklingen av aerosoler.
Hva er aerosol?
En aerosol består av to faser, en gassfase og en partikkelfase. Partiklene kan være av fast stoff eller væske, eller av både fast stoff og væske. Størrelsen på partiklene varierer fra ca. 2 nanometer (nm) til ca 100 mikrometer (μm) (1). Vi er til enhver tid omgitt av aerosol, både utendørs og innendørs. Aerosol kan være naturlig eller menneskeskapt og være flyktig eller mer statisk i rom og tid (2).
Under de siste månedene har det blitt åpenbart at det er mye språklig forvirring rundt ordet «aerosol». I noen publikasjoner blir ordet aerosol brukt som en betegnelse av partikler eller dråper i lufta som er mindre enn 5 mikrometer. I denne artikkelen benyttes imidlertid utrykket aerosol konsekvent for å betegne både partiklene (stoff eller væske) og lufta som en samlet enhet.
Aerosol blir i litteraturen omtalt og diskutert med utgangspunkt i forskjellige kvantitative eller kvalitative kjennetegn. I noen sammenhenger er det massekonsentrasjonen av partikler i luft som er mest relevant, og mengde blir angitt som mikrogram partikler per kubikkmeter luft (µg/m3). I annen sammenheng kan det være turbulensen av en lokal aerosol som er studert, eksempelvis aerosoler forårsaket av hosting eller nysing (3). Et tredje eksempel er studier av kinetikken på enkeltpartiklene i en aerosol for å bedømme nytte-effektivitet av å dosere en medisin ned til lungealveolene ved bruk av inhalator eller forstøverapparat (nebulisator) uten at det oppstår uønskede bivirkninger (4).
Partikler i en aerosol varierer med hensyn til geometrisk form. De kan være sfæriske, fiber- eller irregulært formede, med eller uten porer, eller bestå av aggregater av nanopartikler som kan være kompakte, løselige eller lineære. Betegnelsen nanopartikler er definert internasjonalt som partikler som er på mellom 1 nm og 100 nm. For å angi et felles mål for størrelse uavhengig av form benyttes ofte betegnelsen aerodynamisk diameter, som tilsvarer en teoretisk diameter til en sfærisk partikkel. Aerodynamisk diameter angis ved hjelp av ulike matematiske omregningsformler avhengig av partiklenes geometriske form, tetthet og masse(vekt). En partikkel med en tetthet på 1 g/cm3 og en diameter på 1 µm, har en aerodynamisk diameter på 1 µm. Uavhengig av geometrisk form, tetthet og masse vil partikler med samme aerodynamiske diameter utvise de samme dynamisk bevegelsene i luft, inkludert fallhastigheten mot bakken. I en tannhelseklinikk er aerosoler polydisperse, dvs, partiklene i lufta har ulike størrelser. Forholdet mellom antallet, samlet overflateareal og samlet volum på partiklene er som vist i figur 1.
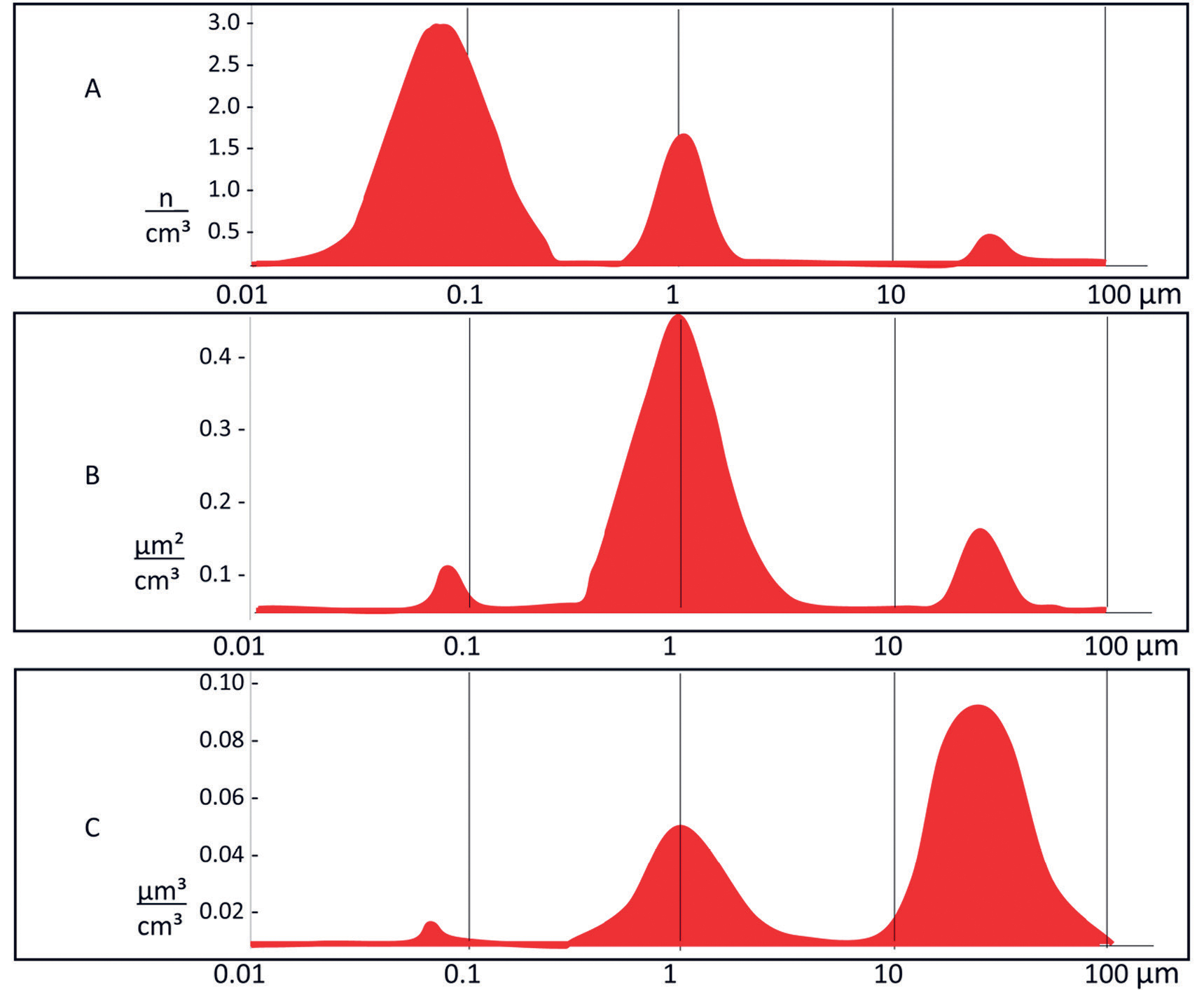
Figur 1. Karakteristikk av en polydispers aerosol med hensyn til fordeling av partiklene etter aerodynamisk diameter: A: Samlet antall (n) partikler per cm³ luft/gass; B: Samlet overflateareal (µm²) av partiklene per cm³ luft/gass; C: Samlet volum (µm³) av partiklene per cm³ luft/gass.
Aerosol og helse
Partiklene i aerosoler påvirker primært slimhinnene i luftveiene og øynene (5). Nanopartikler kan i tillegg penetrere hud og spres i blodbanen via lungene (6). Biologisk respons på cellenivå vil blant annet avhenge av om partiklene er organiske eller uorganiske (7). Helserisiko i forbindelse med eksponering for aerosol bedømmes ut fra en rekke faktorer der sentrale parametre vil være partiklenes størrelse, antall, samlet overflate areal i en inhalerbar fraksjon samt potensiale for infeksjon, allergi eller toksisitet. Det er ikke en eksakt korrelasjon mellom partikkelstørrelse og helserisiko fordi det kan variere for forskjellige størrelsesfraksjoner. Tolkning av resultater fra eksperimentelle studier vil avhenge av hvilke statistiske modeller som benyttes, og ekstrapolering fra epidemiologiske observasjonelle data er åpen for forskjellige tolkninger (8). Kunnskapsgrunnlaget for å bedømme helserisiko ved eksponering fra ulike luftpartikler og luftkvalitet er dynamisk, og derfor har retningslinjer for internasjonale tiltak endret seg kontinuerlig og vil sannsynligvis fortsette å forandres etter hvert som man bedre forstår helseeffekter av ultrafine partikler og nanopartikler (9).
Den biologiske responsen på luftpartikler skyldes avsetning av partikler i målorganer. For inhalerbare partikler vil den totale dosen avhenge av en rekke faktorer som konsentrasjoner av partikler i aerosolen, eksponeringens varighet, luftveienes anatomi, lungeventilasjonen og egenskaper ved partiklene i seg selv (10). Når partiklene er deponert i luftveiene er det flere biologiske mekanismer som kan bidra til å fjerne disse igjen, som hosting og nysing, mukociliær transport, opptak av makrofager eller epitelceller, partikkeloppløsning eller -translokering, dvs. partiklene flyttes fra overflaten til annen lokalisasjon i luftveiene eller til annet vev (11).
Innhold av støv i inne- og uteluft blir vanligvis angitt i tre fraksjoner; PM10 (partikler med aerodynamisk diameter mellom 2.5–10 μm), PM 2,5 (partikler mellom 0.1–2,5 μm og PM 0,1 (ultrafine partikler under 0.1 μm i aerodynamisk diameter) (12). Partiklenes størrelser er en viktig egenskap i relasjon til hvor i luftveiene de vil avsettes, og aerodynamisk diameter kan være utgangspunkt for å beregne dette. Det helseskadelige potensialet til aerosoler i ute- og innemiljø vil i tillegg til faktorene diskutert over, avhenge av den kjemiske sammensetningen av organiske og uorganiske partikler, eller partikler bestående av en kombinasjon, samt tilstedeværelse av eventuelle mikroorganismer eller komponenter fra mikroorganismer, samt av eksponertes individuelle følsomhet. Sistnevnte vil variere fra person til person og avhenge av faktorer som alder og underliggende sykdommer. Det er i tillegg biologisk variasjon med hensyn til vertsrespons, (13), dels forårsaket av at partiklene bindes til muciner på slimhinneoverflatene og at kvaliteten og kvantiteten av mucin varierer fra person til person og over tid (14). Kombinasjonseksponeringer for ulike inne- og uteaerosoler kan påvirke helse i større grad enn enkelteksponeringer (8, 9, 15, 16)
År (ca.) |
Behandlingsprosedyre |
Innhold |
Utsatt gruppe |
Helserisiko utover kontaktsmitte |
|---|---|---|---|---|
~1950 → |
Puss, polering, avtakbar akrylprotese/ mykforing |
Partikler |
Pasient / Personell |
Øyeskade /-infeksjon Dråpe/luftsmitte, bakteriell |
~1960 → |
Roterende instrument / treveissprøyte, hard & bløtvev |
Væskedråper & Partikler |
Personell |
Dråpe/luftsmitte, bakteriell |
~1965 → |
Luftscaler & ultralyd, maskinell tannrens |
Væskedråper & Partikler |
Personell |
Dråpe/luftsmitte, bakteriell |
~1980 → |
Slip, puss, polering, metaller & amalgam |
Partikler |
Pasient / Personell |
CNS-toksisitet Øyeskade |
1983–2005 |
Roterende instrument / ultralyd |
Væskedråper |
Pasient / Personell |
(Blod)dråpe/luftsmitte, HIV virus Hepatitt B virus |
2000 → |
Vannslanger i behandlingsunit |
Væskedråper |
Personell |
Vanndråpe/luftsmitte, Legionella |
2003–2004 |
Roterende instrument / ultralyd / treveissprøyte |
Væskedråper & Partikler |
Pasient / Personell |
Vann/mucus/saliva-dråpe/luftsmitte, SARS-virus |
2008–2009 |
Roterende instrument / ultralyd / treveissprøyte |
Væskedråper & Partikler |
Pasient / Personell |
Vann/mucus/saliva-dråpe/luftsmitte, H1N1 virus |
2009 → |
Kontakt, potensielt høyinfeksiøse pasienter |
Væskedråper & Partikler |
Personell |
Luftsmitte Mycobacterium tuberculosis |
2012 → |
Slip, puss, polering, nanokompositt |
Partikler |
Pasient / Personell |
Øye-Lunge-Nanotoksikologi |
2020 → |
«Aerosol-genererende prosedyrer» (AGP) (= Roterende instrument / ultralyd / treveissprøyte) & Kontakt, potensielt høyinfeksiøse pasienter |
Væskedråper & Partikler |
Pasient / Personell |
Vann/mucus/saliva-dråpe/luftsmitte, SARS-CoV-2 virus |
Typer aerosol i en tannhelseklinikk
Dentale aerosoler kan være problematisk ut fra et helseskadelig perspektiv og har derfor i lang tid vært studert, med et uttalt mål om å begrense aerosolutvikling i arbeidsmiljøet eller å finne løsninger for å beskytte alle berørte (tabell 1).
Spesielt aerosoler med innhold av partikler som er så små at de kan nå helt ned til de nedre luftveiene, har vært studert. Tidligere arbeider har dokumentert ved hjelp av elektronmikroskopi, at mange partikler er i nanometerskala. Mengden av nanopartikler og ultrafine partikler kunne ikke kvantifiseres for femti år siden, men det ble likevel estimert at dentale aerosoler inneholdt en vesentlig mengde partikler som er mindre enn 1 µm (17). Det er først etter tusenårsskiftet at ny måleteknologi har gjort det mulig å presist kvantifisere mengden av partikler som er mindre enn 1 µm i lufta i tannhelseklinikker (18, 19). Studier utført på inneluft i tannhelseklinikker har åpenbart at aerosoler fra roterende instrumenter utvikler langt flere nanopartikler enn det som tidligere har vært antatt (20–24). Ved pussing av kompositt som inneholder nanopartikler har det ikke blitt påvist «rene» nanopartikler, slik de er tilsatt materialet, men partiklene har vært omgitt av organisk matriks. Ny kunnskap om aerosolisering av nanopartikler tilsatt nye materialer og ultrafine partikler fra dentale materialer, åpner for at risikovurderinger av helseeffekter muligens må revurderes. (25).
Tidligere risikovurderinger av aerosoler i sammenheng med dentale biomaterialer har hatt vekslende fokus. Toksisitet har vært omtalt generelt (26), i relasjon til amalgam (27, 28) og kompositt plast (23, 29). Annet fokus har vært på helserisiko forbundet med aerosol fra uedle legeringer (30), pneumokoniose (støvlunge) (31, 32) og idiopatisk fibrose (33) fra slipestøv, berylliose fra beryllium i støpelegeringer (34) og allergi fra aerosolisert hanskepulver i gummihansker (35). Også aerosolisert titandioksid brukt i sammenheng med intraorale digitale avtrykk har vært problematisert (36).
Antall, størrelse og massekonsentrasjon av partikler i aerosoler i tannhelseklinikker og tannlaboratorier, varierer som en funksjon av materiale, arbeidsprosedyre og utstyrsbruk. Generelt gjelder at partikler med lav tetthet forblir svevende lenger enn partikler av samme fysiske dimensjon med høy tetthet. Tetthet på dentale materialer som inngår i typiske aerosoler i en tannhelseklinikk er gummihanskepulver (ca. 0.5 g/cm3), akryl (ca. 1 g/cm3), kompositt plast og dentin (ca. 2 g/cm3), keramer (ca. 2.5 g/cm3), emalje og sink-oksyd (ca. 2.5 – ca. 3 g/cm3), titanlegering (ca. 4.5 g/cm3), zirkona (ca. 6 g/cm3), amalgam og uedle legeringer (ca. 8 g/cm3), høy-edle legeringer (ca. 14–17 g/cm3).
Partikler med høy tetthet, eksempelvis slipestøv fra en metallegering, vil ha en mindre fysisk diameter enn partikler med lik aerodynamisk diameter i eksempelvis akrylstøv. Relevansen av størrelser og overflatekjemi i forhold til inhalasjon, luftventilasjon og helseaspekter er utførlig diskutert i et stort antall artikler, inkludert i flere av artiklene sitert i avsnittet ovenfor.
I sammenheng med kirurgi i munnhulen kan det oppstå mer eller mindre synlig blodsprut utenfor munnhulen i tillegg til aerosolisert blod som ikke er synlig (37, 38). Det er flere studier som har påvist at det er spesielt bruk av roterende instrumenter under kirurgioperasjoner som aerosoliserer blod (39). Smittepotensialet for aerosolisert blod i sammenheng med blodbåren smitte er uavklart. Estimat av risiko i dag er å anse som svært lav så lenge tannhelsepersonell gjennomgår vaksinasjon (40).
Pasientens posisjon har i liten grad vært evaluert i mengden av studier som har målt aerosolutvikling i operatørenes umiddelbare nærhet. En studie har påvist at dersom pasienten ligger horisontalt har aerosol fra AGP en hovedsakelig vertikal dynamisk bevegelse, mens den er mer horisontal når pasienten befinner seg i en sittende eller halvveis bakover lent posisjon (38).
Det er et gjennomgående trekk i flere studier av aerosolutvikling i tannhelseklinikker, at massekonsentrasjonen av partikler i innelufta øker i sammenheng med spesielle arbeidsoperasjoner (41). I en større behandlingsinstitusjon i Tyskland ble det målt mer mikrobiell aerosol på formiddagen og ettermiddagen, med høy aktivitet og lavere i lunsjpausen (42). Tilsvarende funn der man i tillegg målte andre flyktige organiske komponenter er blitt rapportert fra institusjoner i Hellas (43) og i Taiwan (44). Begge de to siste studiene kommenterte at nivåer av partikler (PM10, PM2,5), organisk flyktige forbindelser og CO2, var over anbefalte internasjonale grenseverdier.
Tiltak for å begrense aerosol i tannhelseklinikker blir presentert i artikkeldel 2 (45).
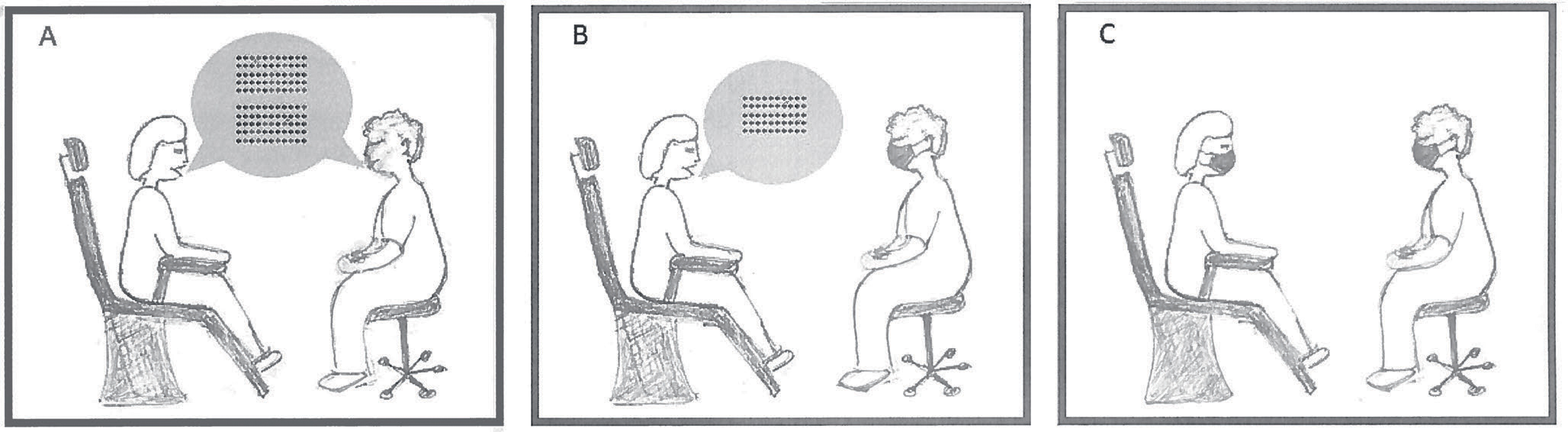
Figur 2. Aerosoldannelse ved verbal kommunikasjon, med og uten munnbind. A: Pasient og tannlege kommuniserer uten munnbind, begge genererer aerosol gjennom pust og tale. B: Tannlegen har munnbind på under kommunikasjonen, aerosol genereres fra pasientens pust og tale. C: Både pasient og tannlege har munnbind på mens de prater sammen.
Mikrobielle aerosoler
Overføring av mikroorganismer i aerosoler skjer via kontaminerte faste partikler eller dråper. Dråper som har fordampet omtales som dråpekjerner, og de har en diameter på 1–5 µm. Smitterisiko bedømmes ut fra partiklenes fysiske egenskaper, slik som størrelse og overflate, og om partiklene er i fast eller i væskeform. Mens det for faste partikler er overflateareal som er av størst betydning, vil det for dråper være samlet volumstørrelse som er mest relevant, i kombinasjon med antall og sammensetning av mikroorganismer, deres evne til å overleve transport via luften samt potensiale for sykdomsfremkallende egenskaper etter påvirkning av uttørking.
Et surrogatmål som i mange år er blitt benyttet for å estimere kontaminasjon av mikroorganismer i luft er å telle antall bakteriekolonier (kim) ved dyrkning, angitt som CFU (colony forming units). I noen sammenhenger måles dette passivt ved å utplassere ulike typer vekstmedier, avhengig av hvilken type mikroorganisme man ønsker å kvantifisere. I andre situasjoner benyttes aktive metoder der luftmengde kan måles for å estimere CFU/m3 luft (46, 47). Det er hovedsakelig bare bakterier og fungus som er blitt målt, og andelen av mikroorganismer som lar seg dyrke er begrenset (48). Teknologiske fremskritt har gjort det mulig i dag å identifisere flere mikroorganismer enn tidligere, fordi det er utviklet skånsomme metoder for innsamling og oppbevaring av luftprøver (49) i kombinasjon med nye analysemetoder (50) og som til dels tillater analyser i sanntid (51). Måling av luftbårent virus på sykehus har inntil nylig bare vært utført i liten grad fordi det er mange teknologiske og praktiske utfordringer (52).
De aller fleste målinger av mikrobiell aerosol i tannhelseklinikker er basert på dyrkning av mikroorganismer (53). Svært få rapporter om mikrobiell aerosol i tannhelseklinikker har vært utført med genetiske analyser (54, 55). Det er gjort forsøk på å oppnå konsensus om beste praksis for måling av mikrobiell aerosol i tannhelseklinikker, men ikke internasjonalt (56, 57). Ut fra spektrumet av rapporterte mikrobielle arter kan det virke som mange funn mest sannsynlig stammer fra aerosolisert kontaminert vann (58, 59).
Vi er pr. i dag ikke kjent med noen studier som rapporterer mengde virus i luft målt i tannhelseklinikker.
Mikrobielle aerosoler i en tannhelseklinikk antas å stamme først og fremst fra arbeidsprosedyrer som innebærer atomisering av vev med væskesprut og luftturbulens over fuktige overflater i munnhulen, alternativt fra biofilm i mulig kontaminerte vannslanger i tannlegeuniten. Det er usikkert hvilken enkeltfaktor som bidrar mest til at aerosoler blir kontaminerte av mikroorganismer. Studier som er utført i større klinikkorganisasjoner tyder på høyest mengde mikrobiell aerosol på venteværelset, dernest på periodontiavdelingen og steriliseringsentralen. Noe mindre grad av mikrobiell aerosol ble målt på allmenodontologi voksen og allmennodontologi barn, mens lavest mikrobiell aerosol ble målt på kjeveortopediavdelingen (60).
Mikrobiell aerosol fra munnhulen
Mikrobielle aerosoler blir utvekslet mellom pasienten og operatøren når sistnevnte posisjonerer seg for nære pasienten i forbindelse med f.eks. dialog ved anamneseopptak eller under diskusjon av behandlingsforslag. Utveksling av aerosoler vil avhenge av om tannlege og pasient benytter munnbind i forbindelse med verbal kommunikasjon (figur 2).
Ved respirasjon og tale frembringes det væskedråper i ulike størrelse og utgangshastighet. Størrelsen og hastigheten på dråpene ut fra munnhulen har betydning for hvor lenge dråpen forblir i luften og (i henhold til ballistiske beregninger) den horisontale avstanden dråpen vil nå før den treffer gulvet.
Det foreligger mange studier som har forsøkt å karakterisere både størrelser og antallet på dråper som genereres under pusting, tale, hosting og nysing. Ny vitenskap viser at mye av den eldre litteraturen er utdatert (61). Moderne teknologi har gjort det mulig å måle dråpene mer presist og samtidig modellere inn i beregningene faktorer som luftturbulens og relativ fuktighet (62–65). Dråpestørrelser varierer mellom 100 nm og 1 mm, men 95 % av dråpene ligger innenfor området 2 µm til 100 µm, altså at 5 % av respiratoriske dråper har en diameter på under 2 µm (66).
Mikrobiell aerosol fra munnhulen forårsaket av AGP
Aerosoliserte mikroorganismer i tannhelseklinikken har vært en kilde til bekymring siden midten av femtitallet, etter at høyhastighet vinkelstykker ble introdusert. Betegnelsen aerosol-genererende prosedyre, aerosolgenererende prosedyrer (AGP), er imidlertid ny og ble introdusert i kjølvannet av SARS-pandemien i 2004, etter at epidemiologiske analyser viste at flere ansatte på sykehus ble smittet til tross for at basale smittevernrutiner ble fulgt (67, 68).
Begrepet AGP skaper forvirring fordi i noen sammenhenger inkluderes dentale aerosoler, mens det i andre sammenhenger utelukkende inkluderer operative inngrep i luftveiene. I noen publikasjoner benyttes derfor i stedet uttrykket «aerosol generating medical procedures (AGMP)» for å avgrense til operative inngrep i luftveiene. WHO utarbeidet en AGP-liste i 2007 som ble revidert i 2009 og i 2014, og den seneste er begrenset til trakeal intubering, ikke-invasiv ventilering, trakeotomi, hjerte-lunge redning, og manuell ventilering for intubering (69). I WHO-dokumentet fra 2014 (70) er det oppsummert i annex A, at AGP er dårlig definert, at det mangler mye forskning om helserisiko forbundet med AGP, og at anbefalingene bygger hovedsakelig bare på en oversiktsartikkel som konkluderer med at evidens er svak (71). Uansett, følgen er at en del andre operative inngrep i luftveiene er utelukket, som laryngoskopi, bronkoskopi, nasoskopi, indusert sputum (indusert opphostet slim) og undersøkelse av tonsiller i munnhulen, inkludert alle andre typer operative inngrep i munnhulen. Det er noe uklart hvorfor noen prosedyrer er utelatt, tatt i betraktning at forskjellige typer mikroorganismer som gir forskjellige typer sykdommer, befinner seg i ulike områder i øvre og nedre luftveier (72). Tidselementer er heller ikke vektlagt; det er ikke åpenbart at en enkelthendelse utvikler mer infeksiøs aerosol sammenliknet med et operativt inngrep som eksponerer helsepersonellet i mange minutter.
Et ekstramoment i sammenheng med estimat av helserisiko fra dental AGP, er at i munnhulen gjelder en uttynningsfaktor av aerosolisert væske på anslagsvis 1:5 mellom salivavolum og mengde vann brukt i instrumentene som genererer aerosol. Gitt at man kan anta at saliva er maksimalt stimulert under operative inngrep i munnhulen, produserer pasienter ca. 7 ml/min saliva, mens mengden av kjølevann gjennom ultralydinstrumenter samt turbin og vinkelstykker er typisk 30 til 40 ml/min.
Studier som beskriver målinger av mikrobiell aerosol fra AGP i tannhelseklinikker, viser stor metodologisk heterogenitet med hensyn til bruk av passive eller ulike typer av aktive målemetoder, metoder for estimering av luftvolum ved aktiv måling, kontroll av ventilasjon, avstand mellom måleapparater fra der aerosolen utvikles, operatør-pasient konfigurasjon og en rekke andre forsøksbetingelser (53, 68, 71, 73). Det er derfor ikke mulig å eksakt estimere mengde mikrobielle aerosoler i tannhelseklinikker.
Siden 1960 årene har det vært kjent at nesten alle arbeidsprosedyrer som tannleger utfører i pasientens munnhule aerosoliserer mikroorganismer. Det er hovedsakelig tre hovedkilder til mikrobielle aerosoler; roterende instrument til preparering av hardvev, treveis-sprøyte og maskinelle scalere (figur 3).
Roterende instrument
Å avvirke kroppens hardeste vev krever mye energi og stiller store krav til instrumenter. Først etter 2. verdenskrig ble det utviklet teknologi som gjorde det mulig å bruke roterende instrumenter til å fjerne emalje, først med store diamantbor og noe senere hardmetallbor. På mikronivå er det en forskjell mellom de to bortypene; i sprø materialer skaper diamantpartikler mikrokrakelering under overflaten, og i duktile materialer deplasseres arbeidsherdet materiale, mens hardmetallbor har en bladegg som river av og pulveriserer overflaten. Stålbor (en tredje bortype) fungerer som hardmetallbor, men er ikke egnet til å fjerne emalje. I andre typer av hardvev skal de derfor bare brukes ved 500 – 25 000 rpm (74).
Å fjerne tannvev krever mye energi, dvs opp til 12 Joule/mm3 (75) og den kinetiske energioverføringen fra boret under avvirkning forårsaker høy temperatur i kontaktsonen. For å unngå irreversible pulpaskader må området nedkjøles kontinuerlig med vann- og luftspray. En rekke studier har målt pulpatemperatur eller brukt konfokalmikroskopi for å studere effekten av faktorer som rotasjonshastighet, trykk, avkjøling og diamantgrovhet på roterende instrumenter. I sum har resultatene ledet til at de fleste vinkelstykker, uavhengig av om det er turbin eller elektriske, opererer med 10–55 ml/min vanntilførsel for å forebygge pulpaskader og for at arbeidsdelen av boret kontinuerlig blir spylt ren (76).
Effektiv avvirkning av tannvev avhenger av perifer hastighet på boroverflaten. Periferihastighet kan beregnes etter formelen [periferihastighet = π x diameter x rotasjonshastighet]. Retningshastigheten på et bor med en diameter på 1 mm og en rotasjonshastighet på 300 000 rpm er ca. 16 m/s. Til sammenlikning har dråper fra munnhulen ved tale og hosting en utgangshastighet på henholdsvis 2–4 m/s og 10–15 m/s (62–64.) Sentrifugalkreftene fra roterende bor er mer enn tilstrekkelig til å slynge pulverisert tannvev og væskedråper i ulike størrelser ut av munnhulen og ut i rommet (77–79).
Det ble raskt åpenbart at de nye roterende instrumentene skapte aerosoler, og infeksjonshygiene ble tidlig problematisert. Uavhengige studier utført på sekstitallet i Tyskland (80), England (81), Norge (82) og USA (83) var de første av anslagsvis 20 eksperimentelle og kliniske studier som dokumenterte mikrobiell aerosol i tannhelseklinikken som en følge av bruk av roterende instrumenter.
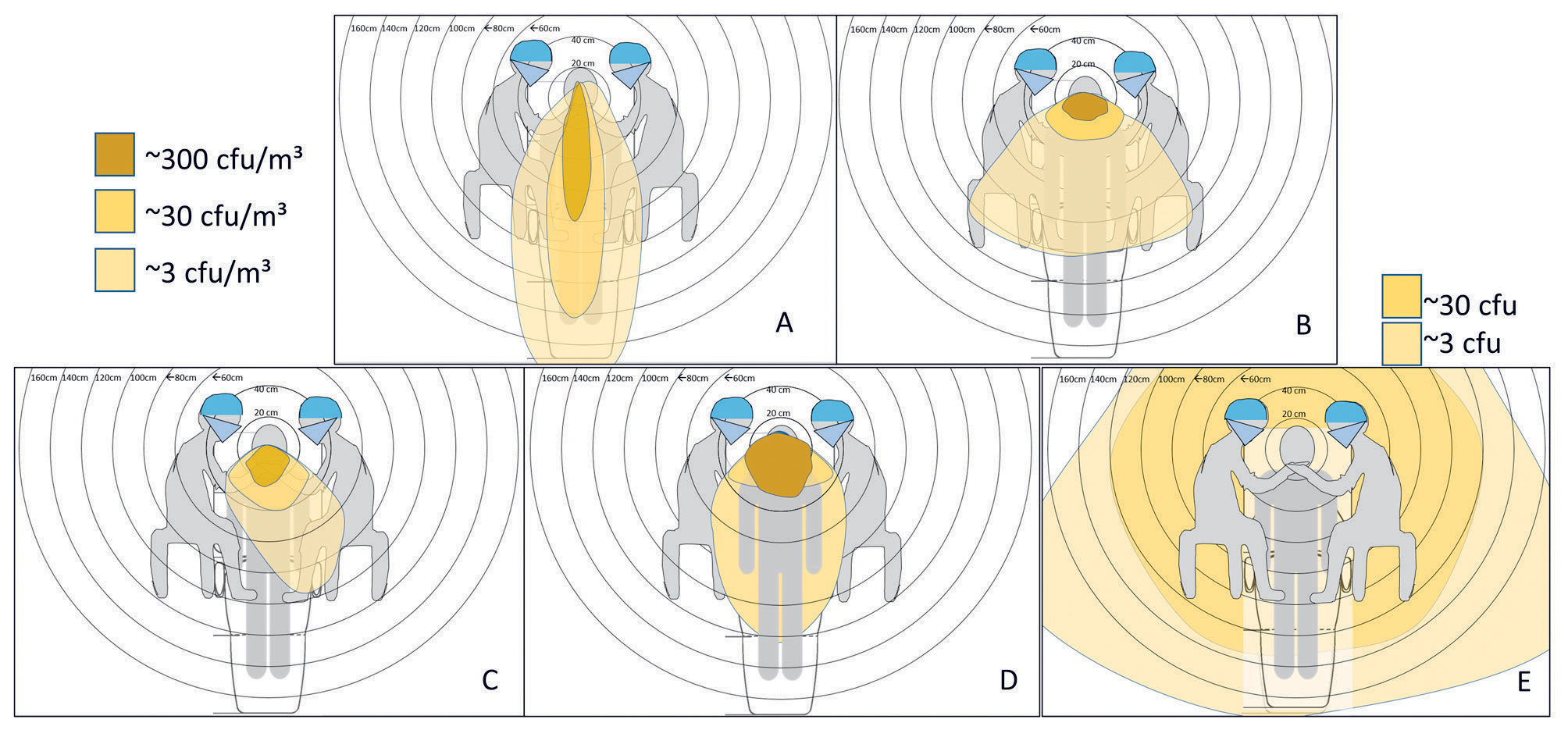
Figur 3. Mikrobielle aerosoler i en tannhelseklinikk målt med bakteriedyrking. A: Nys fra pasienten; B: Sprut («splatter») fra pusseskive brukt på anteriore tenner; C: Sprut fra turbin med vannavkjøling; D: Sprut fra treveis-sprøyte; E: Aerosol fra maskinell scaling (merk: CFU i figurene A – D målt som antall CFU/kubikkmeter luft, i figur E målt som antall CFU). Figurer er basert på data hentet fra referansene 53, 85, 90.
Treveissprøyte
Eldre studier har vist at spredning ved bruk av tre-veis sprøyte skaper et høyt antall CFU per minutt opptil 2,5 meter fra pasientens munnhule spredt via større væskedråper i 1 meters høyde (84, 85). Det er usikkert om funnene fortsatt gjelder, ettersom det ikke ble brukt plast-engangsspisser på treveissprøytene. Studier utført rundt årtusenskiftet påviste utstrakt kontaminasjon i vannrørene i forrige generasjon av treveissprøyter, som dermed var en viktig kilde til spredning av aerosoliserte mikroorganismer (86). Vi er ikke kjent med at det har vært publisert relevante data fra senere studier om aerosol fra treveissprøyter.
Luft- og ultralydscalere
Luftscalere (sonic scaler/airscaler) og ultralydscalere (magnetostriktive scalere og piezoelektriske scalere) er maskinelle scalere som benyttes i forbindelse med profylakse og periodontal behandling. I tillegg benyttes også laser og forskjellige former for maskinell polering. Luftscalere (6 kHz) drives av trykkluft (32–35 psi, 2,2–2,4 bar) og er ofte innpasset i uniten, mens ultralydscalere (20–50 kHz) er elektriske og kan deles inn i magnetostriktive og piezoelektriske. Magnetostriktive scalere er mest brukt i Nord Amerika (eks.: Cavitron) og har en elliptisk bevegelse. Piezoelektriske scalere er mest brukt i Europa (eks.: EMS) og har en lineær bevegelse. Begge former for ultralydscalere er varmeproduserende, men piezoelektriske scalere produserer mindre varme enn magnetostriktive scalere og krever dermed mindre volum vann til kjøling.
Felles for all maskinell scaling, er at det kreves vannkjøling ved bruk og at det skapes aerosol. Det har vært utført flere laboratoriestudier og kliniske studier siden sekstitallet (87) der mengde mikroorganismer som en følge av aerosol skapt ved maskinell scaling har blitt målt. De fleste studiene måler antall bakterier i form av CFU, men det diskuteres likevel at virus sannsynligvis spres på samme måte (88). Studiene lar seg vanskelig sammenligne mhp tall, ettersom det bl.a. er brukt forskjellige scalere og forskjellige mikrobielle dyrkningsmetoder, men felles konklusjon er at det produseres en stor mengde mikrobiell aerosol ved bruk av maskinelle scalere (89, 90).
Smitterisiko fra mikrobiell aerosol i tannhelseklinikken
Dentale aerosoler inneholder partikler og væskedråper i ulike andeler og størrelsesfraksjoner og må alltid anses som kontaminert av mikroorganismer (bakterier, virus, fungi). Det orale mikrobiom inneholder over 700 bakteriearter (91) og det orale viromet er estimert til et sted mellom ca. 300 og 2000 ulike genotyper, hvorav de fleste virustyper er bakteriofager (92). For enkeltindivider vil antallet mikroorganismer være lavere (93, 94) og variere kontinuerlig som en konsekvens av et komplekst mikroøkologisk samspill (95, 96).
I litteraturen skilles det mellom luftbåren overføring av mikroorganismer fra en vert til en annen som dråpesmitte eller som luftsmitte via en infeksiøs aerosol. Det er ikke internasjonal konsensus om klassifisering eller definisjon av størrelsen på infeksiøse væskedråper i forhold til dråpesmitte eller luftsmitte fra partikler i aerosoler (97, 98).
Luftsmitte kan kategoriseres i tre grupper, obligat, preferert eller opportunistisk (99). Obligat luftsmitte oppstår bare gjennom aerosol og gjelder bare for tuberkulose; preferert luftsmitte er en naturlig infeksjon som kan oppstå via flere forskjellige smitteveier, men der aerosol er den vanligste måten, eksempelvis meslinger og vannkopper. Opportunistisk smitte er infeksjoner som kan oppstå via andre smitteveier, eksempelvis gastrointestinalt, men kan under spesielle omstendigheter også oppstå via aerosol, eksempelvis kopper, norovirus, SARS og influensa. WHO og det amerikanske sentret for sykdomskontroll; Centers for Diseases Control and Prevention (CDC) har med bakgrunn i dagens kunnskap, identifisert bare tre infeksjonssykdommer som kan oppstå via aerosol, og disse er tuberkulose, meslinger (eng. measles) og vannkopper (chickenpox) (70, 100). Det er imidlertid en stor tverrfaglig forskningsaktivitet som pågår innenfor feltet virusinfeksjoner og aerobiologi i kjølvannet av den første SARS pandemien i 2003, fugleinfluensaen (A/H5N1) i 2005, svineinfluensaen i 2009 (A/H1N1), MERS i 2012, ny fugleinfluensa (A/H7N9) i 2013, Ebola virus i 2014 (101) og nå covid-19 fra SARS-CoV-2.
Under behandling i munnhulen kan det skje overføring av mikroorganismer via væskedråper i størrelsesorden over 100 µm, eller via aerosoliserte væskedråper, dråpekjerner eller kontaminerte partikler. Kompliserende i forhold til risikovurdering av mikrobiell aerosol fra AGP er at andelen og størrelsene av partikler/ væskedråper forandrer seg raskt i tid og rom og også påvirkes av et lokales ventilasjon og luftfuktighet (102). Sedimenteringshastigheten påvirkes også av partikkelkonsentrasjonen i lufta, demonstrert eksperimentelt ved at bakteriesporer i partikkelfri luft forsvinner raskere enn i luft tilsatt trikalsiumfosfatstøv eller hårspray (103). Det antas at forklaringen er at partiklene aggregerer og dissosieres, og at elektrostatiske mekanismer sannsynligvis er involvert. For øvrig er fysisk-kjemiske reaksjoner i aerosoler generelt komplekse. Dette gjelder særlig i atmosfærer som i en tannhelseklinikk, der det i tillegg er mange flyktige organiske komponenter.
For partikler som er overflatekontaminert av smittestoff eller har et allergent eller toksisk potensiale, er det i tillegg til antallet og størrelsene på de kontaminerte partiklene, blant annet det samlede overflatearealet, deres løselighet, og om partiklene kan virke som adjuvans (forsterke immunologiske reaksjoner) av betydning. For væskedråper blir estimeringen enda en grad mer komplisert fordi størrelsene på væskedråpene ikke er konstante, som følge av fordampning, og fordampningen vil være relatert til væskedråpens opprinnelige volum. Dersom væskedråpene inneholder mikroorganismer, blir den neste beregningen hvor lenge ulike typer mikroorganismer har et smittepotensiale ved fordampning av fuktighet (figur 4).
Av forståelige grunner er det vanskelig å gjennomføre kontrollerte kliniske studier på mennesker for å beregne alle parameterne beskrevet over. Bare et fåtall kliniske studier er utført, og da på unge, friske frivillige, som gjør det usikkert i hvilken grad funnene er overførbare til sårbare pasientgrupper. Det finnes kliniske studier hvor frivillige er blitt smittet med mikroorganismer, men det betyr ikke at funnene er direkte overførbare til andre typer mikroorganismer.
En europeisk arbeidsgruppe innen oral mikrobiologi, oppsummerte i 2011 i et «position paper», at smitte mellom pasient og tannhelsepersonell er underrapportert i litteraturen, og et antall tilfeller synes å bli ignorert av pasienter, helsearbeidere og myndigheter (104). Artikkelen beskriver risiko for ulike virus- og bakterielle infeksjoner via kontakt-, dråpe- og luftsmitte og påpeker rapportering av smitteoverføringer til helsepersonell innen ulike fagfelt i medisin, men ikke fra tannhelsesektoren. En forklaring på at tannhelsesektoren er utelatt, kan være at inkubasjonstiden fra smitte til symptomer oppstår kan være fra dager (pseudomonas, legionella, gule stafylokokker), til uker (herpes, varicella zoster) til måneder (hepatitt B/C/D, tuberkulose) og flere måneder eller år (HIV/AIDS). I de danske nasjonale retningslinjene for infeksjonshygiene (105) er det listet kasusbeskrivelser og rapporter der tannhelsepersonell er blitt smittet fra pasienten via store og små væskedråper i aerosol.
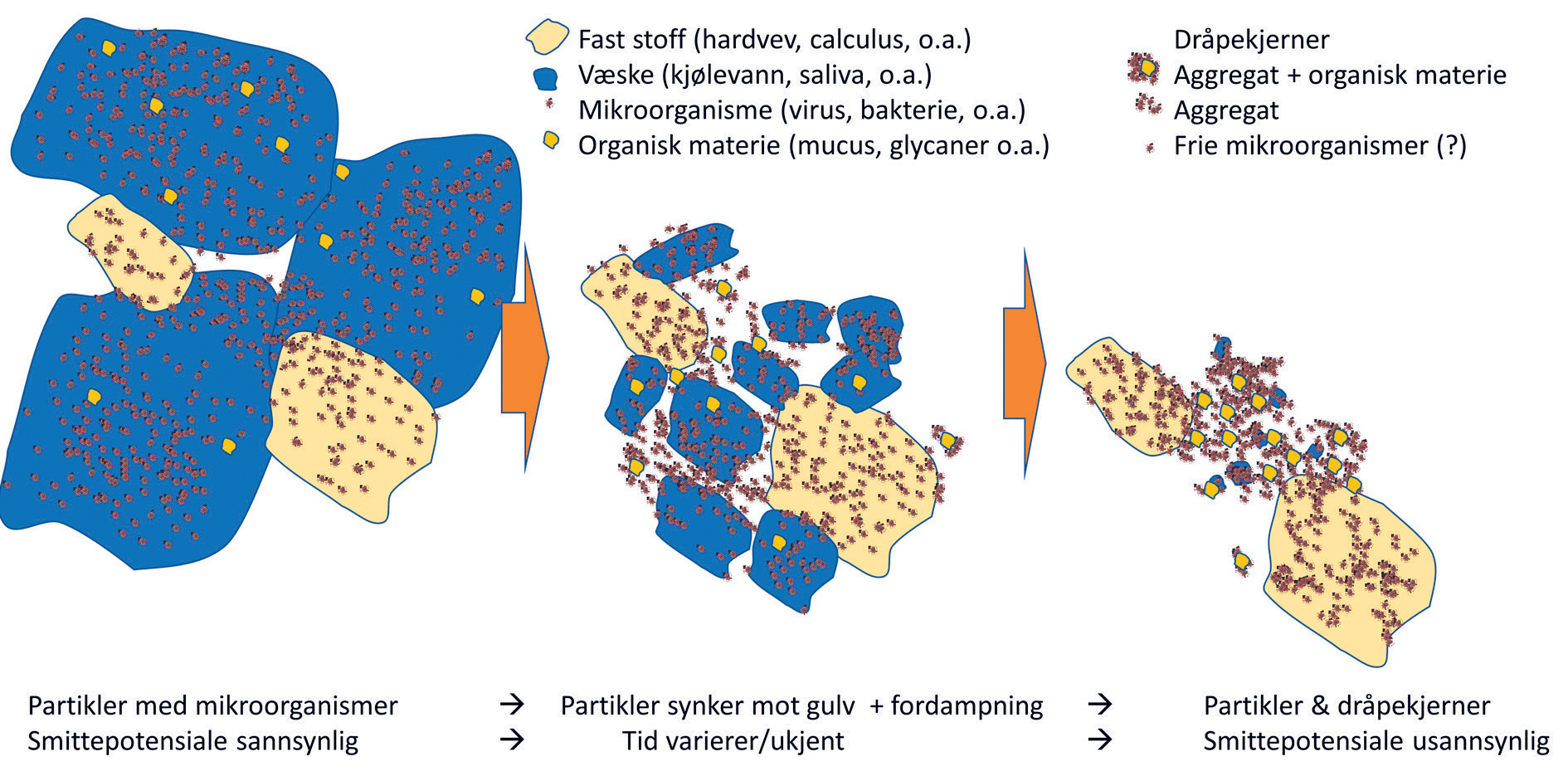
Figur 4. Dental aerosol kontaminert med mikroorganismer med eller uten smittepotensiale etter fordampning av væske. Figur adaptert etter referanse 19.
Bakterier
Potensielt infeksiøse bakterielle aerosoler i en tannhelseklinikk kan bl.a. oppstå i sammenheng med pasienter med tuberkulose (TB), eller som en sekundærfølge av at biofilm i vannslanger i tannlegeuniten eller vanntilførselen er kontaminerte. Mikroorganismer fra kontaminerte vannslanger er gram-negative bakteriegrupper, primært ulike arter av legionella og pseudomonas, som kan aerosoliseres og utgjøre en helserisiko for spesielt utsatte pasienter (106). Flere studier er utført i land med mangelfull vannforsyning og infrastruktur, og data herfra er ikke direkte overførbart til Norge, hvor vi har god vannforsyning. Imidlertid er det klare indikasjoner på at dårlig vannkvalitet tilfører store mengder mikroorganismer i arbeidslufta, og forholdet kan bare delvis korrigeres med ulike tiltak på arbeidsplassen (107). Påvisning av bakterier fra vannledningssystem i uniter er også rapportert i Norge, men årsaken antas å være en konsekvens av mangelfullt vedlikehold og renhold (108).
Tuberkulose
Tuberkulosebakterien Mycobacterium tuberculosi, kan holde seg levende og gi sykdom etter å ha svevet i luften i flere timer. På tretti-tallet, før det forelå vaksiner, hadde tannleger i England en dødsrisiko på grunn av tuberkulose (TB) som var dobbelt av hva legene hadde, og som var høyere enn gjennomsnittet i sammenlignbare grupper i befolkningen (109). Litteratur fra samme periode beskriver flere tilfeller av smitte fra pasient til tannlege, og fra tannlege til pasienter og til andre kolleger. Så sent som i 1980 ble det konstatert utbrudd av TB blant barn som hadde fått ekstrahert melketenner av en tannlege med TB (110). BCG-vaksinen som ble utviklet mot TB, var meget effektiv og ble etter 2. verdenskrig påbudt i mange vestlige land. Etter hvert som man i vestlige land anså at TB var kommet under kontroll, ble påbud om vaksinasjon og regelmessig tuberkulintesting avsluttet i mange land. Norge avsluttet obligatorisk BCG vaksinasjon i 1995 og hadde tilbud om frivillig vaksine frem til 2009. I dag er det ingen epidemiologiske data som indikerer en høyere forekomst av TB blant tannhelsepersonell i forhold til populasjonen (111).
TB i tannhelseklinikker ble noe aktualisert i sammenheng med behandling av immunokompromitterte pasienter med AIDS (112, 113). Smittetiltak utover basale smittevernrutiner dersom man har en kjent TB-pasient, er å bruke åndedrettsvern og god ventilasjon (114).
TB var i mange år ikke omtalt i norsk media, men i 2015 ble sykdommen aktualisert i sammenheng med behandling av flyktninger fra Syria. Mens risiko for smitte av M. tuberculosis i mange vestlige land har vært minimal, er TB endemisk med høye dødstall i mange andre land. India har flest smittede, deretter kommer Kina, Indonesia, Filipinene, Pakistan, Bangladesh og Sør-Afrika, og disse landene står for 2/3 av alle TB tilfellene i verden i 2018. På grunn av økende utbredelse av TB og at det har oppstått antibiotikaresistente varianter, dør det årlig minst 1.5 mill. mennesker av TB hvert år globalt. Et utbrudd av TB på den amerikanske vestkysten i 2010, identifiserte en tannhelseklinikk som felles smittekilde. Av 743 pasienter ble 305 testet med tuberkulintest og 23 (7,5 %) var positive for mulig tuberkuloseinfeksjon, mens 10 % av de ansatte på tannhelseklinikken også var positive for mulig TB smitte. Erfaringene resulterte i at helsemyndighetene i USA, i lys av et økende antall potensielle TB individer i forhold til tidligere, anbefaler tannhelsepersonell å vurdere egen vaksinasjonsstatus og andre administrative rutiner på arbeidsplassen for å forebygge luftsmitte av TB (115).
Legionella
Det har lenge vært kjent at vann fra tannlegeuniter kan inneholde legionella (116), og det har vært diskutert om aerosolisert vann kan være en mulig kilde til legionærsykdom (117). Innånding av aerosol som inneholder Legionella, er ansett som risiko for spesielt utsatte pasienter (118). Et dødsfall som følge av legionærsykdom, ble knyttet til sannsynlig eksponering av kontaminert vann i en tannhelseklinikk (119). Senere mikrobiologiske analyser i denne hendelsen klarlagte imidlertid at pasienter som i utgangspunktet har legionærsyke, kan kontaminere tannlegeuniter i motsatt vei (120). Lærdommen er at daglig desinfeksjonsrutiner av vannsystemer er viktig, samt påminnelsen om at det er viktig å ha oppdatert medisinsk status på alle pasienter som behandles i tannhelseklinikken.
Med hensyn til yrkeseksponering, er det rapportert motstridende funn. Årlige helsesjekker av tannhelsepersonell, utført av den amerikanske tannlegeforeningen gjennom 10 år frem til 2012, har ikke vist økt seropositivitet for Legionella (121). En metaanalyse av serologiske data fra studier med til sammen 2232 helsearbeidere og 1172 ueksponerte personer, viste ingen statistisk signifikant forskjell i insidensen for legionella infeksjoner (122). Forfatterne påpekte i tillegg at det ikke er nok vitenskapelig bevis for å bedømme om tannhelsepersonell har en yrkesrisiko med hensyn til legionella, men utelukker ikke at dette kan ha vært tilfellet tidligere (123, 124). Noe påfallende er den store variasjonen i primærstudier av målt Legionella seroprevalens i kontrollgrupper, hvilket indikerer varierende studiemetodologi og målemetoder (125).
Virus
Eldre studier har vist at tannhelsepersonell har høyere titre av seropositivitet for luftveisvirus i forhold til resten av befolkningen (126). Det er rimelig å anta at dette er forårsaket av smitte fra pasienter. Pasienter som har blitt smittet av et virus, vil i større eller mindre grad skille ut dette viruset i saliva som en konsekvens av «viral shedding» (127). Eksempler er zikavirus, cytomegalovirus hos AIDS pasienter, Ebola virus, HIV virus, og rabiesvirus. Enkelte pasienter skiller ut Herpes Simplex virus 1 (128). Pasienter med parotitt kan være infisert av kusmavirus, alternativt av influensa virus A (ved gjentatt parotitt), og begge former skilles ut i saliva.
Fordi virus ofte skilles ut i saliva, har det blitt utviklet en rekke salivatester for å påvise ulike typer virus-infeksjoner (129). Selv om man kan resonnere at høye verdier av virus i saliva korrelerer med høye verdier i en aerosol fra munnhulen og derfor økt smitterisiko, er ikke dette nødvendigvis korrekt. Smitteevne på mange virus avtar raskt i luft og blir i tillegg påvirket negativt av en serie av andre ytre faktorer som ikke nødvendigvis er målbare i diagnostiske tester (130, 131).
Human immunodeficiency virus (HIV) ble i noen år mistenkt å ha blitt overført fra en HIV-smittet tannlege til en pasient via en ukjent smittevei. Tretti år senere med mye debatt, undersøkelser og klinisk erfaring, er oppfatningen i dag at mistanken sannsynligvis var ubegrunnet, og at HIV smitte fra en infisert kliniker til en pasient, utelukkende kan skje hvis blod fra kliniker kommer direkte inn i et sår, dvs. såkalt «bleed-back» (132).
Hepatittvirus
Før Hepatitt B virus (HBV) vaksine ble utviklet, registrerte man høyere positiv serologistatus blant tannhelsepersonell i forhold til gjennomsnittsbefolkningen, eksempelvis 46 % blant tannleger i Singapore (133) og 26 % blant oralkirurger i USA (134). Konklusjonen fra denne siste studien samstemmer med en noe senere studie fra Tyskland (135) om at personlig verneutstyr som hansker, munnbind og øyebeskyttelse ikke forhindret smitte av HBV. Studier som ble utført for å måle virusinnhold i aerosoler, fant ingenting og konkluderte derfor med at smitte ble overført som kontaktsmitte (136). Imidlertid viste det seg senere at målemetodene som ble anvendt var metodologisk problematiske (19). Hepatitt B smitter lett, og med molekylære metoder er det dokumentert flere tilfeller av smitte også mellom tannhelsepasienter. En eldre kvinne som fikk akutt Hepatitt B infeksjon etter behandling hos sin tannlege, viste seg å være smittet av virus fra en Hepatitt B-infisert pasient som hadde vært i samme behandlingsrom med samme personell, men 2 timer tidligere. Helsemyndigheten kunne ikke påpeke noen brudd på sikkerhetsregler og internkontroll. En antar at aerosoler med Hepatitt B virus kan ha falt ned på instrumenter som ble brukt, eller kanskje fortsatt var i lufta etter 2 timer (137). Vi er ikke kjent med senere studier av HBV i aerosoler i tannhelseklinikker.
Influensavirus
Det finnes flere typer influensa virus (A – D). Influensa typene A og B er de som sirkulerer og gir opphav til den årlig sesonginfluensa. Smitteoverføring av influensa virus forekommer hovedsakelig ved større dråper ved hosting eller nysing, eller ved indirekte kontakt. Overføring via små partikler i en aerosol kan også forekomme. Det har blant annet blitt vist i ett nyere studie at symptomatiske individer genererte partikler under 5 µm med influensavirus, uten forutgående hosting eller nysing (138). Influensavirus har også blitt påvist i saliva. Det anbefales at alt helsepersonell som har pasientkontakt, vaksineres mot sesonginfluensa.
SARS-CoV-1-virus
Under den første SARS-pandemien i 2004 oppdaget man at SARS-CoV-1 virus ble utskilt i saliva (139, 140), hvilket ikke har vært kontroversielt. Derimot har en ofte sitert studie som konkluderte med at SARS-CoV-1 virus sannsynligvis ble overført via luftsmitte (141), vært kontroversiell.
SARS-CoV-2-virus
Tilgjengelig kunnskap tyder så langt på at smitte av SARS-CoV-2 virus skjer primært i form av kontakt- eller dråpesmitte (142), hvilket ikke utelukker mulig risiko for luftsmitte av SARS-CoV-2 virus under spesielle eksponeringssituasjoner (143). Det er foreløpig lite data som kan tyde på smitte via aerosol (144).
Det ble i en tidlig fase av covid-19-pandemien lansert en teori om at covid-19-pasienter kunne ha mye virus i saliva (145, 146). Teorien bygget ikke på nye data, men henviste til funn fra den tidligere SARS-pandemien i 2004 (139), en studie på aper (147) og en cellestudie (148), samt en klinisk studie (149).
De to ikke-humane studiene satte søkelys på at epitelcellene i spyttkjertlene og i munnslimhinnen inneholder et høyt antall ACE-2-reseptorer (Angiotensin Converting Enzyme 2) som binder SARS-CoV-2-virus og som er nødvendig for at viruset skal infisere cellene. Humanstudien beskrev i tittelen «novel coronavirus in saliva», men det fremgår tydelig i materiale og metode-delen at det snarere dreier seg om sputum (ekspektorat) (149). Forfattergruppen modifiserte senere tittelen til «posterior oropharyngeal saliva» i en parallelartikkel (150). Senere studier har imidlertid vist at smittede individer har en saliva som inneholder høye titre av SARS-CoV-2 virus. Foreløpig kjenner man ikke i detalj mengden i saliva under ulike sykdomsfaser etter smitte (151). Imidlertid betyr oppdagelsen at enhver aerosol fra munnhulen på en antatt eller sikker covid-19 pasient, er å måtte anses som kontaminert av SARS-CoV-2 virus i saliva.
Oppsummering
For hundre år siden var de kjente yrkessykdommene blant tannleger, infeksjonssykdommene syfilis og tuberkulose og noen tiår senere poliomyelitt (152). Spissformulert har tannhelsepersonell blitt reddet av vaksiner, antibiotika og et robust helsevesen. For seks tiår tilbake ble det formulert: «Few aerobiologists would take a random sample of saliva, hemorrhage, and tissue debris of any description and atomize it 6–18 inches (15–45 cm) from his nose and mouth with an air syringe, rotary or vibrating instrument without taking special precautions to prevent the inhalation of this material and the contamination of his person and environment… The association of oral cavity contents with aerosol production is not frequently recognized by the dentist as anything more than a nuisance requiring the operator to clean his glasses frequently while operating» (153).
Dagens covid-19-pandemi var forhåndsvarslet, i likhet med andre pandemier som med høy statistisk sannsynligvis vil komme i fremtiden (154). Det synes fornuftig at tannhelsepersonell spesielt og helsemyndigheter generelt, bør studere og vurdere mulige helsemessige konsekvenser som følge av aerosolisering av biologisk materie i tannhelseklinikker i sammenheng med pasientbehandling.
Takk
Takk til Arne Hensten, professor emeritus, UiT Norges Arktiske Universitet og konsulent, Nordisk institutt for odontologiske materialer – NIOM, for gode kommentarer og innspill til manuskriptet.
Referanseliste – komplett. (N= 25 markert tekst til papirutgave)
Hinds WC. Aerosol Technology: Properties, Behavior, and Measurement of Airborne Particles. 2nd ed., New York, USA: John Wiley & Sons Inc. 1999. ISBN: 9780471194101.
Morawska L, Ayoko GA, Bae GN, Buonanno G, Chao CYH, Clifford S, et al. Airborne particles in indoor environment of homes, schools, offices and aged care facilities: The main routes of exposure. Environ Int. 2017; 108: 75-83. https://doi.org/10.1016/j.envint.2017.07.025
Bourouiba L, Dehandschoewercker E, Bush JW. Violent expiratory events: on coughing and sneezing. J Fluid Mech. 2014; 745: 537-63. https://doi.org/10.1017/jfm.2014.88
Darquenne C. Aerosol deposition in health and disease. J Aerosol Med Pulm Drug Deliv. 2012; 25: 140-7. https://doi.org/10.1089/jamp.2011.0916
Thomas RJ. Particle size and pathogenicity in the respiratory tract. Virulence. 2013; 4: 847-58. https://doi.org/10.4161/viru.27172
Riediker M, Zink D, Kreyling W, Oberdörster G, Elder A, Graham U, et al. Particle toxicology and health - where are we? Part Fibre Toxicol. 2019; 16: 19. https://doi.org/10.1186/s12989-019-0302-8
Kim KH, Kabir E, Jahan SA. Airborne bioaerosols and their impact on human health. J Environ Sci. 2018; 67: 23-35. https://doi.org/10.1016/j.jes.2017.08.027
EPA, U.S. Environmental Protection Agency. Chapter 4. Dosimetry of particulate matter. In: Integrated Science Assessment (ISA) for Particulate Matter (Final Report, 2019). EPA/600/R-19/188. p. 477-564. https://ofmpub.epa.gov/eims/eimscomm.getfile?p_download_id=539935 (lest 2.8.2020)
Heal MR, Kumar P, Harrison RM. Particles, Air Quality, Policy and Health. Chem Soc Rev. 2012; 41: 6606-30. https://doi.org/10.1039/c2cs35076a
Carvalho TC, Peters JI, Williams RO 3rd. Influence of particle size on regional lung deposition--what evidence is there? Int J Pharm. 2011; 406: 1-10. https://doi.org/10.1016/j.ijpharm.2010.12.040
Bustamante-Marin XM, Ostrowski LE. Cilia and Mucociliary Clearance. Cold Spring Harb Perspect Biol. 2017; 9: a028241. https://doi.org/10.1101/cshperspect.a028241
WHO, World Health Organization. Air quality guideline for Europe. 2nd ed. WHO Regional Publication Series no 91. København: WHO Regional Office for Europe, 2000. http://www.euro.who.int/__data/assets/pdf_file/0005/74732/E71922.pdf (lest 2.8.2020)
Shu F, Shi Y. Systematic Overview of Solid Particles and Their Host Responses. Front Immunol. 2018; 9: 1157. https://doi.org/10.3389/fimmu.2018.01157
Chen S, Guo H, Cui M, Huang R, Su R, Qi W, et al. Interaction of particles with mucosae and cell membranes. Colloids Surf B Biointerfaces. 2020; 186: 110657. https://doi.org/10.1016/j.colsurfb.2019.110657
FHI, Folkehelseinstituttet. Luftkvalitetskriterier. Virkninger av luftforurensning på helse. Folkehelseinstituttet, FHI Rapport. 2013:9. https://www.fhi.no/globalassets/dokumenterfiler/rapporter/2013/luftkvalitetskriterier---virkninger-av-luftforurensning-pa-helse-pdf.pdf (lest 2.8.2020)
FHI, Folkehelseinstituttet. Svevestøv. 2017. https://www.fhi.no/nettpub/luftkvalitet/svevestov/svevestov (lest 2.8.2020)
Timbrell V, Eccles JD. The respirability of aerosols produced in dentistry. J Dent. 1973; 2: 21-31. https://doi.org/10.1016/s0300-5712(73)80006-5
Sotiriou M, Ferguson SF, Davey M, Wolfson JM, Demokritou P, Lawrence J, et al. Measurement of particle concentrations in a dental office. Environ Monit Assess. 2008; 137: 351-61. https://doi.org/10.1007/s10661-007-9770-7
Verreault D, Moineau S, Duchaine C. Methods for Sampling of Airborne Viruses. Microbiol Mol Biol Rev. 2008; 72: 413-44. https://doi.org/10.1128/MMBR.00002-08
Van Landuyt KL, Yoshihara K, Geebelen B, Peumans M, Godderis L, Hoet P, et al. Should we be concerned about composite (nano-)dust? Dent Mater. 2012; 28: 1162-70. https://doi.org/10.1016/j.dental.2012.08.011
Polednik, B. Aerosol and bioaerosol particles in a dental office. Environ Res. 2014; 134: 405-9. https://doi.org/10.1016/j.envres.2014.06.027
Lang A, Ovsenik M, Verdenik I, Remskar M, Oblak C. Nanoparticle Concentrations and Composition in a Dental Office and Dental Laboratory: A Pilot Study on the Influence of Working Procedure. J Occup Environ Hyg. 2018; 15: 441-7. https://doi.org/10.1080/15459624.2018.1432864
Liu MH, Chen CT, Chuang LC, Lin WM, Wan GH. Removal efficiency of central vacuum system and protective masks to suspended particles from dental treatment. PLoS One. 2019; 14: e0225644. https://doi.org/10.1371/journal.pone.0225644
Cokic SM, Ghosh M, Hoet P, Godderis L, Van Meerbeek B, Van Landuyt KL. Cytotoxic and genotoxic potential of respirable fraction of composite dust on human bronchial cells. Dent Mater. 2020; 36: 270-84. https://doi.org/10.1016/j.dental.2019.11.009
CDC, Centers for Disease Control and Prevention, National Institute for Occupational Safety and Health. Approaches to safe nanotechnology. DHHS (NIOSH) Publication No. 2009–12. https://www.cdc.gov/niosh/docs/2009-125/pdfs/2009-125.pdf?id=10.26616/NIOSHPUB2009125 (lest 2.8.2020)
Hensten -Pettersen A. Section 4. General Toxicology. In: Biocompatibility, toxicity and Hypersensitivity to alloy systems Used in Dentistry. International workshop, June, 1985. Lang BR, Morris HF, Razzoog ME. (eds). The University of Michigan, Ann Arbor, MI, USA, 1986; pp. 143-91.
OSHA, U.S. Occupational Safety and Health Administration. Particulate Mercury in Workplace Atmospheres. Sampling and Analytical Method. OSHA Method ID-145, 1987, Revised Dec 1989. https://www.osha.gov/dts/sltc/methods/inorganic/id145/id145.html (lest 2.8.2020)
Hammerstrøm KT, Holte HH, Dalsbø TK, Vist GE, Steiro A, Lidal IB, et al. Kvikksølveksponering hos tannhelsepersonell. Rapport fra Kunnskapssenteret nr 2 - 2011. Oslo: Nasjonalt kunnskapssenter for helsetjenesten, 2011. https://www.fhi.no/globalassets/dokumenterfiler/rapporter/2011/rapport_2011_02_kvikksoelv_eksponering.pdf (lest 2.8.2020)
Van Landuyt KL, Hellack B, Van Meerbeek B, Peumans M, Hoet P, Wiemann M, et al. Nanoparticle release from dental composites. Acta Biomater. 2014; 10: 365-74. https://doi.org/0.1016/j.actbio.2013.09.044
Wataha JC. Predicting clinical biological responses to dental materials. Dent Mater. 2012; 28: 23-40. https://doi.org/10.1016/j.dental.2011.08.595
Brune D, Beltesbrekke H. Dust in dental laboratories. Part I: Types and levels in specific operations. J Prosthet Dent. 1980; 43: 687-92. https://doi.org/10.1016/0022-3913(80)90385-6
Brune D, Beltesbrekke H. Dust in dental laboratories. Part II: Measurement of particle size distributions. J Prosthet Dent. 1980; 44: 82-7. https://doi.org/10.1016/0022-3913(80)90053-0
Nett RJ, Cummings KJ, Cannon B, Cox-Ganser J, Nathan SD. Dental personnel treated for idiopathic pulmonary fibrosis at a tertiary care center - Virginia, 2000-2015. MMWR. 2018; 67: 270-4. https://doi.org/10.15585/mmwr.mm6709a2
NIOSH, U.S. National Institute for Occupational Safety and Health. Criteria document on Beryllium: National Technical Information Service No. PB 210806. DTS Publ. Dissemination, NIOSH, Cincinnati, 1979.
Hamann CP, DePaola LG, Rodgers PA. Occupation-related allergies in dentistry. J Am Dent Assoc. 2005; 136: 500-10. https://doi.org/10.14219/jada.archive.2005.0207
Rupf S, Berger H, Buchter A, Harth V, Ong MF, Hannig M. Exposure of patient and dental staff to fine and ultrafine particles from scanning spray. Clin Oral Investig. 2015; 19: 823-4. https://doi.org/10.1007/s00784-014-1300-8
Ishihama K, Iida S, Koizumi H, Wada T, Adachi T, Isomura E, et al. High Incidence of Blood Exposure Due to Imperceptible Contaminated Splatters During Oral Surgery. J Oral Maxillofac Surg. 2008; 66: 704-10. https://doi.org/10.1016/j.joms.2007.06.663
Yamada H, Ishihama K, Yasuda K, Hasumi-Nakayama Y, Shimoji S, Furusawa K. Aerial dispersal of blood-contaminated aerosols during dental procedures. Quintessence Int. 2011; 42: 399-405.
Aguilar-Duran L, Bara-Casaus JJ, Aguilar-Duran S, Valmaseda-Castellon E, Figueiredo R. Blood spatter in oral surgery. Prevalence and risk factors. J Am Dent Assoc. 2020; 151: 438-43. https://doi.org/10.1016/j.adaj.2020.02.026
Cleveland JL, Gray SK, Harte JA, Robison VA, Moorman AC, Gooch BF. Transmission of blood-borne pathogens in US dental health care settings: 2016 update. J Am Dent Assoc. 2016; 147: 729-38. https://doi.org/10.1016/j.adaj.2016.03.020
Bennett AM, Fulford MR, Walker JT, Bradshaw DJ, Martin MV, Marsh PD. Microbial Aerosols in General Dental Practice. Br Dent J. 2000; 189: 664-7. https://doi.org/10.1038/sj.bdj.4800859
Kimmerle H, Wiedmann-Al-Ahmad M, Pelz K, Wittmer A, Hellwig E, Al-Ahmad A. Airborne microbes in different dental environments in comparison to a public area. Arch Oral Biol. 2012; 57: 689-96. https://doi.org/10.1016/j.archoralbio.2011.11.012
Helmis CG, Tzoutzas J, Flocas HA, Halios CH, Stathopoulou OI, Assimakopoulos VD, et al. Indoor air quality in a dentistry clinic. Sci Total Environ. 2007; 377: 349-65. https://doi.org/10.1016/j.scitotenv.2007.01.100
Hong YJ, Huang YC, Lee IL, Chiang CM, Lin C, Jeng HA. Assessment of volatile organic compounds and particulate matter in a dental clinic and health risks to clinic personnel. J Environ Sci Health A Tox Hazard Subst Environ Eng. 2015; 50: 1205-14. https://doi.org/10.1080/10934529.2015.1055129
Gussgard AM, Valen H, Olsvik Ø, Jokstad A. Aerosol i tannhelseklinikken. Del 2: Tiltak for å begrense smitte. Nor Tannlegeforen Tid. 2020;
Stetzenbach LD, Buttner MP, Cruz P. Detection and enumeration of airborne biocontaminants. Curr Opion Biotechnol. 2004; 15: 170-4. https://doi.org/10.1016/j.copbio.2004.04.009
Napoli C, Marcotrigiano V, Montagna MT. Air sampling procedures to evaluate microbial contamination: a comparison between active and passive methods in operating theatres. BMC Public Health. 2012; 12: 594. https://doi.org/10.1186/1471-2458-12-594
Viani I, Colucci ME, Pergreffi M, Rossi D, Veronesi L, Bizzarro A, et al. Passive air sampling: the use of the index of microbial air contamination. Acta Biomed. 2020; 91(3-S): 92-105 https://www.mattioli1885journals.com/index.php/actabiomedica/article/view/9434 (lest 2.8.2020)
Santarpia JL, Ratnesar-Shumate S, Haddrell A. Laboratory study of bioaerosols: Traditional test systems, modern approaches, and environmental control. Aerosol Sci Technol. 2020; 54: 585-600. https://doi.org/10.1080/02786826.2019.1696452
Cox J, Mbareche H, Lindsley WG, Duchaine C. Field sampling of indoor bioaerosols. Aerosol Sci Technol. 2020; 54: 572-84. https://doi.org/10.1080/02786826.2019.1688759
Huffman JA, Perring AE, Savage NJ, Clot B, Crouzy B, Tummon F, et al. Real-time sensing of bioaerosols: Review and current perspectives. Aerosol Sci Technol. 2020; 54: 465-95. https://doi.org/10.1080/02786826.2019.1664724
Prussin AJ 2nd, Marr LC, Bibby KJ. Challenges of studying viral aerosol metagenomics and communities in comparison with bacterial and fungal aerosols. FEMS Microbiol Lett. 2014; 357: 1-9. https://doi.org/10.1111/1574-6968.12487
Zemouri C, de Soet H, Crielaard W, Laheij A. A scoping review on bio-aerosols in healthcare and the dental environment. PLoS One. 2017; 12: e0178007. https://doi.org/10.1371/journal.pone.0178007
Decraene V, Ready D, Pratten J, Wilson M. Air-borne microbial contamination of surfaces in a UK dental clinic. J Gen Appl Microbiol. 2008; 54: 195-204. https://doi.org/10.2323/jgam.54.19547
Adhikari A, Kurella S, Banerjee P, Mitra A. Aerosolized bacteria and microbial activity in dental clinics during cleaning procedures. J Aerosol Science. 2017; 114: 209-18. https://doi.org/10.1016/j.jaerosci.2017.09.019
Pasquarella C, Veronesi L, Napoli C, Castiglia P, Liguori G, Rizzetto R, et al. Microbial environmental contamination in Italian dental clinics: A multicenter study yielding recommendations for standardized sampling methods and threshold values. Sci Total Environ. 2012; 420: 289-99. https://doi.org/10.1016/j.scitotenv.2012.01.030
Veronesi L, Colucci ME, Napoli C, Castiglia P, Liguori G, Torre I, et al. Air microbial contamination in dental clinics: comparison between active and passive methods. Acta Biomed. 2020; 91: 165-7. https://www.mattioli1885journals.com/index.php/actabiomedica/article/view/9440/8674 (lest 2.8.2020)
Kadaifciler DG, Cotuk A. Microbial contamination of dental unit waterlines and effect on quality of indoor air. Environ Monit Assess. 2014; 186: 3431-44. https://doi.org/10.1007/s10661-014-3628-6
Zemouri C, Volgenant CMC, Buijs MJ, Crielaard W, Rosema NAM, et al. Dental aerosols: microbial composition and spatial distribution. J Oral Microbiol. 2020; 12: 1762040. https://doi.org/10.1080/20002297.2020.1762040
Liu MH, Tung TH, Chung FF, Chuang LC, Wan GH. High total volatile organic compounds pollution in a hospital dental department. Environ Monit Assess. 2017; 189: 571. https://doi.org/10.1007/s10661-017-6265-z
Gralton J, Tovey E, McLaws ML, Rawlinson WD. The role of particle size in aerosolised pathogen transmission: a review. J Infect. 2011; 62: 1-13. https://doi.org/10.1016/j.jinf.2010.11.010.
Chao CYH, Wan MP, Morawska L, Johnson GR, Ristovski ZD, Hargreaves M, et al. Characterization of expiration air jets and droplet size distributions immediately at the mouth opening. J Aerosol Sci. 2009; 40: 122-33. https://doi.org/10.1016/j.jaerosci.2008.10.003
Kwon SB, Park J, Jang J, Cho Y, Park DS, Kim C, et al. Study on the initial velocity distribution of exhaled air from coughing and speaking. Chemosphere. 2012; 87: 1260-4. https://doi.org/10.1016/j.chemosphere.2012.01.032
Asadi S, Wexler AS, Cappa CD, Barreda S, Bouvier NM, Ristenpart WD. Aerosol emission and superemission during human speech increase with voice loudness. Sci Rep. 2019; 9: 2348. https://doi.org/10.1038/s41598-019-38808-z
Chen W, Zhang N, Wei J, Yen HL, Li Y. Short-range airborne route dominates exposure of respiratory infection during close contact. Build Environm. 2020; 176: 106859. https://doi.org/10.1016/j.buildenv.2020.106859
Bake B, Larsson P, Ljungkvist G, Ljungström E, Olin AC. Exhaled particles and small airways. Respir Res. 2019; 20: 8. https://doi.org/10.1186/s12931-019-0970-9
Davies A, Thomson G, Walker J, Bennett AM. A review of the risks and disease transmission associated with aerosol generating medical procedures. J Infect Prevent. 2009; 10: 122–6. https://doi.org/10.1177/1757177409106456
Tran K, Cimon K, Severn M, Pessoa-Silva CL, Conly J. Aerosol generating procedures and risk of transmission of acute respiratory infections to healthcare workers: a systematic review. PLoS One. 2012; 7: e35797. https://doi.org/10.1371/journal.pone.0035797
WHO, World Health Organization. Infection prevention and control during health care when novel coronavirus (nCoV) infection is suspected. 2020. https://www.who.int/publications-detail/infection-prevention-and-control-during-health-care-when-novel-coronavirus-(ncov)-infection-is-suspected-20200125 (lest 2.8.2020)
WHO, World Health Organization. Infection prevention and control of epidemic- and pandemic-prone acute respiratory infections in health care. Geneva: World Health Organization; 2014. ISBN 9789241507134. https://apps.who.int/iris/bitstream/handle/10665/112656/9789241507134_eng.pdf (lest 2.8.2020)
Tran K, Cimon K, Severn M, Pessoa-Silva CL, Conly J. Aerosol-generating procedures and risk of transmission of acute respiratory diseases: a systematic review. Ottawa, Canadian Agency for Drugs and Technologies in Health, 2011. http://www.cadth.ca/media/pdf/M0023__Aerosol_Generating_Procedures_e.pdf (lest 2.8.2020)
Judson SD, Munster VJ. Nosocomial Transmission of Emerging Viruses via Aerosol-Generating Medical Procedures. Viruses. 2019; 11. pii: E940. https://doi.org/10.3390/v11100940
Brurberg KG, Fretheim A. Aerosol generating procedures in health care, and COVID-19. Rapid review 2020. Oslo: Norwegian Institute of Public Health, 2020. https://www.fhi.no/globalassets/dokumenterfiler/rapporter/2020/aerosol-generating-procedures-in-health-care-and-covid19-rapport-2020.pdf (lest 2.8.2020)
Donovan TE, Boushell LW, Eidson RS. Instruments and Equipment for Tooth Preparation. In: Sturdevant's Art and Science of Operative Dentistry. Ritter AV, Boushell LW, Walter R, Sturdevant CM (eds). 7th ed. Elsevier, 2019: ISBN: 9780323478281 032347828X.
Westland IA. The energy requirement of the dental cutting process. J Oral Rehabil 1980; 7: 51-64. https://doi.org/10.1111/j.1365-2842.1980.tb01464.x
von Fraunhofer JA, Siegel SC, Feldman S. Handpiece coolant flow rates and dental cutting. Oper Dent. 2000; 25: 544-8.
Mount GJ. Cutting instruments used in tooth restoration. In: Preservation and Restoration of Tooth Structure. Mount GJ, Hume WR (Eds). Mosby, 1998: ISBN: 0 7234 3102 7. p. 45-54.
Li QZ, Wang CY, Zheng LJ, Zhao DN, Zeng CF. Machinability of enamel under grinding process using diamond dental burs. Proc Inst Mech Eng H. 2019; 233: 1151-64. https://doi.org/10.1177/0954411919873804
Wu SX, Li KQ, Zhu WZ, Wang CY, Chen WL. Machinability of high-speed enamel cutting with carbide bur. J Mech Behav Biomed Mater. 2020; 103: 103529. https://doi.org/10.1016/j.jmbbm.2019.103529
Riethe P. Über die Infektionsmöglichkeit bei der Anwendung von luftgetriebenen Schnellstlaufgeräten. Dtsch Zahnärtzl Z 1960; 15: 353-7.
Kazantzis PG. Air Contamination from High-Speed Dental Drills. Proc R Soc Med 1961; 54: 242–4. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1870233/pdf/procrsmed00247-0108.pdf
Rølla G. En undersøkelse over luftkontaminasjonen ved bruk av turbin-boremaskin I tannlegepraksis. Nor Tannlegeforen Tid. 1963; 73: 442.
Miller RL, Burton WE, Spore RW. Aerosols produced by dental instrumentation. In: The Role of Aerobiology in Dentistry. Proc First Intern Symp Aerobiol, Berkeley, Calif, 1963. pp. 97-118. https://apps.dtic.mil/dtic/tr/fulltext/u2/614709.pdf (lest 2.8.2020)
Micik RE, Miller RL, Mazzarella MA, Ryge G. Studies on dental aerobiology. I Bacterial aerosols generated during dental procedures. J Dent Res 1969; 48: 49-56. https://doi.org/10.1177/00220345690480012401
Miller RL, Micik RE, Abel C, Ryge G. Studies on dental aerobiology. II. Microbial spatter discharged from the oral cavity of dental patients. J Dent Res 1971; 50: 621-5. https://doi.org/10.1177/00220345710500031701
Martin MV. The air/water syringe: a potential source of microbial contamination. Br Dent J. 1998; 184: 278-9. http://doi.org/10.1038/sj.bdj.4809601
Larato DC, Ruskin PF, Martin A. Effect of an Ultrasonic Scaler on Bacterial Counts in Air. J Periodontol 1967; 38: 550-4. https://doi.org/10.1902/jop.1967.38.6_part1.550
Holbrook WP, Muir KF, Macphee IT, Ross PW. Bacteriological investigation of the aerosol from ultrasonic scalers. Br Dent J 1978; 144: 245-7. https://.doi.org/10.1038/sj.bdj.4804072
Wirthlin MR, Marshall GW. Evaluation of Ultrasonic Scaling Unit Waterline Contamination After Use of Chlorine Dioxide Mouthrinse Lavage. J Periodontol. 2001; 72: 401-10. https://doi.org/10.1902/jop.2001.72.3.401
Marui VC, Souto MLS, Rovai ES, Romito GA, Chambrone L, Pannuti CM. Efficacy of preprocedural mouthrinses in the reduction of microorganisms in aerosol: A systematic review. J Am Dent Assoc. 2019; 150: 1015-26. https://doi.org/10.1016/j.adaj.2019.06.024
eHOMD. The expanded Human Oral Microbiome Database. http://www.homd.org/index.php
Pride DT, Salzman J, Haynes M, Rohwer F, Davis-Long C, White RA 3rd, et al. Evidence of a robust resident bacteriophage population revealed through analysis of the human salivary virome. ISME J. 2012; 6: 915-26. https://doi.org/10.1038/ismej.2011.169
Wylie KM, Mihindukulasuriya KA, Zhou Y, Sodergren E, Storch GA, Weinstock GM. Metagenomic analysis of double-stranded DNA viruses in healthy adults. BMC Biol. 2014; 12: 71. https://doi.org/10.1186/s12915-014-0071-7
Kilian M, Chapple ILC, Hannig M, Marsh PD, Meuric V, Pedersen AML, et al. Det orale mikrobiom - en opdatering for tandplejeteamet. Nor Tannlegeforen Tid. 2017; 127: 398-411. https://www.tannlegetidende.no/i/2017/5/d2e455 (lest 2.8.2020)
Baker JL, Bor B, Agnello M, Shi W, He X. Ecology of the Oral Microbiome: Beyond Bacteria. Trends Microbiol. 2017; 25: 362-74. https://doi.org/10.1016/j.tim.2016.12.012
Xiao J, Fiscella KA, Gill SR. Oral microbiome: possible harbinger for children's health. Int J Oral Sci. 2020; 12: 12. https://doi.org/10.1038/s41368-020-0082-x
Jones RM, Brosseau LM. Aerosol transmission of infectious disease. J Occup Environ Med. 2015; 57: 501–508. https://doi.org/10.1097/JOM.0000000000000448
Tellier R, Li Y, Cowling BJ, Tang JW. Recognition of aerosol transmission of infectious agents: A commentary. BMC Infect Dis. 2019; 19: 101. https://doi.org/10.1186/s12879-019-3707-y
Roy CJ, Milton DK. Airborne transmission of communicable infection-the elusive pathway. N Engl J Med. 2004; 350: 1710-1712. https://doi.org/10.1056/NEJMp048051
Siegel JD, Rhinehart E, Jackson M, Chiarello L; Health Care Infection Control Practices Advisory Committee. 2007 Guideline for Isolation Precautions: Preventing Transmission of Infectious Agents in Health Care Settings. Am J Infect Control. 2007; 35(10 Suppl 2): S65-S164. https://doi.org/10.1016/j.ajic.2007.10.007
Tang JW, Wilson P, Shetty N, Noakes CJ. Aerosol-Transmitted Infections-a New Consideration for Public Health and Infection Control Teams. Curr Treat Options Infect Dis. 2015; 7: 176-201. https://doi.org/10.1007/s40506-015-0057-1
Wei J, Li Y. Airborne spread of infectious agents in the indoor environment. Am J Infect Control. 2016; 44(9 Suppl): S102-8. https://doi.org/10.1016/j.ajic.2016.06.003
Shreve WB, Wachtel LW. Effect of Extraneous Particulate Matter on Airborne Bacteria. J Dent Res 1970; 49: 589-92. https://doi.org/10.1177/00220345700490032101
Laheij AM, Kistler JO, Belibasakis GN, Välimaa H, de Soet JJ; European Oral Microbiology Workshop (EOMW) 2011. Healthcare-associated viral and bacterial infections in dentistry. J Oral Microbiol. 2012; 4. https://doi.org/10.3402/jom.v4i0.17659
SSI, Statens Serum Institut. Nationale infektionshygieniske retningslinjer. P. 13. 2019. https://hygiejne.ssi.dk/-/media/arkiv/subsites/infektionshygiejne/retningslinjer/nir/nir-tandklinikker.pdf (lest 2.8.2020)
Pankhurst CL, Coulter WA. Do contaminated dental unit waterlines pose a risk of infection? J Dent. 2007; 35: 712-20. https://doi.org/10.1016/j.jdent.2007.06.002
Singh TS, Bello B, Mabe OD, Renton K, Jeebhay MF. Workplace determinants of endotoxin exposure in dental healthcare facilities in South Africa. Ann Occup Hyg. 2010; 54: 299-308. https://doi.org/10.1093/annhyg/mep095
Skaug N, Nielsen Ø, Lofthus B. Mikrokontaminasjon av vann fra dentaluniter i Norge. Nor Tannlegeforen Tid. 2005, 115: 260-5. https://www.tannlegetidende.no/asset/2005/P05-05-260-4.pdf (lest 2.8.2020)
Shaw AB. Tuberculosis in medical and dental students: a study at Guy's hospital. Lancet 1952; 260: 400-4. https://doi.org/10.1016/S0140-6736(52)90218-3
Smith WH, Davies D, Mason KD, Onions JP. Intraoral and pulmonary tuberculosis following dental treatment. Lancet. 1982; 1(8276): 842-4. https://doi.org/10.1016/s0140-6736(82)91886-4
Petti S. Tuberculosis: Occupational risk among dental healthcare workers and risk for infection among dental patients. A meta-narrative review. J Dent. 2016; 49: 1-8. https://doi.org/10.1016/j.jdent.2016.05.003
Cleveland JL, Kent J, Gooch BF, Valway SE, Marianos DW, Butler WR, et al. Multidrug-resistant Mycobacterium tuberculosis in an HIV dental clinic. Infect Control Hosp Epidemiol. 1995; 16: 7–11. https://doi.org/10.1086/646995
Samaranayake P. Re-emergence of tuberculosis and its variants: implications for dentistry. Int Dent J. 2002; 52: 330-6. https://doi.org/10.1002/j.1875-595x.2002.tb00880.x
Cleveland JL, Robison VA, Panlilio AL. Tuberculosis epidemiology, diagnosis and infection control recommendations for dental settings: an update on the Centers for Disease Control and Prevention guidelines. J Am Dent Assoc. 2009; 140: 1092-9. https://doi.org/10.14219/jada.archive.2009.0335
Merte JL, Kroll CM, Collins AS, Melnick AL. An epidemiologic investigation of occupational transmission of Mycobacterium tuberculosis infection to dental health care personnel. J Am Dent Assoc. 2014; 145: 464-71. https://doi.org/10.14219/jada.2013.52
Atlas RM, Williams JF, Huntington MK. Legionella Contamination of Dental-Unit Waters. Appl Environ Microbiol. 1995; 61: 1208-13. https://aem.asm.org/content/61/4/1208 (lest 2.8.2020)
Olsen I, Jantzen E, Skaug N. Legionella og andre mikrober i vann fra dentaluniter – et helseproblem? Nor Tannlegeforen Tid. 2002; 112: 374-9. https://www.tannlegetidende.no/i/2002/7/dntt-30253 (lest 2.8.2020)
Dutil S, Veillette M, Mériaux A, Lazure L, Barbeau J, Duchaine C. Aerosolization of mycobacteria and legionellae during dental treatment: Low exposure despite dental unit contamination. Environ Microbiol. 2007; 9: 2836-43. https://doi.org/10.1111/j.1462-2920.2007.01395.x
Ricci ML, Fontana S, Pinci F, Fiumana E, Pedna MF, Farolfi P, et al. Pneumonia associated with a dental unit waterline. Lancet. 2012; 379(9816): 684. https://doi.org/10.1016/S0140-6736(12)60074-9 .
Petti S. The Chicken-Egg Dilemma: Legionnaires' Disease and Retrograde Contamination of Dental Unit Waterlines. Infect Control Hosp Epidemiol. 2016; 37: 1258-60. https://doi.org/10.1017/ice.2016.184 .
Estrich CG, Gruninger SE, Lipman RD. Rates and predictors of exposure to Legionella pneumophila in the United States among dental practitioners. J Am Dent Assoc. 2017; 148 : 164-71. https://doi.org/10.1016/j.adaj.2016.11.032
Petti S, Vitali M. Occupational risk for legionella infection among dental healthcare workers: meta-analysis in occupational epidemiology. BMJ Open. 2017; 7: e015375. https://doi.org/10.1136/bmjopen-2016-015374
Fotos PG, Westfall HN, Snyder IS, Miller RW, Mutchler BM. Prevalence of Legionella-specific IgG and IgM antibody in a dental clinic population. J Dent Res 1985; 64: 1382–5. https://doi.org/10.1177/00220345850640121101
Reinthaler FF, Mascher F, Stunzner. Serological examinations for antibodies against Legionella species in dental personnel. J Dent Res 1988; 67: 942–3. https://doi.org/10.1177/00220345880670061001
Graham FF, Hales S, White PS, Baker MG. Review Global seroprevalence of legionellosis - a systematic review and meta-analysis. Sci Rep. 2020; 10: 7337. https://doi.org/10.1038/s41598-020-63740-y
Davies KJ, Herbert AM, Westmoreland D, Bagg J. Seroepidemiological study of respiratory virus infections among dental surgeons. Br Dent J 1994, 176: 262-5. https://doi.org/10.1038/sj.bdj.4808430
Corstjens PL, Abrams WR, Malamud D. Detecting viruses by using salivary diagnostics. J Am Dent Assoc. 2012; 143(10 Suppl): 12S‐18S. https://doi.org/10.14219/jada.archive.2012.0338
Slots J, Slots H. Bacterial and viral pathogens in saliva: disease relationship and infectious risk. Periodontol 2000. 2011; 55: 48-69. https://doi.org/10.1111/j.1600-0757.2010.00361.x
Corstjens PL, Abrams WR, Malamud D. Saliva and viral infections. Periodontol 2000. 2016; 70: 93-110. https://doi.org/10.1111/prd.12112
Niedrig M, Patel P, El Wahed AA, Schädler R, Yactayo S. Find the right sample: A study on the versatility of saliva and urine samples for the diagnosis of emerging viruses. BMC Infect Dis. 2018; 18: 707. https://doi.org/10.1186/s12879-018-3611-x
Bing-Yuan, Zhang YH, Leung NHL, Cowling BJ, Yang ZF. Role of viral bioaerosols in nosocomial infections and measures for prevention and control. J Aerosol Sci. 2018; 117: 200-11. https://doi.org/10.1016/j.jaerosci.2017.11.011
Flint SR, Croser D, Reznik D, Glick M, Naidoo S, Coogan M. HIV transmission in the dental setting and the HIV-infected oral health care professional: workshop 1C. Adv Dent Res. 2011; 23: 106-11. https://doi.org/10.1177/0022034511400075 .
Goh KT, Chan YW, Wong LY, Kong KH, Oon CJ, Guan R. The Prevalence of Hepatitis B Virus Markers in Dental Personnel in Singapore. Trans R Soc Trop Med Hyg. 1988; 82: 908-10. https://doi.org/10.1016/0035-9203(88)90038-7
Reingold AL, Kane MA, Hightower AW. Failure of Gloves and Other Protective Devices to Prevent Transmission of Hepatitis B Virus to Oral Surgeons. JAMA. 1988; 259: 2558-60. https://doi.org/10.1001/jama.1988.03720170034029
Ammon A, Reichart PA, Pauli G, Petersen LR. Hepatitis B and C Among Berlin Dental Personnel: Incidence, Risk Factors, and Effectiveness of Barrier Prevention Measures. Epidemiol Infect. 2000; 125: 407-13. https://doi.org/10.1017/s0950268899004537
Petersen NJ, Bond WW, Favero MS. Air Sampling for Hepatitis B Surface Antigen in a Dental Operatory. J Am Dent Assoc. 1979; 99: 465-7. https://doi.org/10.14219/jada.archive.1979.0326
Redd JT, Baumbach J, Kohn W, Nainan O, Khristova M, Williams I. Patient-to-patient transmission of hepatitis B virus associated with oral surgery. J Infect Dis. 2007; 195: 1311–4. https://doi.org/10.1086/513435
Yan J, Grantham M, Pantelic J, Bueno de Mesquita PJ, Albert B, Liu F, et al. Infectious virus in exhaled breath of symptomatic seasonal influenza cases from a college community. PNAS. 2018; 115; 1081-6. https://doi.org/10.1073/pnas.1716561115
Wang WK, Chen SY, Liu IJ, Chen YC, Chen HL, Yang CF, et al. Detection of SARS-associated coronavirus in throat wash and saliva in early diagnosis. Emerg Infect Dis. 2004; 10: 1213–9. https://doi.org /10.3201/eid1007.031113
Cheng VC, Chan JF, To KK, Yuen KY. Clinical management and infection control of SARS: lessons learned. Antiviral Res. 2013; 100: 407-19. https://doi.org/10.1016/j.antiviral.2013.08.016
Yu IT, Li Y, Wong TW, Tam W, Chan AT, Lee JH, et al. Evidence of airborne transmission of the severe acute respiratory syndrome virus. N Engl J Med. 2004; 350: 1731-9. https://doi.org/10.1056/NEJMoa032867
WHO, World Health Organization. Modes of transmission of virus causing COVID-19: implications for IPC precaution recommendations. V. 29.3. WHO/2019-nCoV/Sci_Brief/Transmission_modes/2020.2. Først publisert 28 mars 2020. Oppdatert 9 juli 2020. https://www.who.int/news-room/commentaries/detail/modes-of-transmission-of-virus-causing-covid-19-implications-for-ipc-precaution-recommendations (lest 2.8.2020)
Brurberg KG. SARS-CoV-2, MERS-CoV og SARS-CoV og risiko for luftbåren smitte – en hurtigoversikt. Hurtigoversikt 2020. Oslo: Folkehelseinstituttet, 2020. https://www.fhi.no/globalassets/dokumenterfiler/rapporter/2020/sars-cov-2-mers-cov-og-sars-cov-og-risiko-for-luftbaren-smitte-rapport-2020-v2.pdf (lest 2.8.2020)
Liu Y, Ning Z, Chen Y, Guo M, Liu Y, Gali NK, et al. Aerodynamic analysis of SARS-CoV-2 in two Wuhan hospitals. Nature. 2020 Apr 27. https://doi.org/10.1038/s41586-020-2271-3
Xu J, Li Y, Gan F, Du Y, Yao Y. Salivary Glands: Potential Reservoirs for COVID-19 Asymptomatic Infection. J Dent Res. 2020: 22034520918518. https://doi.org/10.1177/0022034520918518 16.
Xu R, Cui B, Duan X, Zhang P, Zhou X, Yuan Q. Saliva: potential diagnostic value and transmission of 2019-nCoV. Int J Oral Sci. 2020; 12: 11. https://doi.org/10.1038/s41368-020-0080-z
Liu L, Wei Q, Alvarez X, Wang H, Du Y, Zhu H, et al. Epithelial cells lining salivary gland ducts are early target cells of severe acute respiratory syndrome coronavirus infection in the upper respiratory tracts of rhesus macaques. J Virol. 2011; 85: 4025-4030. https://doi.org/10.1128/JVI.02292-10.
Xu H, Zhong L, Deng J, Peng J, Dan H, Zeng X, et al. High expression of ACE2 receptor of 2019-nCoV on the epithelial cells of oral mucosa. Int J Oral Sci. 2020c; 12: 8. https://doi.org/10.1038/s41368-020-0074-x
To KK, Tsang OT, Chik-Yan Yip C, Chan KH, Wu TC, Chan JMC, et al. Consistent detection of 2019 novel coronavirus in saliva. Clin Infect Dis. 2020a. pii: ciaa149. https://doi.org/10.1093/cid/ciaa149
To KK, Tsang OT, Leung WS, Tam AR, Wu TC, Lung DC, et al. Temporal profiles of viral load in posterior oropharyngeal saliva samples and serum antibody responses during infection by SARS-CoV-2: an observational cohort study. Lancet Infect Dis. 2020b, pii: S1473-3099(20)30196-1. https://doi.org/10.1016/S1473-3099(20)30196-1
Juvet LK, Lauvrak V. Spyttprøver for testing av SARS-CoV-2 infeksjon - en hurtigoversikt. Oslo: Folkehelseinstituttet, 2020.05.08. https://www.fhi.no/publ/2020/Spyttprover-for-testing-av-SARS-CoV-2-infeksjon (lest 2.8.2020)
Brune DK, Edling C. Occupational Hazards in the Health Professions. CRC Press, 1989. ISBN 0849369312
Burton WE, Miller RL. The role of aerosobiology in dentistry. Proc First Intern Symp Aerobiol, Berkeley, Calif, 1963. p. 89. https://apps.dtic.mil/dtic/tr/fulltext/u2/614709.pdf#https://apps.dtic.mil/dtic/tr/fulltext/u2/614709.pdf (lest 2.8.2020)
GPMB, Global Preparedness Monitoring Board. A world at risk: annual report on global preparedness for health emergencies. World Health Organization. ISBN 9789241517010. 2019. https://apps.who.int/gpmb/assets/annual_report/GPMB_annualreport_2019.pdf (lest 2.8.2020)
English summary
Aerosols in the dental clinic. Part 1: Risks of infectious disease transmission
Aerosol-generating procedures associated with oral care may involve risks for disease transmission between patients and dental staff. Article part I describes characteristics of aerosols and possible influence on health. This paper focuses on microbial aerosols and on situations and procedures that produce microbial aerosols in the dental clinic. Several forms of microbial aerosols are created in a dental clinic, and the highest aerosol-generation is by use of rotating instruments, the air-water syringe, and machine scaling. Risks of aerosol transmission of infectious diseases are described with examples of some bacterial and viral contagious diseases in the dental clinic. Dental clinic staff should be aware of possible health consequences of aerosols in the dental operatory, to prevent spreading infectious diseases. Such knowledge is essential to ensure the health of both patients and the dental clinic staff.
Korresponderende forfatter: Anne M. Gussgard, Institutt for klinisk odontologi, UiT Norges arktiske universitet, Postboks 6050 Langnes, 9037 Tromsø, Norge. E-post: anne.m.gussgard@uit.no
Artikkelen har gjennomgått ekstern faglig vurdering.
Akseptert for publisering 10.08.2020
Gussgard AM, Valen H, Olsvik Ø, Jokstad A. Aerosol i tannhelseklinikken. Del 1: Risiko for smitte. Nor Tannlegeforen Tid. 2020; 130: 676–87
Norsk MeSH: Aerosoler; Tannlegekontorer; Infeksjonskontroll; Kliniske prosedyreanbefalinger; Risiko; Oversikt
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Gussgard AM, Valen H, Olsvik Ø, Jokstad A. Aerosol i tannhelseklinikken Del 1: Risiko for smitte. Nor Tannlegeforen Tid. 2020;131:676-87. doi:10.56373/2020-9-3