Legemiddelbivirkninger i munnhulen
Bakgrunn. En av de eldste og fortsatt valide dogmer innen medisinen er at munnhulen er kroppens speil. Sykdomsmanifestasjoner i munnen kan fortelle om sykdommer andre steder i kroppen. Omvendt kan praktisk talt alle sykdomstilstander i munnhulen imiteres av legemiddelbivirkninger.
Materiale og metode. Relevant litteratur ble funnet gjennom søk i databasene Medline og Google Scholar, samt ved gjennomgang av referanselistene i sentrale artikler fra disse søkene og annen tilgjengelig litteratur.
Resultater og fortolkning. Legemiddelbivirkninger i munnregionen kan likne flere sykdommer, for eksempel lichen planus, erythema multiforme og pemfigus. Som oftest er imidlertid de orale symptomene uspesifikke, som ved munntørrhet, den vanligste orale bivirkning av legemidler. Medikamentindusert gingival hyperplasi er en karakteristisk bivirkning som det vanligvis er enkelt å diagnostisere. Også urtemedisin kan gi orale bivirkninger. Bisfosfonatassosiert kjevebeinnekrose, som først ble rapportert i 2003, har i den senere tid fått betydelig oppmerksomhet.
For hundre år siden ble syfilis beskrevet som «den store imitator», fordi sykdommen kunne etterlikne, mimikere, praktisk talt hver eneste sykdomsmanifestasjon. Medikamentelle bivirkninger har i våre dager overtatt denne rollen. Det gjelder også i munnhulen, der nesten alle sykdomstilstander kan imiteres av legemiddelbivirkninger. Et eksempel på en karakteristisk og relativt lett diagnostiserbar oral bivirkning er medikamentinduserte gingivale hyperplasier (Figur 1) (1). De orale symptomene er imidlertid ofte uspesifikke, som for eksempel ved medikamentindusert erythema multiforme. Spørsmål om bruk av legemidler er alltid relevant ved utredning av sykdomstilstander i munnregionen.
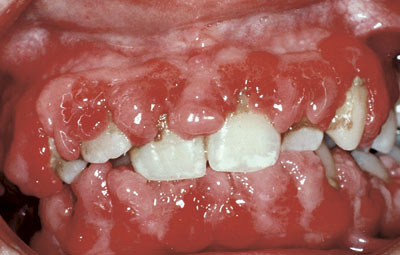
Figur 1. Gingival hyperplasi hos en 28 år gammel mann som etter nyretransplantasjon er behandlet med ciklosporin og nifedipin i seks måneder. Begge disse medikamentene kan indusere tannkjøtthyperplasi (1). Gjengitt med tillatelse av R.A. Seymour, Newcastle.
Oversikter over orale legemiddelbivirkninger er stort sett basert på kasuistikker og angivelser fra små pasientgrupper (2 – 6). For kun få medikamenter er det publisert velkontrollerte studier av orale bivirkninger. En undersøkelse i USA i 1992 viste at for de 200 medikamentene som oftest ble forskrevet, var de hyppigst angitte orale bivirkninger munntørrhet (80 %), smaksforstyrrelser (47 %) og stomatitt (34 %) (7).
Munntørrhet og spyttflod
Munntørrhet er ikke noe entydig begrep. Det bør skilles mellom xerostomi og hyposalivasjon. Xerostomi er den subjektive følelsen av å være tørr i munnen, hyposalivasjon innebærer en målbar reduksjon av spyttproduksjonen. Ofte er de to tilstandene sammenfallende, men ikke alltid. Det er mange årsaker til munntørrhet, og medikamentbruk er den vanligste. Munntørrhet er en potensiell bivirkning av mer enn 500 medikamenter. Ved medikamentindusert munntørrhet er endring av medisineringen en mulighet, men ofte må det satses på symptomlindring og forebygging av skader. En mer utførlig redegjørelse om medikamenter og munntørrhet er publisert i Tidende (8), artikkelen inneholder blant annet en tabell over de mest aktuelle legemidler.
Spyttflod (ptyalisme) er langt mindre vanlig enn munntørrhet. Når det synes å være for meget spytt, slik at pasienten sikler, skyldes det oftere problemer med svelging enn reell overproduksjon (3). Farmaka som stimulerer kolinerge reseptorer kan gi økt spyttsekresjon. Ved bruk av kolinesterasehemmere som neostigmin er hypersalivasjon en velkjent effekt. Det er også rapportert at kaptopril, litium, nitrazepam og ketamin kan føre til økt sekresjon (3).
Effektene av det antipsykotiske midlet klozapin på spyttsekresjonen illustrerer noe av kompleksiteten i reguleringen av salivaproduksjonen. Klozapin gir spyttflod hos 30 – 50 % av pasientene, særlig om natten, beskrevet som våt pute-fenomenet. Dette kan virke overraskende, fordi midlet har en kraftig antikolinerg effekt som hos andre gir munntørrhet. Hvorfor klozapin gir hypersalivasjon hos noen og munntørrhet hos andre, er uklart og omdiskutert (9).
Smaksforstyrrelser
Sammen med luftveisinfeksjoner og mangelfullt kosthold er legemidler den vanligste årsak til forandringer i smaksopplevelsen, og det i ca. 30 % av tilfellene (10, 11). Insidensen av medikamentelle smaksforstyrrelser øker med stigende alder. Dette kan delvis bero på samtidig økning i forekomsten av medikamentbetinget munntørrhet (12). Smaksforstyrrelsene kan ytre seg forskjellig: bitter eller metallisk smak, endret smak slik at for eksempel surt smaker søtt, nedsatt følsomhet eller tap av smak; avsmak for mat eller medikamentsmak. Luktesansen kan også være affisert. Ikke minst hos gamle kan slike forstyrrelser forringe livskvaliteten, føre til ikke-etterlevelse av medisineringsopplegg, og gi nedsatt appetitt, vekttap og depresjon (11).
Antihypertensiver og serum-lipidsenkende midler
Mer enn en tredel av disse vanlig brukte farmaka kan forandre opplevelsen av smak og lukt (11). ACE-hemmere kan gi metallisk, bitter eller sur smak som skjuler andre smaksopplevelser (12). Mellom ACE-hemmerne er det forskjeller i insidens av smaksforstyrrelser, som vist i en stor studie der insidensen var 3,1 % med kaptopril og 0,5 % med enalapril. Smaksfunksjonen normaliseres vanligvis i løpet av noen dager etter seponering (11). Disse smaksforstyrrelsene antas å bero på sinkmangel, økt lokal konsentrasjon av bradykinin eller ennå uidentifiserte mekanismer (12). Noen angiotensin-II-reseptorantagonister kan også gi smaksforandringer, for eksempel losartan, men ikke så ofte som ACE-hemmere. De fleste kalsiumantagonistene kan gi smakforstyrrelser, også alle de fem statinene som er på markedet i Norge (11). Etter bruk av adrenerge blokkere, antiarytmika og diuretika er smaksforstyrrelser mer uvanlig.
Andre medikamenter
Om lag 200 legemidler er assosiert med smaksforstyrrelser (10, 13). Blant dem som kan gi metallsmak er sovemidlet zopiklon, giktmidlet allopurinol og diabetesmidlet glipizid (13). Smaksforstyrrelser av varierende karakter er forbundet med legemidler som baklofen, klorheksidin, levodopa, litium, metronidazol og terbinafin, samt medikamentgrupper som antibiotika (betalaktamantibiotika, makrolider og tetrasykliner), antidepressiver, proteasehemmere ved HIV-infeksjon, antineoplastiske og immunmodulerende midler, epilepsimidler, H2-reseptorantagonister, ikke-steroide antiinflammatoriske legemidler (NSAID) og protonpumpehemmere (2, 3, 12, 13). For mange medikamenter er det uoverensstemmelser i litteraturen når det gjelder smaksforstyrrelsens karakter og hyppighet.
Smaksforstyrrelser kan skyldes dysfunksjon i smaksløkenes ionekanaler eller påvirkning av intracellulære budbringere slik at smaksstimuli mistolkes (12). Ioner som kalsium spiller en viktig rolle i disse prosessene. Sink angis å være av betydning for normal smakssans og luktesans. Danning av sinkkelater kan spille en nøkkelrolle ved medikamentinduserte smaksforstyrrelser (10). Introduksjon av sinksalter i behandlingen av slike forstyrrelser har imidlertid ikke gitt entydige resultater.
Stomatitt
Stomatitt er en uspesifikk sekkediagnose som kan omfatte mange legemiddelreaksjoner, gjerne klassifisert som stomatitis venenata eller stomatitis medicamentosa. Førstnevnte betegner en allergisk reaksjon eller irritasjonsreaksjon på overflateappliserte medikamenter, sistnevnte betegner stomatitt utløst av systemisk virkende medikamenter (3).
Ulcerasjoner
Den vanligste intraorale ulcerasjon er rekurrent aftøs stomatitt (15 – 20 % av befolkningen). Det overflateaktive stoffet natriumlaurylsulfat, som blant annet inngår i de fleste tannkremer, kan ødelegge den beskyttende orale spytthinnen og disponere for afteliknende lesjoner (14). Medikamentinduserte afteliknende ulcerasjoner er rapporter for rekke legemidler, blant annet betablokkere, NSAID-preparater, kaptopril, tacrolimus og sulfonamider (2). For betablokkere og NSAID-midler er assosiasjonen med orale ulcerasjoner bekreftet i en kontrollert studie (15). Den patogene mekanismen er fortsatt uklar.
Lokalt appliserte medikamenter, for eksempel acetylsalisylsyretabletter bukkalt ved tannpine eller pancreasenzympreparater, kan forårsake ulcerasjoner ved henholdsvis etsing og enzymatisk aktivitet. Mange medikamenter som brukes i behandling av kreft, kan gi dype, smertefulle ulcerasjoner, for eksempel metotreksat, fluorouracil og merkaptopurin (4). Sår kan oppstå i løpet av dager etter behandlingsstart og være inngangsport for systemiske infeksjoner.
Fast lokalisert utbrudd
Fast lokalisert utbrudd (fixed drug eruption) er en medikamentutløst immunologisk reaksjon som opptrer på samme sted(er) hver gang pasienten får medikamentet. Lesjonene kan være lokalisert i munnhulen eller opptre samtidig med lesjoner på andre slimhinner og manifestere seg som ulcerasjoner, vesikler, erytematøse flekker eller overflatiske erosjoner. Til å begynne med er det vanligvis enkeltlesjoner, men de kan bli mange ved gjentatt medikamenteksponering (4). Mange legemidler kan utløse fast lokalisert utbrudd, slik som sulfonamider, tetrasykliner, barbiturater, fenytoin, paracetamol og andre NSAID-midler.
Lichenoide legemiddelreaksjoner
Lichen planus er en mukokutan sykdom med uklar etiologi. Det er karakteristisk morfologi, med nettformede eller ringformede hvite striper, sjelden ulcerasjoner og vesikler. Ved lichenoide legemiddelreaksjoner er det liknende kliniske og histologiske funn som ved vanlig lichen planus, men de skiller seg fra lichen planus ved at de forsvinner når det aktuelle legemidlet seponeres (16). Lesjonene kan persistere i lang tid etter seponering (17). Blant de mest aktuelle medikamenter er NSAID-midler og ACE-hemmere (4), men legemidler fra omtrent alle terapigrupper er blitt assosiert med lichenoide legemiddelreaksjoner.
Det er nylig vist en signifikant assosiasjon mellom lichen planus eller lichenoide legemiddelreaksjoner og inntak av medikamenter som metaboliseres av polymorfe cytokrom P-450-enzymer med risiko for genetisk betinget langsom metabolisme hos noen mennesker. Dette tyder på at enkelte av disse reaksjonene kan ha en farmakologisk patogenese relatert til manglende, ikke-funksjonelle eller inhiberte cytokromenzymer (17).
Pemfigoide lesjoner
Minst 30 medikamenter er knyttet til pemfigoide eller andre vesikulære slimhinneaffeksjoner, for eksempel sulfonamider, NSAID-midler, legemidler mot hjerte- og karsykdommer og betalaktamantibiotika (2). Oral mucosa kan være den eneste affiserte slimhinne. Bortsett fra at munnslimhinnen ofte er involvert, spesielt ved penicillamin, er andre kliniske kjennetegn for medikamentindusert pemfigoid yngre alder enn det som er vanlig ved idiopatisk pemfigoid og tilheling når medikamentet seponeres (3, 4).
Erythema multiforme
Dette er et syndrom med symmetriske mukokutane lesjoner som typisk kan affisere munnregionen, hender og føtter. Det starter som erytem, og i løpet av timer kan det dannes vesikler og erosjoner. Når syndromet er medikamentutløst, inntreffer det vanligvis etter 1 – 3 ukers behandling (5, 6). Barbiturater, NSAID-midler, sulfonamider, antibiotika og gull er blant de mange medikamenter som er assosiert med erythema multiforme. Det kan være umulig klinisk å skille medikamentindusert erythema multiforme fra erytem av annen årsak (2).
Mens herpes simplex-virus er den dominerende utløsende faktor (70 – 80 %) ved erythema multiforme, utløser medikamenter 80 – 95 % av tilfellene av toksisk epidermal nekrolyse og mer enn 50 % av tilfellene av Stevens-Johnsons syndrom (18).
Opportunistiske infeksjoner
To viktige faktorer for munnhulens helsetilstand er spyttet og den orale mikroflora. Spytt er svært rikt på antimikrobielle faktorer. Det fungerer imidlertid som et selektivt medium for mikrobevekst. Saliva gir næring til og tillater tilstedeværelse av tolerable mengder av mikrober som normalt ikke er patogene. Disse bidrar til å hindre kolonisering av patogener. Både lokalt og systemisk virkende antimikrobielle stoffer kan fremkalle superinfeksjoner ved å forårsake endringer i munnhulens økosystem.
Overvekst av sopp, vanligvis Candida albicans, er en typisk superinfeksjon i munnhulen som særlig oppstår ved behandling med bredspektrede antibiotika. Slike infeksjoner kan også oppstå når for eksempel cytostatika eller immunsuppressiver interfererer med kroppens forsvarsmekanismer. Likeledes ved bruk av glukokortikoider, både ved inhalasjon eller systemisk administrasjon.
Pigmentering av munnslimhinne og tenner
Metaller som sølv, gull, vismut og kvikksølv var tidligere den vanligste årsaken til vevsmisfarvinger. Typisk var fargeforandringer langs tannkjøttranden forårsaket av metallsulfider dannet ved reaksjon mellom metallene og produkter fra plakk i tannkjøttlommen (5). Medikamenter assosiert med pigmentering av munnslimhinnen omfatter blant annet zidovudin, østrogen, cyklofosfamid, ketokonazol, doksorubicin, fluorouracil, fentiaziner og antimalariamidler (19).
Minocyklin er et tetrasyklin som er mye brukt i andre land, særlig mot akne. Det kan gi utbredt blå, blågrå eller brun pigmentering av tannkjøtt, munnslimhinne og tunge. Pigmenteringen kan delvis avspeile misfarging av underliggende bein og tannrøtter (2). Minocyklin og fentiaziner kan ved direkte reaksjon med melanin danne medikament-pigment-komplekser (19). Det er vel kjent at tetrasykliner kan misfarge og irreversibelt skade tenner under danning. De bør derfor ikke gis til gravide eller barn under 12 år.
Mange stoffer, også i mat og drikke, kan gi overflatisk misfarging i munnhulen. Det samme kan medikamenter som for eksempel jernsalter, vismut, klorheksidin og antibiotika.
Medikamentrelaterte hevelser
Medikamentinduserte slimhinnehevelser er ofte av allergisk karakter og affiserer fortrinnsvis leppene og tungen. Angioødem i uvularegionen kan være livstruende, men forekommer sjelden (4). ACE-hemmere, NSAID-midler, barbiturater og antibiotika, ikke minst penicilliner, er legemidler som er forbundet med angioødem.
ACE-hemmere er implisert i om lag en tredel av alle tilfeller av angioødem (20). Det er da vanligvis ikke en immunologisk, men en anafylaktoid reaksjon. ACE-hemmerindusert angioødem skyldes sannsynligvis økt mengde bradykinin og andre inflammasjonsmediatorer, samt genetiske og/eller miljøfaktorer (3, 21). Rapporterte tilfeller av angioødem med de nyere angiotensin-II-reseptorantagonistene, uten bradykininøkning, viser at etiologien fortsatt er uklar (20).
Kusmaliknende spyttkjertelhevelse, vanligvis bilateral, er rapportert som bivirkning av blant annet NSAID-midler, sulfonamider, fentiaziner, klorheksidin og intravenøse kontrastmedier.
Sukkerholdige medikamenter
I 1960- og 70-årene var det mye oppmerksomhet omkring kariesrisikoen ved bruk av sukkerholdige medikamenter. Dette er nå et lite problem i forhold til andre former for sukkerinntak. Problemet er redusert fordi det er færre sukkerholdige preparater på markedet. Det kan imidlertid være et problem for eldre med munntørrhet og barn som får langvarig eller hyppig behandling med antimikrobielle sukkermiksturer. Er slik behandling nødvendig, bør det sørges for skikkelig, regelmessig tannrengjøring og optimal bruk av fluorid mot karies. Barn bør om mulig heller gis tabletter.
Gingival hyperplasi
Gingival hyperplasi, først rapportert ved bruk av fenytoin i 1940-årene, er etter hvert blitt en velkjent bivirkning av flere medikamenter. Tilstanden starter ofte med nodulær forstørring av tannkjøttpapillene mellom fortennene. Utviklingen kan manifestere seg fra 1 – 3 måneder til år etter behandlingsstart. Hyperplasien kan vokse seg så stor at det interfererer med tygge- og talefunksjonen (Figur 1) (1).
Patogenesen ved slik gingival overvekst antas å være multifaktoriell – et samspill mellom farmakologiske faktorer og vertsfaktorer, der blant annet nivået av TGF-
For de mest aktuelle medikamentene angis varierende insidenser: fenytoin 20 – 40 %, kalsiumkanalblokkere 0,5 – 50 % og ciklosporin 10 – 30 %. For noen andre medikamenter er det spredte rapporter om gingival hyperplasi, det gjelder blant annet erytromycin, sertralin, valproat, vigabatrin og fenobarbital.
Urtemedisin
Om lag 25 % av godkjente legemidler stammer fra urtemedisin. Naturlegemidler fra planteriket vil, på samme måte som godkjente legemidler, kunne gi så vel ønskede effekter som uønskede bivirkninger. Dette gjelder også bivirkninger i munnregionen. Her er noen eksempler: johannesurt (Hypericum perforatum), kyskhetstre (Vitex agnus castus) og salvie (Salvia officinalis) kan gi munntørrhet, og yohimbin (Pausinystalia yohimbe) kan øke spyttsekresjonen (23, 24). Matrem (Tanacetum partheninum) er assosiert med både munntørrhet, smaksforstyrrelser og orale after. Solhatt (Echinacea purpura) kan gi en kriblende og nummen følelse i tungen, mens kavakava (Piper methysticum) er assosiert med orale og lingvale dyskinesier. Spørsmål om bruk av naturlegemidler bør følgelig også inngå som en del av anamnesen ved utredning av sykdomstilstander i munnhulen.
Bisfosfonater og kjeveosteonekrose
De siste to år er det kommet mange rapporter om terapiresistent smertefull bisfosfonatrelatert kjevebeinnekrose (25 – 28), også fra Norge (29, 30). Figur 2 viser ett slikt tilfelle (25). Bisfosfonatassosiert kjevebeinnekrose anses nå som et distinkt klinisk syndrom, selv om etiologien fortsatt er uklar og det kan være en rekke medvirkende faktorer. Det karakteriseres blant annet ved å være spesielt terapiresistent, kun lokalisert i mandibelen og/eller maksillen, uten tilsvarende lesjoner i andre deler av skjelettet (25, 26). De fleste tilfellene av kjevebeinnekrose er knyttet til intravenøs administrasjon av bisfosfonater ved kreftbehandling (25 – 28). Bisfosfonater er kraftigvirkende osteoklasthemmere, med antitumoregenskaper og antiangiogene egenskaper og halveringstid på mange år.
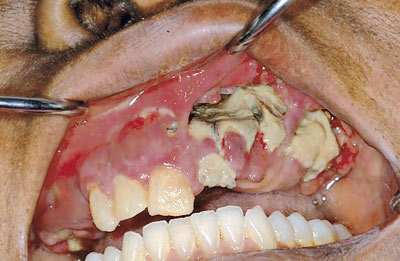
Figur 2. Blottlagt nekrotisk overkjevebein i en pasient som er behandlet med et bisfosfonat (zolodronat) i seks måneder. Fire måneder tidligere var tenner ekstrahert fra bakre del av overkjeven. Gjengitt med tillatelse fra Jay Neugarten, New Hyde Park, New York, Journal of Oral & Maxillofacial Surgery (25) og The American Association of Oral and Maxillofacial Surgeons.
Høypotente bisfosfonater administreres vanligvis intravenøst for å redusere hyperkalsemi ved krefttyper som multiple myelomer, brystkreft og prostatakreft med beinmetastaser. Mindre potente bisfosfonater gis peroralt over lang tid for å hemme beinresorpsjonen ved osteoporose. Tall fra Nasjonalt folkehelseinstitutt viser at salget av bisfosfonater, målt i definerte døgndoser (DDD), har økt kraftig de siste fem årene. I 2005 ble det solgt totalt vel 40 000 DDD/døgn, som gir et estimat over antall daglige brukere. Bisfofonatene brukes hovedsakelig innenfor osteoporoseområdet, kun en liten andel brukes ved maligne tilstander (S. Sakshaug, personlig meddelelse).
The International Myeloma Foundation gjorde i 2004 en Internett-basert undersøkelse av kjeveosteonekrose assosiert med bisfosfonatbehandling. Både osteonekrose og mistenkelige funn, inkludert beinerosjoner og spisse beinekskresenser, samt blottlagt bein ble registrert. Av 904 myelompasienter var det hos 62 kjevebeinnekrose og hos 54 mistenkelige funn. Av 299 brystkreftpasienter var det kjevebeinnekrose hos 13 og mistenkelige funn hos 23. 71 % av myelompasientene hadde fått zoledronat, 29 % kun pamidronat. Utviklingen av kjevebeinnekrose startet tidligere med zoledronat. Kumulativ insidens tre år etter behandlingsstart var for zoledronat og pamidronat henholdsvis 10 % og 4 % (31). Fordelene med slik intravenøs kreftbehandling anses som så store at de klart oppveier risikoen for kjevebeinnekrose. Det er imidlertid viktig at onkologer og tannleger samarbeider for å redusere risikoen (26, 27).
En nylig publisert oversikt gir en god beskrivelse av risikofaktorer, diagnostikk, forebygging, behandling og oppfølging av bisfosfanatindusert kjevebeinnekrose (26). Før det startes intravenøs administrasjon av bisfosfonater bør pasienten utredes og behandles av kvalifisert odontologisk personell, helst i en sykehusavdeling. Nødvendige invasive dentale prosedyrer, som tannekstraksjoner, periodontal kirurgi og endodonti, bør utføres før behandlingen. Det bør ikke settes inn dentale implantater. I tillegg kommer restorativ tannbehandling og tilpasning av proteser. Dersom pasienten trenger invasive prosedyrer, bør behandlingsstart med bisfosfonat utsettes en måned slik at det blir tilstrekkelig tid til bein- og sårtilheling (26).
Det er langt mindre risiko for utvikling av kjevebeinnekrose ved behandling av osteoporose med lavpotente bisfosfonater som alendronat og risedronat. I en studie av 63 pasienter med bisfosfonatrelatert kjevebeinnekrose var det 56 som hadde fått intravenøs kreftbehandling i minst ett år, mens seks hadde fått peroral langtidsbehandling for osteoporose med alendronat og en med risedronat (25). Tatt i betraktning at det på verdensbasis årlig blir behandlet titalls millioner personer med alendronat, er det svært få tilfeller som er rapportert (28). Dette kan imidlertid endre seg. Alendronat har en halveringstid på mer enn ti år og brukes nå av mange relativt unge kvinner til forebygging og behandling av osteoporose, og langvarig bruk er sannsynlig (26 – 28).
Leger og tannleger bør være oppmerksomme på muligheten for utvikling av kjeveosteonekrose hos osteoporosepasienter som behandles med bisfosfonater. Det typiske kliniske syndromet med mukøs ulcerasjon og blottlagt nekrotisk bein kan forutgås av symptomer som smerte, bløtvevshevelse, løse tenner og parestesier.
Hovedbudskap | |
|---|---|
• |
Bivirkninger av legemidler kan imitere praktisk talt alle sykdomstilstander i munnhulen |
• |
Legemiddelanamnese er følgelig alltid en relevant del ved utredning av slike sykdommer |
• |
Medikamentinduserte symptomer er ofte ukarakteristiske og vanskelige å skille fra tilsvarende sykdomsbilder med annen årsak |
English summary
Adverse drug effects in the oral region
Syphilis was previously termed «the great imitator» because so many of the signs and symptoms are indistinguishable from those of other diseases. This role has been taken over by drugs, and this also applies to adverse drug reactions in the oral region. Accordingly, a careful drug history, including identification of any prescription, over-the-counter, or herbal medicines used, may give an important clue to the differential diagnosis of oral diseases when the aetiology is not apparent. Virtually all drugs have the potential to cause oral adverse reactions, but some have a greater ability to do so than others. Among the numerous adverse oral manifestations are xerostomia, taste disturbances and ulceration. The reactions are often non-specific, but they may mimic specific disease states such as erythema multiforme, lichen planus and pemphigus. Drug-induced gingival hyperplasia is an example of a quite characteristic and easily recognisable oral side effect. This article briefly describes some of the presentations and mechanisms of oral manifestations of drug therapy and the drugs that most commonly are responsible. Just like approved pharmaceuticals, herbal medicines are also associated with adverse oral manifestations. Finally we comment on some of the more recent reports on osteonecrosis of the jaws associated with the use of bisphosphonates.
Løkken P, Skoglund LA. Legemiddelbivirkninger i munnhulen. Nor Tannlegeforen Tid. 2006;116:408–13. doi:10.56373/2006-7-4
Litteratur
1. Løkken P, Skomedal T. Kalsiumkanalblokkerindusert gingival hyperplasi. Sjelden, eller tusener av tilfeller i Norge? Tidsskr Nor Lægeforen 1992; 112: 1978 – 80.
2. Scully C, Bagan JV. Adverse drug reactions in the orofacial region. Crit Rev Oral Biol Med 2004; 15: 221 – 39.
3. Tack DA, Rogers RS. Oral drug reactions. Dermatologic Therapy 2002; 15: 236 – 50.
4. Porter SR, Scully C. Adverse drug reactions in the mouth. Clin Dermatol 2000; 18: 525 – 32.
5. Abdollahi M, Radfar M. A review of drug-induced oral reactions. J Contemp Dent Pract 2003; 3: 10 – 31.
6. Byrne BE. Oral manifestations of systemic agents. I: Ciancio SG, red. ADA guide to dental therapeutics. Chicago: ADA Publishing, 2000: 496 – 568.
7. Smith RG, Burtner AP. Oral side-effects of the most frequently prescribed drugs. Spec Care Dentist 1994; 14: 96 – 102.
8. Løkken P, Birkeland JM. Munntørrhet – årsaker og aktuelle tiltak. Nor Tannlegeforen Tid 2005; 115: 642 – 6.
9. Davydov L, Botts SR. Clozapine-induced hypersalivation. Ann Pharmacother 2000; 34: 662 – 5.
10. Tomita H, Yoshikawa T. Drug-related taste disturbances. Acta Otolaryngol Suppl 2002; 546: 116 – 21.
11. Doty RL, Philip S, Reddy K et al. Influences of antihypertensive and antihyperlipidemic drugs on the senses of taste and smell: a review. J Hypertens 2003; 21: 1805 – 13.
12. Ackerman BH, Kasbekar N. Disturbances of taste and smell induced by drugs. Pharmacotherapy 1997; 17: 482 – 96.
13. Duxbury AJ, Oliver RJ, Pemberton MN. Persistent impairment of taste associated with terbinafine. Br Dent J 2000; 188: 295 – 6.
14. Herlofson BB, Barkvoll P. Sodium lauryl sulfate and recurrent aphthous ulcers. A preliminary study. Acta Odontol Scand 1994; 52: 257 – 9.
15. Boulinguez S, Reix S, Bedane C et al. Role of drug exposure in aphthous ulcers: a case-control study. Br J Dermatol 2000; 143: 1137 – 9.
16. DeRossi SS, Ciarrocca KN. Lichen planus, lichenoid drug reactions, and lichenoid mucositis. Dent Clin North Am 2005; 49: 77 – 89.
17. Kragelund C, Thomsen CE, Bardow A et al. Oral lichen planus and intake of drugs metabolized by polymorphic cytochrome P450 enzymes. Oral Dis 2003; 9: 177 – 87.
18. Roujeau JC, Kelly JP, Naldi L et al. Medication use and the risk of Stevens-Johnson syndrome or toxic epidermal necrolysis. N Engl J Med 1995; 333: 1600 – 7.
19. Hatch CL. Pigmented lesions of the oral cavity. Dent Clin North Am 2005; 49: 185 – 201.
20. Chiu AG, Krowiak EJ, Deeb ZE. Angioedema associated with angiotensin II receptor antagonists: challenging our knowledge of angioedema and its etiology. Laryngoscope 2001; 111: 1729 – 31.
21. Gislon Da Silva GM. Captopril-induced bilateral parotid and submandibular sialadenitis. Eur J Clin Pharmacol 2004; 60: 449 – 53.
22. Ellis JS, Morgan CL, Kirby JA et al. Plasma TGF-beta1 as a risk factor for gingival overgrowth. J Clin Periodontol 2004; 31: 863 – 8.
23. Abebe W. An overview of herbal supplement utilization with particular emphasis on possible interactions with dental drugs and oral manifestations. J Dent Hyg 2003; 77: 37 – 46.
24. Magee KA. Herbal therapy: a review of potential health risks and medicinal interactions. Orthod Craniofac Res 2005; 8: 60 – 74.
25. Ruggiero SL, Mehrotra B, Rosenberg TJ et al. Osteonecrosis of the jaws associated with the use of bisphosphonates: a review of 63 cases. J Oral Maxillofac Surg 2004; 62: 527 – 34.
26. Marx RE, Sawatari Y, Fortin M et al. Bisphosphonate-induced exposed bone (osteonecrosis/osteopetrosis) of the jaws: risk factors, recognition, prevention, and treatment. J Oral Maxillofac Surg. 2005; 63: 1567 – 75.
27. Migliorati CA, Schubert MM, Peterson DE et al. Bisphosphonate-associated osteonecrosis of mandibular and maxillary bone: an emerging oral complication of supportive cancer therapy. Cancer 2005; 104: 83 – 93.
28. Hellstein JW, Marek CL. Bisphosphonate osteochemonecrosis (bis-phossy jaw): is this phossy jaw of the 21st century? J Oral Maxillofac Surg. 2005; 63: 682 – 9.
29. Hågensli N, Skjelbred P. Uforklarlig osteonekrose i kjeven ved bruk av zoledonsyre (Zometa®). Nor Tannlegeforen Tid 2005; 115: 920 – 1.
30. Herlofson BB, Bruland ØS. Kjeveosteonekrose assosiert med bisfosfonater og ekstraksjon av tenner. Nor Tannlegeforen Tid 2005; 115: 922.
31. Durie BGM, Katz M, Crowley J. Osteonecrosis of the jaw and bisphosphonates. N Engl J Med 2005; 353: 99 – 100.
Adresse: Seksjon for odontologisk farmakologi og farmakoterapi, Universitetet i Oslo, Postboks 1057 Blindern, 0316 Oslo. E-post: perl@odont.uio.no
Artikkelen har gjennomgått ekstern faglig vurdering.
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Løkken P, Skoglund LA. Legemiddelbivirkninger i munnhulen. Nor Tannlegeforen Tid. 2006;116:408–13. doi:10.56373/2006-7-4