Allmänsjukdomar som predisponerande faktorer vid parodontala förändringar
Författare
professor, odont.dr., spec.tandläkare. Kliniken för tand- och munsjukdomar, Uleåborgs universitetssjukhus, Odontologiska institutionen, Oulun yliopisto, Finland
odont.dr., spec.tandläkare, biträdande lärare. Uleåborgs universitet, Odontologiska institutionen, Oulun yliopisto, Finland
odont.lic., spec.tandläkare, avdelningstandläkare. Uleåborgs universitet, Odontologiska institutionen, Oulun yliopisto, Finland
Artikeln behandlar sådana allmänsjukdomar som förändrar organismens inflammationsreaktion, vävnadernas läkningsförmåga och/eller förhållandena i munnen och som samtidigt ökar risken för parodontala förändringar.
Den risk allmänsjukdomen utgör är i allmänhet beroende av sjukdomens svårighetsgrad, nivån på munhygienen och parodontiets hälsotillstånd.
Av artikeln framgår det att erfarenheterna av sambandet mellan allmänsjukdomar och parodontalsjukdomar varierar. Det betyder att man inte kan uppskatta den exakta risk många sjukdomar medför på ett pålitligt sätt.
En effektiv och regelbunden parodontal behandling är speciellt motiverad för patienter med allmänsjukdomar samt patienter som genomgått en organtransplantation. Ofta skapar den parodontala behandlingen även goda förutsättningar för behandling av patientens allmänsjukdom.
Kopplingen mellan allmänsjukdom och parodontit kan bestå av att sjukdomen utgör en riskfaktor. Det har klarast visats när det gäller diabetes och sådana sjukdomar som modifierar inflammations- och immunreaktionerna. Det kan finnas flera gemensamma faktorer i allmänsjukdomens och parodontitens etiologi och patogenes trots att det inte, eller bara i begränsad mån, går att hitta ett orsakssamband. Många reumatiska sjukdomar och osteoporos är exempel på en sådan situation. Vid vissa inflammatoriska/immunologiska sjukdomar, till exempel Crohns sjukdom, SLE och Wegeners granulomatos kan det förekomma förändringar inom parodontalområdet trots att det inte finns ett klart disponerande samband med parodontit. Uremi är ett exempel på en sjukdom som förändrar förhållandena i munnen så att de främjar uppkomsten av parodontit. Dessa förändringar kan i sin tur framkalla parodontala komplikationer i samband med njurtransplantationer.
Utöver de biologiska faktorerna har även hälsovanorna en stor betydelse som förenande faktor mellan allmänsjukdomar och parodontalsjukdomar. Munhygienen inverkar ofta på hur stor risk allmänsjukdomen medför. Många undersökningar fäster för litet avseende vid hur allvarlig och långvarig allmänsjukdomen är och hur den medicineras. Det inverkar också på hur stark associationen är.
En effektiv och regelbunden parodontologisk behandling är speciellt motiverad vid allmänsjukdomar som är förbundna med inflammatoriska/immunologiska förändringar. Ofta skapar den parodontala behandlingen även goda förutsättningar för behandling av allmänsjukdomen. Samarbetet med den behandlande läkaren betonas vid vård av patienter med allmänsjukdomar om parodontitens svar på behandlingen är dåligt. Vid dessa tillfällen kan behovet av blod-, vävnads-, eller mikrobiologiska undersökningar övervägas.
Endokrina sjukdomar/diabetes mellitus
Diabetes två huvudtyper är som bekant diabetes av typ 1, juvenil diabetes, och typ 2, vuxendiabetes. Diabetes uppträder hos 1 – 2 procent av befolkningen men incidensen har under de senaste åren varit stigande. Cirka 90 procent av diabetikerna lider av typ 2. Resterande del, cirka 10 procent, lider av typ 1. Diabetes som uppträder i samband med graviditet och vissa allmänsjukdomar är ovanliga sjukdomsformer.
Vid diabetes av typ 1 upphör organismen att producera insulin på grund av att de insulinproducerande cellerna i bukspottkörteln förstörs. I samband med vuxendiabetes förekommer tre centrala störningar: förändrad insulinproduktion, insulinresistens och ökad glukosproduktion i levern. Patienterna insjuknar i regel efter 30 års ålder efter att länge ha burit på ett symtomfritt metaboliskt syndrom. Den rubbade socker-, fett- och proteinmetabolin leder i första hand till fyra olika typer av komplikationer: degeneration av ögats näthinna eller retinopati, njurskador eller nefropati, nervdegeneration eller neuropati och ateroskleros eller förkalkning av de större blodkärlen som till exempel kransartärerna.
Parodontalsjukdomar anses höra till komplikationerna vid diabetes (1, 2). Även om manifestationen av komplikationerna är beroende av genetiska faktorer är uppkomsten främst beroende av den terapeutiska balansen. Den bestäms på basis av halten glykosylerat hemoglobin i blodet, HbA1c (riktvärde 4,5 – 6,2 %) som avspeglar långtidsbalansen under de senaste 1 – 3 månaderna. Medicineringen vid diabetes typ 1 är insulin. Vid typ 2 använder man huvudsakligen endast oral medicinering (bland annat metformin eller sulfonylurea) alternativt kombinerat med insulin och lämpliga matvanor.
I jämförelse med icke-diabetiker är diabetikers risk för att insjukna i parodontit två- till fyrfaldig (3). Även om man på befolkningsnivå kan konstatera att parodontalinfektionernas prevalens är större hos barn- och vuxendiabetiker (infektionerna är dessutom allvarligare) hör inte alla diabetiker till riskgruppen. Gingivit och parodontit är vanligast hos diabetiker som har en lång sjukdomshistoria, vars terapeutiska balans har varit dålig (HbA1c > 10 %) och/eller patienter som har haft andra komplikationer i anslutning till sin diabetes (4, 5). Speciellt utsatta för destruktion av fästevävnaderna är patienter som röker mycket och som har en dåligt balanserad diabetes (Fig. 1). Vi vet av klinisk erfarenhet att om en långvarig parodontit reagerar dåligt på behandling, eller om det förekommer akuta skeden i underhållsbehandling i en långt gången parodontit, så kan detta vara tecken på höga blodsockervärden (subklinisk diabetes).
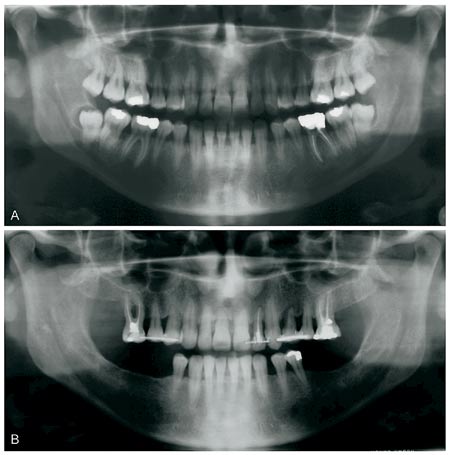
Fig. 1. Parodontiten framskrider hos diabetiker med dålig terapeutisk balans. A: Patienten söker vård vid 29 års ålder efter att ha haft diabetes i 17 år. Sjukdomen är komplicerad (retinopati, nefropati, blodtryck). Patienten röker ett paket cigaretter/dag. B: Trots regelbunden parodontologisk vård förlorar patienten många tänder under en uppföljningstid om 12 år. Patienten avlider i hjärtinfarkt vid 41 års ålder.
Det är speciellt viktigt att varje diabetespatients parodontologiska status, diagnos och vårdbehov utvärderas och ställs i proportion till sjukdomsbilden; det vill säga hur långvarig sjukdomen har varit, hur god terapeutisk balans som har uppnåtts och vilka komplikationer som har förekommit. I problematiska fall finns det skäl för att samarbeta med det vårdteam som behandlar patientens diabetes. Uppföljande studier har visat att diabetikers vävnader på kort sikt reagerar lika positivt på parodontologisk hygienisk behandling som icke-diabetiker. De diabetiker som har större benägenhet för parodontit behöver däremot tätare underhållsbehandling (5). En icke-diabetiker kan klara sig med 12 månaders intervall. En diabetiker med dålig terapeutisk balans kan dock fordra att lokala etiologiska faktorer avlägsnas med 4 – 6 månaders mellanrum. En komplicerad och illa balanserad diabetes försämrar prognosen vid parodontalkirurgi. Infektioner försämrar den terapeutiska balansen. Resultaten beträffande parodontala infektioners inverkan på den terapeutiska balansen är tills vidare motstridiga (1). Det finns dock tecken på att behandling av parodontalinfektionen förbättrar balansen.
Flera undersökningar visar att diabetes ökar risken för att förlora implantat. En väl balanserad diabetes kan ändå inte anses kontraindicera implantatbehandling.
Om möjligt ska man behandla diabetiker vid korta besök, odramatiskt och gärna under förmiddagen. Om man utför långa och tidskrävande ingrepp eller om patientens diabetes är komplicerad finns det skäl för att konsultera den behandlande läkaren om förändringar i medicinering och måltider. Om den terapeutiska balansen är dålig rekommenderas antibiotika som stöd för försämrade värdreaktioner och långsammare sårläkning (6).
De kliniska dragen hos diabetikers parodontala infektioner skiljer sig inte från motsvarande hos icke-diabetiker. Den höga glukoshalten i serumet återspeglar sig direkt i glukosinnehållet i gingivalvätskan. De förändrade subgingivala förhållandena verkar ändå inte gynna tillväxten av parodontopatogener i subgingivalområdet. Man kan inte heller se en subgingival flora som avviker från icke-diabetikerns bakom diabetikernas ökade risk för parodontit. Å andra sidan känner man till många mekanismer i diabetes patogenes som ökar diabetikers risk för att insjukna i parodontit (1, 6) (Tabell 1). Inom parodontalområdet är förändringarna i PMN-cellernas och fibroblasternas funktion betydelsefull. Förändringarna leder till en försämrad försvarsreaktion och en långsammare läkningsprocess men de reverseras om den terapeutiska balansen förbättras. I en hyperglykemisk miljö glykosyleras proteinerna, inklusive kollagenet. Glukosen fäster sig icke-enzymatiskt vid proteinerna och det bildas så kallade glykosyleringsprodukter (AGE, advanced glycosylatin end products) i vävnaderna. Glukos bildar korsbindningar mellan kollagenmolekylerna som försvårar kollagenets omsättning och på det sättet bland annat sårläkningen. Monocyter, makrofager och endotelceller har så kallade AGE-ytreceptorer. När glykosyleringsprodukter fastnar i ytreceptorerna aktiveras cellen i ett hyperreaktivt tillstånd. Salvi et al. har konstaterat att monocyter hos insulindiabetiker producerar högre nivåer av TNF-a, IL-1b och PGE2 än icke-diabetikers (7, 8). Hyperlipidemi som förekommer i samband med diabetes kan också ha en stegrande effekt på inflammationsreaktionen.
· PMN-cellernas adherens, kemotaxi och fagocytosförmåga minskar |
· Kollagensyntesen blir långsammare, lösligheten minskar |
· Kollagenasets aktivitet ökar |
· Fibroblasternas proliferation och tillväxt blir långsammare |
· Proteinerna glykosyleras |
· Mängden IL1-b, TNF-a och PGE2 i parodontalvätskan ökar |
· Blodkärlens basalmembran blir tjockare, lumen förträngs |
Blodkärlsförändringar är vanliga hos diabetiker och sådana förekommer även i kapillärerna i gingivan. Proteinerna i blodkärlens basalmembran glykosyleras och väggarna blir tjockare. Proteiner från blodströmmen fastnar i kärlens innerväggar och lumen blir trängre. Som en följd av det antar man att kärlväggarnas fysikaliska egenskaper förändras: migrationen av PMN-celler och syrediffusionen till vävnaderna försämras. Transporten av metaboliprodukter från vävnaderna till blodet och serumkomponenter som till exempel antikroppar till vävnaderna blir också lidande.
Reumatiska sjukdomar/reumatoid artrit
Till de reumatiska sjukdomarna hör många inflammationer som skadar antingen ben-brosk-system eller mjukvävnader. En kronisk ofta progressiv inflammation är det typiska drag som förenar reumatiska sjukdomar och parodontala infektioner.
Cirka 1 procent av befolkningen lider av ledgångsreumatism, rematoid artrit. Prevalensens tyngdpunkt ligger hos personer över 50 år. Merparten av fallen är polycykliska till sin natur, men det förekommer även monocykliska och progressiva former. De varierande forskningsresultaten beträffande förhållandet mellan parodontal vävnadsdestruktion och reumatoid artrit kan förklaras med sjukdomens mångfacetterade natur. Undersökningarna har dessutom ofta gjorts på ett relativt litet material. I vissa undersökningar har man konstaterat ett positivt samband mellan reumatoid artrit och parodontit (9 – 11). Mercado et al. undersökte olika reumatiska symtom och den reumatoida artritens svårighetsgrad och fann att grav parodontit var vanligare i samband med allvarligare fall av ledgångsreumatism samt i fall som också omfattade svullnad i lederna. Man undersökte förlusten av alveolärt ben under 6 år och konstaterade att reumatoid artrit var en betydande faktor då det gällde att förutse benförlust (12). Sjöström et al. (13) fann däremot inget samband mellan artrit och parodontit men konstaterar att reumapatienterna hade mindre plack och tandsten än kontrollgruppen.
Mängden lokal mikrobretning spelar säkert en central roll för den reumatoida artritens och andra allmänsjukdomars betydelse vid förändringen av parodontitens utveckling. Patienter med ledgångsreumatism kan till exempel ha funktionsbegränsningar som kan göra det svårt för dem att utnyttja vårdtjänster samt att sköta munnen själv. Medicineringen av reumatism varierar från fall till fall och det är svårt att bedöma dess betydelse som predisponerande faktor vid parodontit. Immunosuppressiv medicinering kan till exempel ha en skyddande effekt. Samtidig användning av flera immunosuppressiva mediciner (till exempel methotrexate, azathioprin, ciclosporin, leflunomid, prednisolon) ökar risken för svampinfektioner. Detta gäller särskilt hos reumapatienter som har sekundär Sjögrens syndrom. Långvarig användning av nonsteroida antiinflammatoriska läkemedel verkar dock inte ha ett samband med benförlust eller fickdjup. Eftersom det inte finns hållbara bevis för ett orsakssamband i någon riktning finns det skäl för att snarare betona störningen i organismens allmänna förmåga att handskas med inflammationsreaktioner som den gemensamma faktorn vid dessa sjukdomar (Tabell 2). Även det är en tillräcklig anledning till att sköta reumapatienters parodontala infektioner samt andra infektioner i munnen ordentligt.
· Likheter i immunresponsen |
· Monocyternas reaktivitet |
· Förekomsten av proinflammatoriska cytokiner (NO, PGE2, TNF, interleukiner) |
· Förekomsten av metalloproteinaser/inhibitorer |
· Molekylär likhet mellan heat-shock-proteiner från mikrober och värd (immunologisk tolerans) |
· Gemensam benägenhet för genpolymorfism |
Torrhet i mun och ögon och vissa immunologiska avvikelser är typiska för Sjögrens syndrom. Av en prevalens på cirka 0,5 – 1 procent är ungefär hälften den primära formen, som främst förekommer hos kvinnor. Den andra hälften utgörs av den sekundära formen som vanligen hänger samman med autoimmuna sjukdomar (reumatoid artrit i 10 – 30 % samt SLE) eller celiaki. Vid hyposalivation, systemiska förändringar samt samtidig immunosuppressivisk medicinering finns en tydlig ökad risk för svamp- och virusinfektioner vilket kan medföra komplikationer vid vård av parodontit. Forskningsresultaten stöder inte entydigt en ökad risk för parodontala infektioner vid Sjögrens syndrom (14, 15). Bara i två av de cirka 10 undersökningar som publicerats under 1990-talet eller senare konstateras att Sjögrens syndrom medför en klart ökad risk för parodontit.
Systemisk lupus erytematosus (SLE), systemisk skleros och Wegeners granulomatos är sällsynta autoimmuna sjukdomar. Förutom förändringar i gommen och den buckala mucosan kan SLE också medföra gingivit som svarar dåligt på behandling (Fig. 2). Även om SLE-patienter är känsligare mot infektioner än vanligt finns det inga pålitliga bevis för ökad parodontit. I samband med systemisk skleros ser man oftast en vidgning av periodontalligamentutrymmet inom molarområdet medan Wegeners granulomatos associeras med granulär gingivahyperplasi, så kallade strawberry gums.
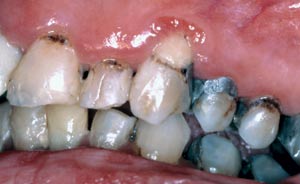
Fig. 2. Medelålders kvinna med systemisk lupus erythematosus och Sjögrens syndrom. Hon lider av gingivit med dåligt terapisvar.
Osteoporos
När förlusten av mineraltätheten i benvävnaden överstiger 2,5 x standardavvikelsen (beräknad enligt ett standardiserat tillstånd hos en ung vuxen, justerat enligt kön och ras) är det enligt WHO:s kriterier från 1994 fråga om osteoporos. Det råder en relativt utbredd enighet om att alveolarbenet och käkbenet har en lägre mineraltäthet (mineral density) eller mineralhalt (mineral content) hos personer med osteoporos. Trots det kan man inte fastslå ett automatiskt samband mellan systemisk bentäthet och förlust av parodontalt fäste (16 – 18).
Forskningsresultaten avviker från varandra. I cirka 50 procent av undersökningarna har man dragit slutsatsen att det finns ett positivt samband. Svårigheten att behärska alla störande faktorer i de tvärgående studierna och det begränsade antalet prospektiva undersökningar betyder dock att möjligheterna att dra pålitliga slutsatser begränsas. Hos personer som har egna tänder har ju tuggandet en klart stärkande effekt på alveolarbenets trabekulation på samma sätt som aktiv motion ökar den systemiska bentätheten.
Parodontit och osteoporos har flera gemensamma predisponerande faktorer: Livsstilen (life style factors) till exempel rökning och matvanor samt psykosociala faktorer är typiska sådana. Dessutom är det tydligt att delvis samma genetiska faktorer antingen predisponerar för eller inverkar på båda sjukdomarna. När bland annat östrogennivån sjunker vid osteoporos kan man notera många förändringar i mängden av och de inbördes relationerna hos de molekyler som styr cellernas funktion och samverkan. Samma molekyler är även involverade i parodontitens patogenes. Det är därför riktigt att anta att de två sjukdomarna framskrider parallellt. Om osteoporosen försvagar trabekulationen i alveolarbenet och den kortikala delen i märkbar grad är det ju möjligt att benförlusten sker snabbare vid en parodontalinfektion. Forskning på en liten mängd patienter under tre år visade större referenser av ökad benförlust hos de som hade osteoporos än hos de friska. Det tycks inte heller omöjligt att parodontit är en riskfaktor i samband med osteoporos.
När effekterna av behandling och profylax vid osteoporos visar sig även i samband med parodontit kan det ge oss ny kunskap om de båda sjukdomarnas inbördes relation. Vid djurförsök och preliminära kliniska undersökningar har man konstaterat att alendronat, ett antiresorptivt preparat som hör till gruppen bisfosfonater, får parodontiten att framskrida långsammare. Man känner inte till vilken betydelse selektiva östrogenreceptormodulatorer eller kalcitonin har för parodontit. Substitutionsbehandling med östrogen verkar dock ha en effekt på upprätthållandet av mineraltätheten i alveolarbenet, men effekten på förlusten av fäste verkar inte lika klar. I en omfattande amerikansk undersökning av intaget av kalcium och D-vitamin hos män kunde man konstatera att ett kalciumintag på över 1 000 mg/dag minskade antalet tänder där man kunde upptäcka benförlust jämfört med personer med ett intag som låg på under 1 000 mg/dag. Kalciumintaget verkar med andra ord ha en modifierande inverkan på parodontit (19).
Blodsjukdomar
Gingivitens och parodontitens patogenes är nära förknippad med polymorfonukleära leukocyter, monocyter/makrofager, lymfocyter och plasmaceller.
Neutropeni kan vara en ärftlig eller idiopatisk, ibland förvärvad, störning i produktionen av leukocyter som också kan vara förknippad med en kompensatorisk monocytos. Neutropeni kan också förekomma cykliskt. Då sjunker antalet neutrofila leukocyter mycket lågt (ofta under 500/mm3) för att sedan återgå till ett suboptimalt värde i cykler, ofta inom cirka 3 – 4 veckor. Ofta varierar antalet övriga leukocyter och trombocyter i samma cykel. När mikrobretningen inte kan behärskas och/eller den cykliska neutropenin är grav är tandköttet ödemiskt, rött och blöder lätt. Under sådana betingelser kan också nedbrytningen av parodontalvävnad framskrida märkbart redan under ett år (20). I svårare fall kan man hitta lokala ulcerationer och vävnadsnekros i den marginala tandköttskanten samt i papillområdet. Neutropena ulcerationer förekommer typiskt också på slemhinnorna. Ett flertal undersökningar har visat att man med framgång kan förhindra parodontala skador om man eliminerar plack och andra irriterande faktorer noggrant. Terapin omfattar regelbunden depuration av en professionell person före neutropeniskedet.
Tandköttsförändringarna som hänger samman med leukemi är en följd av infiltration av leukemiska celler och leukemiterapin (kemoterapi, graft-versus-host-rejektion). Det kan också bero på att en indirekt manifestation av att benmärg och lymfatisk vävnad avtar (21). Den leukemiska infiltrationen ger upphov till ödemisk utvidgning av gingivan och stor blödningsbenägenhet. Förutsättningen för nekrotiska förändringar på grund av bakteriell retning ökar. Dessa förändringar kan tjäna som diagnostiska indikatorer när patienten söker hjälp hos tandläkare. Förändringar i form av svullnad påträffas oftast (60 – 70 %) i samband med den sällsynta akuta monocytiska formen av sjukdomen, vid akut myelomonocytisk leukemi (ca 20 – 30 %) samt vid akut myeloid leukemi (färre än 10 %). I kroniska fall är förändringarna inte typiska, förutom vid kronisk lymfatisk leukemi. Däremot är en ökad blödningsbenägenhet i tandköttet som orsakas av förändringar i blodbilden (framför allt av trombocytopeni och delvis av anemi) vanlig även i kroniska fall.
Den infiltration av leukocyter som normalt förekommer vid gingivit kan delvis förklara den rikliga anhopningen av leukemiska celler kring tandkött och tandköttsfickor som i sin tur förstärker inflammationen. Kliniskt är tandköttet blåaktigt och cyanotiskt. Svullnaden är kraftig kring papiller och tandköttskant, vilket leder till att tandköttet får en tendens att täcka tandens yta (Fig. 3). Det finns också rikligt med leukemiska celler kring periodontalligament och i alveolarbenet. Vid djurförsök har man konstaterat att detta leder till snabb destruktion av parodontala vävnader. Granulocytopeni, nedsatt fagocytaktivitet och nedsatta immunreaktioner kan vara möjliga orsaker till att gingivit akutiseras och till att det uppstår ulcerativa nekrotiska förändringar.
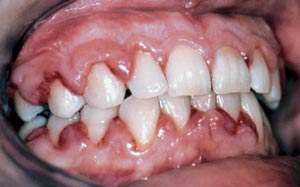
Fig 3. 32-årig kvinna med akut leukemi. Ödemisk förtjockning av tandköttet på grund av leukemisk infiltration.
Det finns skäl för att sträva efter att eliminera den risk som de gingivala/parodontala infektionerna medför med antibiotika redan i början av behandlingen. Behandlingen kompletteras med klorhexidin (22). Här har vi dock inte behandlat de direkta toxiska effekterna hos kemoterapipreparat eller graft-versus-host-rejektion i samband med benmärgstransplantationer inte heller de sekundära förändringar som kan uppstå på grund av förlamning av benmärgen.
Funktionsstörningar hos leukocyter kan förekomma i samband med att de förflyttar sig genom endotelet, i cellernas kemotaktiska rörelser, i fagocytosen eller i förmågan att döda fagocyterade mikrober. De sjukdomar där dessa förändringar förekommer är sällsynta och till största delen ärftliga syndrom. De parodontala förändringarna kan konstateras redan hos barn. Tandförluster inträffar hos unga vuxna eller rent av hos ungdomar. Med mycket god munhygien kan man reducera skadeverkningarna på parodontiet. I Tabell 3 redovisas syndrom som involverar förändringar i leukocyterna och där man har beskrivit parodontala förändringar.
Trombocytopeni är ytterligare ett exempel på förändringar som hänger samman med blodceller. Detta samband omfattar inte bara ökad gingival blödning utan också en exceptionellt stark inflammationsreaktion vid lokal mikrobretning. Langerhans-cellhistiocytos klass 1 och 2, tidigare kallade histiocytos x med undertyper, är sällsynta störningar som har ett samband med antigenprocesserna. De ökar benägenheten för bland annat grava parodontala problem. Även här reagerar vävnaderna positivt på effektiv parodontalvård.
Human immunodeficiency virus (HIV) har en stark affinitet speciellt till T-celler av typ CD4 men också till andra celler i försvarssystemet, till exempel monocyter, makrofager och Langerhans celler. Även om B-cellerna inte är infekterade framträder störningen i form av sekundära förändringar i deras samt i neutrofilernas funktion. I samband med HIV förekommer även leukoplaki, candidainfektioner av olika slag, Kaposis sarkom, bacillär angiomatos, non-Hodgkins lymfom, hyperpigmentos, ospecifika ulcerationer samt parodontala förändringar. Gingivalt erytem, nekrotisk gingivit och parodontit är de mest typiska förändringarna i parodontiet (23 – 25). De förtjänar därför att granskas närmare.
Gingivalt erytem kan förekomma som en lineär marginal förändring eller som en diffus förändring som täcker den fasta gingivan. Förändringen kan i vissa fall leda till nekrotisk gingivit eller parodontit. Det är uppenbart att en Candida-infektion (dubliniensis, albicans) hänger samman med erytemet. Den kan också ha en etiologisk betydelse. Systemisk svampmedicinering minskar eller botar i vissa fall erytemet men svaret på normal gingivitbehandling är dåligt.
Gingivit och parodontit förekommer i mycket varierande grad hos HIV-patienter. Den typiska nekrotiska gingiviten har en prevalens om 0 – 11 procent. Prevalensen för nekrotisk parodontit anses vara 1 – 6 procent. I allmänhet har man inte tagit hänsyn till sjukdomens svårighetsgrad (exempelvis lymfocytmängden). Drogmissbrukarna utgör dessutom en egen speciell grupp.
Nekrotiserande förändringar i gingivan/parodontiet kan inte anses som ett pålitligt tidigt tecken på en HIV-infektion eftersom det inte är någon skillnad på prevalensen för de nekrotiserande förändringarna om lymfocytmängden ligger över eller under 400/mm3. Sannolikheten för nekrotisk ulcerativ parodontit förefaller däremot att öka då mängden lymfocyter understiger 200/mm3. Utöver de normala parodontitpatogenerna verkar också candidas roll i parodontala infektioner vara klar. Det betonar naturligtvis vikten av lokal och/eller systemisk antifungal behandling utöver den normala antiinfektiösa vården. De nekrotiska förändringarnas terapisvar är ofta sämre än genomsnittet. När HAART-vård (highly active antiretroviral therapy) ges som svar på en HIV-infektion verkar den minska parodontitens aktivitet.
Tarmsjukdomar/Crohns sjukdom
Av de kroniska inflammationssjukdomarna i tarmkanalen är det främst i samband med Crohns sjukdom som man ser mjukvävnadsförändringar i munregionen. I vissa fall kan förändringar också ses i samband med ulcerativ kolit (26, 27). Crohns sjukdoms prevalens är 20 – 60 fall per 100 000 invånare. Munförändringar ses i 1 – 20 procent av fallen men siffran är högre hos barn (48 – 80 %). Sjukdomens förlopp omfattar aktiva skeden och remissionsskeden. Detta förefaller dock inte att påverka symtomen i munnen. Förändringar i munnen är vanligare hos män. De är även vanligare då sjukdomen uppträder i tjocktarmen jämfört med fall som involverar tunntarmen. Munförändringarna har också ett klart samband om artrit eller erythema nodosum uppträder i anslutning till Crohns sjukdom.
De flesta munförändringarna uppträder på läpparna (25 % av fynden), därnäst på gingivan (18 % av fynden), sedan i vestibulum och den buckala mucosan. En ödematisk hyperplasi som ofta ser granulär ut samt rodnad i den fasta gingivan är de typiska förändringarna på tandköttet. Ibland ser man också ulcerationer och små ytliga varblåsor. Förutom diffust ödem kan man på slemhinnorna se ett specifikt fynd: begränsad inflammatorisk hyperplasi som ser ut som kullersten (cobblestones). När man utgått från omfattande kliniska material har man inte kunnat fastslå något samband mellan parodontit och Crohns sjukdom. I vissa fall har en snabbt framskridande parodontit hängt samman med sjukdomen. Vid parodontiter har man också beskrivit höga halter av PGE2. Den kraftiga immunreaktionen i tarmväggen som förmedlas av T-celler leder till en riklig produktion av cytokin. Samtidigt ökar mängden enzymer som bryter ned bindvävsmatrix. En liknande reaktion kan vara möjlig i gingivan. Crohns sjukdom verkar inte ha någon specifik inverkan på mikrobfloran vid parodontit.
Njursjukdomar/uremi, organtransplantationer
Kronisk nedsatt funktion i njurarna, uremi, indelas i olika skeden enligt hur funktionen så småningom minskar. Gränsen för grav hypofunktion anses finnas där < 10 procent av glomeruli fungerar och kreatininhalten i serum är > 550 mol/l. Terminal uremi är det yttersta stadiet. Då överstiger kreatininnivån 700 – 800 mol/l och dialysbehandling blir nödvändig. Hos en del av patienterna finns en systemisk sjukdom som diabetes, SLE eller en reumatisk sjukdom i bakgrunden. En framskridande uremi leder till allvarliga störningar i kroppens vitala funktioner. Patienten måste hålla diet med begränsat proteinintag, aptiten är dålig och det råder en katabolisk situation i kroppen. Illamående och uppkastningar som kan utsätta tänderna för kraftig erosion är viktiga faktorer ur munnens och tändernas synvinkel. Uremin leder till utveckling av myelogen anemi och trombocytos. Lymfocyternas proteinsyntes och PMN-cellernas kemotaxiska förmåga försvagas. Tandköttets blödningstendens ökar och sårläkningen blir långsammare.
Som en följd av njurarnas hypofunktion avges stora mängder urea och proteiner i saliven och parodontalvätskan. Saliven är viskös eller till och med skummig. Förhöjd pH i placken och fosfor som frigörs från organismen främjar kraftigt bildningen av både sub- och supragingival tandsten. Patienterna har svårt att hålla sina tänder rena. Dialys påverkar inte salivavsöndringen kvantitativt. Uremi medför inte någon speciell risk för framskridande parodontit men den lokala etiologiska belastningen är avsevärt förhöjd.
Patienterna har ofta en kraftig blodtrycks- och diuretmedicinering på grund av en kombination av olika läkemedel. Kalciumblockerare verkar sänkande på motståndet i njurarnas perifera blodomlopp och används allmänt. Dihydropyridiner har en svag immunomodulatorisk effekt. De minskar trombocyternas aggregation och utvidgar perifera blodkärl. På det sättet ökar de blödningsbenägenheten och förlänger blödningstiden något i samband med ingrepp. Dessutom medför dessa preparat en risk för tandköttshyperplasi (prevalensen är cirka 5 – 10 procent) (28).
Efter en njurtransplantation ger man patienten kraftig immunosuppressiv medicinering som i huvudsak består av cyklosporin, azatioprin och metylprednisolon. Medicineringen sänks gradvis till underhållsnivå under det första året efter transplantationen. Direkt efter en transplantation kan herpes- och cytomegalovirusblåsor samt sår uppträda på munnens slemhinnor. Diabetiker som genomgått en organtransplantation är märkbart oftare än andra patientgrupper utsatta för svampinfektioner. Den kumulativa sepsisrisken når sin höjdpunkt under de sex första månaderna efter transplantationen (29). Patienter som får immunosuppressiv medicinering har inte primärt en förhöjd risk för att parodontiten ska avancera men illa skötta infektioner i munnen kan utgöra en potentiell risk för patienten. Prednisolon och azatioprin ökar infektionsbenägenheten.
Prevalensen för tandköttshyperplasi vid cyklosporinbehandling är cirka 20 – 30 % men samtidig medicinering med dihydropyridin ökar siffran till över 50 procent. Blödning ur tandköttsfickorna är den enda kliniska parameter som korrelerar märkbart med tandköttshyperplasi. Tandköttshyperplasi utvecklas 1 – 3 månader sedan medicineringen påbörjats och är som störst efter 12 – 18 månader (28) (Fig. 4).
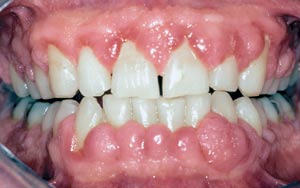
Fig. 4. 32-årig man 2 år efter njurtransplantation. Tandköttshyperplasi i anslutning till cyklosporin- och felodipinmedicinering.
De centrala målen för tandvården är antiinfektiös behandling, minimering av inflammationen, att skapa god munhygien och goda hemvårdsvanor redan innan en organtransplantation för att minimera behovet av invasiva ingrepp.
Efter njurtransplantationer ligger den immunosuppressiva behandlingen på en måttlig nivå. En genomgripande sanering är därför inte motiverad. Hjärttransplantationspatienter har en immunosuppressiv behandling som ligger på dubbelt så hög nivå som vid transplantation av övriga fasta organ. I deras fall bör man vara mera benägen att exempelvis extrahera tänder med furkationsinvolvering.
Så väl patienter med nedsatt njurfunktion som transplantationspatienter med immunosuppressiv medicinering behöver antibiotika som skydd vid tandvård. Protokollet för endokarditprofylax rekommenderas. Under läkningsskedet är det motiverat att använda ett lokalt antiseptikum (sköljning med 0,2 % klorhexidin). Vid svår tandköttshyperplasi kan kirurgiska ingrepp bli nödvändiga men de är inte lämpliga innan man uppnått underhållsskedet med immunosuppressionsbehandlingen. Gingivektomi är en lämplig behandling vid mindre utbredd hyperplasi och där det inte förekommer benförlust. Vid morfologiskt besvärliga hyperplasier och i samband med benförlust ger en flapoperation ett mera bestående behandlingsresultat (30). Recidivbenägenheten är hög hos hyperplasierna.
Övriga sjukdomar som ökar risken för parodontala förändringar
Meyle & Gonzales har i sin översikt (31) behandlat parodontala förändringar i samband med olika syndrom. Papillon-Lefevre är ett syndrom som hör till den mångfacetterade grupp av hudsjukdomar med hyperkeratotiska hudförändringar. Syndromet ärvs autosomalt och recessivt. Det är ovanligt (1:3 000 000 invånare). Grava parodontala skador som leder till för tidig förlust av både mjölktänder och bestående tänder är vanligt vid det här syndromet.
Ehlers-Danlos syndrom har delats in i 10 typer. Förlust av tänder i förtid på grund av parodontala orsaker är typiskt för typ VIII. Den typen ärvs autosomalt och dominant och är mycket sällsynt. Hypofosfatasi i samband med autosomalt nedärvd brist på alkalisk fosfatas är också en betydande riskfaktor då det gäller förlust av alveolarben och parodontala problem.
Downs syndrom är mycket vanligare än de båda ovannämnda. I cirka 90 procent av fallen är det fråga om 21-trisomi. I Finland föds varje år omkring 100 barn med detta syndrom. Typiskt är att parodontiten har hög prevalens och att den är allvarlig till sin natur. Vid uppföljande undersökningar har man funnit att parodontiten framskrider snabbt trots att den kliniska inflammationen är lindrig. Den biologiska bakgrunden till förlusten av parodontalvävnader sammanhänger uppenbarligen med det ringa antalet mogna T-celler, samt med funktionella störningar i leukocyter och monocyter samt avvikelser i kollagensyntesen och i matrixmetalloproteinasfunktionen. Med effektiv och regelbunden lokal antiinfektiös behandling kan man fördröja parodontitens framskridande avsevärt.
Astma är en relativt allmän andningsorgans-/överkänslighetssjukdom. Det finns endast begränsad kunskap om parodontala förändringar i samband med astma. I många, men långt ifrån alla, undersökningar har man funnit att barn och unga med astma har mera gingivit än icke-astmatiker (32). Då det gäller vuxna finns det preliminära bevis för att parodontit är vanligare hos astmatiker men man har inte klarlagt sambandet närmare (33).
Eftersom ämnet för artikeln är vidsträckt har vissa urval gjorts beträffande de sjukdomar som behandlats. Även i samband med hudsjukdomar som till exempel lichen planus, psoriasis, pemfigus, pemfigoid, lineär IgA-sjukdom förekommer det i varierande grad gingivala manifestationer. Dessa har vi dock valt att inte gå in på i den här artikeln.
English summary
Knuuttila M, Tervonen T, Pernu H
General diseases as risk factors for periodontal diseases
80 – 6.
Many general diseases act as risk factors for periodontal diseases. This has been shown clearly in the case of diabetes mellitus as well as in some other general diseases with decreased inflammatory/immunologic response. On the other hand, some general diseases, such as rheumatoid arthritis and osteoporosis, have many factors in common with periodontitis. In these cases there is only minor or no causality between the general disease and periodontal disease. In some other inflammatory/immunologic diseases such as Crohn"s disease, SLE and Wegener"s granulomatosis, there are local tissue changes in the periodontal area but no increase in susceptibility to periodontal diseases. Uremia is an example of a disease in which gingival inflammation is increased as a result of changes in oral conditions. This, on the other hand, may be one reason for complications associated with renal transplant therapy.
In addition to biologic factors, health behaviour plays an important role as an associating factor between general and periodontal diseases. The level of oral hygiene is often related to the magnitude of the risk caused by a general disease. In many studies insufficient attention has been paid to the severity, duration and/or medication of general diseases, which also affect the strength of the associations. Effective and regular anti-infective periodontal therapy is important for patients with general diseases. In many cases it is also a prerequisite for successful treatment of the general disease.
Referenser
1. Soskolne WA. Epidemiological and clinical aspects of periodontal diseases in diabetics. Ann Periodontol 1998; 3: 3 – 12.
2. Soskolne WA, Klinger A. The relationship between periodontal diseases and diabetes: an overview. Ann Periodontol 2001; 6: 91 – 8.
3. Taylor GW. Bidirectional interrelationships between diabetes and periodontal diseases: an epidemiologic perspective. Ann Periodontol 2001; 6: 99 – 112.
4. Karjalainen K, Knuuttila MLE, von Dickhoff KJ. Association of the severity of periodontal disease with organ complications in Type 1 diabetic patients. J Periodontol 1994; 65: 1067 – 72.
5. Tervonen T, Karjalainen K. Periodontal disease related to diabetic status. A pilot study of the response to periodontal therapy in type 1 diabetes. J Clin Periodontol 1997; 24: 505 – 10.
6. Diabetes and periodontal diseases. Position paper. J Periodontol 1999; 70: 935 – 49.
7. Salvi GE, Collins JG, Yalda B, Arnold RR, Lang NP, Offenbacher S. Monocytic TNFa secretion patterns in IDDM patients with periodontal diseases. J Clin Periodontol 1997; 24: 8 – 16.
8. Salvi GE, Yalda B, Collins JG, Jones BH, Smith FW, Arnold RR, et al. Inflammatory mediator response as a potential risk marker for periodontal diseases in insulin-dependent diabetes mellitus patients. J Periodontol 1997; 68: 127 – 35.
9. Tolo K, Jorkjend L. Serum antibodies and loss of periodontal bone in patients with rheumatoid arthritis. J Clin Periodontol 1990; 17: 288 – 91.
10. Mercado F, Marshall RI, Klestov AC, Bartold PM. Is there a relationship between rheumatoid arthritis and periodontal disease? J Clin Periodontol 2000; 27: 267 – 72.
11. Mercado FB, Marshall RI, Klestov AC, Bartold PM. Relationship between rheumatoid arthritis and periodontitis. J Periodontol 2001; 72: 779 – 87.
12. Albandar JM. Some predictors of radiographic alveolar bone height reduction over 6 years. J Periodontal Res 1990; 25: 186 – 92.
13. Sjöström L, Laurell L, Hugoson A, Håkansson JP. Periodontal conditions in adults with rheumatoid arthritis. Community Dent Oral Epidemiol 1989; 17: 234 – 6.
14. Kuru B, McCullough MJ, Yilmaz S, Porter SR. Clinical and microbiological studies of periodontal disease in Sjögren’s syndrome patients. J Clin Periodontol 2002; 29: 92 – 102.
15. Çelenligil H, Eratalay K, Kansu E, Ebersole JL. Periodontal status and serum antibody responses to oral microorganisms in Sjögren’s syndrome. J Periodontol 1998; 69: 571 – 7.
16. Jeffcoat MK, Lewis CE, Reddy MS, Wang C-Y, Redford MA. Post-menopausal bone loss and its relationship to oral bone loss. Periodontol 2000 2000; 23: 94 – 102.
17. Wactawski-Wende J. Periodontal diseases and osteoporosis: Association and mechanisms. Ann Periodontol 2001; 6: 197 – 208.
18. Chesnut III CH. The relationship between skeletal and oral bone mineral density: An overview. Ann Periodontol 2001; 6: 193 – 6.
19. Krall EA. The periodontal-systemic connection: Implications for treatment of patients with osteoporosis and periodontal disease. Ann Periodontol 2001; 6: 209 – 13.
20. Pernu HE, Pajari UH, Lanning M. The importance of regular dental treatment in patiens with cyclic neutropenia. Follow-up of 2 cases. J Periodontol 1996; 67: 454 – 9.
21. Barrett AP. Gingival lesions in leukemia. J Periodontol 1984; 55: 585 – 8.
22. Bergman OJ, Ellegaard B, Dahl M, Ellegaard J. Gingival status during chemical plaque control with or without prior mechanical plaque removal in patients with acute myeloid leukemia. J Clin Periodontol 1992; 19: 169 – 73.
23. Holmstrup P, Westergaard J. HIV infection and periodontal diseases. Periodontol 2000 1998; 18: 37 – 46.
24. Ryder MI. Periodontal management of HIV-infected patients. Periodontol 2000 2000; 23: 85 – 93.
25. Rees TD. AIDS and the periodontium In: Carranza’s clinical periodontology. Newman MG, Takei HK, Carranza FA, editors. 9th ed. Philadelphia: Saunders; 2002. p. 415 – 29.
26. Kalmar JR. Crohn’s disease: orofacial considerations and disease pathogenesis. Periodontol 2000 1994; 6: 101 – 15.
27. Scheper HJ, Brand HS. Oral aspects of Crohn’s disease. Int Dent J 2000; 52: 163 – 72.
28. Seymour RA, Ellis JS, Thomason JM. Risk factors for drug-induced gingival overgrowth. J Clin Periodontol 2000; 27: 217 – 23.
29. Scroggs MW, Wolfe JA, Bollinger RR, Sanfilippo F. Causes of death in renal transplant recipients. A review of autopsy findings from 1966 through 1985. Arch Pathol Lab Med 1987; 111: 983 – 7.
30. Pilloni A, Camargo PM, Carere M, Carranza FA Jr. Surgical treatment of cyclosporine A- and nifedipine-induced gingival enlargement: gingivectomy versus periodontal flap. J Periodontol 1998 69: 791 – 7.
31. Meyle J, Gonzáles JR. Influences of systemic diseases on periodontitis in children and adolescents. Periodontol 2000 2001; 26: 92 – 122.
32. Mc Derra EJC, Pollard MA, Curzon MEJ. The dental status of asthmatic British school children. Pediatr Dent 1998; 20: 281 – 7.
33. Laurikainen K, Kuusisto P. Comparison of the oral health status and salivary flow rate of asthma patients with those of nonasthmatic adults – results of a pilot study. Allergy 1998; 53: 316 – 9.
Översättning från finska till svenska av Anders Bergman.
Søkeord på Internett: www.tannlegetidende.no: Periodontitt, marginal; Sykdom; Symptom.
Korrespondens: Matti Knuuttila, Kliniken för tand- och munsjukdomar, Uleåborgs universitetssjukhus, Odontologiska institutionen, PB 5281, 90014 Oulun yliopisto, Finland. E-post: matti.knuuttila@oulu.fi.