Anne Marie Lynge Pedersen, Kathrine Skarstein, Hülya Çevik-Aras, Arja M. Kullaa, Hanna Laine og Janicke Liaaen Jensen
Sygdomme og tilstande der påvirker spytkirtlerne og deres funktion
Professor, ph.d., tandlæge. Sektion for Oral Patologi og Medicin, Odontologisk Institut, Det Sundhedsvidenskabelige Fakultet, Københavns Universitet, Danmark
Professor, ph.d., tandlæge. The Gade Laboratory for Pathology, Department of Clinical Medicine, University of Bergen, and Department of Pathology, Haukeland University Hospital, Bergen, Norway
Associate professor, ph.d., tandlæge. Institute of Odontology, Department of Oral Pathology and Medicine, University of Gothenburg, Sweden
Professor, ph.d., tandlæge. Institute of Dentistry, School of Medicine, University of Eastern Finland, Kuopio campus, Finland
Clinical instructor, ph.d., tandlæge. Department of Oral and Maxillofacial Diseases, University of Helsinki, Helsinki, Finland
Professor, ph.d., tandlæge. Institute of Clinical Dentistry, Faculty of Dentistry, University of Oslo, Norway
Klinisk relevans
Xerostomi og spytkirteldysfunktion er komplekse tilstande med stigende udbredelse, især i den ældre del af befolkningen. Det er vigtigt, at tandlæger er opmærksomme på xerostomi og påbegynder udredning af symptomerne med henblik på at påvise årsagen og på den baggrund igangsætte relevante behandlingstiltag. Det er ligeledes vigtigt, at tandlæger har kendskab til andre spytkirteltilstande som fx mukosacyster og spytsten, da disse er relativt hyppigt forekommende.
Hypofunktion af spytkirtlerne (objektivt påvist reduktion af spytsekretionen) og xerostomi (den subjektive fornemmelse af mundtørhed) er almindeligt forekommende tilstande. Patienter med nedsat spytsekretion og ændret sammensætning af spyttet har øget risiko for at udvikle af caries, orale gærsvampeinfektioner, mundslimhindeforandringer, invaliderende symptomer, synkebesvær og ændret smagsoplevelse. Den hyppigste årsag til xerostomi og nedsat spytsekretion er indtagelse af lægemidler, der påvirker den nervøse regulering af spytsekretionen. Strålebehandling af cancer i hoved- og halsregionen medfører ofte permanent og alvorlig xerostomi og hypofunktion af spytkirtlerne som følge af degeneration af spytkirtelvæv, der ligger inden for strålefeltet. Sjögrens syndrom, en autoimmun sygdom der påvirker eksokrine kirtler, forårsager permanent xerostomi og hyposalivation på grund af immun-medierede forandringer i spytkirtlernes struktur. Aldring kan ligeledes medføre strukturændringer i spytkirtlerne, som kan påvirke spytsekretionen. Denne artikel giver en oversigt over ætiologi, patogenese, kliniske manifestationer, diagnostik og behandling af tilstande med nedsat spytkirtelfunktion, almindelige spytkirtelsygdomme (mukosacyster og spytsten) og spytkirteltumorer.
Xerostomi og hypofunktion af spytkirtler
Xerostomi er en udbredt tilstand i befolkningen, især blandt ældre. Forekomsten af xerostomi og hyposalivation og den deraf følgende svækkelse af den orale sundhed forventes at stige markant i de kommende år, eftersom befolkningsandelen af ældre med naturlige tænder vokser støt, og der sker en stigning i forekomsten af aldersrelaterede systemiske sygdomme, som bliver behandlet med flere lægemidler samtidigt, herunder en del nye stoffer med endnu ukendte bivirkninger. Ideelt set bør alle i sundhedssektoren derfor være opmærksomme på patienter, der klager over mundtørhed.
Spytkirteldysfunktion er betegnelsen for enhver kvantitativ og/eller kvalitativ ændring i spytproduktionen. Spytkirtelhypofunktion er den mest udbredte type af dysfunktion og er ofte forbundet med ændringer i spyttets sammensætning. Betegnelsen hyposalivation anvendes, når der objektiv måling af helspytsekretionen (sialometri) er påvist en en ustimuleret sekretionshastighed på ≤ 0,1 ml/min og/eller en tyggestimuleret sekretionshastighed på ≤ 0,7 ml/min. Xerostomi,den subjektive fornemmelse af mundtørhed, optræder ofte ved nedsat spytsekretion [1], men kan også forekomme hos patienter med normal spytsekretion. Desuden kan der forekomme patienter med markant nedsat spytsekretion, som ikke føler sig tørre i munden, på trods af at de har kliniske tegn på hyposalivation som fx øget cariesaktivitet. De to tilstande kan derfor kræve forskellige behandlingsmæssige indsatser. For patienter med moderat nedsat spytsekretion (ikke hyposalivation) kan stimulation af spytkirtlerne med tyggegummi og andre sukkerfri pastiller undertiden være tilstrækkeligt til at løse problemet. Mens patienter med hyposalivation og svær xerostomi rådes til at anvende højviskøse spyterstatningsmidler (fx gel) og stimulere den tilbageværende spytkapacitet med tyggegummi.
Eftersom spyttet udgør vores første forsvarslinje mod infektioner, er en normal spytsekretion afgørende for opretholdelse af den orale sundhed [1]. Spyttets muciner og glykoproteiner smører og beskytter mundslimhinden og beskytter mod tandslid, mens buffersystemer og salte i spyttet beskytter tænderne mod caries. Spyttet indeholder også antimikrobielle komponenter, og væskestrømmen bidrager til at rense munden. Uanset årsagen vil permanent hyposalivation ofte føre til svær mundtørhed, caries, infektioner i slimhinden, især oral candidose, ubehag og smerter, hvilket kan resultere i vanskeligheder med at spise, tygge og synke. Sidstnævnte kan i værste fald medføre fejlernæring, vægttab og forringet livskvalitet [1][2][3]. Tabel 1 viser mulige konsekvenser af hyposalivation.
Orale subjektive symptomer |
Objektive kliniske tegn |
Andre manifestationer |
|---|---|---|
|
Tørhed og ømhed i munden Klæbende fornemmelse (tænderne klæber til mundslimhinden) Tørstfornemmelse, hyppigt væskebehov Brændende fornemmelse i munden Talebesvær Synkebesvær (dysfagi) Nedsat tyggefunktion Problemer med at have aftagelige proteser i munden Smagsforstyrrelser (dysgeusi eller hypogeusi) |
Plak og madrester på tænderne Forøget cariesaktivitet (cervikale og incisale læsioner) Tørre og sprukne læber Atrofisk, tør og rød mundslimhinde Atrofi af de filiforme papiller Fissurer og lobuleringer på tungeryggen Ulcerationer i slimhinden Protesestomatitis Oral candidiasis, angulær cheilitis Nedsat smagsevne ved tærskeltest Dentale erosioner Halitose |
Pharyngitis, laryngitis Øsofagitis, øsofageal dysmotilitet Syrereflux, halsbrand og kvalme Fejlernæring, obstipation, vægttab Kostændringer, fx at undgå tørre og krydrede fødevarer Nedsat livskvalitet Depression |
Lægemiddelinduceret xerostomi og hypofunktion
Xerostomi er den tredje mest almindelige lægemiddelbivirkning [4]. I en systematisk oversigt fra World Workshop on Oral Medicine VI fandt man 94 undergrupper af lægemidler i henhold til WHO’s Anatomical Therapeutic Chemical (ATC) klassifikationssystem, som kunne forbindes med spytkirteldysfunktion [5]. Det drejer sig om bl.a. psykoleptika, psykoanaleptika, antiepileptika og centralt virkende analgetika (opioider), antiemetika, antihypertensiva, midler mod inkontinens, antihistaminer til systemisk anvendelse, midler til behandling af obstruktive luftvejslidelser samt øjenmidler (Tabel 2). De lægemidler, der oftest angives at forårsage xerostomi og/eller hyposalivation, omfatter antidepressiva, antipsykotika, antikolinergika, antihypertensiva, antihistaminer og sedativa [4]. Adskillige lægemidler har xerostomi som bivirkning, men kun et fåtal er blevet testet for objektive ændringer i spyttets mængde og/eller sammensætning [4][5]. Incidensen af xerostomi og hyposalivation stiger i øvrigt i tilfælde af polyfarmaci [6].
Lægemiddelgruppe (ATC-kode) |
Virkningsmekanisme |
|---|---|
|
Psykoleptika (N05) Diazepam, Lorazepam, Zopiclon, Zolpidem: Benzodiazepin-derivater som anvendes mod søvnløshed og angst. Clozapin: Neuroleptikum som anvendes mod skizofreni. Hæmmer α-adrenerge og kolinerge receptorer samt histaminerge receptorer. Har desuden anti-serotonerge egenskaber. |
Fremmer GABA-effekt i centralnervesystemet; reducerer spytsekretion. |
|
Psykoanaleptika (N06) Citalopram, Sertralin, Escitalopram, Fluoxetin: Selektive serotonin (5HT) genoptagshæmmere, der anvendes som antidepressiva. Amitriptylin, Nortriptylin: Nonselektive monoamin-genoptagshæmmere som anvendes til behandling af neuropatisk smerte, kronisk hovedpine og migræne. |
Blokerer genoptag af serotonin, histamin, dopamin og noradrenalin. |
|
Antiepileptika (N03) Carbamazepin (Tegretol): er kemisk beslægtet med tricykliske antidepressiva, anvendes i behandling af epilepsi. Gabapentin: Anvendes ved behandling af epilepsi og perifer neuropatisk smerte. |
Virker centralt ved at fremkalde et fald i frigivelsen af neurotransmittere som fx glutamat, noradrenalin, serotonin og dopamin. |
|
Analgetika (N02) Tramadol,Tapentadol: Centraltvirkende syntetiske opioidanalgetika som anvendes mod moderate til stærke smerter. Fentanyl: Opiodanalgetikum som anvendes mod kronisk smerte. |
Hæmmer reguleringen af spytsekretionen i centralnervesystemet, bl.a. ved at blokere genoptag af noradrenalin. |
|
Antiemetika (A03, A04) Metoclopramid (A03): Dopaminreceptor (D2) og serotoninerg 5HT3 receptorhæmmer som anvendes for at opnå centralt virkende antiemetisk virkning. Skopolamin (A04): Antagonist til muskarine, kolinerge receptorer som anvendes forebyggende mod kvalme og opkast i forbindelse med transportsyge. |
Blokerer neurotransmitterne dopamin D2 og serotonin (5HT2-4), hæmmer kolinerge receptorer (muskarine typer M1-5). |
|
Antihistaminer (R06) Loratidin, Ebastin, Fexofenadin: Selektive perifere H1 receptorhæmmere som anvendes til symptombehandling ved allergisk rhinitis. Azelastin: Potent langtidsvirkende antiallergikum. |
Central hæmmende virkning på histamin type 1 receptorer. |
|
Kardiovaskulære midler (C02, C03, C07, C08) Moxonidin (C02): Mindre xerostomi end α2-adrenerge receptorhæmmere, anvendes mod let til moderat essentiel hypertension. Furosemid (C03): Diuretikum som anvendes mod hypertension og lungeødem. Atenolol, Bisoprolol, Metaprolol, Timolol (C07): β1-blokkere som anvendes mod hypertension, kronisk, stabil angina pectoris og hjertesvigt. Verapamil (C08): Calciumkanalblokker som anvendes mod hypertension, angina pectoris og forkammerarytmi. |
Hæmmende virkning på sympaticus: adrenerge receptorer. |
|
Urologika (G04) Solifenacin, Tolterodin, Fesoterodin, Darifenacin Oxybutynin: Muskarin receptorantagonist som anvendes ved symptombehandling for inkontinens. |
Blokerer muskarine, kolingerge receptorer (M2 og M3) Tolterodin og Solifenacin er mindre xerogene end Fesoterodin og Oxybutynin. |
|
Midler mod obstruktive luftvejslidelser (R03) Tiotropium, ipratropium Glycopyrroniumbromid: Langtidsvirkende muskarine receptorantagonister. |
Blokerer muskarine, kolinerge receptorer. |
|
Øjenmidler(S01) Brimonidin: α2-adrenerg agonist som anvendes mod glaukom. |
Forårsager xerostomi, mekanismen er ukendt. |
Lægemidlernes virkning på spytsekretionen er kompleks. Et lægemiddel kan påvirke mekanismerne for spytdannelsen på flere måder og samtidigt, dvs. både reguleringen af spytsekretionen i centralnervesystemet og perifert ved aktiveringen af spytkirtlerne. Desuden kan bivirkningerne variere fra person til person afhængig af dosis, lægemidlets absorptions- og udskillelseshastighed, komorbiditeter, antallet af lægemidler og interaktionerne imellem dem. Vores viden om lægemiddelinduceret hyposalivation stammer hovedsageligt fra dyreeksperimentelle studier [4]. Det er udfordrende at kortlægge patogenesen hos mennesker, idet det kan være vanskeligt at skelne specifikke virkninger af et givent lægemiddel fra effekten af den underliggende sygdom. Systemiske sygdomme som endokrine og neurodegenerative lidelser kan medføre patologiske forandringer i spytkirtelvævet og xerostomi med eller uden hyposalivation [4]. Tabel 3 opsummerer de vigtigste årsager til spytkirteldysfunktion. Prævalensen af xerostomi er høj blandt ældre og er relateret til indtagelse af et højt antal lægemidler [6]. Der er dog også en nyere undersøgelse fra primærsektoren, der tyder på, at lægemiddelforbrug er en signifikant prædiktor for forekomst af xerostomi uanset alder og køn, og at lægemidler har en større effekt på forekomsten af xerostomi end sygdomme per se [7]. Da antallet af præparater, som indtages, er en vigtig faktor, er samarbejde mellem tandlæger og den øvrige primærsektor af afgørende betydning for opretholdelse af oral sundhed for patienter med xerostomi og spytkirtelhypofunktion.
|
Iatrogene årsager: Indtagelse af visse lægemidler, polyfarmaci, stråleterapi mod hoved- og halscancer, graft versus host sygdom, kirurgiske traumer Kroniske inflammatoriske bindevævssygdomme,fx Sjögrens syndrom, reumatoid artritis, systemisk lupus erythematosus, skleroderma, blandet bindevævssygdom Kroniske inflammatoriske mavetarmsygdomme, fx Crohns sygdom, ulcerativ colitis, cøliaki, autoimmune leversygdomme Endokrine sygdomme, fx diabetes (type 1 og 2, især dårligt regulerede), hyperthyroidisme og hypothyroidisme Neurologiske sygdomme, fx CNS-traumer, cerebral parese, Parkinsons sygdom, Alzheimers sygdom, autonome dysfunktioner Infektionssygdommes, fx parotitis, HIV/AIDS, hepatitis C, Epstein-Barr virus Genetiske lidelser, fx cystisk fibrose, ektodermal dysplasi, Prader-Willi syndrom Metaboliske forstyrrelser, fx dehydrering, natriumretention, fejlernæring Spiseforstyrrelser,fx bulimia nervosa, anorexia nervosa Andre, fx burning mouth syndrome, mundånding |
Fremtidige studier må fokusere på, hvordan spytkirtlerne påvirkes af de forskellige systemiske sygdomme og lægemiddelkategorier, hvilke mekanismer der står bag lægemiddelinduceret xerostomi eller hyposalivation, hvordan spyttets mængde, sammensætning og funktionelle egenskaber bidrager til oplevelsen af mundtørhed, samt på at finde nye diagnostiske og terapeutiske strategier til behandling af patienter med xerostomi og hyposalivation.
Alderens betydning for spyttets dannelse og sammensætning
Spytkirtler undergår aldersrelaterede degenerative forandringer, som omfatter tab af acinusceller, stromale ændringer (øget fibrose) og relativt øget forekomst af udførselsgange. En række faktorer såsom nedsat blodcirkulation, dehydrering, faldende aktivitet af neurotransmittere, kroniske sygdomme, medicinforbrug og svækket immunforsvar (immunologisk aldring), kan bidrage til såvel strukturelle som funktionelle forandringer i spytkirtlerne [8]. På trods af det aldersrelaterede tab af sekretorisk væv, der generelt ses i alle spytkirtler, er der stor individuel variation i den funktionelle kirtelsvækkelse, der følger med aldringen [1][8]. Glandula (gl.) parotidea, der bidrager mest til dannelsen af tyggestimuleret helspyt, ser ud til at opretholde et stabilt funktionsniveau under aldring hos i øvrigt raske personer [1][9]. Den ustimulerede produktion af helspyt er mere tilbøjelig til at falde med alderen, og dette skyldes formentlig lavere sekretion fra glandula submandibularis og glandula sublingualis [9]. Dette kan også forklare den stigende prævalens af xerostomi med stigende alder [10][11].
Reducerede mucinniveauer er fundet associeret svækkelse af mundslimhindens forsvars-/barrierefunktion hos ældre [12]. Spytmuciner er store, rigt glykosylerede proteiner, som især produceres af de mukøse acinusceller i gl. submandibularis, gl. sublingualis og de små spytkirtler. Disse muciner, fx MUC5B, MUC7 og MUC1, udgør hovedbestanddelen af den beskyttende pellikel, der dækker mundslimhinden [13][14]. Reducerede mucinniveauer og nedsat smøreevne kan bidrage til at forklare den forhøjede risiko for mundslimhindelidelser, xerostomi og spiseproblemer, der ses blandt ældre mennesker [1][3][6][8].
Xerostomi og spytkirteldysfunktion som følge af cancerbehandling
Strålebehandling af tumorer i hoved- og halsregionen kan rammede store og små spytkirtler, der ofte ligger i strålefeltet. Sværhedsgraden af den xerostomi og spytkirtelhypofunktion, der forårsages af strålebehandlingen, afhænger af den kumulative stråledosis og mængden af spytkirtelvæv inden for det bestrålede område. Celledelingshastigheden for spytkirtelceller er forholdsvis langsom (cirka 60 dage), men på trods heraf er acinuscellerne strålefølsomme, og der opstår spytkirteldysfunktion allerede i løbet af den første uge af behandlingen, og spytsekretionen fortsætter med at falde 1-3 måneder efter behandlingens afslutning [15]. Den terapeutiske standardstråledosis for et planocellulært karcinom i hoved- og halsregionen løber op i en totaldosis på 60-70 Gy. Doser over 60 Gy medfører almindeligvis irreversibel hyposalivation og xerostomi, mens spytkirteldysfunktionen ved doser på 30-50 Gy kan være reversibel. Strålingen forårsager direkte skade på acinusceller, især de serøse acinusceller, men også på nerver og blodkar. Ved hjælp af intensitetsmoduleret stråleterapi (IMRT) er det muligt at reducere bestrålingen på de store spytkirtler og dermed mindske graden af spytkirtelhypofunktion, hvorved de orale funktioner og livskvaliteten også bliver mindre påvirket. Det er vanskeligere at skåne de små spytkirtler, som især bidrager til sekretionen af smørende muciner, og det kan forklare at xerostomi forbliver et hyppigt forekommende symptom [16][17]. Strålebehandling, der involverer spytkirtelvæv, kan også ændre spyttets indhold af antimikrobielle komponenter, herunder sekretorisk IgA, IgG, lactoferrin, lysozym og peroxidase [16]. Spyttet bliver typisk mere klæbrigt og tyktflydende.
Prævalensen af xerostomi blandt patienter, der får cancerkemoterapi, er omkring 50 %, og spytkirtelfunktionen er som regel genoprettet 6-12 måneder efter afsluttet behandling. Det er ikke afklaret, hvordan samtidig strålebehandling og kemoterapi påvirker risikoen for at udvikle spytkirteldysfunktion [17]. Nye undersøgelser har vist lovende resultater ved stamcellebehandling med henblik på genoprettelse af spytkirtelfunktionen efter strålebehandling [18].
Sjögrens syndrom
Sjögrens syndrom (SS) er en reumatisk autoimmun sygdom, som er karakteriseret ved immun-medieret destruktion af eksokrine kirtler, især tåre- og spytkirtler, der medfører symptomer på tørhed i mund og øjne som følge af hhv. hyposalivation og keratoconjunctivitis sicca. Mere end 80 %af patienterne lider af mundtørhed, tørre øjne, træthed og ledsmerter, og disse symptomer påvirker livskvaliteten kraftigt i negativ retning. Primært SS (pSS) kan også afficere andre organer end kirtler, fx lunger, nyrer, lever og kar. Betegnelsen sekundært SS anvendes, når sygdommen optræder samtidig med en anden autoimmun bindevævssygdom, fx reumatoid artritis, systemisk lupus erythematosus, sklerodermi eller dermatomyositis [19][20].
Prævalensen af pSS anslås til 0,3-3 per 1.000 i den generelle befolkning [21][22]. Kønsratioen kvinde/mand er 9:1, og incidensen topper i aldersintervallet 40-50 år, men sygdomsdebut i 60- og 70-årsalderen er ikke ualmindelig. Mænd med SS har ofte et mere alvorligt sygdomsbillede med højere koncentrationer af autoantistoffer og hyppigere involvering af andre organer end kirtlerne [23]. Hævelse af gl. parotidea er det mest almindelige symptom på SS hos børn [24].
Den kroniske inflammatoriske proces ved SS inddrager både det adaptive og det innate immunsystem. Autoreaktive B- og T-celler og cirkulerende autoantistoffer (anti-SSA/Ro og anti-SSB/La) forekommer hos de fleste patienter, og dannelse af ektopiske lymfoide strukturer og hypergammaglobulinæmi ses relativt hyppigt. Selvom mange potentielle genetiske, miljømæssige og hormonelle årsager er blevet udforsket, har man indtil videre ikke fundet nogen kausal sammenhæng, der kan forklare det afvigende immunrespons, som rammer en lang række epiteliale strukturer ved SS [19][20][25].
Patienter med pSS har op imod 16 gange forøget risiko for udvikling af malignt B-cellelymfom. Påvisning af kimcenterlignende strukturer i spytkirtelvævet er foreslået som mulig prædiktor for udvikling af lymfom [26]. Denne erkendelse kan danne grundlag for identifikation af højrisikopatienter gennem screening.
De nyeste klassifikationskriterier for SS, som er udgivet af American College of Rheumatology/European League Against Rheumatism (ACR-EULAR), repræsenterer en forenklet udgave af de tidligere kriterier og baserer sig på objektive tests som spytkirtelbiopsi fra læben, test for forekomst af anti-SSA i serum og funktionsmålinger af tåre- og spytkirtler [27] (Tabel 4). I klinikken stilles diagnosen på baggrund af disse kriterier, men udredningen inddrager som regel en række andre sygdomstegn.
2017 ACR/EULAR-kriterier | ||
|---|---|---|
Undersøgelse |
Score |
|
1. |
Læbespytkirtelbiopsi med fokus score ≤ 1 (positiv biopsi) |
3 points |
2. |
Forekomst af autoantistoffer anti-SSA/Ro i serum |
3 points |
3. |
Positiv øjenfarvetest (eller van Bijsterveld score ≥ 4) i mindst ét øje |
1 point |
4. |
Schirmers øjentest ≤ 5 mm/5 min i mindst ét øje |
1 point |
5. |
Ustimuleret helspytsekretionshastighed ≤ 1,5 ml/15 min |
1 point |
Spytkirtelbiopsi fra læben er aktuelt den bedste metode til diagnostik af spytkirteldelen ved SS, da metoden har høj specificitet og er minimalt invasiv. De typiske histopatologiske forandringer er veldefinerede foci af overvejende lymfocytter, som omgiver udførselsgangene og undertiden også de små blodkar. En positiv læbebiopsi defineres som et fokalt mononukleært infiltrat med en focusscore på ≥ 1 per 4 mm2 kirtelvæv. Det fokale infiltrat bør indeholde mindst 50 celler, hovedsagelig lymfocytter, og ligge omkring en udførselsgang, typisk i tæt relation til normalt udseende acini (figur 1A). Det er nødvendigt at foretage histopatologisk undersøgelse af ca. 4-6 små spytkirtler. Fokal inflammation ledsages ofte af acinusatrofi, fibrose og fedtinfiltration [28] (Figur 1B).
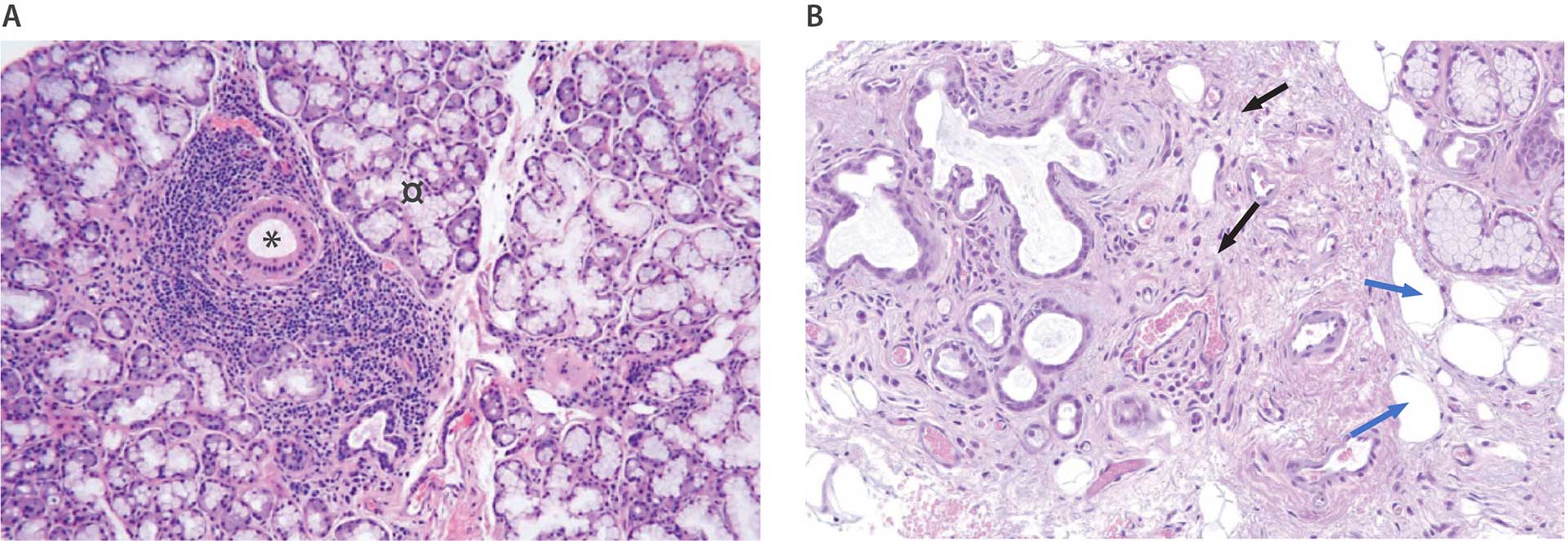
Figure 1 A-B. A: Labial salivary gland biopsy from a patient with pSS. Dense mononuclear focal infiltrates surround the larger ducts (*). Adjacent acini appear normal (¤). B: Labial salivary gland biopsy from a patient with sicca symptoms. Negative biopsy without focal infiltrates. Atrophy of acini and prominent interstitial fibrosis (black arrows). Scattered lymphocytes and plasma cells located in the atrophic areas. Some fat cell infiltration (blue arrows).
Aktuelt er der ikke nogen kurativ behandling for SS. Behandlingen er derfor primært symptomlindrende. Der er dog internationale bestræbelser i gang med henblik på at finde et grundlag for personlig medicinsk behandling af pSS. Forøget viden om patogenesen vil muliggøre nye tilgange til sygdommen, som kan forbedre diagnostik og behandling.
Non-neoplastiske reaktive spytkirtelsygdomme
Mucocele og sialocyste
Mucoceler (eller mucosacyster) er almindeligt forekommende forandringer i mundslimhinden. Klinisk fremtræder et mucocele som en eksofytisk, rund, solitær, blålig, violet, eller translucent og fluktuerende hævelse [29]. Ranula er et mucocele i mundbunden, som typisk opstår efter traume på gl. sublingualis [30]. Nomenklaturen omkring mucoceler har varieret, og et mucocele kan omfatte fænomener som udsivning af mucus eller retentionscyste (sialocyste eller udførselsgangscyste). I denne artikel er mucocele et synonym for udsivning af mucus, og sialocyste er synonym for retentionscyster [29]. Tabel 5 viser de typiske karakteristika for mucoceler og sialocyster [29][30][31].
Mucocele |
Sialocyste |
|
|---|---|---|
Alder |
< 30 år |
50-60 år |
Kønsfordeling |
Ligelig |
Flest kvinder |
Prævalens |
2,5/1.000 |
Sjældnere |
Lokalisation |
Underlæbe |
Glandula parotidea, underlæbe, kindslimhinde. |
Ætiologi |
Traume (læbebidning, blokering af udførselsgang). |
Obstruktion af udførselsgang. |
Histologi |
Ophobet mucin indkapslet af granulationsvæv. Ingen cystisk epitelbeklædning. Tilstødende små spytkirtler kan udvise degenerative forandringer |
En cystisk udvidelse beklædt med cylinderepitel, kubisk epitel eller pladecelleepitel fra en spytkirteludførselsgang. |
Behandling |
Konventionel kirurgisk excision (cystektomi) med fjernelse af tilstødende små spytkirtler. Marsupialisation udføres ved store mucoceler for at undgå beskadigelse af nærliggende strukturer som nerver og blodkar. |
Konventionel kirurgisk excision (cystektomi) med fjernelse af tilstødende små spytkirtler. |
Recidiv |
Hvis beskadiget spytkirtelvæv ikke fjernes. |
Hvis beskadiget spytkirtelvæv ikke fjernes. |
Sialolithiasis (spytsten)
Sialolithiasis er en sygdom, som rammer de store spytkirtler (gl. submandibularis (80-92 %), gl. parotidea (6-19 %) og gl. sublingualis (2 %)). Kliniske karakteristika er episodisk smerte og palpabel hævelse af kirtlen, især i forbindelse med måltider [32]. Der kan dog også i sjældne tilfælde påvises små solitære, submukøse noduli, som diagnosticeres som spytsten i de små spytkirtler (< 1 %), som regel i læbe- eller kindslimhinden [33].
Spytsten kan påvises radiologisk som radioopake forandringer. Mænd og kvinder rammes lige hyppigt, og tilstanden er mest udbredt blandt midaldrende. Ætiologi og patogenese er stadig uafklaret, men inflammation og obstruktion i en udførselsgang kan spille en rolle [33].
Sialendoskopi er en minimalt invasiv teknik til behandling af spytsten i de store spytkirtler. Den muliggør diagnostik og fjernelse af spytsten. Den gængse behandling af sialolithiasis i de små spytkirtler er kirurgisk excision [32].
Spytkirteltumorer
Spytkirteltumorer er sjældne, og de ses hyppigst i gl. parotidea. De første kliniske tegn er som regel en lokaliseret vævsfortykkelse, smerte og paræstesi, afhængig af den anatomiske lokalisation. Den mest almindelige spytkirteltumor er benignt pleomorft adenom, som har en incidens på 4,2-4,9/100.000 person-år og typisk optræder i aldersgruppen 20-50 år med en prædilektion for kvinder. Recidiverende pleomorfe adenomer har 3 %risiko for malign transformation. Basalcelleadenom og Warthins tumor indebærer ligeledes en lille risiko for malign transformation [34]. Maligne spytkirteltumorer udgør kun 3-5 %af hoved- og halscancere [34]. De hyppigste er mucoepidermoidt karcinom og adenocystisk karcinom [34], som har årlige incidensrater på hhv. 0,2-0,4/100.000 og 1-2/100.000 med en vis geografisk variation [33]. Forekomsten topper mellem 50 og 60 år, og kvinder rammes typisk hyppigere end mænd [34].
Billeddiagnostiske metoder (CT- og MRI-scanning) anvendes til bestemmelse af tumorens præcise lokalisation og størrelse. Patologisk diagnostik baseres på immunohistokemi og nye molekylære teknikker, der kan bidrage til erkendelse af tumorspecifikke fusionsgener [34]. Behandlingen af spytkirteltumorer er kirurgisk fjernelse, som i forbindelse med maligne tilstande eventuelt suppleres med postoperativ stråleterapi [35]. Prognosen er dårlig, hvis tumoren histologisk fremtræder aggressivt, og hvis det kliniske stadie er fremskredet, mens tumorer med begrænset udbredelse (»low grade«) har gode overlevelsesrater [34].
Diagnostik og behandling af patienter med mundtørhed
I takt med at verdens befolkning bliver ældre, vil xerostomi og nedsat spytsekretion udgøre et stigende sundhedsproblem i fremtiden. Det er af afgørende betydning, at man i tandplejesektoren har forståelse for, at disse tilstande ikke er ligegyldige. De kræver grundig udredning med henblik på identifikation af den underliggende årsag og iværksættelse af relevant behandling. Figur 2 illustrerer den systematiske vurdering af en patient, der klager over mundtørhed [1][36][37]. Det er veldokumenteret, at xerostomi og spytkirtelhypofunktion kan have konsekvenser for det almene helbred, og at det er nødvendigt at anerkende oral sundhed som et vigtigt og integreret led i den almene sundhedstilstand. Det er i den forbindelse bemærkelsesværdigt, at WHO’s generalforsamling i 2022 vedtog en global strategi for oral sundhed med en vision om universel oral sundhedsdækning for alle personer og samfund i 2030. En detaljeret handlingsplan (2023-30) er under udarbejdelse med henblik på at hjælpe de enkelte lande med at omsætte den globale strategi til praksis, herunder styrkelse af den orale sundheds integration i den primære sundhedstjeneste [38].
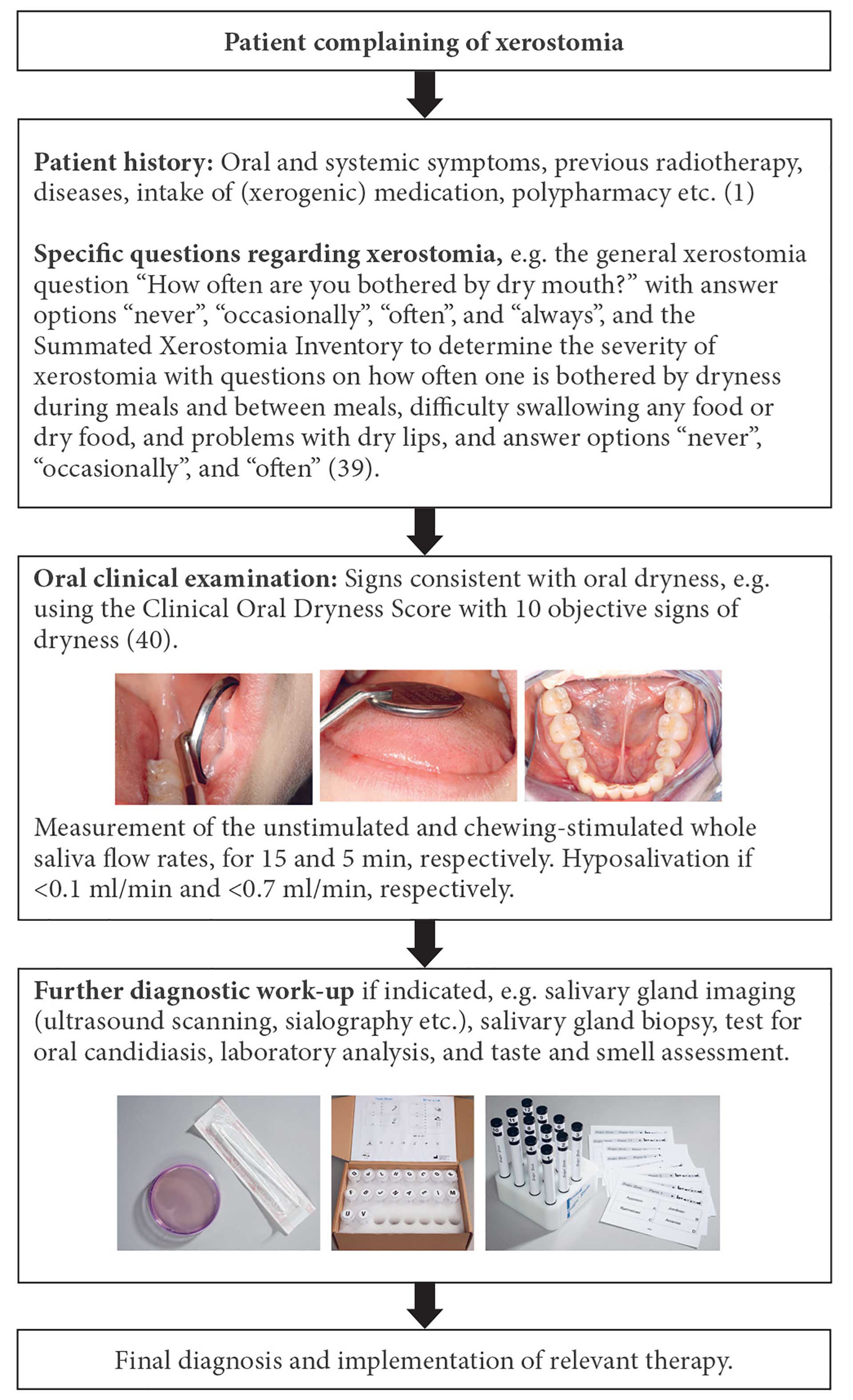
Figur 2. Systematic evaluation of patients with xerostomia.
I de nordiske lande henvises patienter, der klager over xerostomi, almindeligvis til specialister i oral medicin og/eller kæbekirurgi på universitetsklinikker eller hospitalsafdelinger for mere kompleks udredning. Der er meget få tværfaglige klinikker, der udelukkende beskæftiger sig med patienter, som har xerostomi og spytkirteldysfunktion. Et eksempel er den mundtørhedsklinik, som i 2015 blev oprettet på det odontologiske fakultet ved universitetet i Oslo som et samarbejde mellem afdelingerne for oral kirurgi, oral medicin, cariologi og gerodonti. Det overordnede formål er at tilbyde patienter med mundtørhed øget opmærksomhed, forbedret diagnostik og forbedret behandling og opfølgning og derigennem at forbedre deres orale sundhed og livskvalitet. Rationalet bag at samle patienter med pSS, non-SS sicca patienter og patienter, der er blevet strålebehandlet i hoved-halsregionen, er at opnå et overblik over de forskellige årsager til mundtørhed og finde valide sygdomsmarkører, som på længere sigt kan erstatte mere invasive målemetoder. Disse patienter har udtalte symptomer på mundtørhed, meget lav spytsekretion, hyppige Candida-infektioner, reduceret smags- og lugteevne og nedsat livskvalitet [39][40]. Non-SS sicca patienter lider under de samme problemer som patienter med pSS, selvom de har færre objektive symptomer end patienter med pSS [41]. Der er allerede publiceret omfattende kliniske data og biokemiske analyser af spyt fra disse patientgrupper [42].
Det første delmål ved behandling af patienter med mundtørhed er at finde og håndtere den underliggende årsag til tilstanden. Patienter med mundtørhed kan være vanskelige at behandle. Da der ofte ikke er en kurativ behandling for xerostomi og nedsat spytsekretion, er behandlingen rettet mod lindring af symptomerne og iværksættelse af tiltag, der kan forebygge følgetilstande til nedsat spytsekretion. Tabel 6 giver en oversigt over behandlingsmulighederne ved xerostomi og spytkirtelhypofunktion.
|
Generelt Multidisciplinært samarbejde med andre sundhedspersoner om behandling af underliggende systemiske tilstande. Kontakt patientens læge vedrørende det samlede forbrug af receptpligtig medicin og mulig substitution af xerogene lægemidler med mindre xerogene alternativer. |
|
Rådgivning til patienten God mundhygiejne og regelmæssige tandlægebesøg Kostvejledning: Undgå eller begræns indtagelse af tørre, hårde, klæbrige, sure og kariogene fødeemner Undgå eller begræns indtagelse af koffein og alkohol, som kan forværre fornemmelsen af mundtørhed Drik (små mundfulde) vand hyppigt og regelmæssigt (ved måltider og imellem disse) |
|
Stimulation af spytsekretion (forudsætter, at der stadig er fungerende spytkirtelvæv) Fysiologisk: sukkerfrit tyggegummi, sukkerfri bolsjer og pastiller Farmakologisk: fx ordination af parasympatomimetika med muskarin virkning (fx pilokarpin og cevimelin). Vær opmærksom på interaktioner og kontraindikationer Intraoralt elektrostimulationsapparat Akupunktur |
|
Lindring af symptomer på mundtørhed Brug af spyterstatningsmidler og smøremidler (geler, skyllevæsker, sprays), fx med indhold af carboxymetylcellulose, muciner eller colostrum |
|
Løbende forebyggelse og behandling Regelmæssige odontologiske undersøgelser og individuel mundhygiejneinstruktion hver 4.-6. måned Plakkontrol, fx mundskylning med klorhexidin Regelmæssig lokalbehandling med fluorid (tandpasta, gel, skyllevæske, lak) Diagnostik og behandling af oral Candida-infektion (fortrinsvis med lokalt antimykotikum) Protesehygiejne, -kontrol og -korrektion Tandpasta med CPP-ACP (caseinfosfopeptid-amorft calciumfosfat) Caries – restaurering, lokal fluoridbehandling |
Litteratur
Pedersen AML, Sørensen CE, Proctor GB et al. Salivary functions in mastication, taste and textural perception, swallowing and initial digestion. Oral Dis. 2018;24:1399-1416.
Rusthen S, Young A, Herlofson BB et al. Oral disorders, saliva secretion, and oral health-related quality of life in patients with primary Sjögren´s syndrome. Eur J Oral Sci. 2017;125:265-71.
Muñoz-González C, Vandenberghe-Descamps M, Feron G et al. Association between salivary hypofunction and food consumption in the elderlies. A systematic literature review. J Nutr Health Aging 2018;22:407-19.
Villa A, Wolff A, Narayana N et al. World Workshop on Oral Medicine VI: a systematic review of medication-induced salivary gland dysfunction. Oral Dis. 2016;22:365-82.
Wolff A, Joshi RK, Ekström J et al. A guide to medications inducing salivary gland dysfunction, xerostomia, and subjective sialorrhea: A systematic review sponsored by the World Workshop on Oral Medicine VI. Drugs R D. 2017;17:1-28.
Smidt D, Torpet LA, Nauntofte B et al. Associations between oral and ocular dryness, labial and whole salivary flow rates, systemic diseases and medications in a sample of older people. Community Dent Oral Epidemiol. 2011;39:276-88.
Adolfsson A, Lenér F, Marklund B et al. Prevalence of dry mouth in adult patients in primary health care. Acta Odontol Scand. 2022;80:605-10.
Toan NK, Ahn SG. Aging-related metabolic dysfunction in the salivary gland: A review of the literature. Int J Mol Sci. 2021;22:5835.
Affoo RH, Foley N, Garrick R et al. Meta-analysis of salivary flow rates in young and older adults. J Am Geriatr Soc. 2015;63:2142-51.
Nederfors T, Isaksson R, Mörnstad H et al. Prevalence of perceived symptoms of dry mouth in an adult Swedish population--relation to age, sex and pharmacotherapy. Community Dent Oral Epidemiol. 1997;25:211-6.
Ship JA, Pillemer SR, Baum BJ. Xerostomia and the geriatric patient. J Am Geriatr Soc. 2002;50:535-43.
Chang WI, Chang JY, Kim YY et al. MUC1 expression in the oral mucosal epithelial cells of the elderly. Arch Oral Biol. 2011;56:885-90.
Hannig C, Hannig M, Kensche A et al. The mucosal pellicle - An underestimated factor in oral physiology. Arch Oral Biol. 2017;80:144-52.
Kullaa AM, Asikainen P, Herrala M et al. Microstructure of oral epithelial cells as an underlying basis for salivary mucosal pellicle. Ultrastruct Pathol. 2014;38:382-6.
Berthrong M. Pathologic changes secondary to radiation. World J Surg. 1986;10:155-70.
Jensen SB, Pedersen AM, Reibel J et al. Xerostomia and hypofunction of the salivary glands in cancer therapy. Support Care Cancer. 2003;11:207-25.
Jensen SB, Pedersen AM, Vissink A et al. A systematic review of salivary gland hypofunction and xerostomia induced by cancer therapies: prevalence, severity and impact on quality of life. Support Care Cancer. 2010;18:1039-60.
Grønhøj C, Jensen DH, Vester-Glowinski P et al. Safety and efficacy of mesenchymal stem cells for radiation-induced xerostomia: a randomized, placebo-controlled phase 1/2 trial (MESRIX). Int J Radiat Oncol Biol Phys. 2018;101:581-92.
Mariette X, Criswell LA. Primary Sjögren’s syndrome. N Engl J Med. 2018;378:931-9.
Jonsson R, Brokstad KA, Jonsson MV et al. Current concepts on Sjögren’s syndrome - classification criteria and biomarkers. Eur J Oral Sci. 2018;126 (Supp 1):37-48.
Maldini C, Seror R, Fain O al. Epidemiology of primary Sjögren’s syndrome in a French multiracial/multiethnic area. Arthritis Care Res (Hoboken) 2014;66:454-63.
Qin B, Wang J, Yang Z et al. Epidemiology of primary Sjögren’s syndrome: a systematic review and meta-analysis. Ann Rheum Dis. 2015;74:1983-9.
Ramírez Sepúlveda JI, Kvarnström M, Brauner S et al. Difference in clinical presentation between women and men in incident primary Sjögren’s syndrome. Biol Sex Differ. 2017;8:16.
Basiaga ML, Stern SM, Mehta JJ et al. Childhood Sjögren syndrome: features of an international cohort and application of the 2016 ACR/EULAR classification criteria. Rheumatology (Oxford) 2021;60:3144-55.
Thorlacius GE, Björk A, Wahren-Herlenius M. Genetics and epigenetics of primary Sjögren syndrome: implications for future therapies. Nat Rev Rheumatol. 2023;19:288-306.
Theander E, Vasaitis L, Baecklund E et al. Lymphoid organisation in labial salivary gland biopsies is a possible predictor for the development of malignant lymphoma in primary Sjögren’s syndrome. Ann Rheum Dis. 2011;70:1363-8.
Shiboski CH, Shiboski SC, Seror R et al. 2016 American College of Rheumatology/European League Against Rheumatism classification criteria for primary Sjögren’s syndrome: A consensus and data‐driven methodology involving three international patient cohorts. Ann Rheum Dis. 2017;76:9-16.
Fisher BA, Jonsson R, Daniels T et al. Standardisation of labial salivary gland histopathology in clinical trials in primary Sjögren’s syndrome. Ann Rheum Dis. 2017;76:1161-8.
Chi AC, Lambert PR, Richardson MS et al. Oral mucoceles: A clinicopathologic review of 1824 cases, including unusual variants. J Oral Macillofac Surg. 2011;69:1086-93.
Bowers EMR, Schaitkin B. Management of mucoceles, sialoceles, and ranulas. Otolaryngol Clin North Am. 2021;54:543-51.
Stojanov IJ, Malik UA, Woo SB. Intraoral salivary duct cyst: Clinical and histopathological features of 177 cases. Head Neck Pathol. 2017;11:469-76.
Atienza G, López-Cedrún JL. Management of obstructive salivary disorders by sialendoscopy: a systematic review. Br J Oral Maxillofac Surg. 2015;53:507-19.
Lagha NB, Alantar A, Samson J et al. Lithiasis of minor salivary glands: current data. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2005;100:345-8.
El-Naggar AK, Chan JKC, Grandis JR et al. WHO classification of head and neck tumours, 4th ed. Lyon, France: IARC Press, 2017. To be updated 5th ed. 2023
Geiger JL, Ismaila N, Beadle B et al. Management of salivary gland malignancy: ASCO guideline. J Clin Oncol. 2021;39:1909-41.
Thomson WM, van der Putten GJ, de Baat C et al. Shortening the xerostomia inventory. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2011;112:322-7.
Osailan SM, Pramanik R, Shirlaw P et al. Clinical assessment of oral dryness: development of a scoring system related to salivary flow and mucosal wetness. Oral Surg Oral Med Oral Pathol Oral Radiol. 2012;114:597-603.
WHO. WHO discussion paper. Draft global oral health action plan (2023-2030). (Set 2023 april). Tilgænglig fra: URL: https://cdn.who.int/media/docs/default-source/ncds/mnd/eb152-draft-global-oral-health-action-plan.pdf
Tashbayev B, Rusthen S, Young A et al. Interdisciplinary, comprehensive oral and ocular evaluation of patients with primary Sjögren’s syndrome. Sci Rep. 2017;7:10761.
Westgaard KL, Hynne H, Amdal CD et al. Oral and ocular late effects in head and neck cancer patients treated with radiotherapy. Sci Rep. 2021;11:4026.
Tashbayev B, Garen T, Palm Ø et al. Patients with non-Sjögren’s sicca report poorer general and oral health-related quality of life than patients with Sjögren’s syndrome: a cross-sectional study. Sci Rep. 2020;10:2063.
Aqrawi LA, Galtung HK, Vestad B et al. Identification of potential saliva and tear biomarkers in primary Sjögren’s syndrome, utilising the extraction of extracellular vesicles and proteomics analysis. Arthritis Res Ther. 2017;19:14.
English summary
Conditions and diseases affecting the salivary glands and their function
Nor Tannlegeforen Tid. 2024; 134: 28-37.
Salivary gland hypofunction (objective evidence of diminished salivary output) and xerostomia (the subjective sensation of dry mouth) are common conditions. Patients with salivary gland hypofunction and altered saliva composition are at increased risk for developing caries, oral fungal infections, oral mucosal changes and debilitating symptoms, swallowing problems, and diminished or altered taste. The most prominent cause of xerostomia and salivary gland hypofunction is the intake of medications interfering with the nervous regulation of salivary secretion. Radiotherapy for cancer in the head and neck region often leads to permanent and severe xerostomia and salivary gland hypofunction due to degeneration of the salivary gland tissue involved in the radiation field. Sjögren’s syndrome, an autoimmune disease affecting exocrine glands, causes permanent xerostomia and hyposalivation due to immune-mediated structural changes in the salivary glands. Ageing may also be associated with structural changes in the salivary glands that can influence the functions of saliva. This article reviews the aetiopathogenesis, clinical manifestations, diagnosis, and management of conditions with salivary gland hypofunction, common salivary gland diseases (mucous cysts and sialoliths) and salivary gland tumours.
Korrespondanceansvarlig førsteforfatter: Anne Marie Lynge Pedersen. E-mail adresse: amlp@sund.ku.dk
Accepteret til publikation den 4. september 2023
Artikkelen er fagfellevurdert
Artikkelen siteres som: Pedersen AML, Skarstein K, Çevik-Aras H, Kullaa AM, Laine H, Jensen JL. Sygdomme og tilstande der påvirker spytkirtlerne og deres funktion. Nor Tannlegeforen Tid. 2024; 134: 28-37.
Emneord: Xerostomia ǀ hyposalivation ǀ salivary dysfunction ǀ sialolithiasis ǀ mucous cysts ǀ salivary gland tumours
