Alkohol som risikofaktor for hode-halskreft – en litteraturstudie
Hovedbudskap
Alkohol er en godt dokumentert risikofaktor for hode-halskreft
Alkoholnedbrytning i kroppen gir metabolitter som har karsinogen effekt
Alkohol gjør munnslimhinnen mer sårbar for kreftfremkallende stoffer i tobakk
Alkohol kan redusere immunforsvarets evne til å bekjempe kreft
Tannhelsepersonell har en rolle i å kartlegge og forebygge skadelig alkoholkonsum
Inntak av alkoholholdig drikke er en viktig risikofaktor for hode-halskreft. I denne oversiktsartikkelen belyser vi mekanismer som kan forklare hvordan alkohol øker risikoen for hode-halskreft. Vi setter søkelys på tre forhold: 1) nedbrytning av alkohol i kroppen gjennom enzymene alkohol dehydrogenase og aldehyd dehydrogenase, og karsinogene effekter av metabolitten acetaldehyd; 2) effekter på barrierefunksjonen til munnslimhinnen og hvordan dette kan bidra til synergistiske effekter mellom alkohol og andre risikofaktorer som tobakk; og 3) indirekte effekter av alkohol gjennom påvirkning av immunforsvaret. Vi diskuterer også tannhelsepersonell sin rolle i å forebygge og behandle sykdom i munnen, og at dette også bør innbefatte et ansvar for å kartlegge og forebygge mulig skadelig alkoholkonsum hos pasientene.
Kreft som oppstår i munnhulen, lepper, spyttkjertler, svelg, strupe, nese og bihuler kalles hode-halskreft [1], og forekomsten av denne kreftformen øker i Norge [2]. De best dokumenterte risikofaktorene for å utvikle hode-halskreft er tobakk og alkohol [3]. Tobakk inneholder en rekke kjemiske stoffer som kan øke risikoen for kreft – såkalte karsinogener [4]. Alkoholholdige drikker er også klassifisert som karsinogene for mennesker [5], men mekanismene som forklarer kreftrisikoen forbundet med alkohol er dårligere kjent. Tannhelsepersonell har en viktig oppgave i å forebygge sykdom i munnen og bør derfor ha kunnskap om alkohol som en risikofaktor for hode-halskreft. Gjennom denne narrative litteraturstudien ønsker vi derfor å belyse hvordan alkohol kan øke faren for hode-halskreft.
Metode
Denne litteraturstudien bygger på publikasjoner som er funnet gjennom litteratursøk i databasene Oria, PubMed og Google Scholar i perioden januar 2022 til mai 2023. Søkeordene som er brukt er blant annet «oral cancer», «head and neck cancer», «risk factors», «alcohol», «ethanol», «carcinogenesis», «acetaldehyde», «ALDH» og«ADH». Relevante publikasjonene ble i første runde selektert basert på titler og sammendrag, og måtte være skrevet på eller oversatt til engelsk eller norsk. I tillegg er det funnet relevant litteratur i referanselister til andre originalartikler og oversiktsartikler, samt i lærebøker. Det er også hentet informasjon fra nettsidene til Helsedirektoratet, SSB og verdens helseorganisasjon (WHO). På grunn av den brede problemstillingen vi ønsket å belyse i litteraturstudien, valgte vi å gjøre en narrativ og ikke en systematisk, fullstendig litteraturgjennomgang. Det kan derfor være relevante publikasjoner vi ikke har funnet. Dette er en forkortet versjon av en masteroppgave ved Universitet i Tromsø fra 2023 som bygget på 70 kilder. Antallet kilder er redusert i denne artikkelen på grunn av plasshensyn.
Alkohol og hode-halskreft
Hvordan oppstår kreft?
Kreft oppstår hovedsakelig på grunn av forandringer i cellers DNA og i kroppens evne til å bekjempe slike celler. Kjemiske og fysiske påvirkninger som direkte eller indirekte kan føre til DNA-skader kalles karsinogener [6]. DNA-skader kan også oppstå spontant, og forekomsten blir høyere ved økende alder. Det skyldes at kroppen vår med årene blir dårligere til å eliminere celler med skadet DNA, slik at de overlever og kan dele seg. På sikt kan dette medvirke til utvikling av kreftceller. Kreftceller deler seg oftere enn normale celler, og de kan spre seg lokalt og til fjerntliggende deler av kroppen der de fortrenger normale celler og forstyrrer funksjonene til vev og organer [7]. Det kan være livstruende.
Er alkohol en viktig risikofaktor for hode-halskreft?
Ja, det er gjort en rekke studier som viser en klar sammenheng mellom alkoholkonsum og risiko for hode-halskreft. En metaanalyse av sammenhengen mellom alkohol og risiko for å utvikle kreft ulike steder i kroppen fant sterkest sammenheng mellom alkoholkonsum og kreft i munn, svelg og spiserør [8]. Sammenlignet med personer som drakk sjelden eller aldri, økte risikoen for munn- og svelgkreft med henholdsvis 13 %, 86 % og 513 % hos de som normalt drakk litt (≤12 g/dag, tilsvarer en alkoholenhet), moderat (12.1g -50 g/dag) og mye (>50g/dag) alkohol. Studien var fra 2015 og baserte seg på 52 originalstudier om munn- og svelgkreft fra ulike deler av verden [8]. Det er også funnet at fortsatt alkoholbruk hos hode-halskreftbehandlede er forbundet med økt risiko for tilbakefall [9]. Hvis man slutter å drikke alkohol, fant en studie at kreftrisikoen var betydelig redusert etter 3 år, men det tok 14 år før den var på nivå med det en finner hos en som aldri har drukket alkohol [10]. Det er ikke god dokumentasjon for at type alkoholholdig drikke har vesentlig betydning for risiko, men en studie fant at det var større risiko knyttet til å drikke alkohol utenom måltider enn til måltider [10].
Hvordan øker alkohol risikoen for kreft?
Alkoholmetabolisme – acetaldehyd
For å forstå hvordan alkohol kan føre til kreft, må vi vite hva som skjer i kroppen når vi drikker alkohol. Alkohol blir raskt tatt opp fra magen og tarmen og transportert med blodet til leveren som omsetter omtrent 90 % av alkoholen vi inntar [11]. Mindre mengder alkohol omsettes også i slimhinnen i munn, spiserør og i magesekken. Alkohol brytes i hovedsak ned av enzymer i to trinn, som skissert i Figur 1. Et enzym kalt alkohol dehydrogenase (ADH) omdanner først alkohol til acetaldehyd, som deretter blir omdannet til acetat av enzymet aldehyd dehydrogenase (ALDH). Acetat blir senere omdannet til vann og karbondioksid [11].
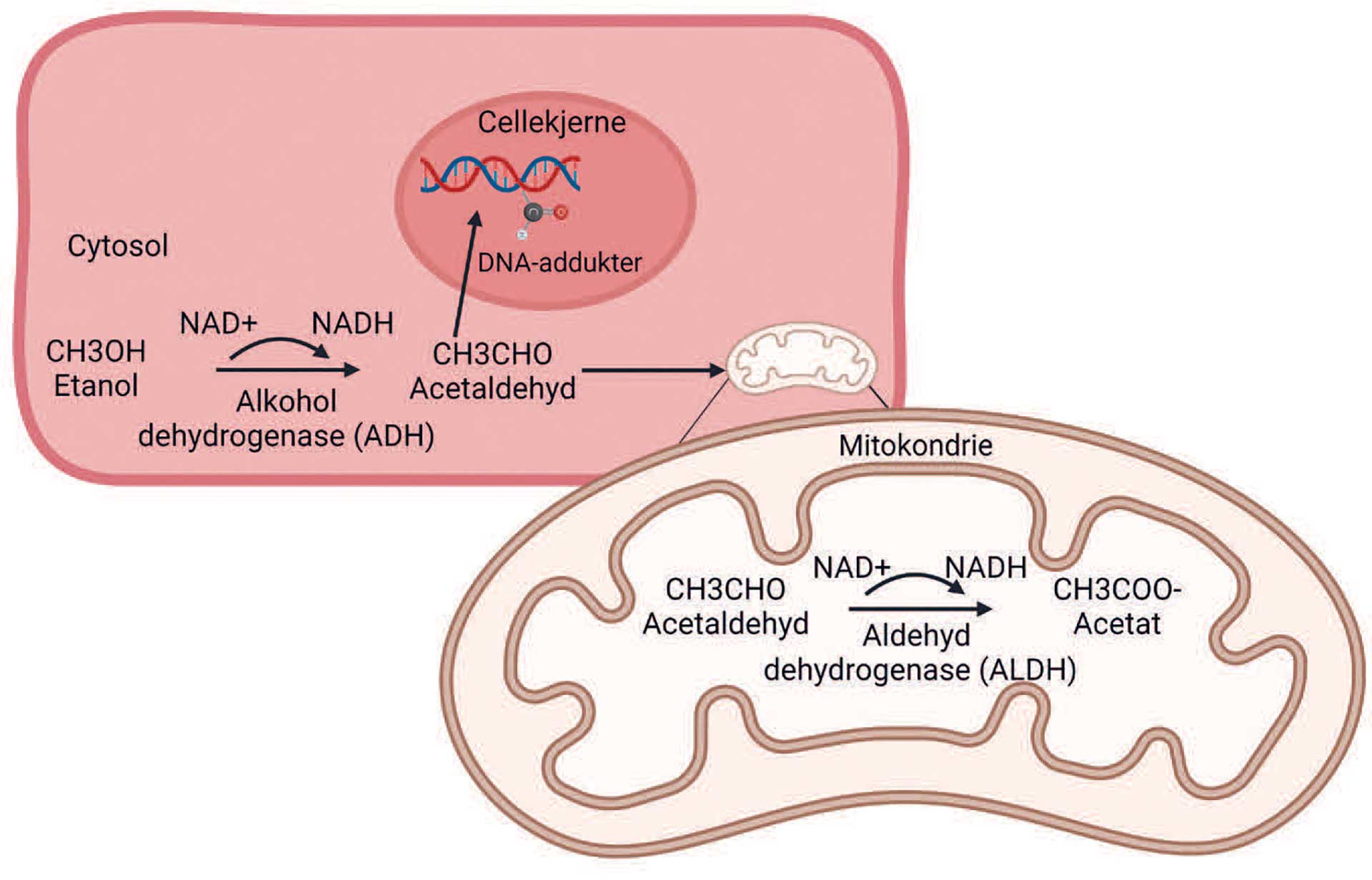
Figur 1. Alkoholmetabolisme. I cellens cytosol blir etanol omdannet til acetaldehyd ved hjelp av enzymet alkohol dehydrogenase. I mitokondriene blir acetaldehyd videre omdannet til acetat ved hjelp av enzymet aldehyd dehydrogenaser. Mellomproduktet acetaldehyd er reaktivt og kan binde til DNA og danne DNA-addukter i cellekjernen. Figuren er laget i BioRender.
Man tror at alkohol øker kreftrisikoen blant annet gjennom mellomproduktet acetaldehyd. Acetaldehyd er reaktivt og kan skade DNA ved å binde seg til dette og danne såkalte DNA-addukter (Figur 1). DNA-addukter kan forstyrre kopieringen av DNAet og gi opphav til mutasjoner, og det er vist at acetaldehyd kan gi forandringer i DNA i dyrkede pattedyrceller [12] [13]. En annen måte acetaldehyd kan fremme karsinogenesen på, er ved å hemme DNA-reparasjonsenzymer [14]. Det er godt underbygd at acetaldehyd virker karsinogent i dyrestudier, men den karsinogene effekten på mennesker er dårligere dokumentert. Verdens helseorganisasjons internasjonale byrå for kreftforskning (IARC) har konkludert med at acetaldehyd er «mulig karsinogent for mennesker» [15], men samtidig fastslått at «acetaldehyd assosiert med inntak av alkoholholdige drikker er karsinogent for mennesker» [5].
Både ADH og ALDH enzymene finnes i flere varianter, kalt isoenzymer. Disse er aktive på forskjellige steder i kroppen og har ulik effektivitet i omsetting av henholdsvis etanol til acetaldehyd og acetaldehyd til acetat [16]. Noen av isoenzymene har ulike undervarianter på grunn av såkalt genetisk polymorfisme, som er små forskjeller i genene som koder dem. Til tross for at de genetiske forskjellene er små, er det stor forskjell i effektiviteten til noen av variantene [16]. Hvilke av disse undervariantene vi har, påvirker derfor hvor fort de ulike trinnene i alkoholomsetningen går, og dermed også hvor eksponerte vi blir for acetaldeyd. Ved inntak av samme mengde alkohol, vil individer med en kombinasjon av effektive ADH-varianter, som gir en rask omsetning av etanol til acetaldehyd, og ineffektive ALDH-varianter, som fører til en langsom omsetning fra acetaldehyd til acetat, ha en høyere eksponering for acetaldehyd enn individer med andre varianter. Flere studier finner at dette gir en økt risiko for hode-halskreft [17] [18] [19] [20], noe som underbygger at acetaldehyd er involvert i kreftrisikoen forbundet med alkohol.
I tillegg til acetaldehyd som kroppens egne ADH-enzymer produserer, har vi mikrober i munnen som har ADH-enzymer, og disse kan produsere acetaldehyd i munnhulen når vi inntar alkohol. Det har blant annet blitt påvist ADH-aktivitet i vanlige munnhule streptokokker som Streptococcus salivarius og Neisseria [13] [21]. I tillegg har det blitt demonstrert at dårlig tannstatus resulterer i en økt acetaldehyd-produksjon fra alkohol i spytt [22], trolig som et resultat av endret bakteriesammensetning. Acetaldehyd finnes også i små mengder i matvarer og drikke som yoghurt, plantejucie, kaffe og alkoholholdig drikke (før omsetning i kroppen) [23].
Direkte effekter av alkohol på munnslimhinnen
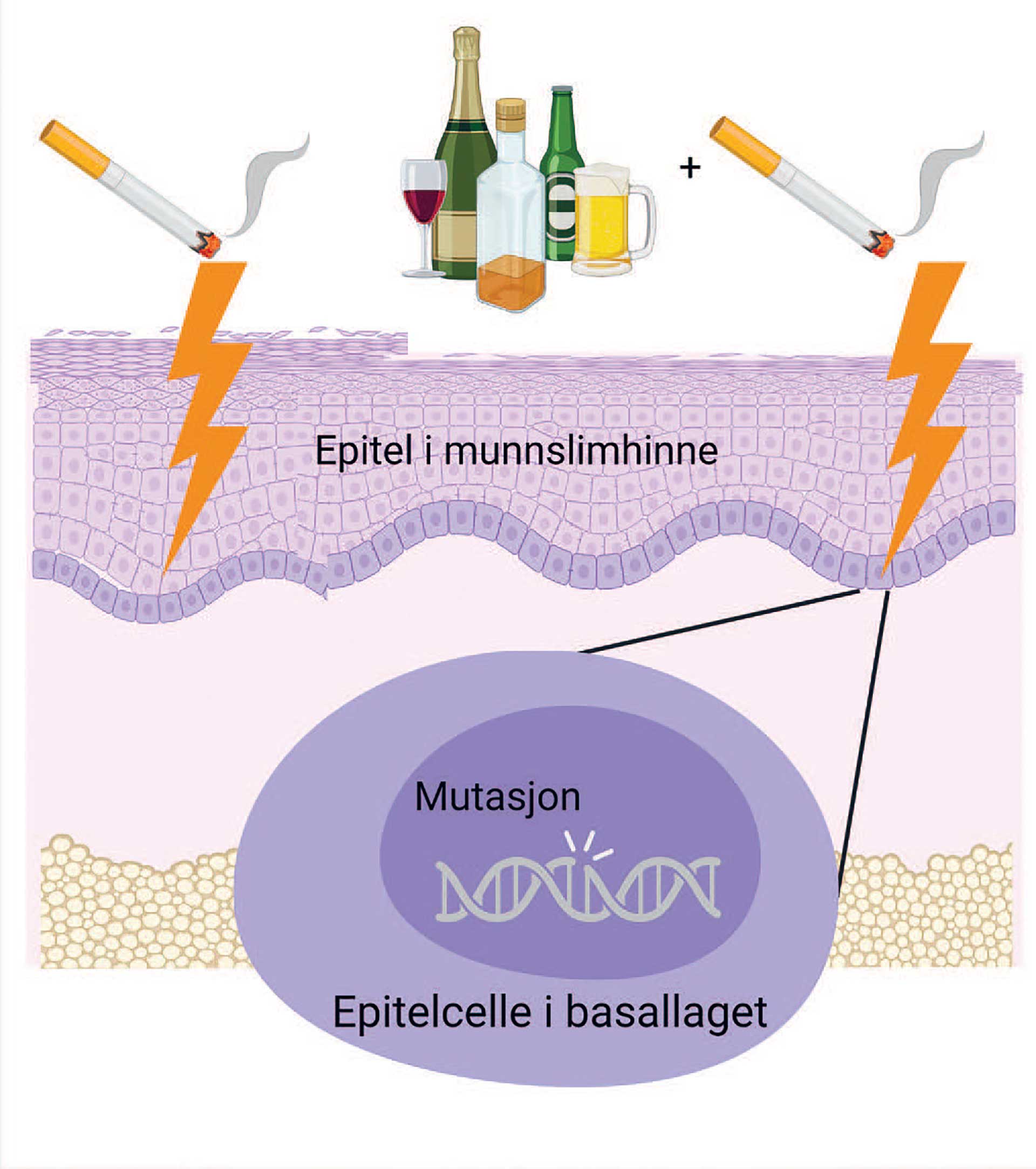
Figur 2. Synergistisk effekt av alkohol og tobakk på munnslimhinnen. Figuren illustrerer at alkohol kan gjøre epitelet i munnslimhinnen mer sårbart for andre karsinogener, som i tobakk, ved å gjøre epitelet mer gjennomtrengelig/permeabelt. Figuren er laget i BioRender.
I tillegg til de antatt karsinogene effektene vi utsettes for gjennom omsetning av alkohol til acetaldehyd, kan alkoholholdige drikker også påvirke kreftrisiko gjennom direkte effekter på munnslimhinnen. Hode-halskreft oppstår vanligvis i epitellaget i slimhinnen [1]. For at et karsinogen skal kunne gi mutasjoner som kan føres videre og forårsake kreft, må det nå det dypeste cellelaget i epitelet – basalcellelaget – der celledelinger foregår. Gjennomtrengeligheten til epitellaget vil derfor kunne påvirke effekten av karsinogener. I studier har man funnet at humant tungevev er mer gjennomtrengelig for både vann og proteiner etter eksponering for 15 % alkohol, og den øker ytterligere ved høyere konsentrasjoner av alkohol [24]. I slimhinne hos gris har man funnet en betydelig økning i gjennomtrengeligheten til det tobakkassosierte karsinogenet N-nitrosonornicotine etter eksponering for alkohol i 25 % konsentrasjon eller høyere [25]. Den økte gjennomtrengeligheten kan blant annet skyldes at lipidlaget som dekker munnslimhinnen blir svakere, men alkohol kan også øke løseligheten til karsinogener i munnhulen og slik forbedre deres evne til å trenge gjennom epitelet – de blir mer potente. Alkohol gjør altså slimhinnen mer sårbar for karsinogener, noe som kan bidra til å forklare hvorfor kreftrisikoen ved å kombinere alkohol og tobakk er større enn summen av risikoen for hver av faktorene for seg, såkalt synergistisk effekt (Figur 2).
I tillegg til å øke gjennomtrengeligheten av munnslimhinnen, kan alkohol også gi direkte skader på epitelceller i munnslimhinnen, det virker cytotoksisk [26]. Slike skader kan korte ned levetiden til cellene og gi hyppigere celledeling i dypere cellelag. Dette kan øke risikoen for mutasjoner, og dermed også risikoen for kreftutvikling.
Indirekte effekter av alkohol
Et høyt alkoholinntak over tid kan forstyrre både det medfødte og det ervervede immunforsvaret vårt. Kronisk alkoholisme er blant annet forbundet med redusert antall og effekt av NK celler (naturlige drepeceller) og cytotoksiske t-lymfocytter [27]. Dette er celler som er viktige i kroppens forsvar mot kreftceller, og når de taper funksjon, blir vi mer utsatt for å utvikle kreft både i munnen og ellers i kroppen. Vi får også dårligere evne til å bekjempe kreftsvulster som alt har oppstått.
Alkohol påvirker også sammensetningen av mikrofloraen i mage-tarmkanalen [28]. Ubalanse i mikrofloraen kan påvirke integriteten i slimhinnen, opptak av næringsstoffer og produksjon av signalstoffer i kroppen, og kan slik direkte og indirekte påvirke hvor utsatte vi er for å utvikle kreft.
Begrensinger i kunnskapsgrunnlaget
Det er svakheter i mange studier rundt alkoholkonsum og kreftrisiko som vi bør være oppmerksomme på. Alkoholkonsum er oftest selvrapportert. I mange land og kulturer er det stigma knyttet til et høyt alkoholkonsum, og man antar derfor at det er store unøyaktigheter og trolig en vesentlig underrapportering av faktisk konsum. Siden en stor del av befolkningen i mange land drikker noe alkohol, er det også vanskelig å finne gode kontrollgrupper i studier. I hverdagen er vi mennesker eksponert for en blanding av mange karsinogener, og det kan være vanskelig å isolere effekten av hvert enkelt av dem. Dette er enklere i forsøksdyr, og dyreforsøk er derfor vanlige når man studerer effekter av alkohol. Det er imidlertid ikke gitt at resultater fra dyr er direkte overførbare på mennesker. Til tross for disse begrensingene i litteraturen, er det liten grunn til å betvile at alkohol er en vesentlig risikofaktor for hode- halsekreft.
Forebygging – vi må tørre å snakke om alkohol
Alkohol er det vanligste rusmidlet i den vestlige verden. Globalt konsumerer hver person over 15 år drøyt 6 liter ren alkohol hvert år [29]. Til sammenligning var det i Norge omsatt nesten 7,5 liter ren alkohol per innbygger i 2021, turistimport og taxfree-salg kommer i tillegg [30]. Mellom 1960 og 2014 økte alkoholkonsumet per innbygger i Norge med 57 %, og vi ser en lignende trend i mange andre europeiske land [31]. Alkohol er en årsaksfaktor for mer enn 200 sykdommer, deriblant hode-halskreft, og det er den tredje største risikofaktoren for dårlig helse globalt [29] [32] [33]. Til tross for dette mener vi at det er lite oppmerksomhet rundt det å kartlegge og forbygge skadelig alkoholkonsum hos pasientene våre i tannhelsetjenesten, og i motsetning til tobakk er alkohol ikke spesifikt omtalt i Den Norske Tannlegeforenings policydokument om folkehelse [34]. Alkohol er hos mange forbundet med avslapping, sosialt samvær, gastronomi og finkultur, og å rette søkelys på alkoholens negative effekter kan bli oppfattet som pedantisk, moralistisk, eller dobbeltmoralsk om man nyter alkohol selv. Som fagpersoner har vi likefullt et ansvar for å kjenne til og forsøke å forebygge alkoholrelatert sykdom, og for å bidra til en opplyst samfunnsdebatt om dette rusmiddelet. Norske helsemyndigheter har ikke fastsatt konkrete grenser for hva som kan regnes som et trygt alkoholkonsum, dels begrunnet i at det ikke er mulig å definere en slik grense. De nordiske ernæringsanbefalingene som nylig ble publisert anbefaler imidlertid å avstå helt fra alkohol [35]. Istedenfor å gi konkrete grenseverdier for et trygt alkoholkonsum, har helsemyndighetene i Canada valgt å angi relativ helserisiko ved inntak av ulike mengder alkohol, der 1–2 alkoholenheter i uka er forbundet med lav helserisiko, 3–6 enheter moderat, og 7 eller flere knyttet til økende og høy helserisiko [36]. Tydeligere offisielle anbefalinger også i Norge kan gjøre det enklere for helsepersonell å ta opp alkoholbruk med pasienter, samt for hver enkelt av oss å vurdere risiko knyttet til eget forbruk. Først når vi er kjent med risikoen, kan vi og våre pasienter gjøre opplyste valg rundt eget alkoholkonsum.
Referanser
Chow LQM. Head and Neck Cancer. N Engl J Med. 2020;382(1):60-72.
Cancer in Norway 2022 -Cancer incidence, mortality, survival and prevalence in Norway. Oslo: Cancer Registry of Norway; 2023.
Pezzuto F, Buonaguro L, Caponigro F, Ionna F, Starita N, Annunziata C, et al. Update on Head and Neck Cancer: Current Knowledge on Epidemiology, Risk Factors, Molecular Features and Novel Therapies. Oncology. 2015;89(3):125-36.
Jethwa AR, Khariwala SS. Tobacco-related carcinogenesis in head and neck cancer. Cancer Metastasis Rev. 2017;36(3):411-23.
Alcohol consumption and ethyl carbamate. Iarc Working Group on the Evaluation of Carcinogenic Risks to Humans; 2010. Report No.: 1017-1606 (Print) 1017-1606 (Linking).
Hernandez LG, van Steeg H, Luijten M, van Benthem J. Mechanisms of non-genotoxic carcinogens and importance of a weight of evidence approach. Mutat Res. 2009;682(2-3):94-109.
Fouad YA, Aanei C. Revisiting the hallmarks of cancer. Am J Cancer Res. 2017;7(5):1016-36.
Bagnardi V, Rota M, Botteri E, Tramacere I, Islami F, Fedirko V, et al. Alcohol consumption and site-specific cancer risk: a comprehensive dose-response meta-analysis. Br J Cancer. 2015;112(3):580-93.
Cadoni G, Giraldi L, Petrelli L, Pandolfini M, Giuliani M, Paludetti G, et al. Prognostic factors in head and neck cancer: a 10-year retrospective analysis in a single-institution in Italy. Acta Otorhinolaryngol Ital. 2017;37(6):458-66.
Castellsagué X, Quintana MJ, Martínez MC, Nieto A, Sánchez MJ, Juan A, et al. The role of type of tobacco and type of alcoholic beverage in oral carcinogenesis. Int J Cancer. 2004;108(5):741-9.
Cederbaum AI. Alcohol metabolism. Clin Liver Dis. 2012;16(4):667-85.
Balbo S, Brooks PJ. Implications of Acetaldehyde-Derived DNA Adducts for Understanding Alcohol-Related Carcinogenesis. Biological Basis of Alcohol-Induced Cancer. 2014;815:71-88.
Balbo S, Juanes RC, Khariwala S, Baker EJ, Daunais JB, Grant KA. Increased levels of the acetaldehyde-derived DNA adduct N 2-ethyldeoxyguanosine in oral mucosa DNA from Rhesus monkeys exposed to alcohol. Mutagenesis. 2016;31(5):553-8.
Espina N, Lima V, Lieber CS, Garro AJ. In vitro and in vivo inhibitory effect of ethanol and acetaldehyde on O6-methylguanine transferase. Carcinogenesis. 1988;9(5):761-6.
World Health Organization IAfRoc. IARC Monographs on the evaluation of carcinogenic risks to humans Re-evaluation of Some Organic Chemicals, Hydrazine and Hydrogen Peroxide. 1999;71.
Edenberg HJ. The genetics of alcohol metabolism: role of alcohol dehydrogenase and aldehyde dehydrogenase variants. Alcohol Res Health. 2007;30(1):5-13.
Tsai ST, Wong TY, Ou CY, Fang SY, Chen KC, Hsiao JR, et al. The interplay between alcohol consumption, oral hygiene, ALDH2 and ADH1B in the risk of head and neck cancer. Int J Cancer. 2014;135(10):2424-36.
Asakage T, Yokoyama A, Haneda T, Yamazaki M, Muto M, Yokoyama T, et al. Genetic polymorphisms of alcohol and aldehyde dehydrogenases, and drinking, smoking and diet in Japanese men with oral and pharyngeal squamous cell carcinoma. Carcinogenesis. 2007;28(4):865-74.
Yokoyama A, Muramatsu T, Ishii H, Ohmori T, Yokoyama T, Okuyama K, et al. Alcohol-related cancers and aldehyde dehydrogenase-2 in Japanese alcoholics. Carcinogenesis. 1998;19(8):1383-7.
Béatrice Secretan KS, Robert Baan, Yann Grosse, Fatiha El Ghissassi, Véronique Bouvard, Lamia Benbrahim-Tallaa, Neela Guha, Crystal Freeman, Laurent Galichet, Vincent Cogliano. A review of human carcinogens—Part E: tobacco, areca nut, alcohol, coal smoke, and salted fish. The Lancet Oncology. 2009;10(11):1033-4.
Tao L, Pavlova SI, Gasparovich SR, Jin L, Schwartz J. Alcohol Metabolism by Oral Streptococci and Interaction with Human Papillomavirus Leads to Malignant Transformation of Oral Keratinocytes. Biological Basis of Alcohol-Induced Cancer. 2014; 815: 239-64.
Homann N, Tillonen J, Rintamäki H, Salaspuro M, Lindqvist C, Meurman JH. Poor dental status increases acetaldehyde production from ethanol in saliva: a possible link to increased oral cancer risk among heavy drinkers. Oral Oncol. 2001;37(2):153-8.
Jeong HS, Chung H, Song SH, Kim CI, Lee JG, Kim YS. Validation and Determination of the Contents of Acetaldehyde and Formaldehyde in Foods. Toxicol Res. 2015;31(3):273-8.
Howie NM, Trigkas TK, Cruchley AT, Wertz PW, Squier CA, Williams DM. Short-term exposure to alcohol increases the permeability of human oral mucosa. Oral Dis. 2001;7(6):349-54.
Du X, Squier CA, Kremer MJ, Wertz PW. Penetration of N-nitrosonornicotine (NNN) across oral mucosa in the presence of ethanol and nicotine. J Oral Pathol Med. 2000;29(2):80-5.
Calderón-Montaño JM, Jiménez-Alonso JJ, Guillén-Mancina E, Burgos-Morón E, López-Lázaro M. A 30-s exposure to ethanol 20 % is cytotoxic to human keratinocytes: possible mechanistic link between alcohol-containing mouthwashes and oral cancer. Clin Oral Investig. 2018;22(8):2943-6.
Molina PE, Happel KI, Zhang P, Kolls JK, Nelson S. Focus on: Alcohol and the immune system. Alcohol Res Health. 2010;33(1-2):97-108.
Engen PA, Green SJ, Voigt RM, Forsyth CB, Keshavarzian A. The Gastrointestinal Microbiome: Alcohol Effects on the Composition of Intestinal Microbiota. Alcohol Res. 2015;37(2):223-36.
Liliana Bachs ALB-J. Alkohol – rusmiddel 2022 [updated 06.05.2022. Available from: https://sml.snl.no/alkohol – rusmiddel.
SSB. Alkoholomsetning 2022 [updated 07.12.2022. Available from: https://www.ssb.no/varehandel-og-tjenesteyting/varehandel/statistikk/alkoholomsetning.
Hannah Ritchie MR. Alcohol consumption: OurWorldInData.org; 2018 [updated Januar 2022. Available from: https://ourworldindata.org/alcohol-consumption.
WHO. Alcohol 2022 [updated 09.05.2022. Available from: https://www.who.int/news-room/fact-sheets/detail/alcohol.
Poznyak V. Global strategy to reduce the harmful use of alcohol [Guideline]. WHO; 2010 [updated 31.05.2010. Available from: https://www.who.int/publications/i/item/9789241599931.
Policydokument om NTFs syn på Folkehelse med særlig vekt på ikke-smittsomme sykdommer, kosthold og tobakk Norway: Den Norske Tannlegeforening; 2013 [Available from: https://www.tannlegeforeningen.no/download/18.18a7cdc416d6d4515e224cc7/1570286325103/policy%20folkehelse.pdf.
Blomhoff R, Andersen, R., Arnesen, E.K., Christensen, J.J., Eneroth, H., Erkkola, M., Gudanaviciene, i., Halldorsen, T.I., Høyer-Lund, A., Lemming, E.W., Meltzer, H.M., Pitsi, T., Schwab, U., Siksna, I., Thorsdottir, I. and Trolle, E. Nordic Nutrition Recommendations 2023. Copenhagen: Nordic Council of Ministers; 2023.
Paradis C, Butt, P., Shield, K., Poole, N., Wells, S., Naimi, T., Sherk, A., & the Low-Risk Alcohol Drinking Guidelines Scientific Expert Panels. Canada’s Guidance on Alcohol and Health: Final Report. Ottawa, Ont: Canadian Centre on Substance Use and Addiction; 2023.
English summary
Head and neck cancer and alcohol – a literature review
Alcoholic beverages are classified as carcinogenic to humans and alcohol consumption is an important risk factor for head-and neck cancer. In this review article, we shed light on mechanisms that may explain how alcohol increases the risk of head- and neck cancer. We focus on three factors: 1) the breakdown of alcohol in the body through the enzymes alcohol dehydrogenase and aldehyde dehydrogenase, and the carcinogenic effects of the metabolite acetaldehyde; 2) effects on the barrier function of the mucosa and how this may explain the synergistic effects between alcohol and other risk factors such as tobacco; and 3) indirect effects of alcohol through the immune system. We also discuss the role of dental health personnel in preventing and treating oral disease, and that this should also include a responsibility to identify and prevent possible harmful alcohol consumption.
Korresponderende forfatter: Elin Hadler-Olsen, TkNN, postboks 2406, 9271 Tromsø. E-post: elin.hadlerolsen@tffk.no.
Akseptert for publisering 22.09.2023
Artikkelen er fagfellevurdert
Artikkelen siteres som:
Hansen M, Palo M, Warzoszczak M, Hadler-Olsen E. Alkohol som risikofaktor for hode-halskreft – en litteraturstudie. Nor Tannlegeforen Tid. 2023; 133: 884-8.
MeSH: Acetaldehyde; Alcohol Drinking; Carcinogens; Mucous Membrane; Risk Factors
Søkeord: Alcohol, head- and neck cancer, carcinogenesis
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Hansen M, Palo M, Warzoszczak M, Hadler-Olsen E. Alkohol som risikofaktor for hode-halskreft – en litteraturstudie. Nor Tannlegeforen Tid. 2023;133:884-9. doi:10.56373/2023-11-3
