Endodontisk diagnostik
Huvudpunkter
Denna artikel diskuterar nuvarande och framtida endodontisk diagnostisk terminologi och procedurer, inklusive den underliggande evidensen. De diagnostiska termer som används i de nordiska länderna för pulpala och periapikala förhållanden granskas i förhållande till litteraturen.
Endodontisk diagnostik är främst inriktad på att identifiera infektionsorsakad inflammation i pulpan och det periapikala området. En historik av problemHistoria av problem, tidigare och aktuella symtom, kliniska observationer och tester samt röntgenfynd är de faktorer som vanligtvis används för att ställa diagnosen. Dock är evidensen för en korrelation mellan specifika anamnestiska eller kliniska fynd och pulpans verkliga tillstånd bristfällig och tydlig konsensus för diagnostiska kriterier saknas. Nya och förbättrade metoder för vital pulpabehandling gör det möjligt att idag bibehålla pulpans vitalitet i större utsträckning än tidigare och därmed ökar kraven på valida och tillförlitliga metoder för identifiering av pulpans tillstånd. En korrekt diagnos är en förutsättning för lämpligt omhändertagande, och därför bör träffsäkerheten hos de nuvarande och framtida diagnostiska tester som används för att ställa diagnos undersökas i högkvalitativa studier. Diagnosterminologin varierar mellan de nordiska länderna men baseras vanligen i viss utsträckning på ICD-10. Ömsesidigt överenskomna diagnostiska termer baserade på tydliga och operationaliserade kliniska och datadrivna diagnostiska kriterier skulle vara till hjälp för tandläkarna och gynna patienterna.
Vad är en diagnos och varför är en korrekt diagnos nödvändig?
Endodontisk diagnos ligger till grund för hantering av alla kliniska fall som involverar sjukdom i pulpa eller periapikala vävnader. Innan någon behandling utförs, faktiskt redan innan tandläkaren fattar beslut om huruvida man ska behandla eller inte, måste tandläkaren göra en noggrann bedömning av patienten och komma fram till en trolig diagnos. Detta uppfattas ofta som utmanande, och en anledning kan vara att vi nästan alltid upplever en viss osäkerhet som först måste hanteras om vi ska kunna hjälpa patienten. Osäkerhetsfaktorn är naturligtvis något vi har gemensamt med alla andra medicinska områden, men inom tandvården är vi kanske mer än de flesta discipliner inställda på handling; patienter såväl som tandläkare förväntar sig att varje situation ska hanteras effektivt och på ett lämpligt sätt.
En annan faktor är att patienter inom tandvården personligen står för kostnaderna i större utsträckning än inom andra former av hälso- och sjukvård och att ersättningssystemet ofta bygger på omedelbara åtgärder. En ofta citerad anonym skotsk kliniker liknade diagnosen vid en ”mental viloplats” från vilken klinikern bör överväga beslut och prognos [1]. Metaforen är attraktiv, men med våra fulla väntrum och hektiska scheman är tiden ofta knapp för överläggning eller reflektion. Det är kanske inte så förvånande att korrekt dokumentation av diagnosen och hur man nådde fram till den ofta saknas i patientjournaler [2].
Av såväl patientsäkerhetsskäl som för adekvat behandlingsplanering bör en diagnos alltid vara grundvalen för alla behandlingsbeslut och tandläkare som grupp skulle tjäna på en bättre förståelse för diagnostisk vetenskap. Endodonti är ett område där detta kanske är särskilt viktigt eftersom sjukdomen är dold, och behandlingen är ofta radikal och inkluderar invasiva och irreversibla procedurer. I denna artikel kommer vi att diskutera nuvarande och framtida endodontiska diagnostiska procedurer och terminologier samt understödjande evidens.
Allmänna och specifika aspekter på endodontisk diagnostik
Diagnoser för sjukdomar i pulpa och periapikala vävnader härrör från olika typer av insamlad information (figur I):
Historik av problem som föregått nuvarande tillstånd, tidigare och nuvarande symtom. Detta inkluderar avvikelser som patienten noterat, både lokala (såsom en öm tand, känslighet för temperaturförändringar et cetera) och systemiska symtom (såsom sjukdomskänsla, feber, svårigheter att svälja et cetera.)
Kliniska tecken såsom karies, tandsprickor eller defekta restaureringar, svullnad et cetera.
Kliniska diagnostiska testresultat såsom pulpavitalitet eller provokationstester.
Information från röntgen; intraorala röntgenbilder och i utvalda fall 3D-röntgen.
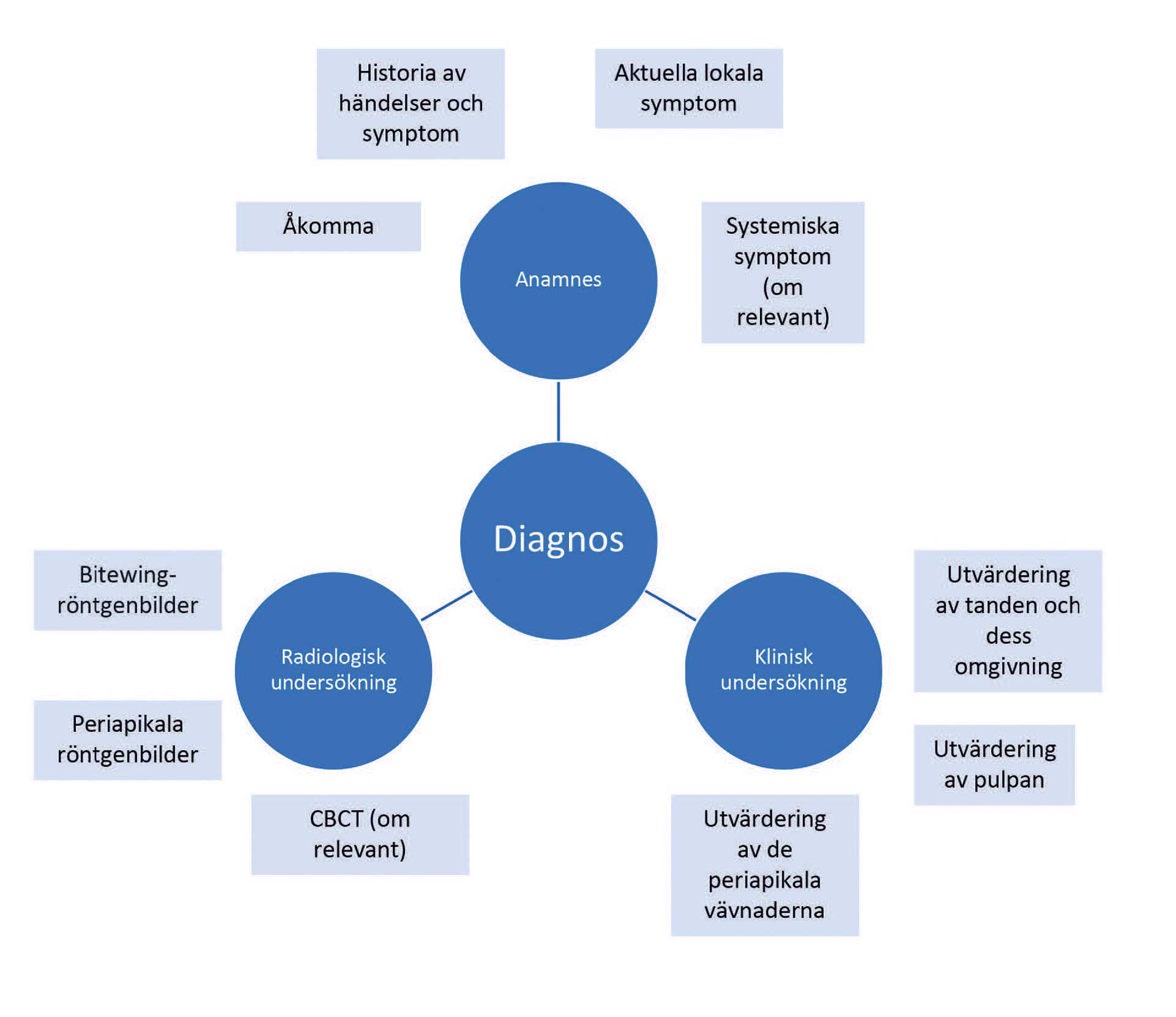
Figur 1. Klinisk diagnostisk procedur. Information samlas in genom kommunikation med patienten samt klinisk och radiologisk undersökning med fokus på dessa huvudfaktorer.
Vår kunskap om sjukdomsprocessen i kombination med summeringen av alla dessa faktorer leder till en preliminär slutsats om de involverade vävnadernas tillstånd och en benämning som representerar tillståndet, som vi kallar för diagnosen. För närvarande är kunskapsunderlaget för att olika tecken, symtom och smärtegenskaper kan korreleras till specifika endodontiska diagnoser inte starkt [3]. Ingen diagnostisk algoritm eller operationaliserade kriterier – i betydelsen ett strukturerat, entydigt och repeterbart förfarande som leder till en korrekt diagnos med hög säkerhet – har föreslagits, men många läroböcker föreslår att olika fynd vanligtvis är förknippade med olika grader eller varianter av sjukdom i pulpan eller den periapikala vävnaden. I allmänhet baseras sådana beskrivningar till största delen på expertutlåtanden. Det behövs högkvalitativa studier av den diagnostiska träffsäkerheten för att klargöra användbarheten av de diagnostiska tecken och tester som används idag [4].
Pulpadiagnoser
Bedömning av pulpavävnadens tillstånd kompliceras av det faktum att direkt inspektion av pulpan endast kan göras efter att behandlingen har påbörjats. Därför måste vi förlita oss på indirekta undersökningar för vår diagnos, såsom anamnestisk information, klinisk undersökning, sensibilitetstestning och röntgenundersökning.
Den minst sofistikerade bedömningen av pulpastatus innebär att man bedömer om pulpan är vital eller icke-vital. Vårt initiala antagande är att pulpan är vital om man noterar en reaktion när den testas. För detta ändamål förlitar vi oss oftast på sensibilitetstestning. Det finns tre typer av sådant test: termiskt, elektriskt och mekaniskt. För alla metoder gäller att det är viktigt att testa såväl tanden som misstänks för sjukdom som en referenstand för att bedöma patientens individuella svar på testet. Studier har visat att kyltest och elektriskt test har relativt god träffsäkerhet [5–9].
Vid svår, långvarig smärta kan det vara besvärligt att identifiera vilken tand som orsakar problemet. I sådana fall kan provokationstest med till exempel värme vara användbart. Selektiv anestesi av den misstänkta tanden kan också vara en möjlighet [10]. Röntgen är inte till stor hjälp eftersom förändringar begränsade till pulpan sällan påverkar det periapikala benet i sådan utsträckning att det kan detekteras i röntgenbilder. Det har föreslagits att användningen av CBCT (Cone Beam Computed Tomography) kan vara till hjälp eftersom mindre förändringar i trabekulärt ben kan visualiseras; det finns dock mycket lite tillgänglig evidens för att stödja detta påstående [11]. En parameter som kan bedömas på en röntgenbild är emellertid djupet av en kariesskada, och indirekt bakteriernas närhet till pulpan. Detta anses vara användbar information, inte bara avseende pulpans förväntade vitalitet utan också gällande graden av ett pulpalt svar/tillstånd/inflammation (figur II a).
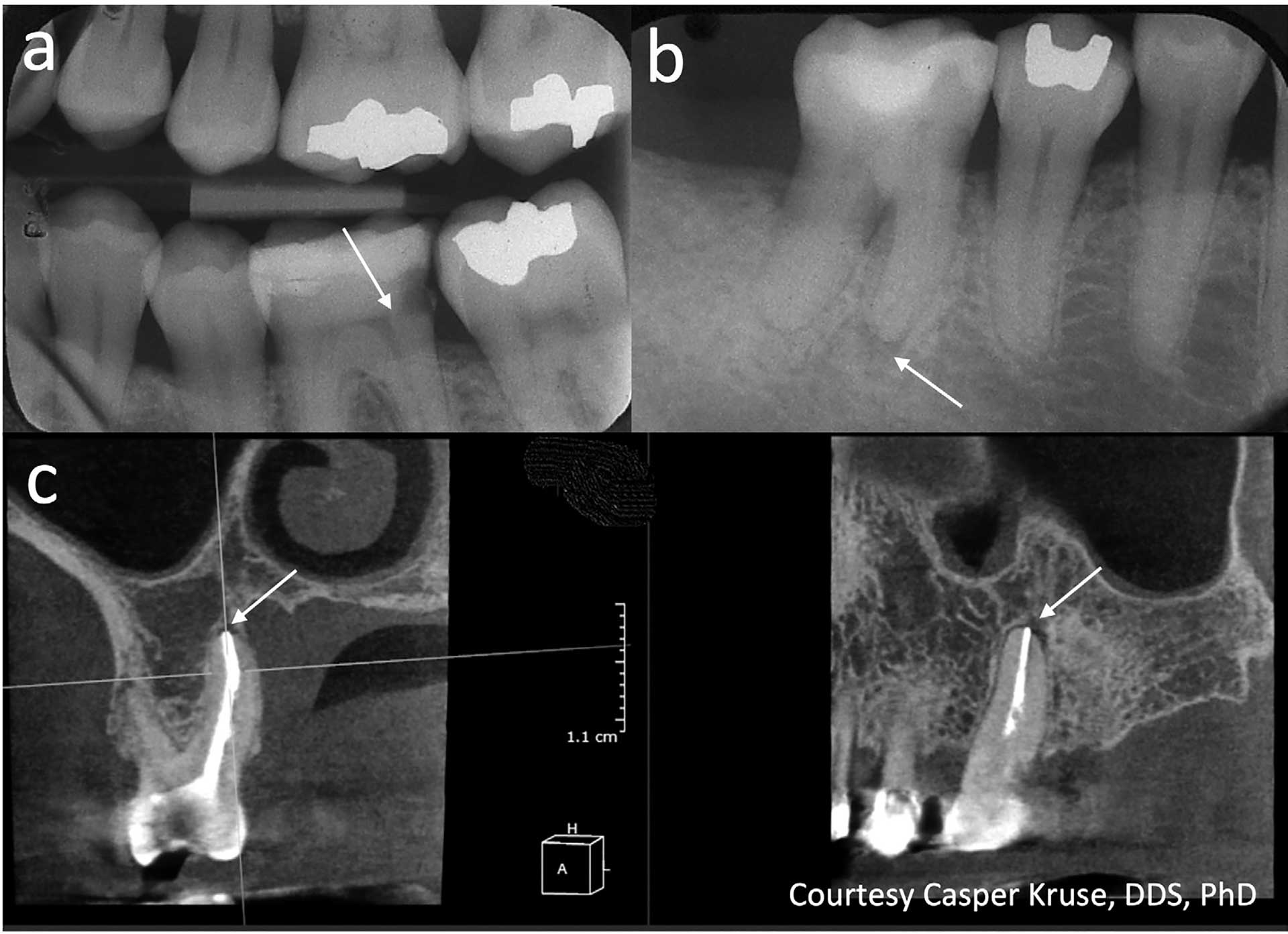
Figur 2 a–c. a) Bitewing-röntgenbild som visar djup karies i tand 36, men med synligt dentin mellan lesionen och pulpan (pil). I dessa fall är pulpainflammationen vanligtvis reversibel, och behandlingen bör syfta till att bevara pulpans vitalitet (Bjørndal et al, 2010).
b) Intraoral periapikal bild som visar en liten men tydlig radiolucens (pil) i anslutning till den icke rotfyllda tanden 46. Om en radioluscens är synlig föreligger sannolikt apikal parodontit. Det intraorala röntgenutseendet underskattar ofta lesionens utsträckning (Bender, 1982).
c) CBCT (sagittal och koronal vy) som visar en rotfylld tand 26 med diskret radioluscens (pilar). Vid rotfyllda tänder kan CBCT överskatta förekomsten av apikal parodontit och fyndet bör tolkas med försiktighet (Kruse et al, 2019).
Man har även förslagit andra metoder, såsom laserdopplerflödesmätning och pulsoximetri [9], som båda kan detektera blodflöde i pulpan. En fördel är att dessa tester inte förlitar sig på patientens svar och därför kan förväntas ge pålitligare information om pulpans status. Hittills har dock tillgänglighet, kostnad och tekniska utmaningar förhindrat en utbredd användning av dessa tester.
Förhoppningen är att det i framtiden kommer att finnas mer information tillgänglig om hur man identifierar svårighetsgraden av pulpainflammation. Nya metoder har föreslagits, såsom magnetresonanstomografi [12] och gen- och proteinuttrycksanalyser av inflammatoriska biomarkörer i dentinvätska eller blod [13]. Dock är metoderna ännu så länge långt ifrån möjliga att införa inom allmäntandvården.
Periapikal diagnos
I likhet med vid misstänkt pulpit kan man inte heller bedöma det sanna tillståndet hos de periapikala vävnaderna, eftersom de är dolda för direkt inspektion. Vid anamnestagningen kan patienten berätta om tidigare erfarenheter, såsom lokala svullnader, fistlar och dålig smak, eller kanske känslan av att en tand ömmar vid påbitning. Utvärdering av de periapikala vävnaderna kan innefatta att undersöka ömhet vid perkussion och palpation. Sådana undersökningar är mindre specifika till sin natur och kan inte användas som fristående diagnostisk information, men kan stödja en misstanke om periapikal inflammation, liksom naturligtvis närvaron av en fistel eller svullnad gör.
Följaktligen förlitar vi oss på indirekta metoder även vid diagnos av apikal parodontit (AP), och här är bildgivande metoder viktiga. Periapikal röntgen är den överlägset mest lättillgängliga och mest använda röntgenmetoden för att diagnostisera AP. Flera studier har bedömt korrelationen mellan röntgenfynd och histologisk bild [14–16]. Den övergripande slutsatsen är att röntgenfynd kan användas för att identifiera periapikal inflammation, trots att röntgeninformationen oftast underskattar den verkliga graden av periapikal inflammation (figur II b).
CBCT-bildens träffsäkerhet avseende periapikal diagnostik har undersökts i några nyligen genomförda kadaverstudier [17–18]. Den goda nyheten från dessa studier är att om en rot bedöms som frisk i CBCT-bilden, är det nästan säkert att den är frisk. Men tyvärr föreföll CBCT vara mindre tillförlitlig när en tand tidigare genomgått rotbehandling; 25–50 procent av de rotfyllda rötter som bedömdes ha AP i CBCT-undersökningen hade i själva verket ingen AP. Detta förhållande kan tyda på att en vänta-och-se-taktik kan övervägas i förhållande till symtomfria rotfyllda tänder som inte uppvisar några kliniska tecken på AP och där det finns tvivel gällande röntgendiagnosen.
Smärta som en diagnostisk markör
Eftersom smärta ofta är den främsta anledningen till att en patient söker akutvård [19] betraktas den av både patienter och vårdpersonal som en central faktor. Även om det är sant ur ett akutbehandlingsperspektiv, för vilket smärtlindring är ett viktigt mål, är värdet av smärta som en diagnostisk ledtråd bästa fall oklart. En omfattande systematisk litteraturöversikt genomförd av Statens beredning för medicinsk och social utvärdering (SBU) 2009 kom fram till att förekomsten, karaktären och varaktigheten av smärta endast uppvisade en svag korrelation till pulpans och de periapikala vävnadernas tillstånd [20]. Detta berodde delvis på brist på högkvalitativa studier, men sannolikt också på att smärta som symtom inte är särskilt specifikt och att individer upplever smärta olika.
Det är välkänt att smärta inte bara är ett sensoriskt fenomen, utan också har affektiva och kognitiva komponenter som skiljer sig mycket åt mellan individer [21]. Till exempel upplever patienter med tandvårdsrädsla mer smärta före, under och efter tandbehandling än sina ”orädda” gelikar [22], och deras smärta lindras i mindre utsträckning av analgetika [23]. Att tolka patientens beskrivning av smärtintensitet och konsekvenser kan därför vara en knepig uppgift, och man bör vara uppmärksam så att man inte överskattar sjukdomens allvarlighetsgrad enbart baserat på patientens beskrivning. I stället bör bedömningen fokusera på att fastslå var infektionen finns och tillståndet hos barriären mot mikrobiell invasion. Dessutom bör andra tillstånd som kan orsaka tandsmärta övervägas i de fall där de kliniska resultaten inte entydigt pekar på att smärtan har sitt ursprung i tänderna.
Refererad smärta från käksystemet till tänder är vanligt förekommande [24] och en undersökning av de regionala musklerna rekommenderas, till exempel DC/TMD-undersökning (Diagnostic Criteria for Temporo-Mandibular Disorders) [25], särskilt om tandsmärtan har pågått en tid och ökar vid käkrörelser eller då man biter eller tuggar. En annan möjlig differentialdiagnos för ihållande tandsmärta med få eller ofullständiga kliniska fynd är posttraumatisk trigeminal neuropatisk smärta, särskilt om smärtan började i samband med primär rotbehandling eller kirurgisk revisionsbehandling (apikalkirurgi).
Om en tand gör ont utan någon identifierbar orsak är det klokt att avstå från ytterligare behandling och hänvisa patienten till en specialisttandläkare inom endodonti eller orofacial smärta. Ett användbart omfattande referensverk för smärtsamma orofaciala tillstånd och deras diagnostiska kriterier är International Classification of Orofacial Pain [26–27].
Diagnostisk terminologi och kriterier
Den endodontiska terminologin varierar mellan de nordiska länderna (tabell 1). Medan de flesta vårdgivare och tandläkarutbildningar använder nationella versioner av ICD-10-diagnoskoderna [28] för patientjournaler och register för tandvårdsförsäkring, saknas det i praktiken ofta tydlig enighet om vilka diagnostiska termer som ska användas och det finns inga ömsesidigt överenskomna diagnostiska kriterier. Detta står i kontrast till många andra länder, där den rekommenderade terminologin från American Association of Endodontists (AAE) [29, 30] används, och AAE-termerna dominerar också den endodontiska litteraturen, även om variationer förekommer. Det bör dock noteras att AAE-diagnoskriterierna inte är baserade på forskningsdata. Bristen på konsensus är olycklig. Globalt accepterade definitioner och kriterier skulle vara till hjälp vid tolkningen av litteraturen och för att främja forskning om diagnostisk träffsäkerhet [4], och en uppmaning till översyn av den diagnostiska terminologin publicerades nyligen [31].
Pulpadiagnoser |
Käkbensdiagnoser |
|
|---|---|---|
ICD-10 |
K04 Diseases of pulp and periapical tissues K04.0 Pulpitis K04.00 Hyperemia of pulp K04.01 Reversible pulpitis K04.02 Irreversible pulpitis K04.1 Necrosis of pulp K04.2 Pulp degeneration K04.3 Abnormal hard tissue formation in pulp Ytterligare möjligheter: K04.9 K04.90 Unspecified diseases of pulp and periapical tissues K04.99 Other diseases of pulp and periapical tissues |
K04.4 Acute apical periodontitis of pulpal origin K04.5 Chronic apical periodontitis K04.6 Periapical abscess with sinus K04.7 Periapical abscess without sinus K04.8 Radicular cyst Ytterligare möjligheter: K04.9 K04.90 Unspecified diseases of pulp and periapical tissues K04.99 Other diseases of pulp and periapical tissues |
AAE |
Normal pulp Reversible pulpitis Symptomatic irreversible pulpitis Asymptomatic irreversible pulpitis Pulp necrosis Previously treated Previously initiated therapy |
Normal apical tissues Symptomatic apical periodontitis Asymptomatic apical periodontitis Acute apical abscess Chronic apical abscess (Condensing osteitis) |
Danmark |
Ingen tydlig nationell konsensus gällande diagnostisk terminologi Även AAEs terminologi lärs ut under tandläkarutbildningen (på engelska) |
|
|
(Pulpa traumata laesa) Reversible pulpititis Acute irreversible pulpitis Chronic irreversible pulpitis |
Acute apical periodontitis Chronic apical periodontitis Sclerotizing apical periodontitis Periapical abscess Radicular cyst |
|
Finland |
ICD-10 används med ett flertal ytterligare specifika ICD-10 koder |
|
Island |
Ingen nationell konsensus gällande diagnostisk terminologi AAEs terminologi används mestadels (översatt till isländska) |
|
Norge |
Viss nationell konsensus gällande diagnostisk terminologi ICD-10 används, med ett flertal ytterligare specifika ICD-10 koder |
|
Sverige |
Viss nationell konsensus gällande diagnostisk terminologi ICD-10 koder används inte* |
|
|
Kliniskt frisk pulpa (Clinically healthy pulp) Symptomatisk pulpit (Symptomatic pulpitis) Asymptomatisk pulpit (Asymptomatic pulpitis) Nekrotisk pulpa (Necrotic pulp) Tidigare instrumenterad (Previously instrumented) Tidigare rotfylld (Previously root-filled) |
Symptomatisk apikal parodontit (Symptomatic apical periodontitis) Asymptomatisk apikal parodontit (Asymptomatic apical periodontitis) Radikulärcysta (Radicular cyst) |
|
*Försäkringskassan kräver att diagnoskoden “3051 Sjukdomar i tandpulpan eller de periradikulära vävnaderna”, som motsvarar ICD-10 kod K04, ska användas i samband med endodontisk behandling.
Med nya behandlingsalternativ och riktlinjer för vital pulpa [32–35], inklusive bredare indikationer, nya bioaktiva material för stegvis exkavering, selektiv kariesexkavering, indirekt/direkt pulpaöverkappning [32, 35] samt ny evidens för att man med framgång kan använda partiell eller fullständig pulpotomi som en permanent behandling i permanenta tänder [36], verkar det tydligt att kliniska metoder för att bestämma progressionen och graden av inflammation i pulpan behövs ännu mer än tidigare. Termer som reversibel/irreversibel, akut/kronisk och symtomatisk/asymtomatisk kan vara mindre lämpliga som diagnostiska termer, eftersom de antingen inte motsvarar sjukdomsgraden, är tvetydiga eller inte påverkar den kausala behandlingen eller prognosen. Till exempel används termen ”irreversibel pulpit” som diagnos, men termen representerar faktiskt det förväntade behandlingsresultatet snarare än pulpans sanna tillstånd.
Med tanke på de få och svaga bevisen för det diagnostiska värdet av symtom och tecken kan ett lämpligt tillvägagångssätt vara att basera den endodontiska diagnosen på den bekräftade eller förmodade lokalisationen för bakterierna som orsakar inflammationen i pulpan eller de periapikala vävnaderna. Studier tyder på att denna faktor är den bästa prediktorn för vävnadens tillstånd [37–40] och för prognosen för pulpaöverlevnad [41–42]. Nyligen har nya klassificeringssystem för pulpit föreslagits, som baseras på symtom snarare än kariesskadans djup enligt röntgen och som indikerar att preoperativ smärta har prognostiskt värde [41, 43–44], men dessa har hittills inte fått bredare acceptans.
Osäkerhet, behandlingsbeslut och konsekvenserna av felaktig diagnos
När vi står inför den diagnostiska uppgiften måste vi komma ihåg att vårt huvudsyfte är att inte göra någon skada och att göra gott. Således bör vi överväga konsekvensen av diagnosen och vilka risker som kan vara förknippade med de beslut vi fattar baserat på en diagnos, trots att vi ibland inte är så säkra på denna som vi skulle önska.
Underdiagnostik i förhållande till vital pulpa kan resultera i ett beslut om ingen behandling eller otillräcklig behandling med risk för sjukdomsprogression, vilket innebär infektion i pulparummet och utveckling av AP med negativ påverkan på behandlingsutfallet. Å andra sidan kan överdiagnostisering resultera i en mer omfattande behandling, till exempel onödigt avlägsnande av hela eller delar av en frisk pulpa, med ökad risk för infektion, förlust av tandsubstans och – på sikt – tandförlust.
Vid bedömning av AP står vi också inför dilemman. Det är välkänt att AP oftast utvecklas med få eller inga symtom för patienten. Det är emellertid också ett tillstånd som kan leda till spridning av infektion och bli livshotande, om än i mycket få fall, så noggrann diagnos är absolut nödvändig.
AP kan förekomma både vid icke rotfyllda tänder och vid rotfyllda tänder. Om AP förekommer vid en icke rotfylld tand är risken för feldiagnos lägre jämfört med den rotfyllda tanden, eftersom vi har fler diagnostiska verktyg tillgängliga: både kliniska pulpatest och radiologi. Utan behandling är sjukdomsprogression sannolik, och så småningom kan tanden gå förlorad och/eller patientens allmänna välbefinnande äventyras. Om AP däremot misstänks vid en rotfylld tand är röntgen vårt primära diagnostiska verktyg. Man bör då komma ihåg att även med mer detaljerad röntgenologisk information (såsom CBCT) uppstår falska positiva diagnoser, och i dessa fall kommer patienten inte att ha nytta av ytterligare behandling (figur II c).
Ett enkelt diagnostiskt system med ömsesidigt överenskomna diagnostiska termer baserade på tydliga och operationaliserade kliniska och datadrivna diagnostiska kriterier skulle vara till hjälp för tandläkaren och gynna patienterna.
Klinisk relevans
Den endodontiska diagnosen är avgörande för korrekt bedömning av det endodontiska behandlingsbehovet och för val av behandling. I takt med utvecklingen av nya metoder för behandling av vital pulpa kan fler tänder förbli vitala och rotbehandling kan undvikas, vilket gynnar patienten. I dag vilar procedurer för pulpa- och periapikal diagnostik i viss utsträckning på expertutlåtanden, och det finns ingen global, eller ens nordisk, konsensus avseende diagnostiska termer och kriterier. Högkvalitativa studier av den diagnostiska träffsäkerheten behövs för att klargöra användbarheten av i dag använda diagnostiska fynd och tester för att utveckla framtida diagnostiska verktyg som kan indikera korrekt diagnos med hög säkerhet.
Referenser
Wulff HR, Götzsche PC. Rational diagnosis and treatment. Oxford: Blackwell Science; 2000.
Socialstyrelsen: Journalföring inom tandvården. 2012. Accessed 22.03.2022. URL: https://www.socialstyrelsen.se/globalassets/sharepoint-dokument/artikelkatalog/ovrigt/2012-5-5.pdf
Mejàre IA, Axelsson S, Davidson T, Frisk F, Hakeberg M, Kvist T et al. Diagnosis of the condition of the dental pulp: a systematic review. Int Endod J. 2012; 45: 597–613.
Pigg M, Duncan HF, Nagendrababu V, Abbott P, Fouad AF, Kruse C et al. Preferred Reporting Items for Diagnostic Accuracy Studies in Endodontics (PRIDASE): Guidance to improve manuscripts assessing the diagnostic accuracy of procedures, techniques and devices. Int Endod J. 2021; 54: 1005–7.
Petersson K, Söderström C, Kiani-Anaraki M, Lévy G. Evaluation of the ability of thermal and electrical tests to register pulp vitality. Endod Dent Traumatol. 1999; 15: 127–31.
Villa-Chávez CE, Patiño-Marín N, Loyola-Rodríguez JP, Zavala-Alonso NV, Martínez-Castañón GA, Medina-Solís CE. Predictive values of thermal and electrical dental pulp tests: a clinical study. J Endod. 2013; 39: 965–9.
Jespersen JJ, Hellstein J, Williamson A, Johnson WT, Qian F. Evaluation of dental pulp sensibility tests in a clinical setting. J Endod. 2014; 4: 351–4.
Pigg M, Nixdorf DR, Nguyen RHN, Law AS, National Dental Practice-Based Research Network Collaborative Group. Validity of preoperative clinical findings to identify dental pulp status: a national dental practice-based research network study. J Endod. 2016; 42: 935–42.
Mainkar A, Kim SG. Diagnostic accuracy of 5 dental pulp tests: a systematic review and meta-analysis. J Endod. 2018; 44: 694–702.
Petersson K, Reit C. Clinical pulp diagnosis and decision-making. In: Bjørndal L, Kirkevang L-L, Whitworth J, editors. Textbook of Endodontology. 3rd ed. Chichester: John Wiley & Sons, Inc; 2018. p 49–60.
Abella F, Patel S, Duran-Sindreu F, Mercadé M, Bueno R, Roig M. Evaluating the periapical status of teeth with irreversible pulpitis by using cone-beam computed tomography scanning and periapical radiographs. J Endod. 2012; 38: 1588–91.
Kocasarac HD, Geha H, Gaalaas LR, Nixdorf DR. MRI for dental applications. Dent Clin North Am. 2018; 62: 467–80.
Zanini M, Meyer E, Simon S. Pulp inflammation diagnosis from clinical to inflammatory mediators: a systematic review. J Endod. 2017; 43: 1033–51.
Brynolf I. A histological and roentgenological study of the periapical region of human upper incisors. Odonto Revy. Suppl 1967; 18: 1–176.
Barthel CR, Zimmer S, Trope M. Relationship of radiologic and histologic signs of inflammation in human root-filled teeth. J Endod. 2004; 30: 75–9.
Bender IB. Factors influencing the radiographic appearance of bony lesions. J Endod. 1982; 8: 161–70.
Kanagasingam S, Lim CX, Yong CP, Mannocci F, Patel S. Diagnostic accuracy of periapical radiography and cone beam computed tomography in detecting apical periodontitis using histopathological findings as a reference standard. Int Endod J. 2017; 50: 417–26.
Kruse C, Spin-Neto R, Evar Kraft DC, Vaeth M, Kirkevang LL. Diagnostic accuracy of cone beam computed tomography used for assessment of apical periodontitis: an ex vivo histopathological study on human cadavers. Int Endod J. 2019; 52: 439–50.
Jonasson P, Pigg M, Bjørndal L. Endodontic emergencies. In: Bjørndal L, Kirkevang L-L, Whitworth J, editors. Textbook of endodontology. 3rd ed. Chichester: John Wiley & Sons, Inc; 2018. p 171–84.
Methods of diagnosis and treatment in endodontics: a systematic review [Internet]. Stockholm: Swedish Council on Health Technology Assessment (SBU); 2010 Nov. SBU Assessment No. 203.
Melzack R, Casey KL. The affective dimension of pain. In: Arnold M, editor. Feelings and Emotions, New York: Academic Press; 1970. p 55–68.
Lin CS, Wu SY, Yi CA. Association between anxiety and pain in dental treatment: a systematic review and meta-analysis. J Dent Res. 2017; 96: 153–62.
Fernandez-Aguilar J, Guillén I, Sanz MT, Jovani-Sancho M. Patient’s pre-operative dental anxiety is related to diastolic blood pressure and the need for post-surgical analgesia. Sci Rep. 2020: 10: 9170.
Wright EF. Referred craniofacial pain patterns in patients with temporomandibular disorder. J Am Dent Assoc. 2000; 131: 1307–15.
Schiffman E, Ohrbach R, Truelove E, Look J, Anderson G, Goulet JP et al. Diagnostic Criteria for Temporomandibular Disorders (DC/TMD) for clinical and research applications: Recommendations of the International RDC/TMD Consortium Network and Orofacial Pain Special Interest Group. J Oral Facial Pain Headache. 2014; 28: 6–27.
International Classification of Orofacial Pain, 1st edition (ICOP). Cephalalgia. 2020; 40: 129–21.
Pigg M, Nixdorf DR, Law AS, Renton T, Sharav Y, Baad-Hansen L et al. New international classification of orofacial pain: what is in it for endodontists? J Endod. 2021; 47: 345–57.
ICD10Data. Diseases of pulp and periapical tissues. Accessed 22.03.2022. URL: https://www.icd10data.com/ICD10CM/Codes/K00-K95/K00-K14/K04-
AAE glossary of endodontic terms. March 2020 version. Accessed 22.03.2022. URL: https://www.aae.org/specialty/clinical-resources/glossary-endodontic-terms/
AAE recommended endodontic terminology. 2009 Consensus Conference. Accessed 22.03.2022. URL: https://www.aae.org/specialty/wp-content/uploads/sites/2/2017/07/aaeconsensusconferencerecommendeddiagnosticterminology.pdf
Rechenberg DK, Zehnder M. Call for a review of diagnostic nomenclature and terminology used in endodontics. Int Endod J. 2020; 53: 1315–7.
Duncan HF, Galler KM, Tomson PL, Simon S, El-Karim I, Kundzina R et al. European Society of Endodontology position statement: Management of deep caries and the exposed pulp. Int Endod J. 2019; 52: 923–4.
AAE position statement on vital pulp therapy. J Endod. 2021; 47 (9): 1340–4.
Duncan HF. Present status and future directions – Vital pulp treatment and pulp preservation strategies. Int Endod J 2022 Jan 26. doi: 10.1111/iej.13688. Epub ahead of print.
Bjørndal L, Simon S, Tomson PL, Duncan HF. Management of deep caries and the exposed pulp. Int Endod J. 2019; 52: 949–73.
Zafar K, Nazeer MR, Ghafoor R, Khan FR. Success of pulpotomy in mature permanent teeth with irreversible pulpitis: A systematic review. J Conserv Dent. 2020; 23: 121–5.
Seltzer S, Bender IB, Ziontz M. The dynamics of pulp inflammation: correlations between diagnostic data and actual histologic findings in the pulp. Oral Surg Oral Med Oral Pathol. 1963; 16: 846–71.
Seltzer S, Bender IB, Ziontz M. The dynamics of pulp inflammation: correlations between diagnostic data and actual histologic findings in the pulp. Oral Surg Oral Med Oral Pathol. 1963; 16: 969–77.
Mitchell DF, Tarplee RE. Painful pulpitis; a clinical and microscopic study. Oral Surg Oral Med Oral Pathol. 1960; 13: 1360–70.
Ricucci D, Siqueira JF Jr, Li Y, Tay FR. Vital pulp therapy: histopathology and histobacteriology-based guidelines to treat teeth with deep caries and pulp exposure. J Dent. 2019; 86: 41–52.
Careddu R, Duncan HF. A prospective clinical study investigating the effectiveness of partial pulpotomy after relating preoperative symptoms to a new and established classification of pulpitis. Int Endod J. 2021; 54: 2156–72.
Sato T, Matsuyama Y, Fujiwara T, Tagami J. Pulp survival after composite resin restoration of caries lesions in adults. J Oral Sci. 2020; 63: 27–30.
Hashem D, Mannocci F, Patel S et al. Clinical and radiographic assessment of the efficacy of calcium silicate indirect pulp capping: a randomized controlled clinical trial. J Dent Res. 2015; 94: 562–8.
Wolters WJ, Duncan HF, Tomson PL, Karim IE, McKenna G, Dorri M et al. Minimally invasive endodontics: a new diagnostic system for assessing pulpitis and subsequent treatment needs. Int Endod J. 2017; 50: 825–9.
English summary
Diagnostics in Endodontics
Endodontic diagnostics is mainly focused on identifying pulpal and periapical infection-driven inflammation. History of events, previous and current symptoms, clinical observations and tests, and radiographic examination findings are commonly used to derive the diagnosis. However, the evidence for the correlation of specific anamnestic or clinical findings with the true state of the pulp is scarce, and a clear consensus for diagnostic criteria is lacking. New and improved methods for vital pulp treatment enables preservation of pulp vitality to a greater extent today, with increasing demands of valid methods for reliable identification of the state of the pulp. A correct diagnosis is a prerequisite for appropriate management, and the accuracy of current and future diagnostic cues and tests should be examined in high-quality studies. Today, diagnostic terms vary between the Nordic countries but are usually to some extent based on the International Classification of Disease – Tenth Revision (ICD-10) Mutually agreed diagnostic terms based on clear and operationalized clinical and data-driven diagnostic criteria would be helpful for the dentist and benefit the patients.
Korresponderende forfatter: Maria Pigg.
E-post: maria.pigg@mau.se
Godkänd för publicering den 6 augusti 2022 och referentgranskad. Del av den nordiska artikelserien Endodonti.
Artikeln är översatt från engelska av Cecilia Hallström, Köpenhamn, Danmark.
Pigg M, Kirkevang L-L. Endodontisk diagnostik. Nor Tannlegeforen Tid. 2023; 133: 18-25.
Nyckelord: Diagnos, sjukdomar i tandpulpan, diagnostiska tekniker och procedurer, endodonti, apikal parodontit, pulpit
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Pigg M, Kirkevang L. Endodontisk diagnostik. Nor Tannlegeforen Tid. 2023;133:18-25. doi:10.56373/2023-1-5
