Behandling af periimplantitis
Klinisk relevans
Det er nødvendigt for klinikeren at kende til de muligheder og begrænsninger, der findes inden for behandling af periimplantitis. Denne artikel gennemgår nogle af de overvejelser, man må gøre sig, når man skal behandle sygdomsramte implantater.
Periimplantitis er en plakassocieret sygdom i vævene omkring tandimplantater og er karakteriseret ved progressivt tab af knoglevæv omkring implantatet. Læsionerne ved periimplantitis er ofte større og progredierer hurtigere end læsioner ved parodontitis. Det progressive knogletab omkring implantater påvirkes af en række faktorer som fx plak, samtidig parodontal sygdom og almen sundhedstilstand. Der er ingen dokumenteret standardbehandling for periimplantitis, men man kan med fordel følge en behandlingsplan med samme elementer som ved behandling af parodontitis: Undersøgelse med henblikpå atudrede de underliggende årsager til sygdommen, nonkirurgisk behandling, kirurgisk behandling og støttebehandling. Der er forskellige redskaber til brug ved nonkirurgisk behandling, men det er nødvendigt i hvert enkelt tilfælde at vurdere, hvor tilgængelige implantatoverfladerne er. Kirurgisk behandling sigter primært på at skabe bedre adgang til de kontaminerede implantatoverflader og dermed muliggøre effektiv fjernelse af biofilm. Der må tages stilling til, hvorvidt det kirurgiske indgreb skal være resektivt, genopbyggende eller en kombination af disse to. Man må ligeledes overveje, hvordan overfladerne skal dekontamineres. Efter den kirurgiske behandling skal patienterne indgå i et vedligeholdelsesprogram med henblikpå at holdeimplantaterne sygdomsfri.
Implantbehandling vinder stadigt større indpas i forbindelse med erstatning af manglende tænder. Implanter har høj overlevelsesrate på længere sigt (≥ 10 år); men behandlingssuccesen er ikke på samme niveau som overlevelsen, da implantater og implantatbårne rekonstruktioner under funktionen kan udvikle mekaniske og biologiske komplikationer. De biologiske komplikationer skyldes hovedsageligt ophobning af plak, og den fremherskende tilstand er periimplantitis [1].
Periimplantitis er en plakassocieret sygdom i de periimplantære væv og er karakteriseret ved fremadskridende tab af knoglestøtte omkring implantater [2].
Ætiologi og patogenese
Den inflammatoriske læsion ved periimplantitis indeholder flere neutrofile granulocytter og en større andel af B-lymfocytter end læsionerne ved periimplantær mucositis [3]. Ligesom ved parodontitis domineres læsionerne ved periimplantitis af plasmaceller og lymfocytter [4] [5].
Læsionerne ved periimplantitis er typisk dobbelt så store som læsionerne ved parodontitis, og de indeholder også signifikant flere inflammationsceller [7] (Figur 1). Endvidere ses ved periimplantitislæsioner en højere tæthed af vaskulære strukturer uden for og lateralt for celleinfiltratet [7].
I en klinisk sammenhæng kan det være vanskeligt at afgøre, hvilken pochedybde der er forenelig med sunde forhold omkring et implantat. Diagnoserne periimplantær sundhed, periimplantær mucositis og periimplantitis afhænger således af en række kliniske parametre, som må overvejes [8].
Progressivt tab af knoglestøtte omkring implantater påvirkes af en række lokale og systemiske faktorer.
Defekt ved periimplantitis
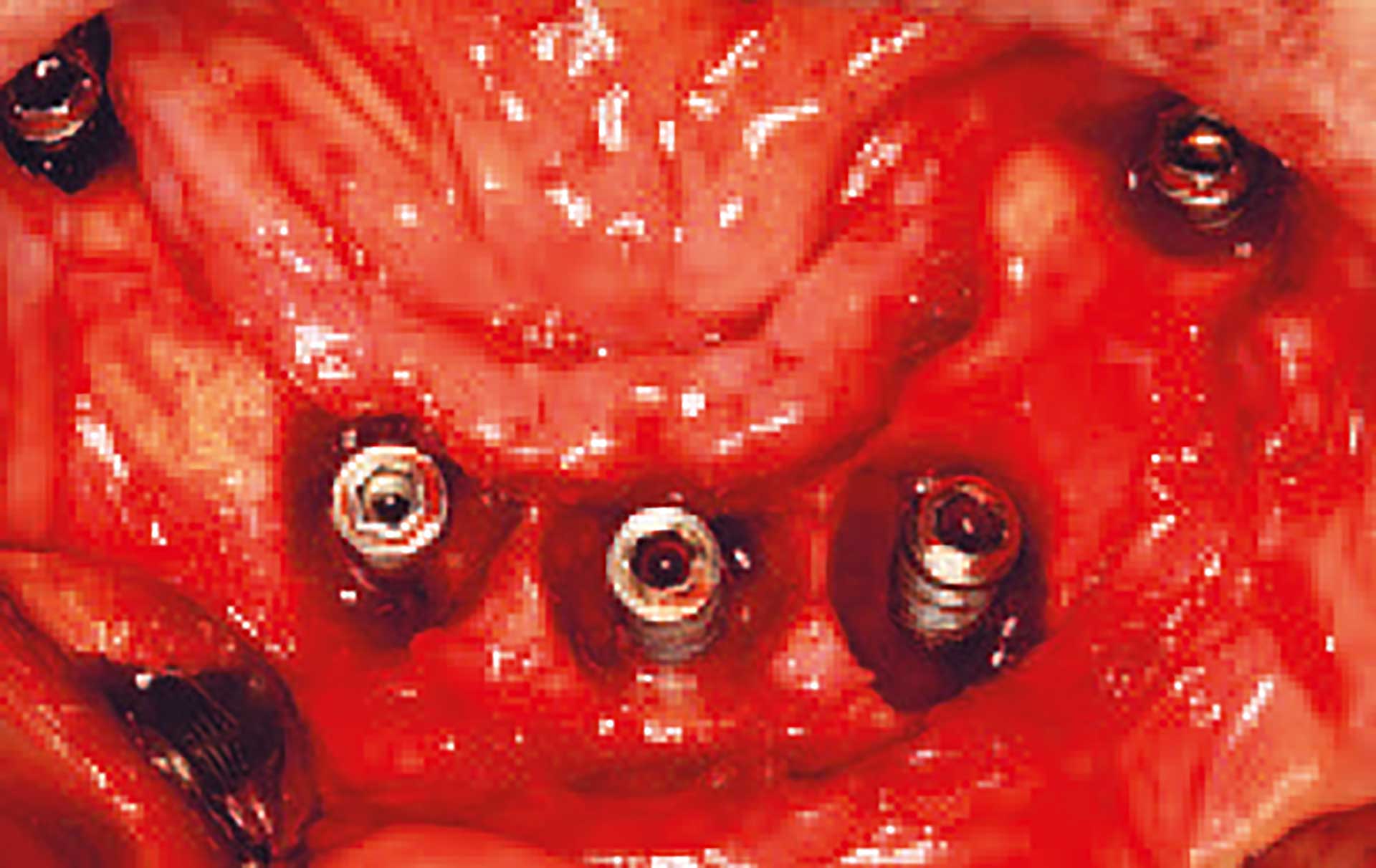
Figur 1. Defekterne ved periimplantitis er ofte større end defekterne ved parodontitis.
Lokale risikoindikatorer
Der findes ikke noget standardimplantat, og der er mange forskellige udformninger af implantater med forskellige overfladeegenskaber og forskellige protokoller for indsættelse og belastning, som alle kan på-virke osseointegrationen og knoglestabiliteten efter implantatindsættelsen [8]. Det er vigtigt at forstå, at den eksisterende videnskabelige litteratur om forskellige aspekter af implantatbehandling kun gælder for de producenter, der har prioriteret at følge op på deres produkter med fagfællebedømt forskning. Faktisk er der ingen litteratur, der kan understøtte, at implantater kan sammenlignes på tværs af fabrikater, når det drejer sig om biologiske egenskaber som fx risiko for udvikling af periimplantitis. Det er derfor klinike-rens ansvar ikke at vælge implantater ud fra økonomiske motiver.
Implantater, der er indsat under suboptimale forhold, har ofte forøget forekomst af periimplantitis. Der er nogen evidens for at knytte periimplantitis til faktorer som cementrester i pochen efter cementering af suprastrukturen og fejlplacering af implantatet, som vanskeliggør sufficient mundhygiejne og professionel vedligeholdelse af implantatet og dermed fører til akkumulation af plak [8] (Figur 2). Patienter med dårlig mundhygiejne (plakindeks > 20 %) har forøget risiko for udvikling af periimplantitis [9]. Patienter med pa-rodontitis har ligeledes forøget risiko for udvikling af periimplantitis [8].
Retraktion af den periimplantære mucosa hænger sammen med fejlplacering af implantatet, manglende bukkal knogle ved implantatindsættelsen, tynd gingival fænotype, manglende keratiniseret væv, reduceret fæsteniveau på nabotænderne samt kirurgiske traumer, især i relation til sårheling [10].Lokale risikoindikatorer
Kompromitteret mundhygiejne
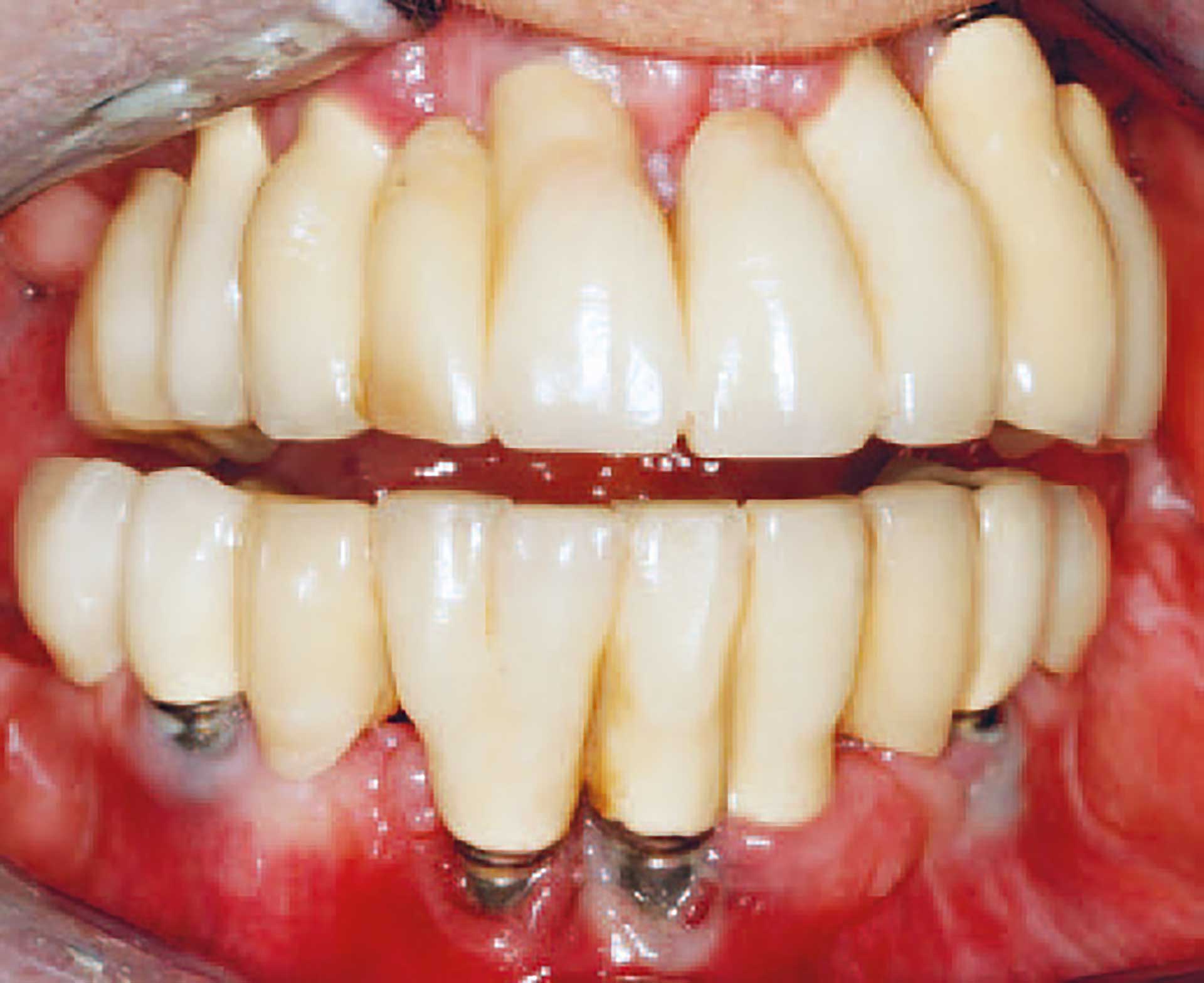
Figur 2. Implantater med en placering af fikstur og suprastruktur, der vanskeliggør sufficient mundhygiejne, har større risiko for at udvikle periimplantære sygdomme.
Systemiske faktorer
Patienter, der ikke følger et regelmæssigt kontrol- og støtteprogram efter implantatbehandling, har for-øget risiko for at udvikle periimplantitis [8].
Rygning og diabetes påvirker det inflammatoriske respons mod den plak, der dannes i den periimplantære sulcus, hvorved den inflammatoriske læsion på sigt kan udvikle sig fra periimplantær mucositis til peri-implantitis; men det er ikke afklaret, om rygning og diabetes er uafhængige risikofaktorer for periimplan-titis [8].
Nonkirurgisk behandling af periimplantitis
Hovedformålet med behandling af periimplantære sygdomme er at opnå kontrol med inflammationen. Der er ikke nogen standardbehandling af periimplantitis. Forskellige behandlingsprotokoller har været foreslået, men ingen har vundet universel anerkendelse [11]. Da de underliggende forhold, der fører til periimplantær inflammation, kan være komplekse og multifaktorielle, har man foreslået, at behandlingen skal følge de samme faser som ved behandling af parodontitis [12]. Behandlingen bør derfor begynde med en grundig medicinsk og odontologisk anamnese og klinisk/radiologisk undersøgelse med henblik på at udrede de faktorer, der er årsag til sygdommen. Anamnesen skal indeholde oplysning om forhold, der kan forværre prognosen for behandlingen. Den kliniske og radiologiske undersøgelse skal bl.a. udrede, om iatrogene fejl kan have bidraget til at igangsætte og vedligeholde inflammationen omkring implantatet (fx overkonturerede protetiske konstruktioner, som kompromitterer sufficient mundhygiejne). Hvis det er muligt at rette op på sådanne forhold, bør dette gøres inden eller samtidig med andre nonkirurgiske behandlinger inden den kirurgiske behandling. Det er nødvendigt omhyggeligt at kortlægge patientens plakkontrol, og instruktion, motivation og fjernelse af retinerende faktorer må udføres for at optimere mundhygiejnen.
Nonkirurgisk depuration bør altid udføres inden en kirurgisk behandling for at forbedre den inflammatoriske tilstand i de periimplantære væv. Det er også vigtigt at vurdere vævsresponset på behandlingen og at sikre sig, at patientens mundhygiejne er effektiv. Der findes forskellige redskaber til udførelse af nonkirurgisk behandling: ultralyd, curetter, laser, air-polishing, roterende børster m.m.
Der er ikke tilstrækkelig dokumentation for, at nogle af disse metoder til nonkirurgisk behandling er bedre end andre [13]; men i hvert enkelt tilfælde må man overveje, hvilket redskab der bedst løser den konkrete opgave. For det første må man vurdere, hvor tilgængelig den kontaminerede implantatoverflade er. Overfladen vil ofte være både ru og forsynet med gevind. Suprastrukturens udformning, implantatets vinkling og dets relation til nabotænder eller -implantater er andre forhold, der kan påvirke valget af depurationsudstyr. Desuden skal instrumentet være i stand til at nå til bunds i den periimplantære poche og rense hele den eksponerede implantatoverflade uden at ridse de glatte overflader på abutment og suprastruktur. In vitro-studier af ændringer i titaniumoverflader efter anvendelse af mekaniske instrumenter har ført til anbefaling af gummikopper og instrumenter, der ikke er lavet af metal, ved rensning af glatte flader [14]. Der er markedsført håndinstrumenter af titanium eller kulfiber og ultralydsrensere med belægning af teflon eller plastik med henblik på at begrænse skader på implantatoverflader.
Af mange grunde er det vanskeligt at sammenligne resultaterne fra undersøgelser af forskellige instrumenters effektivitet ved nonkirurgisk behandling af periimplantitis. Især på grund af de forskellige diagnostiske kriterier, der er anvendt; men også på grund af de kombinationer af behandlinger, der er anvendt i de enkelte studier. Nonkirurgisk behandling af periimplantitis med curetter er dog blevet undersøgt [15] [16]. Selv om der blev påvist mindre inflammation, var inflammationskontrol ikke et forudsigeligt resultat af behandlingen.
Forskellige typer af laserudstyr har også været undersøgt, og der er påvist kortvarige bedringer; men hverken på langt (2-3 år) eller mellemlangt (seks måneder) sigt kunne sygdommen bringes under kontrol [17] [18].
Effekten af air-polishing er blevet sammenlignet med kontrolbehandlinger. I en systematisk oversigt konkluderede man, at air-polishing med glycinpulver gav en mere effektiv reduktion af inflammationen efter nonkirurgisk behandling af periimplantitis; men trods klinisk relevante forbedringer lykkedes det ikke at opnå fuldstændig standsning af sygdommen med nogen af de undersøgte behandlings- og vedligeholdelsesprotokoller [19].
En anden mulighed er anvendelse af roterende (oscillerende) børster monteret i et hånd- eller vinkelstykke til submukøs rensning ved periimplantitis. Trods en vis reduktion af inflammationen kunne man heller ikke med denne metode opnå fuldstændig standsning af sygdommen i alle tilfælde [20].
Supplerende behandling med lokalt applicerede antibiotika og/eller antiseptika kan forbedre effektiviteten af konventionel nonkirurgisk behandling af periimplantitis [21], men set i lyset af de potentielle uønskede bivirkninger, ikke mindst risikoen for udvikling af antibiotikaresistens, kan de temmelig uforudsigelige resultater af disse behandlinger ikke retfærdiggøre rutinemæssig anvendelse af disse stoffer i klinikken.
I sjældne tilfælde kan nonkirurgisk behandling af periimplantitis føre til så gode resultater, at der ikke er behov for yderligere behandling; men behandlingen er ikke forudsigelig, og det vil være påkrævet at overvåge de afficerede implantater grundigt og hyppigt. Periimplantitis progredierer ikke lineært, men accelererende, og data tyder på, at progressionen sker hurtigere end ved parodontitis [2]. Man bør derfor ikke vente for længe med at iværksætte en kirurgisk behandling. Det har været foreslået, at vurdering af implantatets sundhedstilstand bør ske i løbet af 1-2 måneder [12].
Kirurgisk behandling af periimplantitis
Erfaringsmæssigt er der høj recidivtendens efter nonkirurgisk behandling af periimplantitis [22], og der vil derfor i de fleste tilfælde med moderat til alvorlig periimplantitis også være behov for kirurgisk behandling. Formålet med den kirurgiske behandling er at skaffe adgang til de kontaminerede implantatoverflader og derved skabe mulighed for at opnå en effektiv fjernelse af biofilm. Det er vist, at fuldstændig fjernelse af biofilm fra implantatoverflader ikke er muligt, end ikke under laboratoriebetingelser [23], og man har derfor anbefalet en kombination af mekanisk og kemisk rensning under operationen [24]. På baggrund af de eksisterende data er det ikke muligt at anbefale en bestemt metode til dekontaminering i forbindelse med kirurgisk behandling [25]. Beslibning af implantatoverfladen med roterende instrumenter (implantoplastik) må dog forventes at fjerne stort set al biofilm fra implantatoverfladen.
I forbindelse med den kirurgiske behandlingsfase er man nødt til at beslutte, om indgrebet skal være resektivt, genopbyggende eller en kombination af disse. En vigtig parameter i denne beslutningsproces er morfologien på den periimplantære defekt, da det er morfologien, der afgør mulighederne for knogleregeneration i området. Det er umiddelbart forståeligt, at horisontale knogledefekter har begrænsede muligheder for regeneration (Figur 3), mens intraossøse defekter har et potentiale for regeneration (Figur 4). I en systematisk oversigt over dyreforsøg konkluderede man, at udfaldet af knogleregeneration efter kirurgisk behandling af periimplantitis er afhængigt af knogledefektens morfologi [26]. I en klinisk undersøgelse af udfaldet af kirurgisk behandling af periimplantitis, hvor defekten blev udfyldt med et xenogent knoglemateriale og dækket med membran, fandt man, at implantater med omsluttede (firevæggede) knogledefekter opnåede dobbelt så store pochereduktioner og fæstegevinster som implantater med defekter, hvor der manglede en eller flere vægge [27]. Særlig dårligt gik det, hvis den manglende væg befandt sig bukkalt for implantatet, dvs. hvor der var en dehiscens. Tilsvarende blev der i en nyligt publiceret undersøgelse fundet større pochereduktion og større radiologisk bedømt knogleudfyldning ved firevæggede defekter end ved tre- og tovæggede defekter [28]. Disse forhold sættes i perspektiv i en anden ny undersøgelse, hvor man under kirurgisk opklapning har beskrevet morfologien af knogledefekter omkring ca. 200 implantater og fundet, at 20 % af de periimplantære defekter har et overvejende horisontalt forløb [29].
Periimplantær defekt før og efter behandling
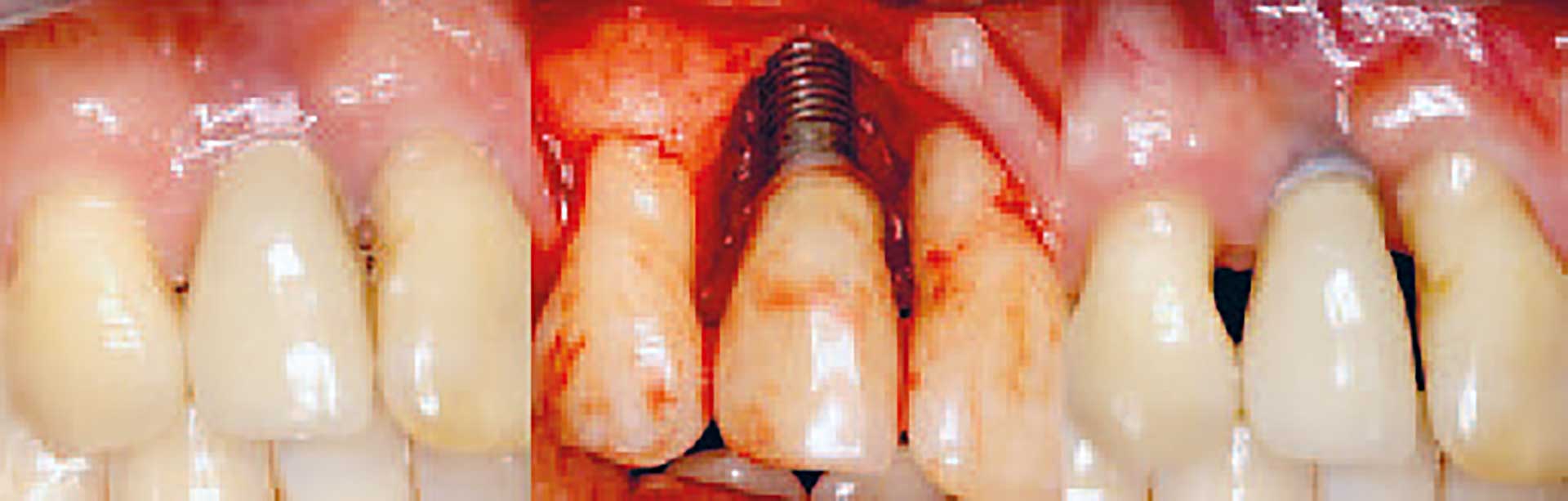
Figur 3. Resektiv kirurgi bedrer den inflammatoriske tilstand, men kompromitterer det æstetiske resultat. Venstre billede: ubehandlet periimplantitis med dybe periimplantære pocher, blødning ved sondering og periimplantært knogletab. Midterste billede: blotlæggelse af knogledefekt, der ikke er velegnet til genopbyggende behandling. Højre billede: efter behandling ses sunde periimplantære forhold med små pochedybder og uden kliniske tegn på inflammation; resultatet er på bekostning af det æstetiske udseende.
En anden parameter, der kan påvirke behandlingsvalget, er implantatoverfladens beskaffenhed, dvs. om den er glat eller ru (modificeret). I den tidligere omtalte systematiske oversigt over dyreforsøg konkluderede man, at implantater med modificeret overflade har større potentiale for reosseointegration end glatte implantater [26]. Til gengæld påvirker overfladens beskaffenhed også mulighederne for dekontaminering af overfladen. I et forsøg på hunde blev fire typer af implantatoverflader behandlet med konventionel kirurgi, dvs. lapoperation med depuration, simpel dekontaminering via afvaskning med sterilt saltvand og gaze og ingen forsøg på genopbygning af defekterne [30]. Der sås fuldstændig fjernelse af periimplantitis omkring glatte implantater, mens der var varierende grader af restinflammation og fortsat knogletab omkring de modificerede implantater. Studiet demonstrerede således tydeligt, at simpel dekontaminering kan fungere fint ved implantater med glatte overflader, mens der må mere kompleks behandling til ved implantater med modificerede overflader.
Genopbyggende behandling efter periimplantitis
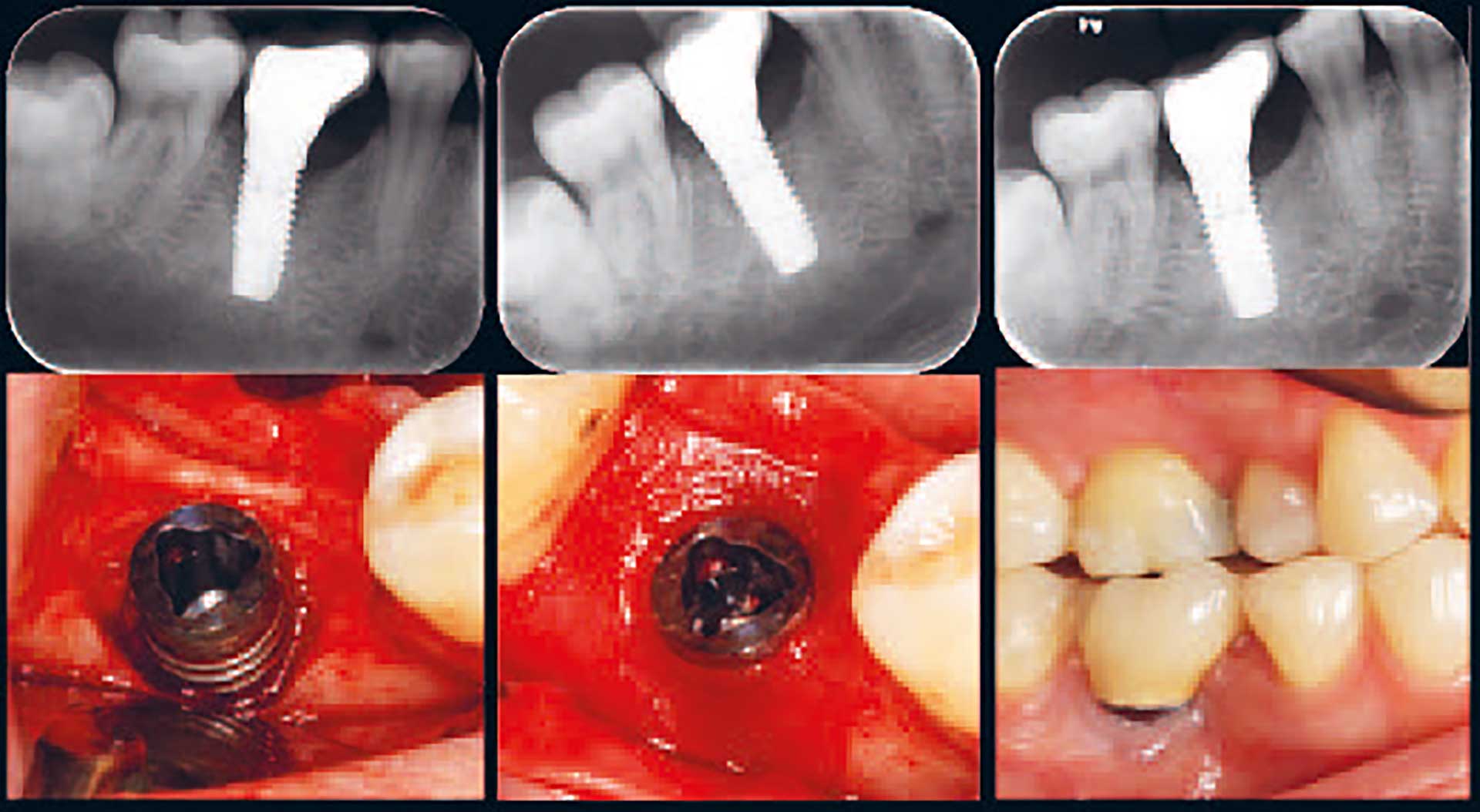
Figur 4. Genopbyggende behandling efter periimplantitis. Venstre billede: røntgenoptagelse og klinisk foto viser periimplantær knogledefekt. Midterste billede: periimplantær læsion fyldt med knoglesubstitut og dækket med en membran, der er tilpasset implantatets diameter. Højre billede: efter 12 måneder ses radiologiske tegn på udfyldning af defekten, og der er ingen kliniske tegn på inflammation.
Det giver mening at forsøge genopbygning, dvs. knogleregeneration og forhåbentlig også reosseointegration af den afficerede og blotlagte del af implantatet, i tilfælde, hvor der er tilbageværende knoglevægge i nærheden af implantatet, især ved implantater med modificerede overflader, men det kræver en mere kompleks dekontamineringsprocedure. Derimod vil forsøg på genopbygning sandsynligvis ikke forbedre resultatet i tilfælde med horisontalt knogletab eller meget brede skålformede defekter. I sådanne tilfælde bør man i stedet betjene sig af resektiv kirurgi. Denne behandlingstype indebærer konventionel lapoperation med depuration og knoglemodellering, eller resektion af periimplantær mucosa, og/eller apikal forskydning af lappen med eller uden knoglemodellering og eventuelt implantoplastik. Resektiv kirurgi fører til pochereduktion, men det sker på bekostning af æstetikken [31] (Figur 3). Mængden af slimhinde, der fjernes, afhænger af knogletabets omfang, implantatets placering og patientens krav til æstetik. Implantoplastik er indiceret ved implantater med modificeret overflade, da indgrebet giver en effektiv dekontaminering; men det efterlader desuden en implantatoverflade, der er mindre plakretinerende og lettere for patienten at holde ren. Dette aspekt er relevant, da man i sådanne tilfælde må forvente, at en større del af implantatet bliver eksponeret i mundhulen (og dermed er i risiko for ophobning af biofilm), enten på grund af slimhinderetraktion eller på grund af bevidst resektion af slimhinde. I en nyere systematisk oversigt konkluderede man på baggrund af dyreeksperimentelle undersøgelser, at overfladens beskaffenhed kan have en signifikant negativ indflydelse på progression af periimplantitis [32]. Endvidere har man i en longitudinel undersøgelse med lang observationstid fundet, at implantater med modificeret overflade havde fem gange så høj risiko for recidiv eller progression af periimplantitis efter konventionel/resektiv kirurgi og simpel dekontaminering [33]. I en ny, perspektivrig systematisk oversigt har man vurderet alle tilgængelige dyreeksperimentelle og kliniske studier om implantoplastik og konkluderet, at implantoplastik ikke synes at være forbundet med nogen væsentlige mekaniske eller biologiske komplikationer hverken på kort eller langt sigt [34]. Det synes indlysende, at man bør anvende en kombination af genopbygning og resektion i tilfælde, hvor der både er intraossøse og horisontale defekter (samt implantoplastik, hvis implantatet har modificeret overflade). Faktisk er der rapporteret gode resultater med en sådan kombinationsbehandling op til syv år efter afsluttet behandling [35] (Figur 5).
Kombination af knogleopbygning og resektiv kirurgi
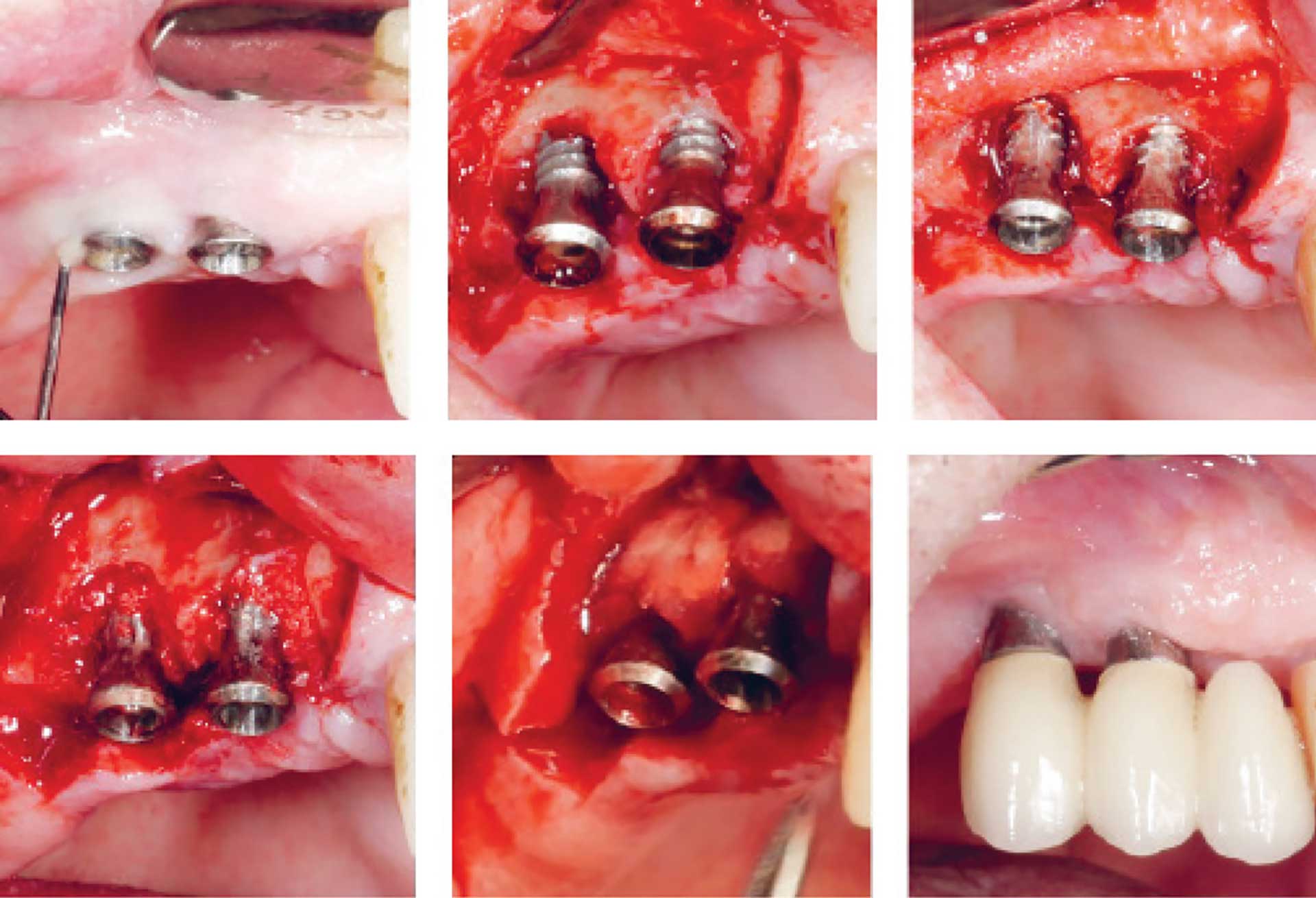
Figur 5. Kombination af knogleopbygning og resektiv kirurgi samt implantoplastik.
Kirurgisk behandling af periimplantitis kombineres ofte med systemisk indgift af antibiotika i et forsøg på at opnå bedre kontrol med biofilmen. En ny randomiseret kontrolleret undersøgelse tyder imidlertid på, at systemiske antibiotika som supplement til konventionel kirurgisk behandling af periimplantitis kun giver ekstra gevinst i forbindelse med overflademodificerede implantater [36]. Systemiske antibiotika ordineres også ofte i forbindelse med knogleopbygning, hvor det kan være afgørende at undgå infektion.
De fleste studier rapporterer om gode resultater ved de fleste implantater efter kirurgisk behandling af periimplantitis, men som forventet afhænger stabiliteten på langt sigt især af den støttebehandling, der ydes efterfølgende [11].
Støttebehandling ved periimplantitis (spit)
Støttebehandling er en afgørende fase ved behandling af parodontitis, og det samme gælder ved behandling af periimplantitis. Kontrol af den periimplantære tilstand og vedligeholdelse af den periimplantære sundhed ved implantater med reduceret knogleniveau omfatter også individuelt tilpassede mundhygiejneprogrammer, som sikrer, at patienten gennemfører en optimal hjemmetandpleje [37], samt professionel fjernelse af hårde og bløde belægninger på tilgængelige implantatflader (Figur 6). Det er vanskeligt at forebygge sygdomsudbrud, og succesen afhænger af en række prognostiske faktorer både på individ- og implantatniveau [33,38,39]. Undersøgelser af effekten af vedligeholdelsesprogrammer på implantater med intakt knogleniveau tyder dog på, at selv om man ikke opnår total udryddelse af sygdommen, har SPiT dog en betydelig positiv virkning ved at bibeholde det periimplantære knogleniveau [40]. Man kan formode, at noget tilsvarende gælder for implantater med reduceret knogleniveau.
Vedligeholdelse af implantate
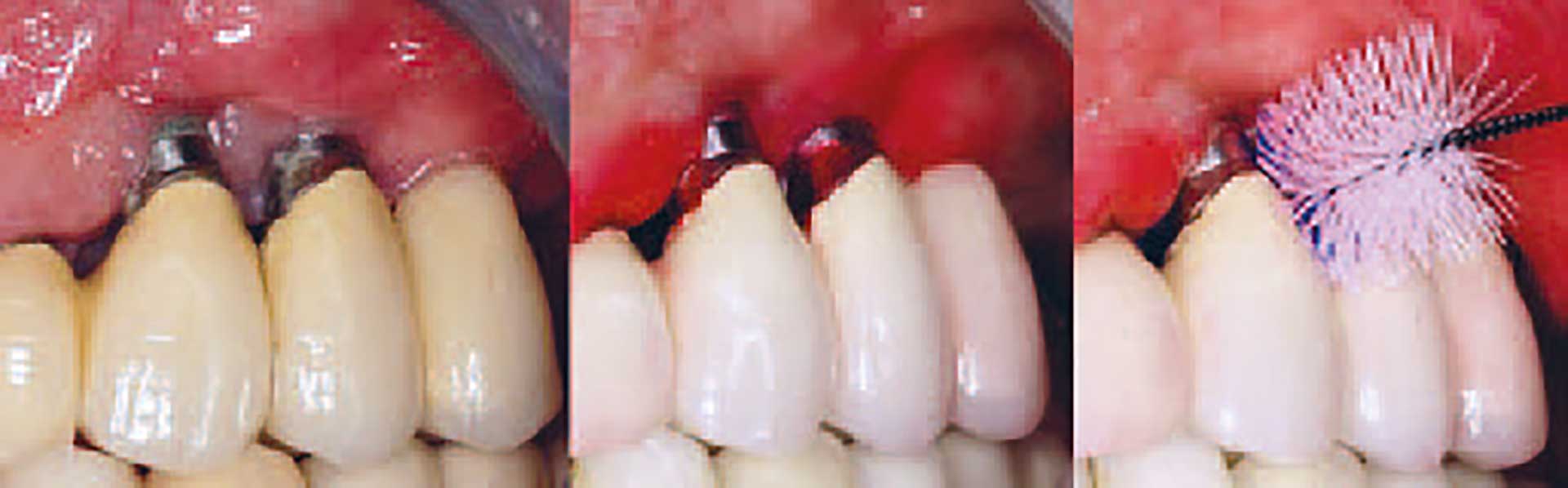
Figur 6. Vedligeholdelse af implantater efter behandling af periimplantitis. Indfarvning af plak og instruktion i anvendelse af interdentalbørster.
Dags dato har vi meget lidt information om effekten af forskellige tiltag, og der er meget få studier, der har sammenlignet effekten af forskellige SPiT-programmer [41]. Oversigtsartikler har dog fastslået, at de fleste patienter, der følger et SPiT-program med regelmæssig professionel fjernelse af biofilm på tænder og implantater, undgår at miste deres implantater [11]
Vurdering af hele tandsættet
Figur 7. Undersøgelse af hele tandsættet med henblik på at identificere områder med ubehandlet inflammation er en obligatorisk del af den initiale behandlingsplanlægning.
Da behandling af periimplantitis er et tidskrævende, undertiden slidsomt og til tider uforudsigeligt arbejde, bør fokus ved tandsæt med implantater i stedet ligge på at undgå, at sygdommen overhovedet opstår. Dette indebærer grundig undersøgelse af hele tandsættet med henblik på at identificere områder med ubehandlet parodontitis allerede inden implantatindsættelsen, da man ved, at parodontitis har en negativ indflydelse på implantaters prognose (Figur 7). Vel gennemført parodontalbehandling er obligatorisk inden implantatindsættelse på patienter, der har tendens til parodontitis. Ligeledes er en vurdering af patientens evne og vilje til at gennemføre en sufficient plakkontrol en nødvendig forudsætning for at kunne tage stilling til eventuel rehabilitering med implantater. Desuden skal man bedømme lokale faktorer, som kan påvirke implantaters langtidsprognose, fx knoglevolumen, afstand til anatomiske strukturer og mængden af keratiniseret slimhinde. Hvis sådanne forhold skønnes at kunne svække prognosen på langt eller kort sigt, bør man overveje, om andre former for rehabilitering er mere hensigtsmæssige i det aktuelle tilfælde. Efter indsættelse af implantater og suprastrukturer skal alle patienter tilbydes et regelmæssigt støttebehandlingsforløb med henblik på at minimere risikoen for, at periimplantær mucositis udvikler sig til periimplantitis [42].
Litteratur
Derks J, Schaller D, Håkansson J et al. Effectiveness of implant therapy analyzed in a Swedish population: prevalence of peri-implantitis. J Dent Res. 2016; 95: 43-9.
Berglundh T, Armitage G, Araujo MG et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Clin Periodontol. 2018; 45 (Supp 20): S286-91.
Gualini F, Berglundh T. Immunohistochemical characteristics of inflammatory lesions at implants. J Clin Periodontol. 2003; 30: 14-8.
Bullon P, Fioroni M, Goteri G et al. Immunohistochemical analysis of soft tissues in implants with healthy and peri-implantitis condition, and aggressive periodontitis. Clin Oral Implants Res. 2004; 15: 553-9.
Cornelini R, Artese L, Rubini C et al. Vascular endothelial growth factor and microvessel density around healthy and failing dental implants. Int J Oral Maxillofac Implants. 2001; 16: 389-93.
Sanz M, Alandez J, Lazaro P et al. Histo-pathologic characteristics of peri-implant soft tissues in Brånemark implants with 2 distinct clinical and radiological patterns. Clin Oral Implants Res. 1991; 2: 128-34.
Carcuac O, Berglundh T. Composition of human peri-implantitis and periodontitis lesions. J Dent Res. 2014; 93: 1083-8.
Schwarz F, Derks J, Monje A et al. Peri-implantitis. J Clin Periodontol. 2018; 45 (Supp 20): S246-66.
Monje A, Wang HL, Nart J. Association of preventive maintenance therapy compliance and peri-Implant diseases: a cross-sectional study. J Periodontol. 2017; 88: 1030-41.
Renvert S, Persson GR, Pirih FQ et al. Peri-implant health, peri-implant mucositis, and peri-implantitis: Case definitions and diagnostic considerations. J Clin Periodontol. 2018; 45 (Supp 20): S278-85.
Roccuzzo M, Layton DM, Roccuzzo A et al. Clinical outcomes of peri-implantitis treatment and supportive care: A systematic review. Clin Oral Implants Res. 2018; 29 (Supp 16): 331-50.
Heitz-Mayfield LJA, Needleman I, Salvi GE et al. Consensus statements and clinical recommendations for prevention and management of biologic and technical implant complications. Int J Oral Maxillofac Implants. 2014; 29 (Supp): 346-50.
Faggion Jr CM, Listl S, Frühauf N et al. A systematic review and Bayesian network meta-analysis of randomized clinical trials on non-surgical treatments for peri-implantitis. J Clin Periodontol. 2014; 41: 1015-25.
Louropoulou A, Slot DE, Van der Weijden FA. Titanium surface alterations following the use of different mechanical instruments: a systematic review. Clin Oral Implants Res. 2012; 23: 643-58.
Karring ES, Stavropoulos A, Ellegaard B et al. Treatment of peri-implantitis by the Vector system. Clin Oral Implants Res. 2005; 16: 288-93.
Máximo MB, de Mendonça AC, Santos VR et al. Short-term clinical and microbiological evaluations of peri-implant diseases before and after mechanical anti-infective therapies. Clin Oral Implants Res. 2009; 20: 99-108.
John G, Becker J, Schmucker A et al. Non-surgical treatment of peri-implant mucositis and peri-implantitis at two-piece zirconium implants: A clinical follow-up observation after up to 3 years. J Clin Periodontol. 2017; 44: 756-61.
Mettraux GR, Sculean A, Bürgin WB et al. Two-year clinical outcomes following non-surgical mechanical therapy of peri-implantitis with adjunctive diode laser application. Clin Oral Implants Res. 2016; 27: 845-9.
Schwarz F, Becker K, Renvert S. Efficacy of air polishing for the non-surgical treatment of peri-implant diseases: a systematic review. J Clin Periodontol. 2015; 42: 951-9.
Wohlfahrt JC, Evensen BJ, Zeza B et al. A novel non-surgical method for mild peri-implantitis – a multicenter consecutive case series. Int J Implant Dent. 2017; 3: 38.
Schwarz F, Schmucker A, Becker J. Efficacy of alternative or adjunctive measures to conventional treatment of peri-implant mucositis and peri-implantitis: a systematic review and meta-analysis. Int J Implant Dent. 2015; 1: 22.
Figuero E, Graziani F, Sanz I et al. Management of peri-implant mucositis and peri-implantitis. Periodontol 2000. 2014; 66: 255-73.
Louropoulou A, Slot DE, Van der Weijden F. The effects of mechanical instruments on contaminated titanium dental implant surfaces: a systematic review. Clin Oral Implants Res. 2014; 25: 1149-60.
Subramani K, Wismeijer D. Decontamination of titanium implant surface and re-osseointegration to treat peri-implantitis: a literature review. Int J Oral Maxillofac Implants. 2012; 27: 1043-54.
Koo KT, Khoury F, Keeve PL et al. Implant surface decontamination by surgical treatment of periimplantitis: a literature review. Implant Dent. 2019; 28: 173-6.
Renvert S, Polyzois I, Maguire R. Re-osseointegration on previously contaminated surfaces: a systematic review. Clin Oral Implants Res. 2009; 20 (Supp 4): 216-27.
Schwarz F, Sahm N, Schwarz K et al. Impact of defect configuration on the clinical outcome following surgical regenerative therapy of peri-implantitis. J Clin Periodontol. 2010; 37: 449-55.
Aghazadeh A, Persson RG, Renvert S. Impact of bone defect morphology on the outcome of reconstructive treatment of peri-implantitis. Int J Implant Dent. 2020; 6: 33.
Wehner C, Bertl K, Durstberger G et al. Characteristics and frequency distribution of bone defect configurations in peri-implantitis lesions – A series of 193 cases. Clin implant Dent Relat Res. 2020; 23: 178-88.
Albouy JP, Abrahamsson I, Persson LG et al. Implant surface characteristics influence the outcome of treatment of peri-implantitis: an experimental study in dogs. J Clin Periodontol. 2011; 38: 58-64.
Englezos E, Cosyn J, Koole S et al. Resective treatment of peri-implantitis: clinical and radiographic outcomes after 2 years. Int J Periodontics Restorative Dent. 2018; 38: 729-35.
Stavropoulos A, Bertl K, Winning, L. et al. What is the influence of implant surface characteristics and/or implant material on the incidence and progression of peri-implantitis? A systematic literature review. Clin Oral Implants Res. 2021; In press.
Carcuac O, Derks J, Abrahamsson I et al. Risk for recurrence of disease following surgical therapy of peri-implantitis – A prospective longitudinal study. Clin Oral Implants Res 2020; 31: 1072-7.
Stavropoulos A, Bertl K, Eren S et al. Mechanical and biological complications after implantoplasty – A systematic review. Clin Oral Implants Res. 2019; 30: 833-48.
Schwarz F, John G, Schmucker A et al. Combined surgical therapy of advanced peri-implantitis evaluating two methods of surface decontamination: a 7-year follow-up observation. J Clin Periodontol. 2017; 44: 337-42.
Carcuac O, Derks J, Charalampakis G et al. Adjunctive systemic and local antimicrobial therapy in the surgical treatment of peri-implantitis: a randomized controlled clinical trial. J Dent Res. 2016; 95: 50-7.
Salvi GE, Ramseier CA. Efficacy of patient-administered mechanical and/or chemical plaque control protocols in the management of peri-implant mucositis. A systematic review. J Clin Periodontol. 2015; 42 (Supp 16): S187-201.
de Waal YCM, Raghoebar GM, Meijer HJ et al. Prognostic indicators for surgical peri-implantitis treatment. Clin Oral Implants Res. 2016; 27: 1485-91.
Koldsland OC, Wohlfahrt JC, Aass AM. Surgical treatment of peri-implantitis: Prognostic indicators of short-term results. J Clin Periodontol. 2018; 45: 100-13.
Costa FO, Takenaka-Martinez S, Cota LOM et al. Peri-implant disease in subjects with and without preventive maintenance: a 5-year follow-up. J Clin Periodontol. 2012; 39: 173-81.
Koldsland OC, Aass AM. Supportive treatment following peri-implantitis surgery: An RCT using titanium curettes or chitosan brushes. J Clin Periodontol. 2020; 47: 1259-67.
Mombelli A. Maintenance therapy for teeth and implants. Periodontol. 2000 2019; 79: 190-9.
English summary
Treatment of peri-implantitis
Peri-implantitis is a plaque-associated disease in tissues around dental implants, characterised by progressive loss of implant-supporting bone. The size of peri-implantitis lesions tend to be larger in size and progress more aggressively than periodontitis lesions. Progressive loss of implant-supporting bone is influenced by a number of factors e.g. plaque, concomitant periodontal disease, and systemic health status. There is no gold standard in treatment of peri-implantitis, but it is advantageous to follow a structured path similar to the treatment steps in periodontal therapy; examination aiming to find the underlying causes of disease, non-surgical treatment, surgical treatment, and supportive treatment. Several different tools are available for non-surgical treatment, but the accessibility of the implant surface must be considered in every case. Surgery aims primarily to provide better access to the contaminated implant surface in order to achieve effective biofilm removal. A decision must be made over, whether the surgical approach should be resective, reconstructive, or combination thereof. Also, the means of surface decontamination must be considered. Following surgery patients need to be enrolled in a maintenance-program in order to keep the implants free of disease.
Odd Carsten Koldsland., Christian Damgaard., Andreas Stavropoulos.. Behandling af periimplantitis. Nor Tannlegeforen Tid. 2022;133:112-20. doi:10.56373/2022-2-3
Korresponderende førsteforfatter: Odd Carsten Koldsland. E-postadresse: oddcko@odont.uio.no
Accepteret til publikation den 14. juni 2021
Artikkelen har gjennomgått ekstern faglig bedømming. Koldsland OC, Damgaard C, Stavropoulos A. Behandling af periimplantitis. Nor Tannlegeforen Tid. 2022; 132: 112–20.
Emneord: Peri-implantitis | dental implants | treatment | maintenance
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Odd Carsten Koldsland., Christian Damgaard., Andreas Stavropoulos.. Behandling af periimplantitis. Nor Tannlegeforen Tid. 2022;133:112-20. doi:10.56373/2022-2-3
