Kraniofaciale og orale senskader etter behandling av barnekreft
Hovedbudskap
To av tre barn har senskader etter kreftbehandling
Lav alder og aggressiv behandling øker risikoen for orale senskader
Munnhulen må være sanert når kreftbehandling påbegynnes. Risiko for karies, infeksjoner og slimhinneproblem under kreftbehandling er stor
Orale senskader er en oversett årsak til redusert livskvalitet
Oppfølgingen av orale senskader etter barnekreft må systematiseres og forbedres
Årlig blir ca. 190 norske barn rammet av kreft. Aldersgruppen 0–6 år har den høyeste forekomsten. Leukemier og svulster i sentralnervesystemet utgjør hver ca. 30 %, lymfomer rundt 12 %, mens de resterende består av mer sjeldne svulster med en prevalens fra 1–7 %. Både diagnostikk og behandling følger internasjonale protokoller og er sentralisert til følgende fire sentre i Norge; Oslo universitetssykehus Rikshospitalet, Haukeland universitetssjukehus, St. Olavs hospital samt Universitetssykehuset Nord-Norge. Behandlingen er ofte multimodal og består av kombinasjoner av cytostatika, kirurgi og strålebehandling eventuelt i kombinasjon med benmargstransplantasjon. 5-årsoverlevelse i 2019 var 86 %, men to av tre barn som overlever får senskader som følge av sykdommen og/eller behandlingen. Senskadene omfatter risiko for sekundærkreft, kronisk trøtthet, endret psykososial funksjon, hjerte-, sirkulasjons- eller lungesykdom, kognitiv svekkelse, infertilitet og endokrin dysfunksjon. Orale senskader kan bestå av kraniofaciale vekstforstyrrelser, tannutviklingsforstyrrelser, som avvik i mineralisering, krone- og/eller rotutvikling eller agenesier, malokklusjon, redusert spyttsekresjon, økt kariesprevalens, trismus og slimhinneproblemer. For å diagnostisere og behandle senskader følger de barneonkologiske avdelingene opp kreftoverleverne i fem år, mens Den offentlige tannhelsetjenesten ikke har tilsvarende system for oppfølging av orale senskader etter barnekreft. Kunnskap om og behandling av orale senskader etter barnekreft er derfor ofte mangelfull og kan være en oversett årsak til redusert livskvalitet.
Kreft hos barn er relativt sjeldent. I Norge ble det i 2019 diagnostisert 191 nye tilfeller i aldersgruppen 0–17 år, noe som gir en insidens på 16–17 per 100 000 barn per år, omtrent på samme nivå som i resten av Europa (1). Insidensen har vært stabil i Norge de siste 35 år, mens internasjonale undersøkelser viser en lett stigende tendens (1, 2). Leukemier og svulster i sentralnervesystemet utgjør ca. 30 % hver, lymfomer ca. 12 %, de resterende inkluderer et panorama av sjeldne svulster som enkeltvis utgjør fra 1–7 %. Kreft hos barn er hyppigst i aldersgruppen 0 til 6 år. Leukemi forekommer oftest i 2- til 5-årsalder, mens lymfomer sjelden oppstår før 13-årsalder, men da mer enn dobles forekomsten. Svulster i sentralnervesystemet (CNS) er mer jevnt fordelt utover hele barnealderen mens solide svulster utenfor sentralnervesystemet forekommer hyppigst i spe- og småbarnsalder og i tenårene. Selv om kreft hos barn er sjeldent, er det likevel den vanligste dødsårsaken av sykdom for barn over 1 år i Norge (1).
Totaloverlevelsen har økt og ifølge «Nasjonalt kvalitetsregister for barnekreft, 2019», er 5-års overlevelsen nå 86 %. Forbedret overlevelse betyr at antall barnekreftoverlevere i det norske samfunnet øker og teller 5 605 personer ved utgangen av 2019 (1). Dette er gledelig, men kreftsykdommen og behandlingen har sin pris: To av tre barn som overlever lider av til dels alvorlige senskader som følge av kreftsykdommen og/eller behandlingen som ble gitt (3). Senskader etter kreft kan defineres som en bivirkning eller komplikasjon til kreftsykdommen eller behandlingen og som varer i mer enn ett år etter avsluttet behandling, eller en bivirkning eller helseplage som sannsynligvis skyldes kreftsykdommen eller behandlingen, og som opptrer ett år eller mer etter avsluttet behandling (4). Det er derfor viktig å forstå og forebygge senskadene som sykdommen og behandlingen kan forårsake. Behovet for å utrede, følge opp og behandle senskader etter behandling for barnekreft representerer en stadig større oppgave i helsevesenet, inkludert i tannhelsetjenesten, som vil kreve økende ressurser de kommende årene (3).
Klassifisering av barnekreft
Barnekreft klassifiseres i tolv hovedgrupper/diagnosegrupper (I-XII), basert på The International Classification of Childhood Cancer (ICCC3) (5). De vanligste kreftformene inngår i diagnosegruppe I, II og III, og det er leukemier og hjernesvulster som utgjør den største andelen. Kreftsvulstene utenfor CNS, gruppe IV–XII, er ofte sjeldne bløtvevs- og beinsvulster som sarkomer, eller embryonale svulster som oppstår fra celler vi har i fosterlivet (3).
Behandling av kreft hos barn
Utredning og behandling av kreft er organisert i pakkeforløp og behandlingen følger internasjonale protokoller. Dette sikrer lik behandling av barnekreft uavhengig av hvor i landet en bor, og at de sjeldne krefttypene også får best mulig behandling. Siden diagnostikk, utredning og behandling krever avansert utstyr og vurdering i multidisiplinære team, er dette sentralisert til fire universitetssykehus: Oslo universitetssykehus Rikshospitalet, Haukeland universitetssjukehus, St. Olavs hospital og Universitetssykehuset Nord-Norge. Disse sykehusene samarbeider med regionale sykehus som står for deler av behandling- og oppfølgingen underveis (3). Behandlingen er ofte mulitimodal og består av ulike kombinasjoner av systemisk kreftrettet behandling, som f. eks kjemoterapi og immunterapi, kirurgi og strålebehandling. Hos en del av barna vil det også være behov for benmargstransplantasjon. Mange typer barnekreft responderer godt på kjemoterapi. Behandlingsprotokollene tar utgangspunkt i krefttypen, men justeres og eventuelt intensiveres etter ulike risikofaktorer, behandlingsrespons og pasientens alder (3). Benmargstransplantasjon som innebærer innledende regimer med helkroppsbestråling eller myeloablativ kjemoterapi er eksempler på intensiv behandling der de toksiske effektene kan gi alvorlige organskader (6). Siden behandlingen oftest er systemisk rammes også friske organer. Hvilke senskader som oppstår vil blant annet være avhengig av krefttype, den gitte behandlingen, barnets alder på behandlingstidspunktet og ulike genetiske faktorer (7). Protonbehandling er en ny, mer presis og skånsom strålebehandling enn tradisjonell stråling. Ved at strålingen kan tilpasses mer nøyaktig til kreftvevet og dets lokalisasjon, blir det gitt mindre stråling til det friske vevet rundt. Dermed reduseres også faren for bivirkninger og senskader. Protonbehandling er derfor særlig godt egnet for barn og unge som har mer strålefølsomt vev enn voksne, større risiko for alvorlige senskader og lengre forventet livslengde. I Norge bygges det protonsenter i Oslo og Bergen som vil være tilgjengelige fra 2023, inntil det er det gjort avtaler med utenlandske sentre (3,8).
De vanligste senskadene
Et barn eller en ungdom som får kreft vil være preget av det lang tid etter sykdommen. Behandlingen kan medføre psykiske, fysiske og sosiale senskader som kan være av alvorlig karakter. Begrepene seneffekter og senskader omfatter flere helserelaterte problemer som kan oppstå i etterkant av gjennomgått kreftbehandling, inkludert økt risiko for sekundærkreft, kronisk trøtthet, endret psykososial funksjon, hjerte-, sirkulasjons- eller lungesykdom, kognitiv svekkelse, infertilitet, endokrin dysfunksjon og tann- og munnhuleproblemer (4, 9–10). Det blir rapportert om at foreldre ønsker mer informasjon om senskader (11). I en studie fra Boston, USA, ble det rapportert at majoriteten av foreldrene følte seg godt forberedt før selve kreftbehandlingen, mens færre var forberedt på skadene som begrenset livsutfoldelsen etter behandlingen. Fem år etter behandling opplevde 72 % av barna begrensninger på minst ett område (12). Senskader kan påvirke kreftoverleverens evne til å delta i samfunnet som selvstendige, uavhengige individer, til å ha jobber og å etablere familie (13, 14). Nordiske studier tyder også på at færre er i arbeid og flere mottar trygd enn i kontroller fra den generelle befolkningen (15, 16).
I det følgende vil vi ha søkelys på de orale senskadene siden disse til nå har vært mindre omtalt i helse- og tannhelsetjenesten. Med det økende antall barn som overlever kreftbehandling, øker behovet for kunnskap om orale senskader slik at både oppfølging og behandling kan forbedres.
Orale senskader
Munnhulen påvirkes av cytostatika og strålebehandling i form av både akutte og langvarige effekter. Akutte orale komplikasjoner som mukositter, munntørrhet, blødninger og infeksjoner er tre ganger vanligere hos barn enn hos voksne (17). De orale bivirkningene er smertefulle og gjør at den kreftrammede får forandrede kostvaner i tillegg til at tannpuss ofte blir vanskeligere å gjennomføre og opprettholde (18). Dette kan føre til økt forekomst av blant annet karies, gingivitt og dentale erosjoner (19). De akutte effektene går oftest over, mens andre skader som forstyrrelser i tannutviklingen og i enkelte tilfeller redusert spyttsekresjon, vil kunne være livsvarige (20,21). Orale komplikasjoner er estimert til 10 % etter gjennomgått adjuvant kjemoterapi, 40 % etter definitiv, kurativ behandling med cytostatika, 80 % etter stamcelletransplantasjon og 100 % etter strålebehandling av hode hals der munnhulen er inkludert i strålefeltet (4). Økt kariesfrekvens, munntørrhet, forstyrrelser i kraniofacial utvikling, trismus og oral transplantat-mot-vert-sykdom (graft-versus-host-disease (GVHD)) er også tilstander som kan være langvarige eller livsvarige (22). Orale og dentale senskader er mer uttalte hos pasienter som blir behandlet før 5-års alder og ved høye doser av både cytostatika og strålebehandling. Det er også vist at helkroppsbestråling i følge med stamcellebehandling gir mer skade på orale og dentale vev enn cytostatika alene (23). Stråling forstyrrer tannutviklingen ved direkte å hemme aktiviteten til cellene i tannutviklingen som danner dentin og emalje (odontoblaster og ameloblaster). Når det gjelder stråledoser, kan så lave doser som 4 Gray (Gy) gi skader på tann/rot avhengig av alder ved behandling. Stråledoser på mer enn 10 Gy kan skade modne ameloblaster og mer enn 30 Gy forårsaker total stans i tannutviklingen (20).
Forskning viser at omfanget av orale komplikasjoner etter kreft og kreftbehandling er underrapportert, ofte ikke blir diagnostisert og behandlet og er en oversett kilde til helserelatert redusert livskvalitet (4). Prevalens av senskader øker med tiden etter behandlingen, og det er derfor anbefalt å undersøke munnhulen og tannsettet umiddelbart etter kreftbehandling og to ganger i året deretter (7).
Oral helse er viktig for generell helse, ernæringsstatus og livskvalitet, og hører med i en helhetlig omsorg for barn under behandling for kreft. Tanndannelse er en komplisert prosess som involverer en rekke signalmolekyler, interaksjon mellom vevstyper og dannelse av spesialiserte celler (24). Perioden fra 0–6 år er den viktigste perioden for utvikling av det permanente tannsettet (25). Vekst av ansiktsskjelettet og kjevene er også mest intens i denne perioden samt i puberteten og samsvarer med periodene der insidensen av barnekreft er høyest (1). Kirurgi i hode hals området og de toksiske effektene av kreftbehandling i disse aldrene kan derfor forårsake uopprettelige skader på utvikling av ansikt, kjever og tenner (figur 1 A-C).
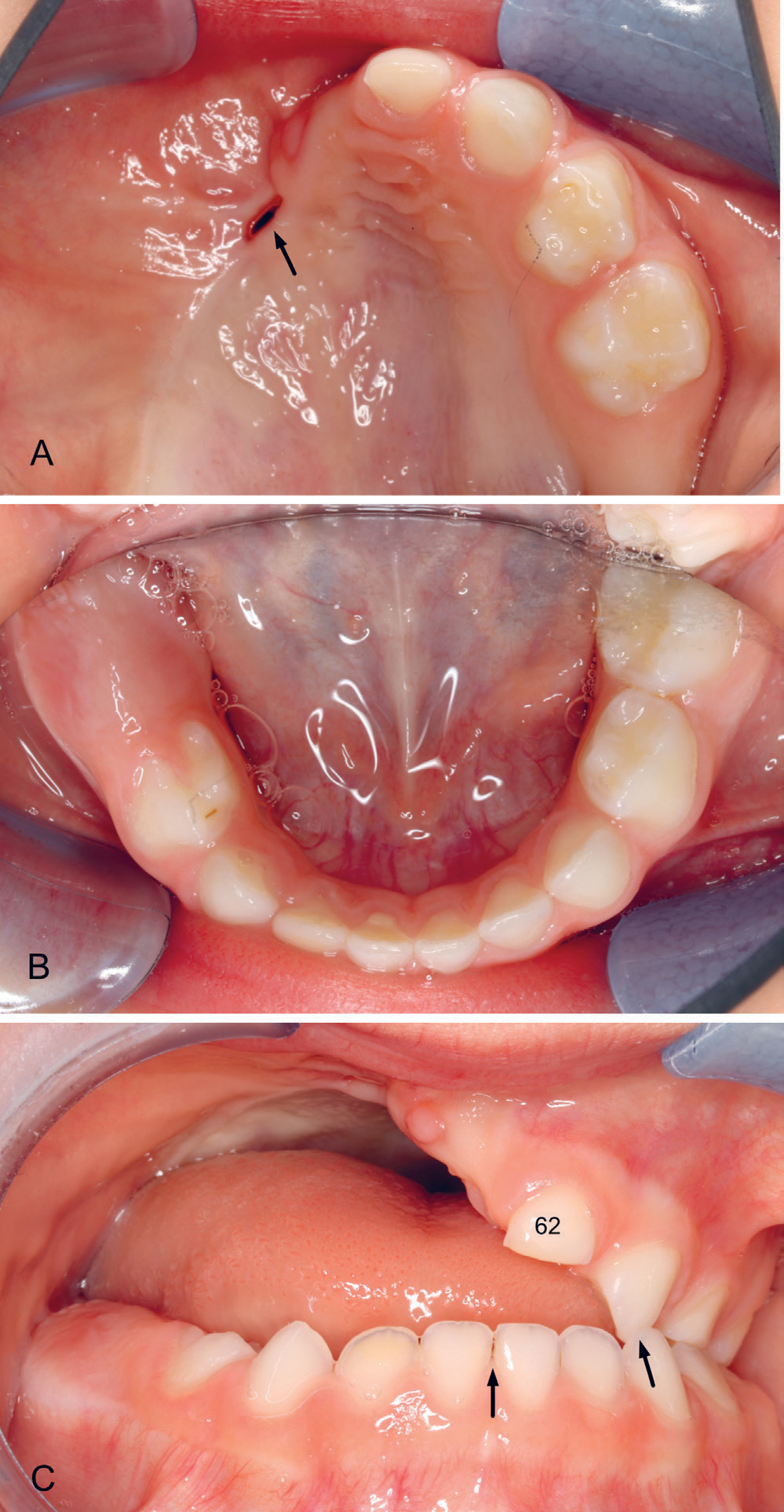
Figur 1. A–C. Bilder fra en 3 år gammel jente etter behandling av tumor i høyre overkjeve. Ved 3–5 måneders alder ble høyre halvdel av maxilla fjernet kirurgisk (hemimaxillectomi) etterfulgt av kjemoterapi. A: Gjenstående tenner i venstre overkjeve, tann 62, 63, 64 og 65 og fistel anteriort i ganen i operasjonsarret (pil). B: I underkjeven er det forsinket erupsjon høyre side av tennene 84 og 85. C: Okklusjonen: Åpent bitt også anteriort ved tann 62, kryssbitt av tennene 63/73 (pil) og markert midtlinjeavvik (pil). Hun har ingen sugeuvaner.
Kraniofaciale utviklingsforstyrrelser
Strålebehandling mot kraniet kan affisere hypofysen og gi generell vekstretardasjon på grunn av redusert utskillelse av veksthormon og andre hypofysehormoner som kjønnshormon (26). Veksthormoner er spesielt viktige for vekst av underkjeven (27) og i puberteten kan vekst av kjeven også påvirkes av en redusert synergieffekt mellom vekst- og kjønnshormon. Direkte stråling mot kjeveleddet kan skade kondrocyttene og forårsake vekst hemming og/eller asymmetrisk vekst av kjeven. Det er rapportert både om redusert vekst av kjeven og vertikal vekst av underansiktet samt ansiktsasymmetri hos pasienter som er strålebehandlet som barn (28–30).
Tannutviklingsforstyrrelser
Tannutviklingsforstyrrelser er senskader som er direkte følge av kreftbehandlingens toksisitet og kan forekomme både etter høye doser cytostatika og etter strålebehandling. De er karakterisert av økt prevalens av agenesier, mikrodonti, mineraliseringsforstyrrelser og forstyrrelser i rotdannelsen (figur 2A, figur 3, 4). Behandling som inkluderer benmargstransplantasjon synes å føre til de alvorligste konsekvensene både for krone- og rotutvikling. Det er rapportert om 8,5 % til 50 % agenesier avhengig av alder ved diagnose, samt type og intensitet av behandling (22). Mineraliseringsforstyrrelser i form av både hypoplasier og hypomineralisasjon er observert, men disse kan være vanskelige å skille i klinikken. Det er beskrevet opasiteter, misfarging, ujevnheter og avskalling av emalje som kan gi symptomer og være så skjemmende at det går ut over barnets eller ungdommens livskvalitet (20, 21, 31–34). Rotavkortning og korte V-formede røtter er et vanlig funn etter gjennomgått barnekreft. De alvorligste tilfellene finner en hos barn som var under fem år ved behandling, men V-formede røtter forekommer også hos barn behandlet etter denne alderen siden rotdannelsen varer til nærmere 20-års alder (35, 36). (figur 2)
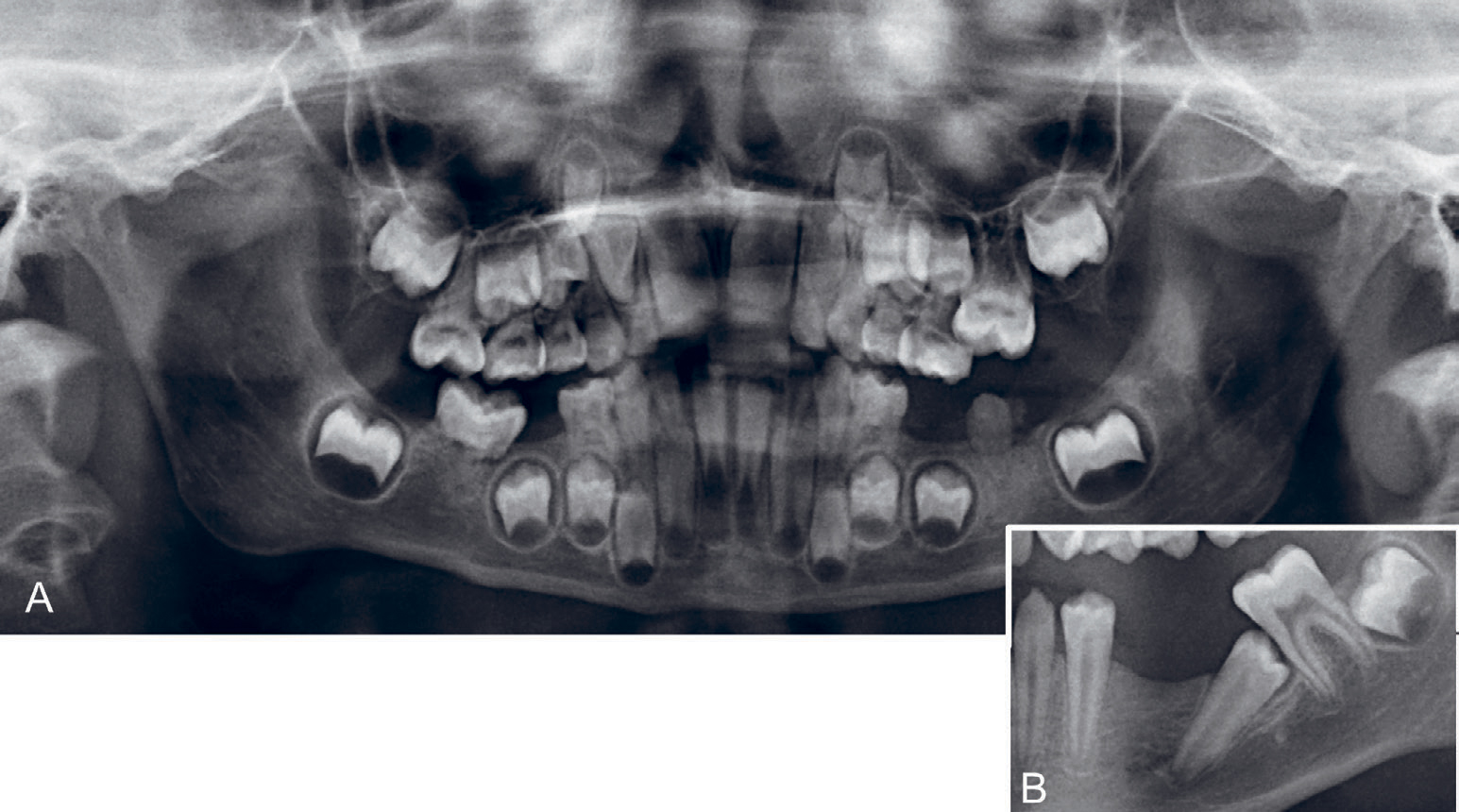
Figur 2. A–B. Panoramarøntgen fra en gutt som ved 1-års alder ble behandlet for nevroblastom med cytostatika. A: Ved åtte års alder viser tennene 16 og 26 ufullstendig rotutvikling, tann 36 har malformasjon av krone og rot, tann 46 har manglende rotutvikling. Det sees ektopisk erupsjon av tann 26. Mikrotann 13, redusert tannstørrelse tennene 23, 33 og 43. Tennene 75 og 85 er ekstrahert på grunn av smerter. Det er nå smerter ved tygging. B: Fra samme pasient ved 14-års alder. Utsnitt fra et panoramabilde. I tredje kvadrant er tann 35 impaktert, 60 grader distovertert med kronen mot mesiale rot på tann 37.
Erupsjonsforstyrrelser
Forsinket eller sen tannerupsjon er en generell observasjon hos barnekreftoverlevere både etter cytostatika og strålebehandling (figur 1C , 2A,B) (36). Både lokale og generelle faktorer kan spille en rolle. Faktorer som kan ha betydning er at mange barnekreftoverlevere har veksthormonmangel og hypothyroidose. Dette er vanlig forekommende seneffekter som også er rapportert å forsinke tannerupsjonen (26, 38). Forandringer i bentetthet og blodgjennomstrømming i kjevebenet som følge av cytostatika og stråling kan også medvirke.
Malokklusjon
Avvikene i kraniofasial- og tannutvikling som er beskrevet bidrar til en større prevalens av malokklusjon (Figur 1A, 2A) (30, 39–41), samtidig som utviklingsforstyrrelser som økt forekomst av agenesier og korte V-formede røtter vanskeliggjør kjeveortopedisk behandling. Få etterundersøkelser etter tannregulering diskuterer om korte V-formede røtter er mer disponerte for økt rotresorpsjon ved tannregulering. En svensk studie beskriver at de ikke har observert mer rotresorpsjon, men her er evidens usikker på grunn av få inkluderte pasienter (42). Det er anbefalt at tannregulering ikke bør påbegynnes før to år etter at kreftbehandlingen er avsluttet og at behandlingen begrenses i tid og omfang (42). Medvirkende faktorer kan være at risiko for ny malignitet er størst i den første tiden etter kreftbehandlingen, samt forandringer i bentetthet med redusert blodgjennomstrømming.
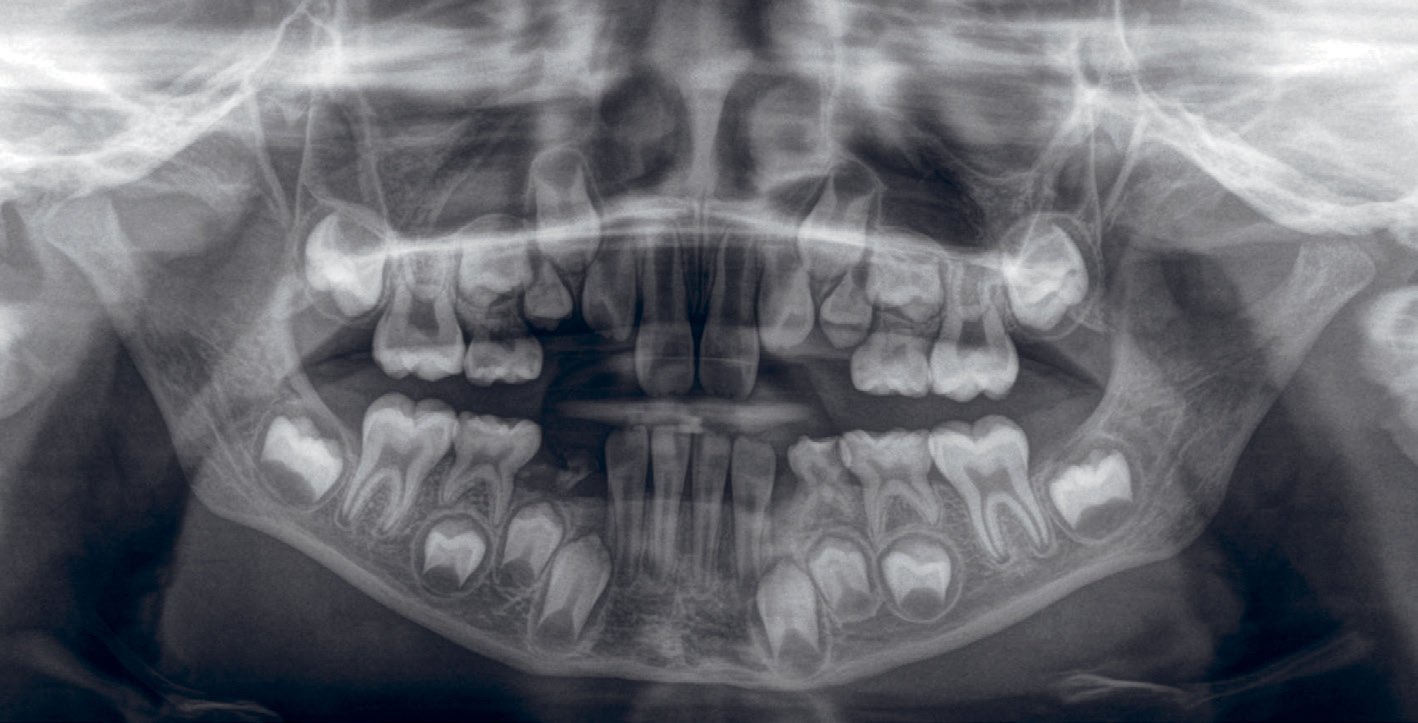
Figur 3. Panoramarøntgen fra en 9 år gammel gutt som ble behandlet med cytostatika for akutt myeloid leukemi (AML) ved 1,5-års alder. Det er utbredt ubehandlet karies og en rotrest tann 84. Tennene 14 og 24 har redusert kronestørrelse (mikrotenner). Det er markert plassmangel begge kjever.
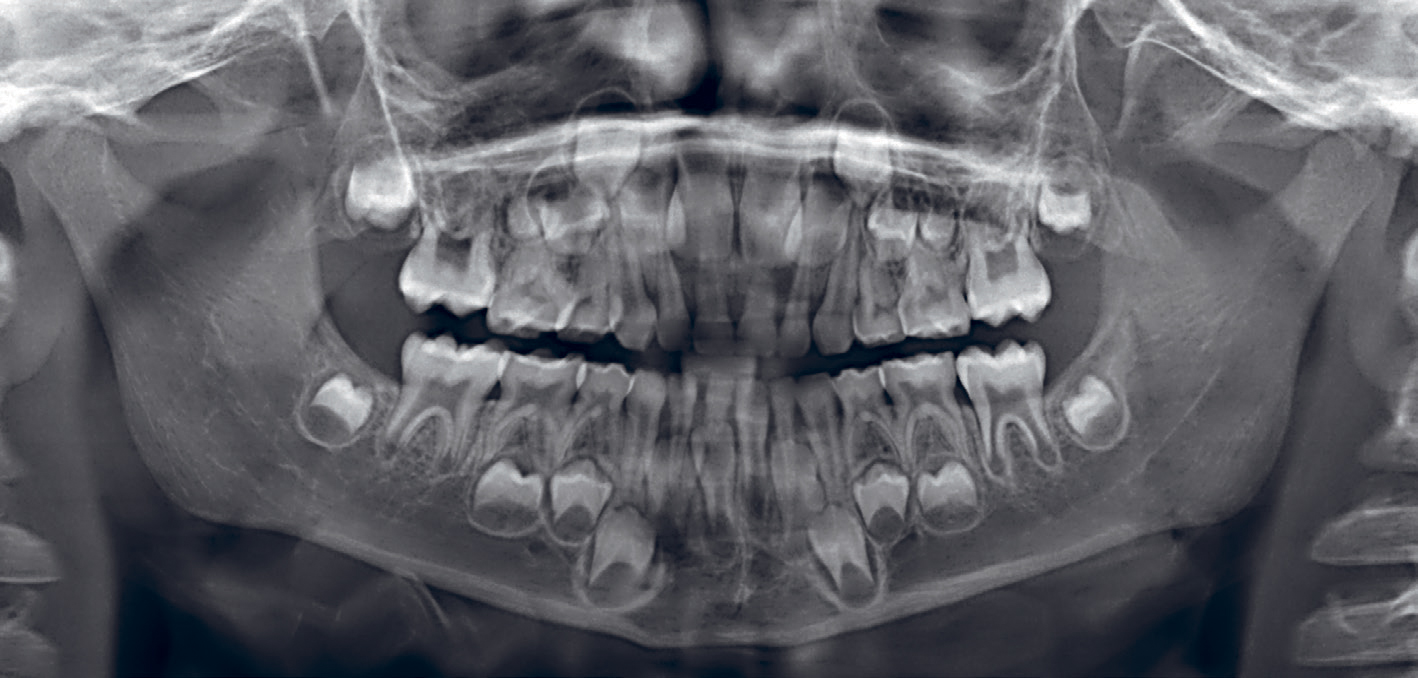
Figur 4. Panoramarøntgen fra en seks år gammel gutt som ble behandlet med cytostatika ved 2-års alder på grunn av blodkreft (akutt lymfatisk leukemi – ALL). Tann 15 og 25 er mikrotenner og det er redusert tannstørrelse av tennene 27, 37 og 47.
Spyttkjertler
Spyttkjertler er ofte inkludert i strålingsfeltet ved hode- og halskreft (22). Både kjemoterapi og strålebehandling kan forårsake skader på spyttkjertler, som resulterer i redusert spyttsekresjon, redusert bufferkapasitet, lavere Ph i saliva og et gunstig miljø for kariesfremmende mikroflora (20, 22). Saliva har en beskyttende effekt på tennene og smører og beskytter munnslimhinnen i tillegg til å delta i fordøyelsesprosessen (43). En følgetilstand av salivadysfunksjon er munntørrhet, som kan gi vanskeligheter med å snakke, spise og svelge. Det vil også være en økende risiko for tørre, sprukne lepper, sår og svie i slimhinner, angulær cheilitt, smaksforstyrrelser, bakterielle infeksjoner, soppinfeksjoner, problemer med å smøre og mykgjøre mat, gingivitt, dental erosjon og karies (43, 44). Salivasekresjonen er mest nedsatt de første månedene etter kreftbehandlingen men det kan forventes en gradvis tilbakevending (20). En studie av pasienter med rabdomyosarkom som fikk strålebehandling mot hode og hals med gjennomsnittlig oppfølging på 7 år viste en prevalens av munntørrhet på 12 % (45). Noen individer plages med salivadysfunksjon livet ut. Kombinasjon av både strålebehandling og kjemoterapi vil øke risikoen for slike irreversible skader på spyttkjertler (46).
Nevrosensoriske sanser som smak- og luktesans kan bli redusert og forandret både forbigående og permanent. I en studie fra 2015 ble det rapportert at 27,5 % hadde forandret smak og ca. 4 % forandret luktesans noe som kan forandre preferanser i kosthold og føre til feilernæring og redusert livskvalitet (47).
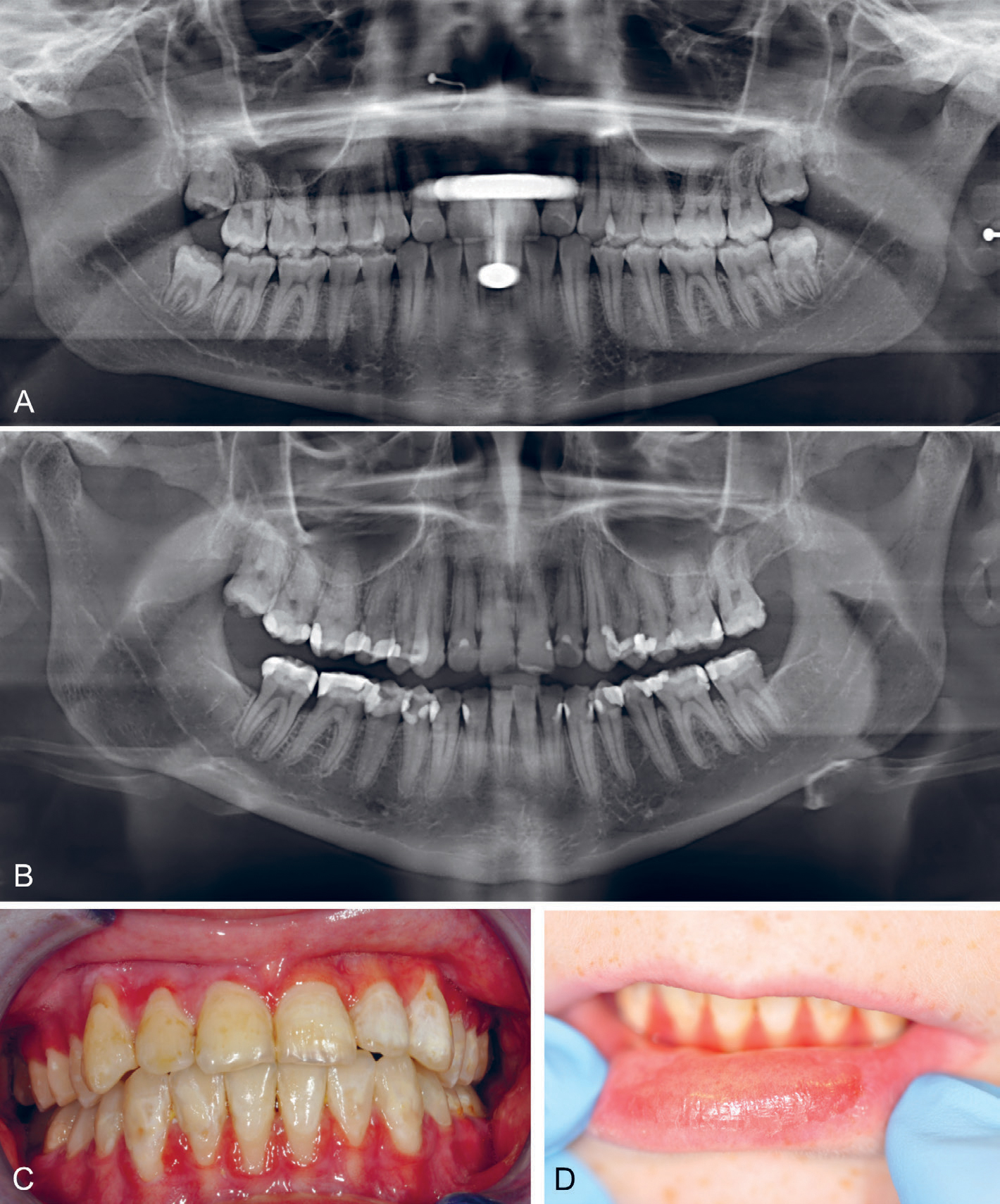
Figur 5. A–D. Bilder fra en 19 år gammel pasient med akutt lymfatisk leukemi. Pasienten gjennomgikk behandling med cytostatika og benmargstransplantasjon.
A: Panoramarøntgen viser god oral status ved begynnelsen av behandlingen.
B-D: Tre år senere er det dramatisk forverring av oral helse, med fyllinger og/eller karies i samtlige tenner (B). Det er skjemmende dekalsinasjoner og misfarging på bukkalflatene (C) og oral «graft-versus-host-disease» (GVHD) på underleppe (D), gingiva og slimhinner.
Karies
Studier har vist at barn har større risiko for karies spesielt i den første tiden etter kreftbehandling (48, 49). Risiko for karies er øket hos barn som har fått strålebehandling i kombinasjon med cytostatika og dersom barnet hadde karies ved behandlingsstart (figur 3, 5 A-C) (47, 49). Det har vist seg at risikoen for karies reduseres med tiden, noe som eventuelt kan forklares med at redusert mengde saliva under kreftbehandlingen kan normaliseres en tid etter avsluttet kreftbehandling (51). I en studie fra Danmark fant man at barn diagnostisert med kreft mellom 5 og 6 års alder hadde økt forekomst av alvorlig karies ved 12-års alder sammenlignet med friske kontroller, men ved 15 års alder var det ingen forskjell (48). Det ble antydet at den gradvise nedgangen i risiko var et resultat av individualisert oppfølging av orale helse til barnekreft-overlevere. Flere studier har vist at overlevere av barnekreft som fikk forebyggende kariesprofylakse under og etter kreftbehandlingen, ikke hadde mer karies enn kontroller (50, 52).
Trismus
Trismus (begrenset gapeevne) og temporomandibulær dysfunksjon er senskader som kan oppstå etter strålebehandling av kjeveledd og tyggemuskulatur (22). Strålebehandling mot kjeveledd og tyggemuskulatur kan føre til arrdannelse (uttalt bindevevsdannelse) og redusert kargjennomblødning i vevene (53). Forekomsten av trismus varierer fra 7 til 27 % for de som overlever barnekreft med nasofaryngeal karsinom (54, 55). Ingen studier på barn har evaluert stråledose forbundet med trismus, men hos voksne har man funnet at de som fikk strålebehandling i hode-halsområdet til over 50 Gy (grey) hadde stor sannsynlighet for å få dette (56). Barn med nasofaryngealt karsinom får vanligvis doser større enn 50 Gy (57).
Oral «transplantat-versus-vert-sykdom» (GVHD)
Kronisk GVHD, er en alvorlig immunologisk seneffekt som kan sees hos personer som har gjennomgått allogen benmargstransplantasjon (58). Etterfulgt av huden, er slimhinnen i munnhulen den vanligste lokalisasjonen for GVHD, og det er vanlig at den debuterer innen 100 dager etter transplantasjonen (22). Prevalensen av oral GVHD hos unge transplanterte pasienter varierer mellom 9 og 45 % (59, 60). Tegn og symptomer på oral GVHD kan minne om autoimmune forstyrrelser som Sjøgrens syndrom og sklerodermi og inkluderer lichenoide endringer i munnslimhinnen med stramhet, stivhet og sår (22). Gingivitt og erytem i slimhinnen er også vanlig (figur 5 C-D). Som følge av oral GVHD kan det oppstå opportunistiske infeksjoner, økt risiko for karies og problemer med å opprettholde munnhygiene, ernæring og tale. En langsiktig bekymring er risikoen for sekundær malignitet i munnslimhinnen (61).
Oppfølging av orale senskader etter barnekreft og forslag til forbedringer
Populasjonen av barnekreftoverlevere er økende: Hvert år overlever vel 160 barn kreftbehandling. Barnekreft inkluderer en lang rekke sjeldne diagnoser. Det finnes derfor mer enn 30 individualiserte behandlingsprotokoller som kan innebære omfattende multimodal behandling og gi omfattende senskader. Siden kreftbehandlingen er kompleks og tilpasset det enkelte barns alder, krefttype, lokalisasjon og utbredelse, vil også seneskadene variere. Det er derfor anbefalt at barn som har vært behandlet for kreft blir utstyrt med et «Survivorship Passport» der tidligere diagnoser og all gjennomgått behandling, inklusive stråledoser, type og dosering av cytostatika er beskrevet (62). Senskader oppstår hos to av tre behandlede barn og mens noen kun vil trenge enkle kontroller, vil andre trenge langvarig oppfølging og intervensjon. Det er derfor behov for individuell vurdering av framtidig oppfølging. Mens det i dag finnes system for kontroll av medisinske senskader i helsetjenesten, har en ikke egne rutiner i Den offentlige tannhelsetjenesten for oppfølging, diagnostikk og behandling av orale senskader etter barnekreft, selv om det burde være en prioritert oppgave. Dette rammer barna og familiene deres både helsemessig og økonomisk.
Organisering, økonomi og forslag til forbedringer
Behandlingsprotokollene for behandling av kreft hos barn har i dag ikke eget punkt om tannundersøkelse og behandling samt fjerning av eventuell kjeveortopedisk apparatur før kreftbehandling iverksettes. Til tross for viktigheten av dette for å forebygge infeksjoner hos immunsupprimerte barn er presisert i internasjonale retningslinjer (7). Dette bør innarbeides.
Alle barn som behandles for kreft bør kunne få adekvat oppfølging og lindrende behandling av tannhelsepersonell under sykdomsforløpet.
Barn og unge i Norge har kostnadsfri tannhelsetjeneste i Den offentlige tannhelsetjenesten ut det året de fyller 18 år og ved 19 og 20 år betales kun 25 % av behandlingskostnaden. Disse ordningene er ikke tilpasset barnekreftoverlevere som ofte må vente til voksen alder med å gjennomgå kirurgi og/eller protetetisk behandling på grunn av vekstforstyrrelser i kjevene eller erstatning av manglende og misdannede tenner. Etter 20 år er mulighetene for refusjon begrenset og egenandelene for behandling betydelige.
Barn og ungdom til og med 20 år får støtte fra HELFO til kjeveortopedisk behandling fra 40 %–90 % avhengig av søskenmoderasjon og bittanomaliens alvorlighet. Siden fast tannregulerings-apparatur alltid må fjernes når kreftbehandling påbegynnes, må mange barn som var i gang med tannregulering når de fikk kreft, behandles på ny med fast apparatur etter at kreftbehandlingen er avsluttet. Dette fører til betydelige merkostnader for disse familiene.
Prevalens av senskader øker med tiden etter behandlingen, og det er derfor anbefalt å undersøke munnhulen og tannsettet umiddelbart etter kreftbehandling og to ganger i året deretter (4,7). Individuelle behov for oppfølging bør vurderes tverrfaglig av tannlegespesialister innenfor aktuelle odontologiske fagområder. Disse arbeider per i dag ved odontologiske kompetansesentra i Den offentlige tannhelsetjenesten, ved landets tre Odontologiske institutter, samt innenfor spesialisthelsetjenesten ved universitetssykehusene.
Kunnskap om orale senskader etter barnekreft må bygges opp gjennom systematisk oppfølging og forskning og resultatet spres i utdanningene og i helse- og tannhelsetjenesten.
Takk
Ved Haukeland universitetssjukehus er det igangsatt et forskningsprosjekt for å kartlegge og følge opp orale senskader etter kreft hos barn. Prosjektet er et samarbeid mellom Barne- og ungdomsklinikken og Kjevekirurgisk avdeling og er ledet av seksjonsoverlege Dorota M. Wojcik. Vi takker Barnekreftforeningen for 1,3 millioner i støtte til dette arbeidet. https: //www.tannlegetidende.no/i/2020/8/m-2787. Illustrasjonene i artikkelen er fra Avdeling for kjevekirurgi og fra privat spesialistpraksis.
Samtykke til bruk av bilder
Samtlige foresatte og pasienter over 16 år har samtykket til bruk av bilder.
Referanser
Årsrapport for barnekreft 2019. «Nasjonalt kvalitetsregister for Barnekreft». https: //www.kreftregisteret.no/Generelt/Rapporter/Arsrapport-fra-kvalitetsregistrene/Arsrapport-for-barnekreft/arsrapport-for-barnekreft-2019/
American Cancer Society. “Key Statistics for Childhood Cancers». [updated August 2020 ). https: //www.cancer.org/cancer/cancer-in-children/key-statistics.html.
Helsedirektoratet. Kreft hos barn-handlingsprogram. Nasjonal faglig retningslinje. Oslo.2020. https://www.helsedirektoratet.no/retningslinjer/kreft-hos-barn-handlingsprogram
Helsedirektoratet. Seneffekter etter kreftbehandling.Faglige råd. Rapport IS-2872. 2020. https: //www.helsedirektoratet.no/rapporter/seneffekter-etter-kreftbehandling/.
Steliarova-Foucher E, Stiller C, Lacour B, Kaatsch P. International Classification of Childhood Cancer, third edition. Cancer. 2005; 103(7): 1457–67.
Bresters D, van Gils IC, Kollen WJ, Ball LM, Oostdijk W, van der Bom JG, et al. High burden of late effects after haematopoietic stem cell transplantation in childhood: a single-centre study. Bone Marrow Transplant. 2010; 45(1): 79–85.
Board PDQPTE. Late Effects of Treatment for Childhood Cancer (PDQÒ): Health Professional Version. PDQ Cancer Information Summaries. Bethesda (MD): National Cancer Institute (US); 2002.
Dale E og Waldeland E. Protonterapi_en realitet i Norge fra 2023.Tidsskr Nor Legefor; 2018; 138(13)
Hudson MM, Ness KK, Gurney JG, Mulrooney DA, Chemaitilly W, Krull KR, et al. Clinical ascertainment of health outcomes among adults treated for childhood cancer. Jama. 2013; 309(22): 2371–81.
Oeffinger KC, Mertens AC, Sklar CA, Kawashima T, Hudson MM, Meadows AT, et al. Chronic health conditions in adult survivors of childhood cancer. New Engl J Med. 2006; 355(15): 1572–82.
Greenzang KA, Cronin AM, Kang T, Mack JW. Parent understanding of the risk of future limitations secondary to pediatric cancer treatment. Pediat Blood Cancer. 2018; 65(7): e27020.
Greenzang KA, Cronin AM, Mack JW. Parental preparedness for late effects and long-term quality of life in survivors of childhood cancer. Cancer. 20.16; 122(16): 2587–94.
Gunnes MW, Lie RT, Bjørge T, Ghaderi S, Ruud E, Syse A, et al. Reproduction and marriage among male survivors of cancer in childhood, adolescence and young adulthood: a national cohort study. Br J Cancer. 2016; 114(3): 348–56.
Gunnes MW, Lie RT, Bjørge T, Syse A, Ruud E, Wesenberg F, et al. Economic independence in survivors of cancer diagnosed at a young age: A Norwegian national cohort study. Cancer. 2016; 122(24): 3873–82.
Ghaderi S, Engeland A, Moster D, Ruud E, Syse A, Wesenberg F, et al. Increased uptake of social security benefits among long-term survivors of cancer in childhood, adolescence and young adulthood: a Norwegian population-based cohort study. Br J Cancer. 2013; 108(7): 1525–33.
Boman KK, Lindblad F, Hjern A. Long-term outcomes of childhood cancer survivors in Sweden: a population-based study of education, employment, and income. Cancer. 2010; 116(5): 1385–91.
Allen G, Logan R, Gue S. Oral manifestations of cancer treatment in children: a review of the literature. Clin J Oncol Nurs. 2010; 14(4): 481–90.
Nemeth O, Hermann P, Kivovics P, Garami M. Long-term effects of chemotherapy on dental status of children cancer survivors. Pediatr Hematol Oncol. 2013; 30(3): 208–15.
Skår R, Løes IM, Thorsen L, Afnan S, Løes S. Cytostatika og oral helse. Nor Tannlegeforen Tid 2010(120): 968—73.
Gawade PL, Hudson MM, Kaste SC, Neglia JP, Constine LS, Robison LL, et al. A systematic review of dental late effects in survivors of childhood cancer. Pediatr Blood Cancer. 2014; 61(3): 407–16.
Wilberg P, Kanellopoulos A, Ruud E, Hjermstad MJ, Fosså SD, Herlofson BB. Dental abnormalities after chemotherapy in long-term survivors of childhood acute lymphoblastic leukemia 7–40 years after diagnosis. Support Care Cancer. 2016; 24(4): 1497–506.
Effinger KE, Migliorati CA, Hudson MM, McMullen KP, Kaste SC, Ruble K, et al. Oral and dental late effects in survivors of childhood cancer: a Children’s Oncology Group report. Support Care Cancer. 2014; 22(7): 2009–19.
Näsman M, Forsberg CM, Dahllöf G. Long-term dental development in children after treatment for malignant disease. Eur J Orthod. 1997; 19(2): 151–9.
Thesleff I. From understanding tooth development to bioengineering of teeth. Eur J Oral Sci. 2018; 126 Suppl 1: 67–71.
Koch G, Thesleff I. The chronology of mineralization of permanent teeth. Developmental disturbances in number and shape of teeth and their treatment. In: Koch G, Poulsen S, editors. Pediatric dentistry—a clinical approach, 1st ed Copenhagen: Munksgaard; 2001. p. 253–71.
Chemaitilly W, Cohen LE, Mostoufi-Moab S, Patterson BC, Simmons JH, Meacham LR, et al. Endocrine Late Effects in Childhood Cancer Survivors. J Clin Oncol. 2018; 36(21): 2153–9.
Litsas G. Growth Hormone and Craniofacial Tissues. An update. Open Dent J. 2015; 9: 1–8.
Vesterbacka M, Ringdén O, Remberger M, Huggare J, Dahllöf G. Disturbances in dental development and craniofacial growth in children treated with hematopoietic stem cell transplantation. Orthod Craniofac Res. 2012; 15(1): 21–9.
Karsila-Tenovuo S, Jahnukainen K, Peltomäki T, Minn H, Kulmala J, Salmi TT, et al. Disturbances in craniofacial morphology in children treated for solid tumors. Oral Oncol. 2001; 37(7): 586–92.
Dahllöf G. Craniofacial growth in children treated for malignant diseases. Acta Odontol Scand. 1998; 56(6): 378–82.
Hölttä P, Alaluusua S, Saarinen-Pihkala UM, Peltola J, Hovi L. Agenesis and microdontia of permanent teeth as late adverse effects after stem cell transplantation in young children. Cancer. 2005; 103(1): 181–90.
Minicucci EM, Lopes LF, Crocci AJ. Dental abnormalities in children after chemotherapy treatment for acute lymphoid leukemia. Leuk Res. 2003; 27(1): 45–50.
Pajari U, Lanning M, Larmas M. Prevalence and location of enamel opacities in children after anti-neoplastic therapy. Community Dent Oral Epidemiol. 1988; 16(4): 222–6.
Wogelius P, Haubek D, Poulsen S. Prevalence and distribution of demarcated opacities in permanent 1st molars and incisors in 6 to 8-year-old Danish children. Acta Odontol Scand. 2008; 66(1): 58–64.
Hölttä P, Hovi L, Saarinen-Pihkala UM, Peltola J, Alaluusua S. Disturbed root development of permanent teeth after pediatric stem cell transplantation. Dental root development after SCT. Cancer. 2005; 103(7): 1484–93.
Tanaka M, Kamata T, Yanagisawa R, Morita D, Saito S, Sakashita K, et al. Increasing Risk of Disturbed Root Development in Permanent Teeth in Childhood Cancer Survivors Undergoing Cancer Treatment at Older Age. J Pediatr Hematol Oncol. 2017; 39(3): e150-e4.
King E. Oral sequelae and rehabilitation considerations for survivors of childhood cancer. Br Dent J. 2019; 226(5): 323–9.
Suri L, Gagari E, Vastardis H. Delayed tooth eruption: pathogenesis, diagnosis, and treatment. A literature review. Am J Orthod Dentofacial Orthop. 2004; 126(4): 432–45.
Cossellu G, Seramondi R, Benedicenti S, Farronato G, Olivi G, Angiero F. Tooth developmental anomalies in severe combined immunodeficiency disease and juvenile myelomonocytic leukemia: common clinical features and treatment outcomes. Eur J Paediat Dent. 2013; 14(4): 328–32.
Dahllöf G, Jönsson A, Ulmner M, Huggare J. Orthodontic treatment in long-term survivors after pediatric bone marrow transplantation. Am J Orthod Dentofacial Orthop. 2001; 120(5): 459–65.
Schoot RA, Hol MLF, Merks JHM, Suttie M, Slater O, van Lennep M, et al. Facial asymmetry in head and neck rhabdomyosarcoma survivors. Pediatr Blood Cancer. 2017; 64(10).
Dahllöf G, Huggare J. Orthodontic considerations in the pediatric cancer patient: A review. Sem Orthod. 2004; 10(4): 266–76.
Lingström P, Moynihan P. Nutrition, saliva, and oral health. Nutrition. 2003; 19(6): 567–9.
Pedersen AML, Sørensen CE, Proctor GB, Carpenter GH, Ekström J. Salivary secretion in health and disease. J Oral Rehabil. 2018; 45(9): 730–46.
Paulino AC, Simon JH, Zhen W, Wen BC. Long-term effects in children treated with radiotherapy for head and neck rhabdomyosarcoma. Int J Radiat Oncol Biol Phys. 2000; 48(5): 1489–95.
Kosuda S, Satoh M, Yamamoto F, Uematsu M, Kusano S. Assessment of salivary gland dysfunction following chemoradiotherapy using quantitative salivary gland scintigraphy. Int J Radiat Oncol Biol Phys. 1999; 45(2): 379–84.
Thouvenin-Doulet S, Fayoux P, Broucqsault H, Bernier-Chastagner V. Neurosensory, aesthetic and dental late effects of childhood cancer therapy. Review Bull Cancer.2015 Jul-Aug; 102(7–8): 642–742.
Wogelius P, Dahllöf G, Gorst-Rasmussen A, Sørensen HT, Rosthøj S, Poulsen S. A population-based observational study of dental caries among survivors of childhood cancer. Pediatr Blood Cancer. 2008; 50(6): 1221–6.
Avşar A, Elli M, Darka O, Pinarli G. Long-term effects of chemotherapy on caries formation, dental development, and salivary factors in childhood cancer survivors. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2007; 104(6): 781–9
Pajari U, Yliniemi R, Möttönen M. The risk of dental caries in childhood cancer is not high if the teeth are caries-free at diagnosis. Pediatr Hematol Oncol. 2001; 18(3): 181–5.
Dahllöf G, Bågesund M, Ringdén O. Impact of conditioning regimens on salivary function, caries-associated microorganisms and dental caries in children after bone marrow transplantation. A 4-year longitudinal study. Bone Marrow Transplant. 1997; 20(6): 479–83.
Cubukçu CE, Sevinir B. Dental health indices of long-term childhood cancer survivors who had oral supervision during treatment: a case-control study. Pediatr Hematol Oncol. 2008; 25(7): 638–46.
Goldstein M, Maxymiw WG, Cummings BJ, Wood RE. The effects of antitumor irradiation on mandibular opening and mobility: a prospective study of 58 patients. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1999; 88(3): 365–73.
Küpeli S, Varan A, Ozyar E, Atahan IL, Yalçin B, Kutluk T, et al. Treatment results of 84 patients with nasopharyngeal carcinoma in childhood. Pediatr Blood Cancer. 2006; 46(4): 454–8.
Daoud J, Toumi N, Bouaziz M, Ghorbel A, Jlidi R, Drira MM, et al. Nasopharyngeal carcinoma in childhood and adolescence: analysis of a series of 32 patients treated with combined chemotherapy and radiotherapy. Eur J Cancer. 2003; 39(16): 2349–54.
Johnson J, van As-Brooks CJ, Fagerberg-Mohlin B, Finizia C. Trismus in head and neck cancer patients in Sweden: incidence and risk factors. Med Sci Monitr. 2010; 16(6): Cr278–82.
Rodriguez-Galindo C, Krailo MD, Krasin MJ, Huang L, McCarville MB, Hicks J, et al. Treatment of Childhood Nasopharyngeal Carcinoma With Induction Chemotherapy and Concurrent Chemoradiotherapy: Results of the Children’s Oncology Group ARAR0331 Study. J Clin Oncol. 2019; 37(35): 3369–76.
Ramachandran V, Kolli SS, Strowd LC. Review of Graft-Versus-Host Disease. Dermatol Clin. 2019; 37(4): 569–82.
Nicolatou-Galitis O, Kitra V, Van Vliet-Constantinidou C, Peristeri J, Goussetis E, Petropoulos D, et al. The oral manifestations of chronic graft-versus-host disease (cGVHD) in paediatric allogeneic bone marrow transplant recipients. J Oral Pathol Med. 2001; 30(3): 148–53.
Treister NS, Woo SB, O’Holleran EW, Lehmann LE, Parsons SK, Guinan EC. Oral chronic graft-versus-host disease in pediatric patients after hematopoietic stem cell transplantation. Biol Blood Marrow Transplant. 2005; 11(9): 721–31.
Ringdén O, Brazauskas R, Wang Z, Ahmed I, Atsuta Y, Buchbinder D, et al. Second solid cancers after allogeneic hematopoietic cell transplantation using reduced-intensity conditioning. Biol BloodMarrow Transplant. 2014; 20(11): 1777–84.
Haupt R, Essiaf S, Dellacasa C, Ronckers CM, Caruso S, Sugden E, et al. The ‘Survivorship Passport’ for childhood cancer survivors. Eur J Cancer. 2018; 102: 69–81.
English summary
Craniofacial and oral late effects after childhood cancer treatment
About 190 Norwegian children are each year diagnosed with cancer. The highest prevalence is between 0–6 years. Leukaemia and tumors in the central nervous system each comprise about 30 %, lymphomas 12 %, while the remaining comprise rare tumors, each with a prevalence of 1–7 %. Diagnostics and treatment follow established international protocols and take place at the four university hospitals: Oslo University Hospital Rikshospitalet (Oslo), St Olav’s Hospital (Trondheim), Haukeland University Hospital (Bergen), and the University Hospital of Northern Norway (Tromsø). The treatment is multimodal and consists of combinations of chemotherapy, surgery and radiation, sometimes in combination with hematopoietic stem cell transplantation. Five-year survival in 2019 was 86 %, but two of three survivors suffer from late effects from previous disease and/or treatment. The late effects include risk of secondary cancer, fatigue, altered psychosocial function, heart-, circulation or lung disease, reduced cognitive capacity, infertility and endocrine dysfunction. Oral late effects comprise craniofacial growth disturbances, disturbances in tooth development, malocclusion, reduced salivary flow, increased caries prevalence, trismus and oral mucosal diseases.
In order to diagnose and treat late effects, the hospital departments follow the survivors for five years, while The Norwegian public dental service does not have specific systems for follow-up on childhood cancer survivors. Knowledge and treatment of oral late effects are therefore often incomplete and a potential source of reduced quality of life.
Wojcik DM, Sivertsen TB, Løes S, Midtbø M. Kraniofaciale og orale senskader etter behandling av barnekreft. Nor Tannlegeforen Tid. 2021;132:454-62. doi:10.56373/2021-5-4
Korresponderende forfatter: Marit Midtbø; e-post: marit.midtbo@helse-bergen.no
Akseptert for publisering 31.03.2021.
Artikkelen har gjennomgått ekstern faglig vurdering.
Wojcik DM, Sivertsen TB, Løes S, Midtbø, M. Kraniofaciale og orale senskader etter behandling av barnekreft. Nor Tannlegeforen Tid. 2021; 131: 454–62
Norsk MeSH: Barns helse; Munnhelse; Overlevere etter barnekreft; Maksillofacial utvikling; Tannutvikling
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Wojcik DM, Sivertsen TB, Løes S, Midtbø M. Kraniofaciale og orale senskader etter behandling av barnekreft. Nor Tannlegeforen Tid. 2021;132:454-62. doi:10.56373/2021-5-4
