Ulla Moberg Sköld, Jukka H. Meurman, Roland Jonsson och Dowen Birkhed
Reumatoid artrit, Sjögrens syndrom och karies
Leg. tandl., odont. dr, docent i kariologi. Sahlgrenska akademin, Göteborg, Sverige
Pofessor, överläkare. Kliniken för Mun- och käksjukdomar, Helsingfors universitetssjukhus, Helsinki, Finland
DMD, odont.dr, professor emeritus. Broegelmanns Forskningslaboratorium, Klinisk Institutt 2, Universitetet i Bergen, Norge
Professor emeritus, Malmö, Sverige
De autoimmuna sjukdomarna reumatoid artrit (RA) och Sjögrens syndrom (SS) medför en ökad kariesrisk på grund av muntorrhet, immunosuppression och nedsatt handfunktion. Det är angeläget att reumatologläkare tidigt i diagnosen remitterar patienten till tandvården för kariesriskbedömning och individuell kariesprevention.
Det finns en stark koppling mellan munhälsa och allmänhälsa där god munhälsa i hög utsträckning bidrar till god allmänhälsa och till allmänt välbefinnande.
Den kanadensiske läkaren Sir William Osler myntade redan på 1800-talets slut uttrycket ”The health of the mouth is the window to the health of the body” vilket med stor tydlighet gäller även idag dryga 100 år senare och visar på sambanden mellan munhälsa och risk för och progression av systemsjukdomar (1). Man kan på goda grunder säga att munnen är kroppens spegel (2).
Det finns ett samband mellan de reumatiska sjukdomarna reumatoid artrit (RA) och Sjögrens syndrom (SS) och orala sjukdomarna parodontit och karies (3).
Karies är en multifaktoriell folksjukdom, som drabbar 60–90 procent av samtliga skolbarn i världen och en majoritet av den vuxna befolkningen (4). Karies innebär stora kostnader för såväl individ som samhälle och är, enligt WHO:s beräkningar, den fjärde dyraste kroniska sjukdomen att behandla (5). Sjukdomen är fortfarande den vanligaste orsaken till tandförlust, som innebär inte bara sämre funktion att tugga och tillgodogöra sig föda utan även sänkt självkänsla, lägre social status och är en stark social markör (6).
Samverkan reumatologi – tandvård
Det är viktigt att etablera en samverkan mellan reumatologivård och tandvård för att säkerställa tidig och korrekt diagnos avseende munsjukdomar, att främja goda vanor och förhindra potentiella orala komplikationer. Detta är av allmänt intresse inom såväl tand- som sjukvården (7-9).
Patient som diagnostiseras med RA eller SS bör som rutin remitteras från ansvarig reumatologläkare till den tandvårdsklinik som patienten är knuten till. Saknas en kontinuerlig tandvårdskontakt bör remissen gå till specialisttandvården oral medicin inom respektive folktandvårdsområde, som i sin tur remitterar till lämplig tandvårdsklinik och även kan fungera som rådgivare.
Vid muntorrhet och/eller sköra och känsliga munslemhinnor i kombination med dålig motorik i händer till följd av smärta, svullnad, stelhet, felställningar, inskränkt rörlighet och dålig gapförmåga är det viktigt att tidigt få kunskap om riskerna för försämrad munhälsa. Tandvårdens uppgift är att göra en riskbedömning ur kariessynpunkt och sätta in preventionsinsatser utifrån den enskilde patientens behov och förutsättningar. Ju tidigare detta sker i patientens diagnos, desto större är chansen att behålla god munhälsa. Tandvården kan också, genom sitt breda kontaktnät gentemot allmänheten, upptäcka sjukdomarna SS och RA genom deras negativa påverkan i munhålan, vilket ytterligare poängterar vikten av fungerande samverkan mellan reumatologivård och tandvård (8).
F5-tandvård och särskilt tandvårdsbidrag
För den vuxne patienten som lider av långvarig RA och har stora svårigheter att sköta sin munhälsa finns tandvårdsstödet F5, som innebär att vården hos tandläkare och tandhygienist ingår i den vård som patienten i övrigt får av hälso- och sjukvården och ingår i högkostnadsskyddet. Patientens reumatologläkare gör ansökan på en särskild blankett från Socialstyrelsen och landstinget beslutar om patienten har rätt till stöd. Exempel på besvär för att beviljas tandvårdsstöd är smärta, stelhet, leddestruktion med felställningar, inskränkning i handens finmotorik och käkledsbesvär med minskad gapförmåga. Patient med SS kan ansöka om särskilt tandvårdsbidrag (STB), för närvarande 600 kronor per halvår, som används för kariesprevention för att undvika risk för försämrad munhälsa.
Reumatoid artrit – RA
RA är en immunologisk störning som börjar flera år före uppkomsten av kliniska symptom. I början är symptomen ospecifika och kan inte skiljas från andra ledbesvär. Så småningom inflammeras små leder, karakteristiskt i fingrarna och handlederna. Den sannolika RA-diagnosen kan fastställas när reumafaktorn, också kallad Waaler-Rose test efter norrmannen Erik Waaler som först beskrev denna autoantikropp, och på senare tid antikroppar mot citrullinerade peptider/proteiner (ACPA) kan påvisas i blodet. Detta sker hos ungefär två tredjedelar av alla patienter med RA. Reumatiska ledbesvär är svårast på morgonen och patienten kan ha feber och lida av trötthet.
I Sverige beräknas det att ca 0,7 procent av den vuxna befolkningen har RA med cirka 40 nyinsjuknade per 100 000 invånare och år (10). Insjuknandet ses i alla åldrar, men majoriteten insjuknar mellan 50 och 70 år. Diagnosen RA är tre gånger vanligare bland kvinnor än bland män. Det finns ett genetiskt anlag för insjuknandet och den risken fördubblas av rökning (11).
Sverige har en betydande roll i reumatiska sjukdomars historia tack vare Nanna Svartz som första kvinnliga professor och chef vid medicinska kliniken vid Karolinska sjukhuset. I slutet av 1930-talet utvecklade hon sulfasalazin (Salazopyrin®) vilket då revolutionerade behandlingen. Läkemedlet är fortfarande en av hörnstenarna i behandlingen.
Utvecklingen av såväl diagnostik som behandling av RA har under senare år varit snabb. Patogenesen bakom RA är ledhinneinflammation så kallad synovit. Modern forskning har uppmärksammat till exempel tumor necrosis factor-alfa (TNF-α) vilket har lett till nutida läkemedel som TNF-α modulatorer (12).
Modern antireumatisk behandling innebär användning av en kombination av olika mediciner såsom metotrexat, sulfasalazin, hydroxiklorokin och glukokortikoider. Andra mediciner som kan komma i fråga är immunosuppressiva mediciner som azatioprin och ciklosporin, men också aurotiomalat (”guld”) och penicillamin används fortfarande. Ifall dessa klassiska antireumatika inte hjälper, övergår man till biologiska mediciner, vanligen kombinerade med metotrexat, som är en folsyraantagonist och tillhör gruppen cytostatika. De biologiska läkemedlen är TNF-α-hämmare (till exempel adalimumab), B- och T-cellshämmare (till exempel rituximab), interleukin-6 receptorblockerare (tosilizumab), interleukin-1-blockerare (anakinra) och januskinas (JAK)-hämmare (upadacitinib) (13).
I praktiken förorsakar alla reumamediciner immunosuppression. Mediciner som patienten använder kan också framkalla biverkningar i munnen såsom muntorrhet och lichenoida slemhinnereaktioner. Den enskilde patientens vård i avvägningen mellan god effekt på sjukdomsaktivitet och oönskade biverkningar kan därför vara mycket komplicerad.
Samband mellan RA och karies
Den vetenskapliga evidensen kring sambandet mellan RA och karies är svag på grund av relativt få studier med ett fåtal patienter. Det är också mest tvärsnittsstudier utan uppföljningstid, och i studierna har man oftast använt de alltför grova måtten DMFT(S)-index för att i enskilda patientfall beskriva karies, och information om kariesaktivitet saknas.
I en nyligen publicerad studie, som inkluderade 80 patienter med RA och 80 friska kontroller, påvisades ingen skillnad i totala DMFT-värden (13,0 mot 14,8), men individer med RA hade fler tänder med manifest karies jämfört med kontroller (5,8 mot 3,9) (14). I samma studie var antalet mutans streptokocker signifikant större i RA-gruppen, vilket i sig kan innebära större kariesrisk.
I en annan studie med 32 patienter med RA som jämfördes med 29 friska individer visades att patienterna med RA, förutom besvär med självupplevd muntorrhet, tandvärk, käkledsbesvär och inskränkt gapförmåga som påverkade livskvaliteten, hade mera karies och plack jämfört med den friska kontrollgruppen (15). Trolig orsak till sämre munhygien ansågs vara fysisk och funktionell inskränkning och svårighet att hålla god munhygien. Författarna poängterade vikten av kontinuerlig kontroll av munhälsan.
I en studie med 53 patienter nyligen diagnostiserade med RA, 28 patienter med kronisk RA och 43 kontroller hade patienterna med RA redan vid start mer karies, och trots god respons på medicinering för sjukdomen fick de mer karies under de 16 månader som studien pågick (16). Patienternas munhygien var sämre jämfört med den friska kontrollgruppen, säkert beroende på konstaterad lägre tandborstningsfrekvens. De hade också högre andel djupa tandköttsfickor. Författarna poängterade vikten av regelbunden tandvård, och inte minst god egenvård redan då RA-diagnosen ställs.
I en spansk studie med 73 patienter med RA och 73 kontroller var plack-indexvärden signifikant högre för patienterna med RA jämfört med friska individer (1,6 mot 1,1), men ingen skillnad i kariessiffrorna (DMFT 11,8 mot 10,6) påvisades mellan grupperna (17). På grund av sämre munhygien rekommenderade författarna användning av elektrisk tandborste för att lättare uppnå god munhygien.
En tidigare studie i Finland om 77 patienter med olika reumatiska sjukdomar och 77 kontroller, visade att karies generellt var mera frekvent hos patienter med reumatiska sjukdomar, men skillnaderna var små. Munhälsan var dock sämre hos patienter med sekundärt SS oberoende av reumasjukdomens exakta diagnos (18).
Hos patienter med juvenil idiopatisk artrit har också rapporterats sämre munhälsa jämfört med motsvarande friska barn och ungdomar. En studie med 147 barn i åldrarna 0–18 år visade att dessa patienter hade fler extraherade tänder och fler tänder med manifest karies, 1,0 mot 0,3, jämfört med en kontrollgrupp, och de hade också sämre munhygien (19). Författarna poängterade vikten av regelbunden tandvård.
Patienter med RA borde besöka tandvården oftare än friska individer, vilket tyvärr inte sker. En australiensisk undersökning visade att 45 procent av patienterna med RA inte hade besökt tandvården under senaste två åren eller längre. Största anledningen till deras tandvårdsbesök var fyllningsterapi och de hade avsevärt mer extraktioner än friska individer (8,6 tänder mot 3,9 tänder) och prevention var helt negligerad (20).
Den vetenskapliga litteraturen indikerar att karies inte behöver vara ett stort problem hos RA-patienter om sjukdomen inte leder till sekundärt SS och/eller patienten inte använder mediciner med markant hyposalivation som biverkning. Dock leder de flesta av de moderna medicinerna till immunosuppression med ökad känslighet för infektioner, varför god munhälsa är av stor betydelse. Felställningar i händer, smärta, stelhet med mera, som hör till den klassiska bilden av RA, kan innebära stora svårigheter att upprätthålla god munhälsa. Detta poängterar ytterligare att RA-patienter är kariesriskpatienter trots att saliven inte behöver vara påverkad.
Sjögrens syndrom – SS
SS har fått sitt namn efter den svenske ögonläkaren Henrik Sjögren (1899–1986). År 1929 undersökte han en patient som klagade på torra ögon, muntorrhet och ledsmärtor. Han noterade att kombinationen av dessa symtom möjligen kunde utgöra en egen sjukdoms entitet och han började beskriva dessa patienter under paraplydiagnosen keratoconjunctivitis sicca. Noggrann undersökning gjordes både kliniskt och mikroskopiskt. Han försvarade sin avhandling ”Zur Kentniss der Keratoconjunctivitis Sicca” som mottogs med stor entusiasm, men blev också starkt kritiserad av opponenterna. Avhandlingen blev senare översatt till engelska och Sjögren fick därigenom en internationell karriär. Han var en duktig kliniker med bred klinisk verksamhet i Jönköping och som erkännande för sitt arbete och internationella renommé utnämndes han till docent 1957 av universitetet i Göteborg och till professor 1961 av svenska regeringen.
SS, som debuterar huvudsakligen hos kvinnor i åldrarna 40 till 60 år med en prevalens på cirka 0,05 procent, är en systemisk autoimmun bindvävssjukdom som karaktäriseras av inflammation i exokrina körtlar. Det leder främst till torrhet i munnen och i ögonen samt ofta torrhet på andra ytor, såsom huden, som har förbindelse till exokrina körtlar (21). Sjukdomen associeras med autoantikroppar som kan upptäckas långt innan symtomen debuterar eller diagnosen fastställs (22). Spektrat av SS sträcker sig från en ren organspecifik autoimmun inflammation till en systemsjukdom som drabbar flera organ och associeras med ökad risk för B-cellslymfom.
Aktuell behandling är huvudsakligen symtomatisk, men vid mer utbredd systemsjukdom kan andra, både lokala och systemiska, behandlingsmöjligheter tillgripas (23, 24).
Som ett resultat av det varierande sjukdomsuttrycket är det en utmaning att förbättra diagnostik och behandling. Ett led i detta har varit att ta fram och validera förbättrade internationella klassifikationskriterier (25). Den kliniska vardagen har två alternativa krav för att kunna ställa diagnosen SS: antingen ska patienten ha autoantikroppar och/eller uppvisa positiv läppbiopsi. Spottkörtelbiopsier med efterföljande histopatologisk undersökning har visat sig vara det närmaste man kan kalla en ”golden standard” som kan användas i kliniska prövningar och för stratifiering av patienter (26). Ultraljud av de stora spottkörtlarna och salivanalys uppfyller kraven på att vara icke-invasiva undersökningar för sökande efter viktiga biomarkörer vid SS (27).
Samband mellan SS och karies
Minskat salivflöde och förändringar i salivens sammansättning gör att patienter med SS har en ökad risk att utveckla karies (28). Den viktiga buffringskapaciteten och förmågan att remineralisera är reducerad. Detta gäller också försvaret mot kariogena mikroorganismer.
Ett stort antal vetenskapliga artiklar har publicerats om sambandet mellan SS och karies, men här nöjer vi oss med att inkludera några från senare tid. Ett ökat DMFT(S)-index har visats hos dessa patienter jämfört med friska individer utan SS (29, 30). I den första av dessa två studier fann man inga skillnader i antalet karierade tänder bland SS-patienter i åldersgruppen 27–61 år mot den friska kontrollgruppen, men de hade fyra gånger så många saknade tänder på grund av karies och de hade också fyra gånger högre tandvårdskostnader jämfört med kontrollgruppen (29). I den andra studien var det ingen skillnad i karierade tandytor, men signifikanta skillnader i saknade och fyllda tandytor gentemot kontrollgruppen. SS-patienterna hade god munhygien men uppvisade ett ökat antal kariogena och acidofila mikroorganismer, såsom mutansstreptokocker och laktobaciller, jämfört med friska individer. De besökte också tandvården mer frekvent än den friska kontrollgruppen (30).
Bland SS-patienter är det vanligt att karies förekommer på mer ovanliga ytor, såsom incisalskär, lingualt, på rotytor och cervikalt runt tänderna (31). DMFS har också visat sig vara omvänt korrelerat till salivflödet. I en amerikansk retrospektiv studie visades nyligen att minskat salivflöde relaterat till SS innebär en större kariesrisk jämfört med hyposalivation av andra orsaker (32). Men här kunde man inte relatera fynden till salivflödet. I en annan amerikansk studie, på över 1 000 försökspersoner, hade SS-patienterna signifikant högre andel karierade och lagade tänder jämfört med frisk kontrollgrupp (33). Tandvårdsbesöken var dubbelt så många under en tolvmånadersperiod, till en tredubblad kostnad, jämfört med kontrollgruppen.
Kariesriskbedömning
Karies – en multifaktoriell folksjukdom
En kariesriskbedömning innebär att försöka se in i framtiden och bedöma sannolikheten för att en patient ska utveckla karies (34). Kariesriskbedömning omfattar medicinsk, odontologisk och social risk. Den medicinska risken som här diskuteras är patientens reumatiska sjukdom och medicinering. Den sociala risken är avhängig patientens miljö och livsstil, där kunskap och intresse för munhälsan spelar in. Den odontologiska risken består av en traditionell bedömning av karies angreppsfaktorer, med kost och mikroorganismer i den ena vågskålen och försvarsfaktorerna saliv och fluorid i den andra vågskålen. Kosten spelar en avgörande roll för karies, varför det är viktigt att för patienter med RA och SS bedöma kosten i sin helhet och intagsfrekvensen i synnerhet.
En bedömning av den totala risken att utveckla karies görs på de flesta folktandvårdskliniker i Sverige via ”Beslutsstöd R2”, som utvecklats av en grupp svenska odontologer i samband med projektet ”Frisktandvård” 2008 med Thomas Jacobsen som projektledare. De kliniker som inte har tillgång till detta beslutsstöd kan använda den pedagogiska kariesriskmodellen Cariogram, som är ett interaktivt dataprogram som bedömer ”den aktuella chansen att undvika karies” och som är enkel att utföra på kliniken (35). Den presenterades för drygt 20 år sedan av Douglas Bratthall i Malmö (36) och kan laddas ner kostnadsfritt på Malmö universitets webbplats för pc- och mac-datorer <https://bit.ly/3sEDBKR>.
Fakta 1
Exempel på frågor att ställa till en patient för att belysa självupplevd muntorrhet -xerostomi (43)
Upplever du muntorrhet under natten eller när du vaknar?
Upplever du muntorrhet under dagen?
Har du ett glas vatten nära dig under natten?
Dricker du vätska då du sväljer torra produkter?
Upplever du muntorrhet under måltiderna?
Upplever du att du har problem att svälja mat?
Använder du tuggummi dagligen för att ta bort känslan av muntorrhet?
Använder du frukter eller karameller dagligen för att ta bort känslan av muntorrhet?
Upplever du att mängden saliv i din mun är för liten eller lägger du inte märke till det?
Måste du fukta munnen ofta?
Muntorrhet – en viktig riskfaktor för karies
Det är få sjukdomar som drabbar munhålan så hårt och där sambandet är så starkt som mellan SS och karies på grund av muntorrhet. Det gäller i många fall även sjukdomen RA, då dessa patienter kan utveckla sekundärt SS.
Saliven är en viktig försvarsfaktor i munhålan, inte bara mot karies utan även mot dentala erosioner och orala munslemhinneförändringar (37). Vid muntorrhet upplever patienten ofta svårighet att prata, svälja och känna smak och får ett ökat vätskebehov. Saliven har en fuktgivande och smörjande funktion i munhålan och en rad centrala funktioner i kariesprocessen. Den späder ut syror och kolhydrater i placket, neutraliserar genom sin buffringsförmåga och remineraliserar genom sitt innehåll av kalcium och fosfat (38). Vid muntorrhet ökar kariesrisken påtagligt eftersom alla dessa försvarsmekanismer mer eller mindre är satta ur spel, och tänderna kan snabbt förstöras (39).
En indirekt kariesrisk vid muntorrhet är att sockertiden är förlängd, vilket medför att pH i plack ligger kvar på en låg nivå under lång tid efter intag av föda eller dryck. Dessutom ändras bakteriefloran med en dramatisk ökning av mutansstreptokocker och laktobaciller, vilket i sin tur resulterar i lägre plack-pH (40, 41).
Fakta 2
Fyra patienter med Sjögrens syndrom
Torra läppar och munvinkelragader.
Atrofisk glossit med utslätade papiller, svullnad och ökad rodnad.
Torra läppar, candidos och karies.
-
Omfattande rotkariesskador.
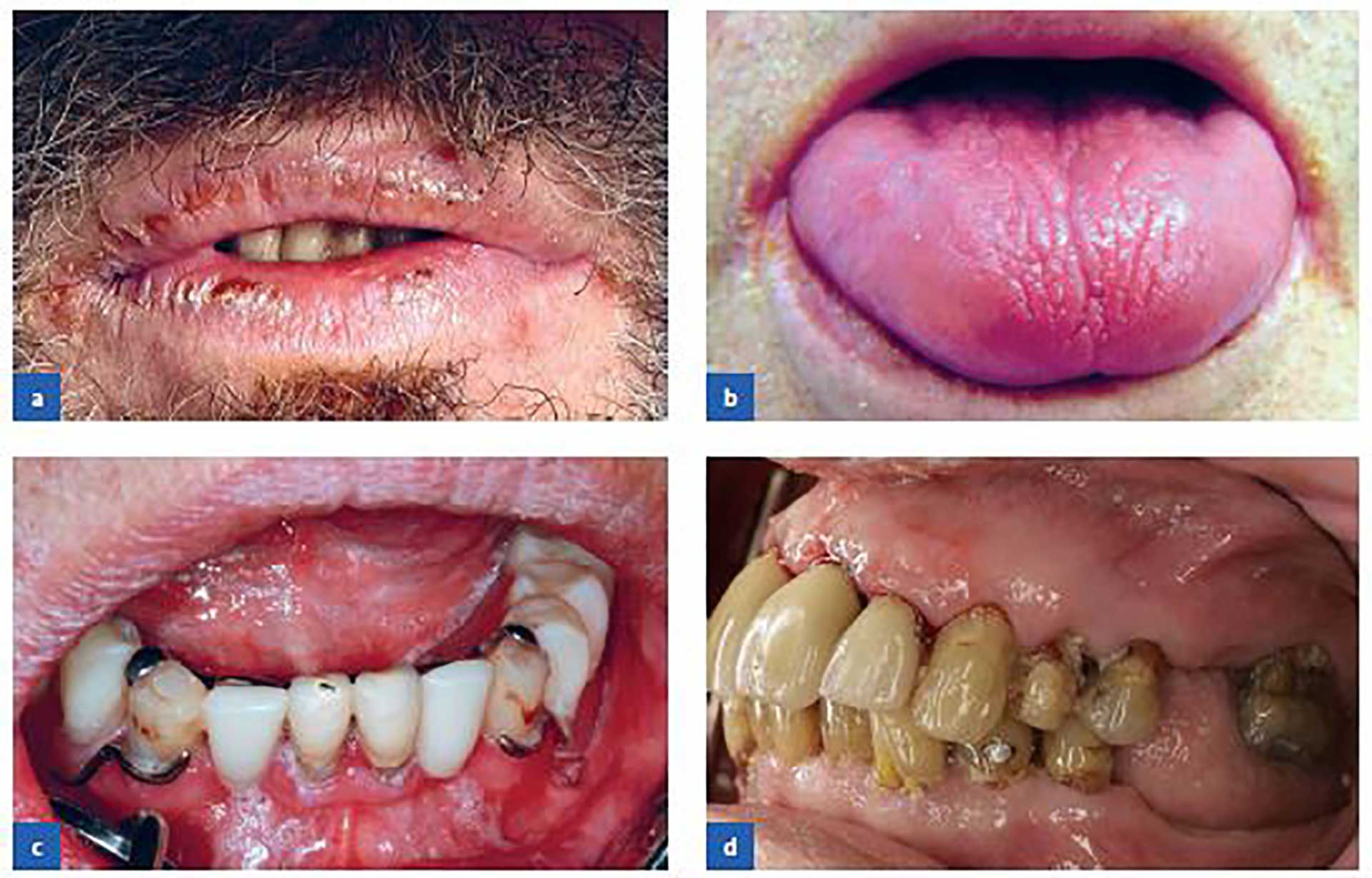
Foto A–C: Folktandvården Västra Götaland, Foto D: Sjukhusfotograf Ari Laine, Helsingfors, Finland
Patientens självupplevda muntorrhet – xerostomi
Genom att ställa frågor om upplevelsen av att känna torrhet i munnen får tandvården en bra uppfattning om patientens subjektiva upplevelse av muntorrhet (42). Patienten blir därmed uppmärksam på sina vanor, som till exempel kan vara att suga på syrliga karameller och dricka söta drycker. Salivsekretionen kan vara nedsatt till 50 procent eller ännu mer innan patienten själv upplever muntorrhet. Lämpliga frågor att ställa till patienten presenteras i faktaruta 1 (43).
Tandvårdens objektiva bedömning av muntorrhet – hyposalivation
Genom en klinisk undersökning och genom att mäta mängden vilosaliv och stimulerad saliv får tandvårdspersonalen en god bild av svårighetsgraden av patientens muntorrhet. Det är viktigt att registrera graden av muntorrhet fortlöpande eftersom salivsekretionen gradvis försämras.
Fakta 3
Vilosaliv och stimulerad saliv
Vilosaliv mäts under 15 minuter genom att patienten sitter avslappnad, något framåtlutad och låter saliven samlas imunbotten, varefter den spottas ut i en bägare eller i ett graderat plaströrw som vägts tom. Bägaren med saliv vägs sedan för att beräkna mängden saliv (1 gram ≈ 1 ml saliv).
Stimulerad saliv mäts genom att patienten får tugga på en paraffinbit (eller ett sockerfritt tuggummi) under 5 minuter och spottar ut med jämna mellanrum i en bägare. Sekretionshastigheten uttrycks i ml/min
Vilosaliv (ml/min) |
Tuggstimulerad saliv (ml/min) |
|
|---|---|---|
Normalt |
>0,25 |
>1 |
Lågt |
0,1-0,25 |
0,7-1 |
Mycket lågt |
<0,10 |
<0,7 |

Foto: Tandläkare Håkan Flink (FTV Sala)
Klinisk inspektion
Börja med att notera om det extraoralt finns torra eller såriga läppar och sår i munvinkeln. Intraoralt kan man se torra och såriga slemhinnor, atrofisk slemhinna vanligtvis mest synlig på tungan då papillerna försvinner, svampinfektion, seg och skummig saliv och problem att bära protes. Med hjälp av en munspegel som dras utefter kindens insida eller på tungans ovansida kan man avgöra om den fastnar eller glider lätt och som kan vara ett mått på graden av muntorrhet (44). Faktaruta 2 visar bilder på fyra patienter med SS.
Salivprovtagning
Salivprov bör tas regelbundet eftersom sekretionshastigheten snabbt kan försämras (45, 46). Man bör mäta både vilosaliv och tuggstimulerad saliv och det är speciellt viktigt att för dessa patientgrupper få en uppfattning om vilosaliven. Den utrustning som behövs för att på tandkliniken mäta saliven är en plastbägare eller ett graderat plaströr, ett tidur, en paraffinbit eller ett sockerfritt tuggummi och en digital våg. Faktaruta 3 visar arbetsgången.
Kariesprevention
God egenvård – grunden för kariesprevention
Oavsett aktiv karies eller inte vid remisstillfället bör varje patient med RA eller SS få ta del av en kariesprevention som innebär god egenvård och prevention på tandklinik för att minska karies angreppsfaktorer och öka försvarfaktorerna. Det görs med ett salutogent förhållningssätt i ett motiverande samtal med patienten i centrum och med mål att stärka befintliga goda vanor och ändra mindre goda vanor (47).
Goda vanor grundläggs tidigt och vanor grundlagda tidigt behålls längre och bör finnas etablerade innan patienten blir alltför dålig i sin reumatiska sjukdom och fortfarande har god munhälsa. Det går inte att nog poängtera vikten av kontinuerlig tandvårdskontakt då dessa patienter ofta brister i följsamhet att uppsöka tandvård och även har stora tandvårdskostnader (29).
Kosten, som den största angreppsfaktorn, spelar en central roll för uppkomsten av karies och det är av största vikt att undvika småätande och att minska mängden socker och lättfermentabla kolhydrater (48, 49). Främst gäller det sockerinnehållande drycker, söta bageriprodukter, konfektyr, glass och sockersötade mjölkprodukter. De mikroorganismer som har betydelse för kariessjukdomen är de mikroorganismer som både är syrabildande och syratåliga och har förmåga att verka vid låga pH-värden (50).
Goda salivegenskaper är första linjens försvar och då denna funktion är satt ur spel hos de flesta av dessa patienter är regelbunden tillförsel av fluorid än viktigare som försvarsfaktor för att balansera angreppsfaktorerna och undvika karies (51, 52). Det finns en bred konsensus att fluorid minskar kariesrisken i alla åldrar genom lokal effekt i munhålan för att förhindra demineralisation och öka remineralisation av tandens hårdvävnad och att påverka bakteriernas metabolism och tandytans ytaktivitet så mindre mängd syra bildas (53–55). Se faktaruta 4.
Fakta 4
God egenvård och prevention på tandklinik
God egenvård
Mat och dryck
Begränsa antal intag av föda till maximalt 5-6 gånger per dag.
Låt tänder och saliv vila tre timmar mellan varje intag.
Vatten som dryck mellan måltider och på natten.
Syrliga sockerfria salivstimulerande tabletter och xylitolsötade tuggummin mellan måltiderna.
Fluorid och tandrengöring
Tandborstning med 1 450 ppm fluoridtandkräm morgon och kväll enligt 3 x 2-metoden som avslutas med sköljning med 0,2% NaF-lösning.
Approximal rengöring innan tandborstning på kvällen.
Ökat tillskott av fluorid
Borsta tänderna en extra gång med 1 450 ppm fluoridtandkräm.
Byt till högfluoridtandkräm Duraphat® 5 000 ppm fluorid eller Morningside® 5000 ppm fluorid och borsta som med en vanlig fluoridtandkräm 2-3 ggr/dag. Dra en dubbelsträng tandkräm för att få tillräckligt med tandkräm då öppningen på tuben är liten, ingår i högkostnadsskyddet.
Skölj fler gånger med 0,2% NaF-lösning.
Massera högfluoridtandkräm med finger utefter tandraderna.
Sug på Fludent fluoridsugtablett 0,25 mg fluorid 6st/dag mellan måltid för salivstimulering.
Tugga på Flux fluoridtuggummi 0,14 mg fluorid under 10 min efter måltid för salivstimulering.
Använd fluoridgel Top Dent® (4200 ppm F) i individuell skena 5 min varje kväll eller borsta som med en vanlig fluoridtandkräm 2-3 ggr/dag, ingår i högkostnadsskyddet.
Smörjande och fuktgivande vid mycket liten eller ingen kvarvarande saliv
Munspray eller munfuktgel salivstimulerande och smörjande med eller utan smak.
Fästtablett med xylitol i gommen under natten.
Rapsolja på muntork smörjande.
På tandklinik var sjätte eller var tredje månad
Uppföljning av egenvård och receptförnyelse.
Depuration och polering vid behov. Vid subgingival depuration bör immunosupprimerade patienter och patienter med ledproteser behandlas under antibiotikaparaply. Låt patienten få chans att vila munnen med jämna mellanrum vid käkledsbesvär och inskränkt gapförmåga.
Fluoridlackning med Duraphat® eller Bifluorid 10® enligt SoS Nationella Riktlinjer (48).
Fluorid – hörnstenen i kariesprevention
Fluoridtandkräm är basen och dess effekt är beroende av faktorer såsom frekvens av tillförsel, fluoridkoncentration, borsttid, mängd tandkräm, spridning av tandkräm, vattensköljning och beteende efter borstning (56, 57).
Den vedertagna 3 x 2-metoden bör användas för att uppnå full effekt av tandborstning med fluoridtandkräm (58). Tandkrämen ska från 6 års ålder innehålla 1 450 ppm fluorid, ha en mild smak, utan starkt slipmedel och ämnen med whiteningeffekt och utan skummedlet natriumlaurylsulfat för att inte irritera munslemhinnan (59). Lämpliga tandkrämer är Zendium sensitive och Proxident röd med mycket mild smak och Proxident gul och Salutem helt utan smak. Ur ergonomisk synpunkt är en tub med stor kork som lätt går att öppna och stänga att föredra och det ska vara lätt att trycka ut tandkrämen ur tuben.
För patienter med RA och SS räcker det inte att enbart tillföra fluorid via tandkrämen för att bevara god munhälsa. Ett viktigt tillägg är att skölja med 0,2 procent NaF-lösning (48, 60). Genom att direkt efter tandborstningen skölja med en 0,2 procent NaF-lösning utnyttjas fluoriders additiva effekt och fluoridkoncentrationen ökas avsevärt i munhålan (61). Patienter med nedsatt salivsekretion får fem gånger högre fluoridkoncentration i munhålan efter sköljning med 0,2 procent NaF jämfört med patienter med normal salivsekretion, och sköljtiden kan därför minskas till 30 sekunder (62). Lösningen bör vara neutral eller ha mycket mild smak för att inte irritera munslemhinnan. Dentan® mild 0,2 procent NaF-lösning finns i enlitersflaska och fås på recept för kariesbehandling och ingår i högkostnadsskyddet för läkemedel, och fluoridlösning på 500 ml kan köpas receptfritt på apotek, i dagligvaruhandeln eller på tandklinik. Lämpliga lösningar som är salivstimulerande och fuktgivande finns från Proxident och Actavis. Flaskan bör vara lätt att öppna och det ska vara lätt att trycka ut lagom mängd lösning.
Vid aktiv karies och vid muntorrhet bör mer fluorid tillföras och det är inte ”antingen eller” som gäller utan ”både och” för att under så stor del som möjligt av dygnets 24 timmar ha en hög fluoridkoncentration i munhålan. Produkter med bäst evidens är högfluoridtandkräm och fluoridgel (48, 63–65). Fluoridtabletter och fluoridtuggummi har betydligt lägre bevisvärde, men de är ändå av intresse för att upprätthålla en hög fluoridkoncentration i munhålan under dygnets alla timmar (48).
Enligt Socialstyrelsens nationella riktlinjer bör patienten fluoridlackas var sjätte, alternativt var tredje, månad på tandklinik med dokumenterad kraftig kariesreduktion (48, 66). En av förklaringarna till fluoridlackets goda effekt tros vara att kalciumfluorid, CaF2, bildas på tandytan då högkoncentrerade fluoridpreparat används och att det verkar som en pH-reglerande fluoridreservoar som frigör fluorid vid låga pH-värden (67, 68). Kalciumfluorid har uppmätts på tandytan veckor och månader efter en enda lackning och utgör ett viktigt komplement till dagliga mer lågkoncentrerade fluoridprodukter. Se faktaruta 4.
Fakta 5
Inhämta kunskap om patientens tandkräms- och tandborstteknik
Låt patienten stå vid handfatet med tandborste och tandkräm för att visa hur han/hon vanligtvis borstar sina tänder.
Registrera utan att kommentera.
Var observant på om patienten blöter tandborsten eller inte, vilken mängd tandkräm som används, om det finns någon systematik i borstningen, hur lång tid borstningen tar, om borstningen sker under rinnande vatten eller inte och om borstningen avslutas med att skölja med vatten eller inte.
Observera eventuella svårigheter som patienten har med greppförmågan mm.
-
Uppmuntra det som är bra och korrigera där så behövs.
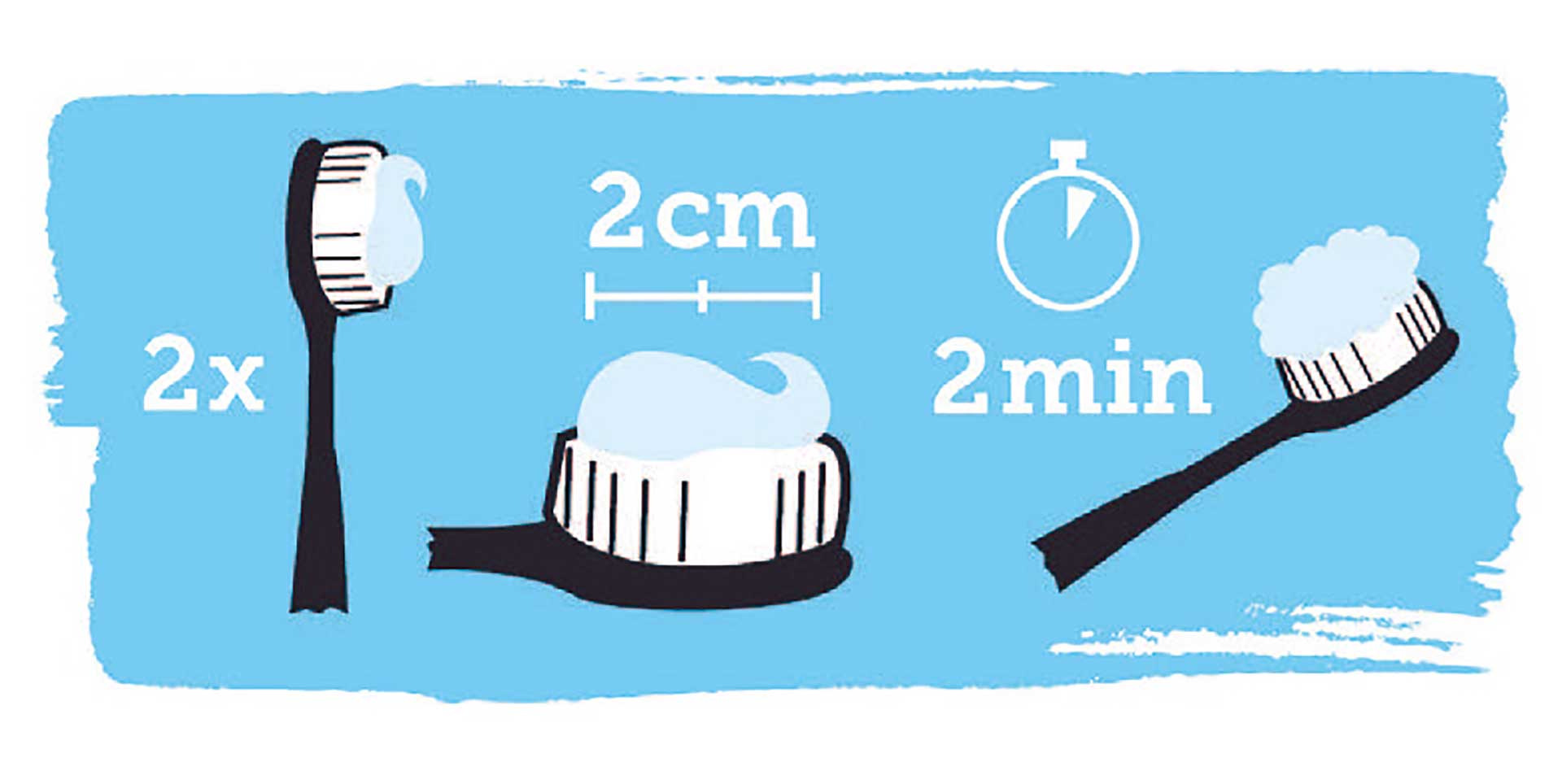
llustration: Proxident
Borsta tänderna med mild fluoridtandkräm minst 2 gånger per dag; på morgon efter frukost och det sista innan läggdags.
Använd minst 2 cm tandkräm utefter hela tandborstens längd och på eltandborste lägg på tandkräm 2 gånger och fördela tandkrämen runt i munnen med tungan.
Borsta i minst 2 minuter.
-
Borsta inte under rinnande vatten och avsluta med att skölja mycket sparsamt med vatten och därefter skölj med en 0,2 % NaF-lösning i 30 sekunder.

Foto: Ulla Moberg Sköld
Att lära ut rätt tandkrämsteknik och att skölja med fluoridlösning
Fluoridtandkräm används inte på ett optimalt sätt i befolkningen, man brister i hur ofta och hur länge man borstar tänderna, mängden tandkräm som läggs på borsten och hur man sköljer med vatten under och efter borstningen (69). Många patienter tror att det är tandborsten som är det viktigaste för att motverka karies, och inte fluoridtandkrämen (69). Det finns en stor förbättringspotential om tandvårdens personal lär ut såväl tandkrämsteknik som tandborstteknik och lär patienter med RA och SS att skölja med en fluoridlösning (70). Det är viktigt att först inhämta kunskap om hur patienten klarar av att borsta rätt med fluoridtandkräm, se faktaruta 5.
Salivstimulerande, fuktgivande och smörjande produkter
Sockerfria tabletter med vinsyra eller äppelsyra och tuggummi har en god salivstimulerande effekt och kan rekommenderas som ett alternativ till vanliga sockerinnehållande tabletter för patienter med muntorrhet (52). Munsprayer och munfuktmedel med eller utan smak återfuktar och smörjer munslemhinnan vid kraftigt reducerad salivkörtelvävnad eller vid helt avsaknad av sådan. Produkter finns av flera märken, såsom Proxident, Zendium, Actavis, GUM och Biotène. Det finns även en munfukttablett, XyliMelts, som fäster i gommen och under natten sakta avger xylitol. Se faktaruta 4.
Kunskap om produkter och hjälpmedel
Tandvårdspersonal bör ha kunskap om produkter och hjälpmedel utifrån individuella behov, och det är bra att på tandkliniken visa, låta patienten prova och om möjligt även köpa.
De produkter som används ska bygga på evidens och tandvårdspersonal bör säkerställa att de används på rätt sätt för att maximera nyttan. Om patienten har svårt att greppa saker, har inskränkt gapförmåga och felställningar i händer med smärta och stelhet är en elektrisk tandborste att föredra, då den medför mindre belastning på hand och fingrar och avlägsnar mer bakterier än en konventionell tandborste (71). Utprovning bör ske på kliniken och patienten instrueras för att undvika skador på gingivan. Om en konventionell tandborste används, finns förstorade grepp att trä på borstskaftet och det finns tandborstar som borstar flera tandytor samtidigt. Patienten bör även få ta del av hjälpmedel som underlättar approximal rengöring.
Olika hjälpmedel kan beställas från Mun-H-Center, www.mun-h-center.se. Se faktaruta 6.
Fördjupad läsning på Internetodontologi
På www.internetodontologi.se finns utförliga behandlingsråd i form av faktablad om
kariologisk riskbedömning
motiverande samtal
muntorrhet
kostanalys och kostrådgivning i kliniken
fluoridtandkräm
fluoridlösning
fluoridlackning.
Fakta 6
Hjälpmedel
Greppförstorare med dubbeltandborste.
Greppförstorare med plasttandsticka.
Greppförstorare med bygeltandtråd.
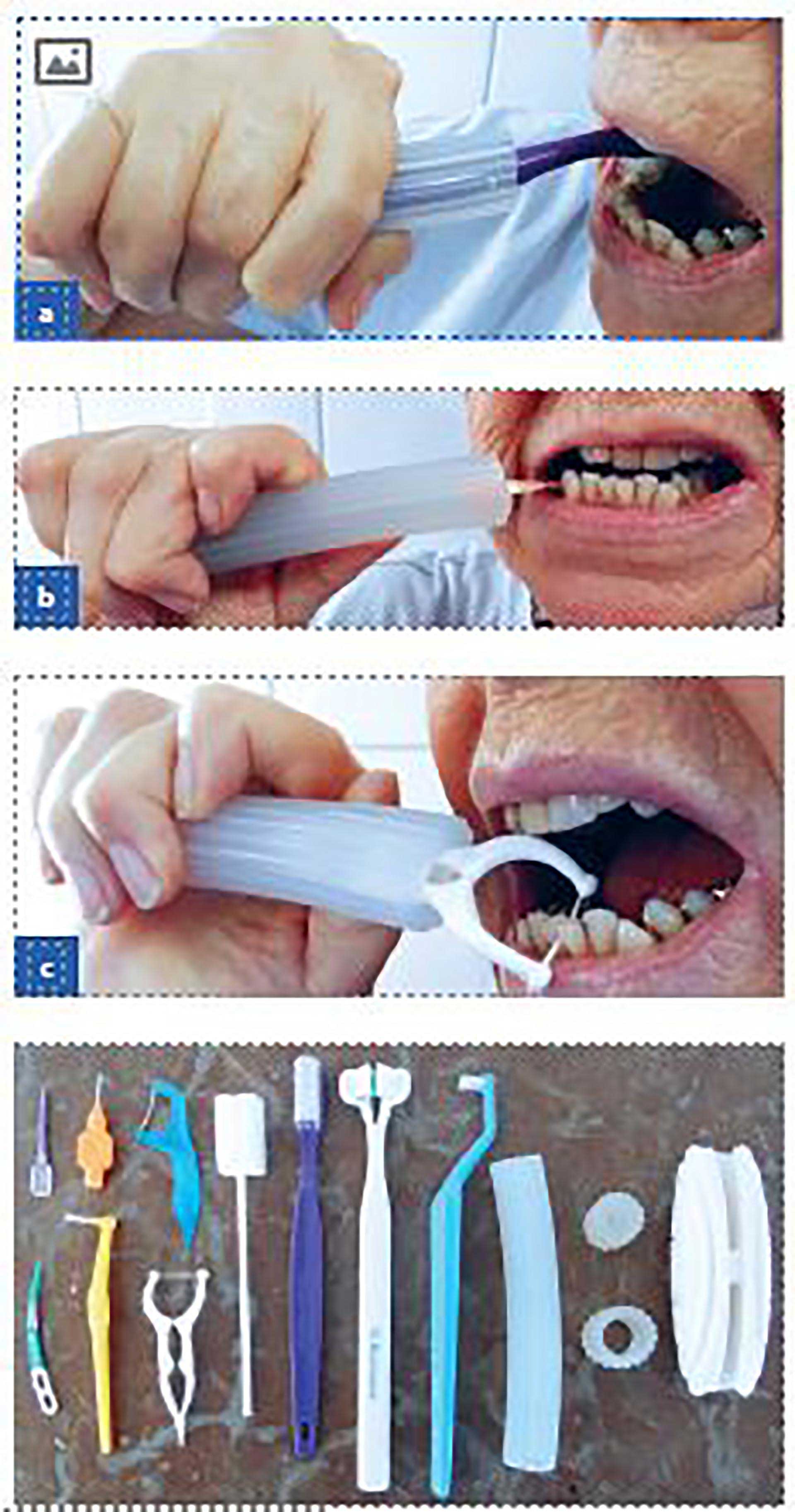
Samtliga foton Folktandvården Västra Götaland
Sammanfattning
De autoimmuna sjukdomarna reumatoid artrit (RA) och Sjögrens syndrom (SS) innebär negativ påverkan i munnen med muntorrhet och en ökad kariesrisk som följd för samtliga SS-patienter och även för många RA-patienter på grund av sekundärt Sjögren. Dessutom ger modern RA-medicinering immunosuppression med ökad infektionsrisk, och kombinerat med smärta och nedsatt funktion i händer och fingrar medför det en ökad kariesrisk.
Vetenskapliga studier visar att patienter med RA och SS har mer karierade och extraherade tänder, sällan kontinuerlig tandvårdskontakt och höga tandvårdskostnader. Det är därför av yttersta vikt att reumatologläkare tidigt i patientens diagnos remitterar patienten till sin ordinarie tandvårdsklinik eller till en specialistklinik för oral medicin för att patienten ska behålla god munhälsa.
Tandvårdens uppgift är att göra en noggrann kariesriskbedömning med betoning på självupplevd muntorrhet, xerostomi, och en objektiv bedömning av hyposalivation via klinisk inspektion och salivprovtagning, där vilosaliv är av största intresse. Kariespreventionen utgår från resultatet av kariesriskbedömningen med tonvikt på god egenvård med fluorid, kost och munhygien och regelbundna besök hos tandvården.
Fluoridtandkräm och fluoridlösning är det viktiga dagliga fluoridskyddet som kompletteras med övriga fluoridprodukter som högfluoridtandkräm, fluoridgel, fluoridtabletter och fluoridtuggummi. För munhygien finns olika hjälpmedel som underlättar tandrengöringen vid nedsatt handfunktion. Salivstimulerande och fuktgivande produkter som finns i ett rikligt sortiment är viktiga komplement till konventionell kariesprevention vid kraftigt förminskad, eller vid avsaknad av, salivkörtelvävnad.
Patienten bör kallas till tandvården var sjätte, alternativt var tredje, månad för kontroll av egenvård och för fluoridlackning.
Omnämnande
Tack till Folktandvården Västra Götaland, sjukhusfotograf Ari Laine, Helsingfors, Finland, och tandläkare Håkan Flink, Folktandvården Sala, för värdefullt bidrag av bilder.
Referenser
Mikuls TR. Help stop tooth decay and prevent RA? J Rheumatol. 2010;37(6):1083-5.
Heyden G. The oral mucosa – a reflection of health. Tandläkartidningen. 1982;74(21):1187, 1189-91.
Bolstad AI, Havemose Poulsen A, Yucel-Lindberg T, Klinge B, Holmstrup P. Kopplingen mellan parodontit och reumatoid artrit. Tandläkartidningen. 2020;1:62-8.
Kassebaum NJ, Bernabé E, Dahiya M, Bhandari B, Murray CJ, Marcenes W. Global burden of untreated caries: a systematic review and metaregression. J Dent Res. 2015;94(5):650-8.
Petersen PE. World Health Organization global policy for improvement of oral health: World Health Assembly 2007. Int Dent J. 2008;58(3):115-21.
SBU. Tandförluster. En systematisk litteraturöversikt. Stockholm: Statens beredning för medicinsk utvärdering (SBU); 2010. SBU-rapport nr 204. ISBN 978-91-85413-40-9.
Bäckman K, Jonsson R. Orala manifestationer vid Sjögrens syndrom – klinik, diagnostik och behandling. Tandläkartidningen. 1988;80(17):896-902.
Fox PC, Brennan M, Pillemer S, Radfar L, Yamano S, Baum BJ. Sjögren´s syndrome: a model for dental care in the 21st century. J Amer Dent Assoc. 1998;129(6):720-8.
López-Pintor RM, Fernandez Castro M, Hernández G. Oral involvement in patients with primary Sjögren’s syndrome. Multidisciplinary care by dentists and rheumatologists. Reumatol Clin. 2015;11(6):387-94.
Gjertsson I. Reumatoid artrit (RA) Internetmedicin.se 2020.
Deane KD, Demoruelle MK, Kelmenson LB, Kuhn KA, Norris JM, Holers VM. Genetic and environmental risk factors for rheumatoid arthritis.Best Pract Res Clin Rheumatol 2017;31(1):3-18. doi: 10.1016/j.berh.2017.08.003.
https://www.internetmedicin.se/behandlingsoversikter/reumatologi/reumatoid-artrit-ra/
Miyabe Y, Lian J, Miyabe C, Luster AD. Chemokines in rheumatic diseases: pathogenic role and therapeutic implications. Rev Rheumatol. 2019;15(12):731-46.
Martinez-Martinez RE, Domínguez-Pérez RA, Sancho-Mata J, Abud-Mendoza C, Ayala-Herrera JL, Popoca-Hernandez EA. The frequency and severity of dental caries, and counts of cariogenic bacteria in rheumatoid arthritis patients. Dent Med Probl. 2019;56(2):137-42.
Manzano BR, da Silva Santos PS, Bariquelo MH, Merlini NRG, Honório HM, Rubira CMF. A case-control study of oral diseases and quality of life in individuals with rheumatoid arthritis and systemic lupus erythematosus. Clin Oral. Investig 2020 Aug 15. doi: 10.1007/s00784-020-03518-8. On line ahead of print.
Äyräväinen L, Heikkinen AM, Kuuliala A, Ahola K, Koivuniemi R, Peltola J, Suomalainen A, Moilanen E, Hämäläinen M, Laasonen L, Meurman JH, Leirisalo-Repo M. Activity of rheumatoid arthritis correlates with oral inflammatory burden. Rheumatol Int. 2018;38(9):1661-9.
Silvestre-Rangil J, Bagán L, Silvestre FJ, Bagán JV. Oral manifestations of rheumatoid arthritis. A cross-sectional study of 73 patients. Clin Oral Investig. 2016;20(9):2575-80.
Helenius LM, Meurman JH, Helenius I, Kari K, Hietanen J, Suuronen R, Hallikainen D, Kautiainen H, Leirisalo-Repo M, Lindqvist C. Oral and salivary parameters in patients with rheumatic diseases. Acta Odontol Scand. 2005;63(5):284-93.
Welbury RR, Thomason JM, Fitzgerald JL, Steen IN, Marshall NJ, Foster HE. Increased prevalence of dental caries and poor oral hygiene in juvenile idiopathic arthritis. Rheumatology. 2003;42(12):1445-51.
Pokrajac-Zirojevic V, Slack-Smith LM, Booth D. Arthritis and use of dental services: A population based study. Austr Dent J. 2002;47(3):208-13.
Brito-Zerón P, Baldini C, Bootsma H, Bowman SJ, Jonsson R, Mariette X, Sivils K, Theander E, Tzioufas A, Ramos-Casals M. Sjögren syndrome. Rev Dis Primers. 2016 Jul 7;2:16047.
Jonsson R, Theander E, Sjöström B, Brokstad K, Henriksson G. Autoantibodies present before symptom onset in primary Sjögren syndrome. JAMA. 2013;310(17):1854-5.
Reksten TR, Jonsson MV, Marthinussen MC. Treatment strategies for xerostomia. Nor Tannlegeforen Tid. 2013;123(7):476-81.
Ramos-Casals M, Brito-Zerón P, Bombardieri S, Bootsma H, De Vita S, Dörner T et al. EULAR recommendations for the management of Sjögren’s syndrome with topical and systematic therapies. Ann Rheum Dis. 2020;79(1):3-18.
Shiboski CH, Shiboski SC, Seror R, Criswell LA, Labetouelle M, Lietman TL et al. 2016 American college of rheumatology/european league against rheumatism classification criteria for primary Sjögren’s syndrome: A consensus and data-driven methodology involving three international patient cohorts. Arthritis Rheumatol. 2017;69(1):35-45.
Fisher BA, Jonsson R, Daniels T, Bombardieri M, Brown RM, Morgan P et al. Standardisation of labial salivary gland histopathology in clinical trials in primary Sjögren’s syndrome. Ann Rheum Dis. 2017;76(7):1161-8.
Jonsson R, Brokstad KA, Jonsson MV, Delaleu N, Skarstein K. Current concepts on Sjögren’s syndrome – classification criteria and biomarkers. Eur J Oral Sci. 2018;126 Suppl 1:37-48.
Bolstad AI, Skarstein K. Epidemiology of Sjögren’s Syndrome - from an oral perspective. Curr Oral Health Rep. 2016;3(4):328-36.
Christensen LB, Petersen PE, Thorn JJ, Schiødt M. Dental caries and dental health behavior of patients with primary Sjögren syndrome. Acta Odontol Scand. 2001;59(3):116–20.
Pedersen AML, Bardow A, Nauntofte B. Salivary changes and dental caries as potential oral markers of autoimmune salivary gland dysfunction in primary Sjögren’s syndrome. BMC Clin Pathol. 2005;5(1):4. doi: 110.1186/1472-6890-5-4.
Newbrun E. Current treatment modalities of oral problems of patients with Sjögren’s syndrome: caries prevention. Adv Dent Res. 1996;10(1):29–34.
Berman N , Vivino F, Baker J, Dunham J, Pinto A. Risk factors for caries development in primary Sjögren syndrome. Oral Surg Oral Med Oral Pathol Oral Radiol. 2019;128(2):117-22.
Fox PC, Bowman SJ, Segal B, Fox PC, Bowman SJ, Segal B, Vivino FB, Marukutla N, Choueiri K et al. Oral involvement in primary Sjögren’s syndrome. J Am Dent Assoc. 2008;139(12):1592–601.
Mejàre I, Axelsson S, Dahlén G, Espelid I, Norlund A, Tranæus S, Twetman S. Caries risk assessment. A systematic review. Acta Odontol Scand. 2014;72(2):81-91.
Bratthall D, Hänsel Petersson G. Cariogram--a multifactorial risk assessment model for a multifactorial disease. Community Dent Oral Epidemiol. 2005;33(4):256-64.
Bratthall D. Dental caries: intervened--interrupted--interpreted. Concluding remarks and cariography. Eur J Oral Sci. 1996;104(2):486-91.
Dawes C. Salivary flow patterns and the health of hard and soft oral tissues. J Am Dent Assoc. 2008;139(suppl):18-24.
Bardow A, Vissink A. Saliva and caries development. In: Dental caries. The disease and its clinical management. Third edition. Edited by Fejerskov O, Nyvad B & Kidd E. Blackwell Munsgaard. Oxford, United Kingdom. 2015, pp 83-106.
Nederfors T, Holmström G, Paulsson G, Sahlberg D. The relation between xerostomia and hyposalivation in subjects with rheumatoid arthritis or fibromyalgia. Swed Dent J. 2002;26(1):1-7.
Almståhl A, Kroneld U, Tarkowski A, Wikström M. Oral microbial flora in Sjögren’s syndrome. J Rheumatol. 1999;26(1):110-4.
Eliasson L, Carlén A, Almståhl A, Wikström M, Lingström P. Dental plaque pH and micro-organisms during hyposalivation. J Dent Res. 2006;85:334-8.
Villa A, Connell CL, Abati S. Diagnosis and management of xerostomia and hyposalivation. Ther Clin Risk Manag. 2014;11:45-51.
Fox PC, Busch KA, Baum BJ. Subjective reports of xerostomia and objective measures of salivary gland performance. J Am Dent Assoc. 1987;115(4):581-4.
Jager DHJ, Bots CP, Forouzanfar T, Brand HS. Clinical oral dryness score: evaluation of a new screening method for oral dryness. Odontology. 2018;106(4):439-44.
Jorkjend L, Johansson A, Johansson AK, Bergenholtz A. Resting and stimulated whole salivary flow rates in Sjögren’s syndrome patients over time: a diagnostic aid for subsidized dental care? Acta Odontol Scand. 2004;62(5):264-8.
Jonsson MV, Reksten TR, Delaleu N, Marthinussen MC. Diagnostikk av munntørrhet og bruk av saliva som diagnostisk verktøy. Nor Tannlegeforen Tid. 2011;121(14):908-13.
Holm Ivarsson B, Sjögren K. MI – motiverande samtal. Praktisk handbok för tandvården. Gothia Förlag, Stockholm, 2010.
Socialstyrelsen. Nationella riktlinjer för vuxentandvård 2011. ISBN 978-91-86885-09-0. Artikelnr 2011-5-1.
Nordiska näringsrekommendationer 2012: Rekommendationer om näring och fysisk aktivitet. https://www.livsmedelsverket.se/globalassets/publikationsdatabas/broschyrer/nordiska-naringsrekommendationer-2012-svenska.pdf Svensk översättning av NNR 2012, kap-1-3. Sundin, A. (2013).
Dahlén G, Carlén A, Leonhardt Å. Riskbedömning av karies och parodontit. Tandläkartidningen. 2008;12(12):68-70.
Lenander-Lumikari M, Loimaranta V. Saliva and dental caries. Adv Dent Res 2000;14:40-7.
Zero DT, Brennan MT, Daniels TE, Papas A, Stewart C, Pinto A, Al-Hashimi I et al. Clinical practice guidelines for oral management of Sjögren disease. Dental caries prevention. JADA Practice guidelines Sjögren disease 2016;147(4):295-305.
Hamilton IR. Biochemical effects of fluoride on oral bacteria. J Dent Res. 1990;69(Spec issue):660-7.
Fejerskov O. Changing paradigms in concepts of dental caries: Consequences for oral health care. Caries Res. 2004;38)3):182-91.
Marinho VCC. Evidence-based effectiveness of topical fluorides. Adv Dent Res. 2008;20(1):3-7.
Zero DT, Creeth JE, Bosma ML, Butler A, Guibert RG, Karwal R, Lynch RJM et al. The effect of brushing time and dentifrice quantity on fluoride delivery in vivo and enamel surface microhardness in situ. Caries Res. 2010;44(2):90-100.
Kumar S, Tadakamadla J, Johnson NW. Effect of toothbrushing frequency on incidence and increment of dental caries: a systematic review and meta-analysis. J Dent Res. 2016;95(11):1230-6.
Sjögren K. Toothpaste technique. Studies on fluoride delivery and caries prevention. Swed Dent J. Supplement 1995;110:1-44.
Walsh T, Worthington HV, Glenny AM, Appelbe P, Marinho VC, Shi X. Fluoride toothpastes of different concentrations for preventing dental caries in children and adolescents. Cochrane Database Syst Rev. 2010;(1):CD007868.
Marinho VCC, Chong LY, Worthington HV, Walsh T. Fluoride mouthrinses for preventing dental caries in children and adolescents. Cochrane Database of Systematic Reviews 2016, Issue 7. Art. No.: CD002284.
Mystikos C, Yoshino T, Ramberg P, Birkhed D. Effect of post-brushing mouthrinse solutions on salivary fluoride retention. Swed Dent J. 2011;35(1):17-24.
Gabre P, Moberg Sköld U, Birkhed D. Simplified methods of topical fluoride administration: effects in individuals with hyposalivation. Spec Care Dentist. 2013;33(3):111-7.
Nordstöm A, Birkhed D. Preventing effect of high-fluoride dentifrice (5,000 ppm) in caries-active adolescents: a 2-year clinical trial. Caries Res. 2010;44:323-31.
Nordstöm A, Birkhed D. Effect of a third application of toothpaste (1,450 and 5,000 ppm F), including a ”massage” method, on fluoride relation and pH drop in plaque. Acta Odontol Scand. 2013;71(1):50-6.
Marinho VC, Worthington HV, Walsh T, Chong LY. Fluoride gels for preventing dental caries in children and adolescents. Cochrane Database Syst Rev. 2015 jun 15;2015(6):CD002280.
Marinho VCC, Worthington JPT, Walsh T, Clarksson JE. Fluoride varnishes for preventing dental caries in children and adolescents. Cochrane Database of Systematic Reviews 2013, Issue 7. Art.No.: CD002279.
ten Cate JM. Review on fluoride, with special emphasis on calcium fluoride mechanisms in caries prevention. Eur J Oral Sci. 1997;105(2):461-5.
Øgaard B. CaF2 formation: cariostatic properties and factors of enhancing the effect. Caries Res. 2001;35(Suppl 1):40-4.
Jensen O, Gabre P, Sköld UM, Birkhed D. Is the use of fluoride optimal? Knowledge, attitudes and behaviour concerning fluoride toothpaste and toothbrushing in different age groups in Sweden. Community Dent Oral Epidemiol. 2012;40(2):175-84.
Jensen O, Moberg Sköld U, Birkhed D, Gabre P. Self-reported changes in using fluoride toothpaste among older adults in Sweden: An intervention study. Acta Odontol Scand. 2015;73(1):48-56.
Adam R, Erb J, Grender J. Randomized controlled trial assessing plaque removal of an oscillating-rotating electric toothbrush with micro-vibrations. Int Dent J. 2020;70(Suppl 1):22-7.
English summary
Sköld UM, Meurman J, Jonsson R, Birkhed D.
Rheumatoid arthritis, Sjögrens syndrome and dental caries
Nor Tannlegeforen Tid. 2021; 131: 1120-30.
The autoimmune diseases rheumatoid arthritis (RA) and Sjögren’s syndrome (SS) have a negative effect on the mouth with hyposalivation and an increased risk of caries as a result for all SS patients and also for many RA patients due to secondary SS. In addition, modern RA medication causes immunosuppression with increased risk of infection, and combined with pain and impaired function in the hands and fingers, it entails an increased risk of caries.
Scientific studies show that patients with RA and SS have more carious and extracted teeth, often not regular dental appointments and high dental costs. It is therefore of the utmost importance that the rheumatologist early in the patient’s diagnosis refers the patient to his/her regular dental clinic or to a Specialist Clinic in Oral Medicine in order for the patient to maintain good oral health.
The task of dental care is to make an accurate caries risk assessment with emphasis on self-perceived dry mouth xerostomia and an objective assessment of hyposalivation through clinical inspection and saliva sampling where the volume of resting saliva is of greatest interest. Caries prevention is based on the results of the caries risk assessment, with emphasis on good self-care with fluoride, diet and oral hygiene and regular visits to dental care. Fluoride toothpaste and fluoride solution are the important daily fluoride protection that should be supplemented with other fluoride products, such as high fluoride toothpaste, fluoride gel, fluoride tablets and fluoride chewing gum.
For oral hygiene, there are various aids that facilitate tooth cleaning in case of impaired hand function. Saliva-stimulating and moisturizing products available in a wide range are important complements to conventional caries prevention when there is a marked reduction or lack of salivary gland tissue.
The patient should be called to the dental care every 6 or alternatively every 3 months for control of self-care and for fluoride varnish application.
Artikkelen er tidligere trykket i Tandläkartidningen nr. 6, 2021.
Korresponderende forfatter: Ulla Moberg Sköld. E-post: ulla.mobergskold@gmail.com
Akseptert for publisering i Tandläkartidningen 18. januar 2021. Tandläkartidningen 2021; 113 (6): 58–67
Artikkelen er fagfellevurdert.Sköld UM, Meurman J, Jonsson R, Birkhed D. Reumatoid artrit och Sjögrens syndrom. Så kan patienterna minska risken för karies. Nor Tannlegeforen Tid. 2021; 131: 1120-30.
Norsk MeSH: Sjögrens syndrom; Revmatoid artritt; Kariesrisiko; Munntørrhet; Munnhygiene
