Evaluering av spyttkjertelbiopsier ved utredning av Sjögrens syndrom
Hovedbudskap
I tidsrommet 2011 til 2018 ble 166 pasienter henvist for å ta spyttkjertelbiopsi ved Det odontologiske fakultet i Oslo.
Blant disse kunne 64 (39 %) klassifiseres som å ha primært Sjögrens syndrom (pSS), og av dem hadde 39 (61%) positiv spyttkjertelbiopsi.
De øvrige pasientene (61 %) oppfylte ikke eksisterende kriterier for pSS og ble klassifisert som non-SS. Selv om non-SS gruppen ikke oppfyller kriterier for pSS, har pasientene likevel stor symptombyrde.
Både pasienter med pSS og non-SS har uttalte plager med tørr munn og tørre øyne, og derfor stort behov for regelmessig oppfølging hos tannhelsepersonell og oftalmolog.
I perioden juni 2011 til desember 2018 ble det henvist 166 pasienter med symptomer på tørr munn og tørre øyne til Det odontologiske fakultet i Oslo for spyttkjertelbiopsi i forbindelse med utredning av primært Sjögrens syndrom (pSS). Formålet med studien var å undersøke forekomsten av positive spyttkjertelbiopsier hos denne pasientgruppen og samtidig se på aldersfordelingen i utvalget. Kun 7 % av pasientene var menn. Flest kvinner ble henvist i aldersgruppen 50–59 år og totalt var det flest positive biopsier i denne gruppen. Forekomsten av pSS var 39 % i gruppen som helhet. Blant pSS pasientene, hadde 61 % positiv spyttkjertel biopsi. Det var langt flere pasienter som hadde positiv spyttkjertelbiopsi blant dem som hadde fått påvist anti-SSA autoantistoffer i serum (55 %) sammenliknet med de seronegative der kun 8 % hadde positiv spyttkjertelbiopsi. Funn i spyttkjertelvevet kan gi indikasjoner om hvordan pasienten bør følges opp. Spyttkjertelbiopsien vil fremdeles være et viktig verktøy i utredning av pSS i påvente av bedre helst ikke-invasive tester.
Primært Sjögrens syndrom (pSS) er en autoimmun sykdom hvor infiltrasjon av kroniske betennelsesceller fører til ødeleggelse av eksokrine kjertler, hovedsakelig spyttkjertler og tårekjertler (1, 2). Dette medfører tørrhetssymptomer fra munn og øyne (sicca symptomer) (3). I likhet med flere andre autoimmune sykdommer er årsaken til pSS ukjent, men det ansees at genetikk og hormonell påvirkning samt ytre miljøfaktorer er av betydning (4).
Det finnes foreløpig ingen kurativ behandling av pSS. Behandlingen av de orale symptomene har derfor fokus på å forebygge skadevirkninger og lindre symptom (3). Munntørrhet er assosiert med karies og andre orale infeksjoner. Pasienter med tørr munn kan ha vanskeligheter med artikulasjon, å tygge og svelge mat, i tillegg til smaksforstyrrelser og utfordringer ved bruk av proteser (5). Pasientene rapporterer redusert livskvalitet knyttet til problemer med å spise og snakke (6).
American European Consensus Group (AECG) definerte i 2002 klassifikasjonskriteriene (7) for gruppeinndelingen av pasienter med pSS til bruk i forskning. De består av seks kriterier hvorav to dekker subjektive tegn på tørrhet i munn og øyne, og fire omfatter objektive mål på: 1) nedsatt sekresjon av spytt 2) nedsatt sekresjon av tårer 3) autoantistoff i serum (anti-Ro/SSA (Ro60 og Ro52) og anti-La/SSB (La48)) og 4) histopatologisk evaluering av små spyttkjertler fra underleppen. Det kreves at enten tre objektive kriterier er oppfylt, eller minst fire av seks kriterier hvorav enten serologi eller biopsi må være positiv for at pasienten skal kunne klassifiseres som pSS. Klassifikasjonskriteriene for inkludering i forskning benyttes ofte også innen diagnostikk da det ikke finnes noen gode diagnostiske kriterier. I det følgende omtales derfor tilstrekkelige oppfylte kriterier som at pasienten fikk diagnosen. Vi har benyttet AECG-kriteriene i vår studie, både fordi de var gjeldende da studien startet, og fordi de fortsatt brukes og dermed underletter sammenligning av studier. American college of rheumatology og European league against rheumatism (ACR/EULAR) kriteriene ble presentert i 2016 (8). ACR/EULAR) kriteriene er ganske like AECG-kriteriene, men inkluderer ikke subjektive symptomer for verken munn eller øyne. Det benyttes «ocular staining», i tillegg til Schirmers test. Ocular staining er en test som avdekker skade på øyets overflate og som utføres av øyeleger. Testen er foreløpig ikke tatt i bruk ved diagnostisk utredning for Sjögrens syndrom i Norge. Ettersom ingen av pasientene i vårt materiale har fått utført denne testen, har vi ikke benyttet disse kriteriene.
De fleste pasienter som plages av munntørrhet og tørre øyne, oppfyller ikke kriteriene for å klassifiseres som pSS, og kalles non-SS. Non-SS pasienter angir like uttalte subjektive plager med munntørrhet og tørre øyne, og har ofte nedsatt tåre- og salivasekresjon (5). Histopatologiske undersøkelser viser at få pasienter i non-SS gruppen har normalt spyttkjertelvev. I vevet sees både kronisk betennelse, atrofi av spyttkjertelendestykker samt fettinfiltrasjon (9). Vi har tidligere vist at disse pasientene hadde mer uttalte symptomer på tørrhet fra munn og øyne enn pasienter med pSS til tross for mindre uttalte objektive funn (5). Det kan være en ekstra byrde for disse pasientene at de ikke får noen diagnose etter en såpass omfattende utredning. Per i dag er det stort behov for en «gullstandard» for diagnostikk og klassifisering av pSS. Spyttkjertelbiopsi fra underleppen er det nærmeste man kommer (7, 10).
Fokale lymfocytære infiltrater i spyttkjertlene er karakteristiske histopatologiske kjennetegn ved pSS. Studier viser at hos 20–25 % av pasientene dannes det ektopiske germinalsentre (GC) i de affiserte spyttkjertlene, liknende det man ser i sekundært lymfatisk vev (11–13). Funn av GC sees oftere hos pasienter med høy FS og høyt autoantistofftiter (SSA og SSB) (14). Ved påvist GC har pSS pasienter 6 ganger økt risiko for å utvikle lymfom (13). Funn av GC i spyttkjertelbiopsi hos pSS pasienter kan derfor være en indikator for senere malignitetsutvikling (12).
Betydningen av spyttkjertelbiopsi kan være undervurdert med tanke på sykdoms- og eventuell lymfomutvikling. Pasienter under utredning for pSS har gjennom mange år blitt henvist for å ta spyttkjertelbiopsi ved Avdeling for oral kirurgi og oral medisin, Det odontologiske fakultet ved Universitetet i Oslo. Noen av disse oppfylte ved henvisningstidspunkt tilstrekkelig antall av AECG kriteriene til å klassifiseres som pSS, mens andre var avhengige av en positiv spyttkjertelbiopsi for å få diagnosen. Formålet med studien var å undersøke forekomsten av positive spyttkjertelbiopsier ved utredning av pSS, og samtidig se på aldersfordelingen i utvalget. En gjennomgang av vårt materiale belyser hensikten ved å ta biopsi også ved etablert diagnose der pasienten hadde fått påvist autoantistoff og for øvrig oppfylte tilstrekkelig antall kriterier for klassifisering som pSS også uten eventuell positiv spyttkjertelbiopsi.
Pasienter og metode
Studiepopulasjon
Pasienter henvist til Avdeling for oral kirurgi og oral medisin for å ta biopsi av spyttkjertler i underleppen som ledd i utredning av pSS i perioden 2011–2018 ble inkludert i studien. Pasientene var i hovedsak henvist fra revmatologer. Resultat fra kliniske undersøkelser (sialometri, Schirmers test og serologi) forelå fra henviser da pasienten møtte til preoperativ undersøkelse. For et fåtall av pasientene var sialometri nødvendig da resultat av dette ikke forelå fra henviser. Alle pasientene samtykket skriftlig til at data kunne brukes videre i forskning. Studien er godkjent av Regionale komiteer for medisinsk og helsefaglig forskningsetikk, region sør-øst (REK 2010/1292).
Kliniske undersøkelser
Spyttsekresjonen ble vurdert ved standardisert prøve av ustimulert helsaliva (UWS) i 15 minutter. Grensen for patologisk sekresjon av hvilesaliva er ≤1,5 ml per 15 minutter. Tåresekresjon ble vurdert gjennom en Schirmers test (Sch). En papirstrips legges inn under nedre øyelokk og etter fem minutter registreres fukting av stripsen i millimeter. Tåresekresjonen ansees patologisk om ≤5 mm per 5 minutter. Blodprøver inkluderte påvisning av SSA autoantistoff (positiv serologi, SSA+). Autoantistoff mot SSB ble ikke målt, men opptrer ofte sammen med funn av SSA.
Biopsi
Biopsi ble utført av én oralkirurg (JLJ), og ble tatt fra innsiden av pasientenes underleppe. Det ble lagt ett horisontalt overfladisk snitt på 10–15 mm i slimhinnen midtveis mellom overgangsfold og lepperødt litt til siden for midtlinjen. Mellom 5–10 spyttkjertler ble stumpt fridissekert og sendt i transportmedium (formalin) for histopatologisk undersøkelse ved Avdeling for Patologi, Haukeland universitetssykehus, Bergen. Dette er et vedvarende samarbeid mellom JLJ og KS.
Histopatologisk undersøkelse
Histopatologisk analyse av biopsiene ble utført av én oralpatolog (KS) for å gradere fokus score (FS). Et fokus defineres som en avgrenset tett ansamling av minst 50 lymfocytter som infiltrerer spyttkjertelvevet (figur 1A). FS defineres som antall foci per 4 mm2 kjertelvev. Biopsien anses som positiv ved FS ≥ 1.Ved evaluering av FS inkluderes ikke fettvev i måling av totalt kjertelareal. I enkelte biopsier kan forholdvis store områder av kjertelvevet være erstattet av fettvev slik Figur 1B viser. Utstrakte funn av atrofiske spyttkjertelendestykker, fibrose og fettinfiltrasjon ble rapportert. I dette materialet ble det også vektlagt påvisning av GC i spyttkjertelvevet.
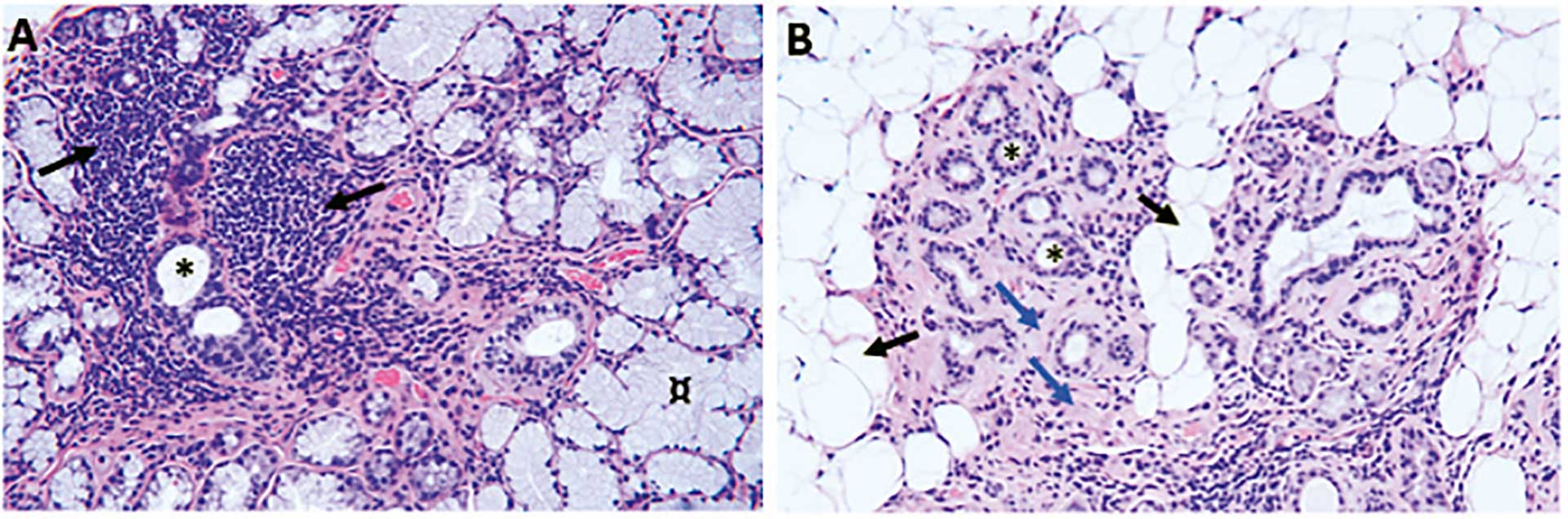
Figur 1. Histologiske vevssnitt fra spyttkjertelbiopsier tatt fra personer med mistanke om Sjögrens syndrom. A) Her sees to fokale infiltrater rundt utførselsganger (*) og med nærliggende normale acinære endestykker (¤). Hos denne pasienten ble FS=1, og dermed ble funn forenlige med pSS. B) I denne spyttkjertelen sees betydelig med fettinfiltrasjon (svarte piler) og tap av spyttkjertelendestykker (blå piler) med gjenværende utførselsganger (*). Fettvevet erstatter store deler av kjertelvevet, noe som gjør diagnostikken utfordrende ettersom representativt spyttkjertelvev reduseres. Hos denne pasienten ble FS< 1, og funn ble ikke tilstrekkelig for positiv spyttkjertelbiopsi med tanke på pSS.
Dataanalyse og presentasjon
Subjektive og objektive opplysninger relatert til munn- og øyetørrhet og spytt- og tåresekresjon, FS, tilstedeværelse av GC og serologiske verdier ble ført inn i en søkbar tabell i Excel (versjon 16.24). Deskriptiv statistikk ble benyttet for analyse og beskrivelse av data.
Pasientene ble delt inn i undergrupper avhengig av hvilke objektive kriterier de oppfylte:
Gruppe 1: positivt autoantistoff (SSA+), positiv biopsi (FS+)
Gruppe 2: negativt autoantistoff (SSA-), positiv biopsi (FS+)
Gruppe 3: positivt autoantistoff (SSA+), negativ biopsi (FS-)
Gruppe 4: negativt autoantistoff (SSA-), negativ biopsi (FS-)
Gruppene 1–3 klassifiseres som pasienter med pSS, mens gruppe 4 utgjør non-SS gruppen. Det er ett krav at gruppene 1–3 har enten 3 objektive tegn, eller totalt 4 eller flere tegn inklusive positiv biopsi og/eller positive autoantistoff.
Resultater
Utvalgets fordeling
Til sammen 166 individer ble inkludert i undersøkelsen (figur 2), og alle fikk utført spyttkjertelbiopsi, 155 kvinner (93 %) og 11 menn (7 %). Kvinnene var fra 23 til 84 år, med gjennomsnittlig alder 53,3 år. Mennene var fra 28 til 80 år, med gjennomsnittsalder 46,5 år.
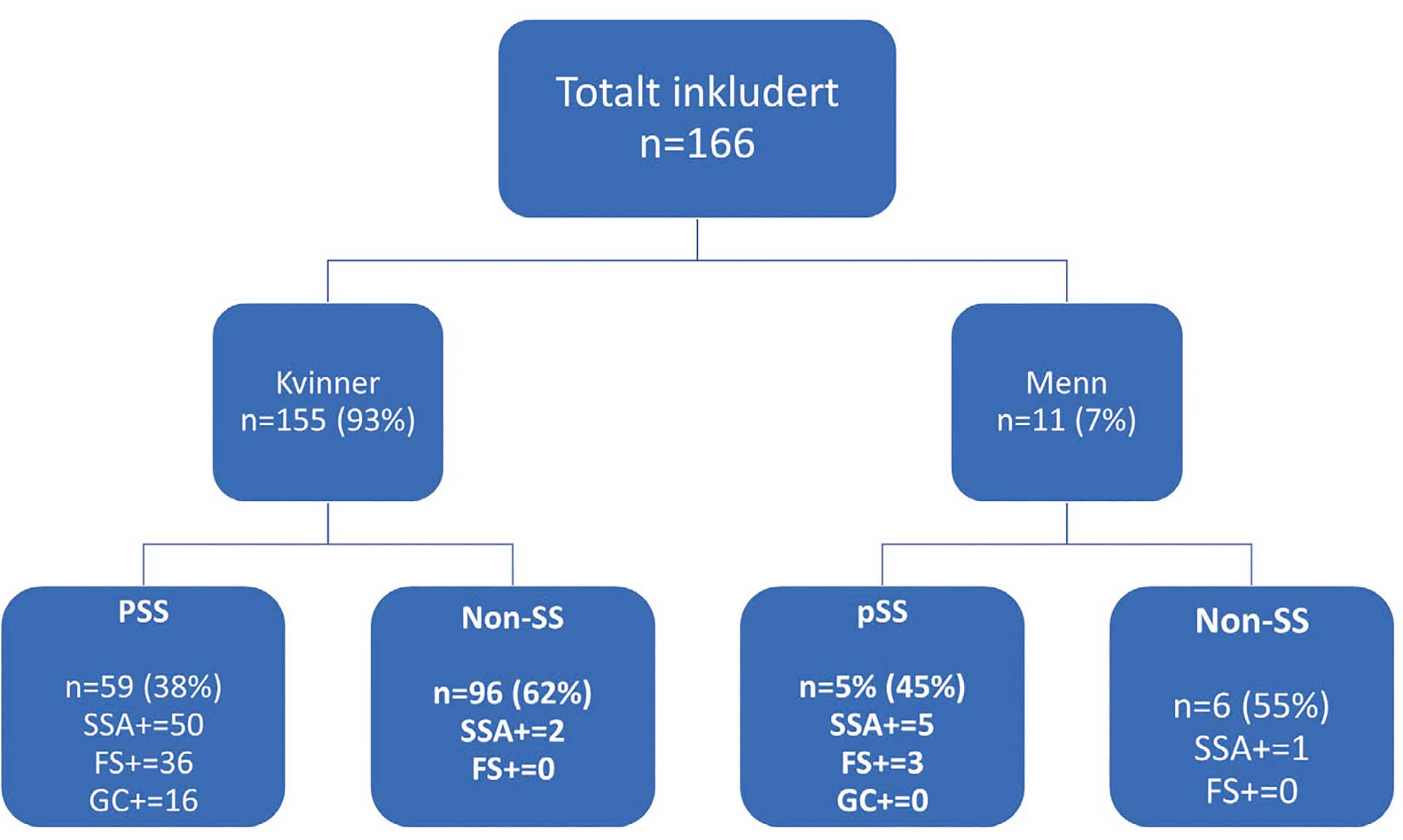
Figur 2. Utvalgets (n=166) kjønnsfordeling, og videre fordeling som pasient med primært Sjögrens syndrom (pSS) eller non-SS. Antall pasienter med positiv serologi (SSA+), og antall med positivt fokus score (FS+) samt påvisning av germinalsentre (GC+) i biopsien er oppgitt for hver undergruppe.
Pasientundergrupper: biopsi, serologi og germinalsenterdannelse
Pasientene ble delt inn i undergrupper 1–4 avhengig av hvilke objektive kriterier de oppfylte. Av de 166 biopsiene som inngikk i undersøkelsen var 39 positive (30 i gruppe 1 og 9 i gruppe 2).
Gruppe 1 omfattet 30 pasienter med positiv biopsi og positiv serologi. De utgjorde 46,8 % av alle pSS pasientene. Kvinnene utgjorde 90 % av denne gruppen. FS varierte mellom 1 og 12.
Gruppe 2 omfattet 9 kvinner med positiv biopsi og negativ serologi. De utgjorde 14,1 % av alle pSS pasientene. Ingen menn i utvalget hadde positiv biopsi uten samtidig positiv serologi. FS varierte mellom 1 og 2.
Gruppe 3 inkluderte 25 pasienter med positiv serologi, men med negativ biopsi. I denne gruppen var 92 % kvinner. Gruppen representerte 39,1 % av pSS pasientene.
Gruppe 4 var de resterende n=102 pasientene. Disse kunne ikke klassifiseres som pSS ettersom de ikke oppfylte tilstrekkelig antall kriterier. Denne non-SS gruppen utgjorde 61,4 % av utvalget, og bestod av 94,1 % kvinner.
Totalt kunne GC påvises hos 25 % av pSS-pasientene i dette utvalget; 43 % av pasientene i gruppe 1 var GC+ og 33 % av pasientene i gruppe 2 var GC+, samtlige 16 var kvinner. For de GC+ i gruppe 1 varierte FS mellom 1 og 12, med ett gjennomsnitt på 5,2. I gruppe 2 hadde alle de 3 GC+ pasientene FS=2. I GC+ biopsier samlet sett (uavhengig av om de var seropositive eller ikke) var gjennomsnittsverdi for FS 4,6, og enda noe høyere (FS=5,2) hos dem som også var seropositive (gruppe 1). Til sammenlikning var i gjennomsnitt FS=1,4 hos de seropositive pSS pasienter uten funn av GC.
En illustrasjon av prosentvis fordeling innen pSS gruppene (gruppe 1–3) er presentert i figur 3.
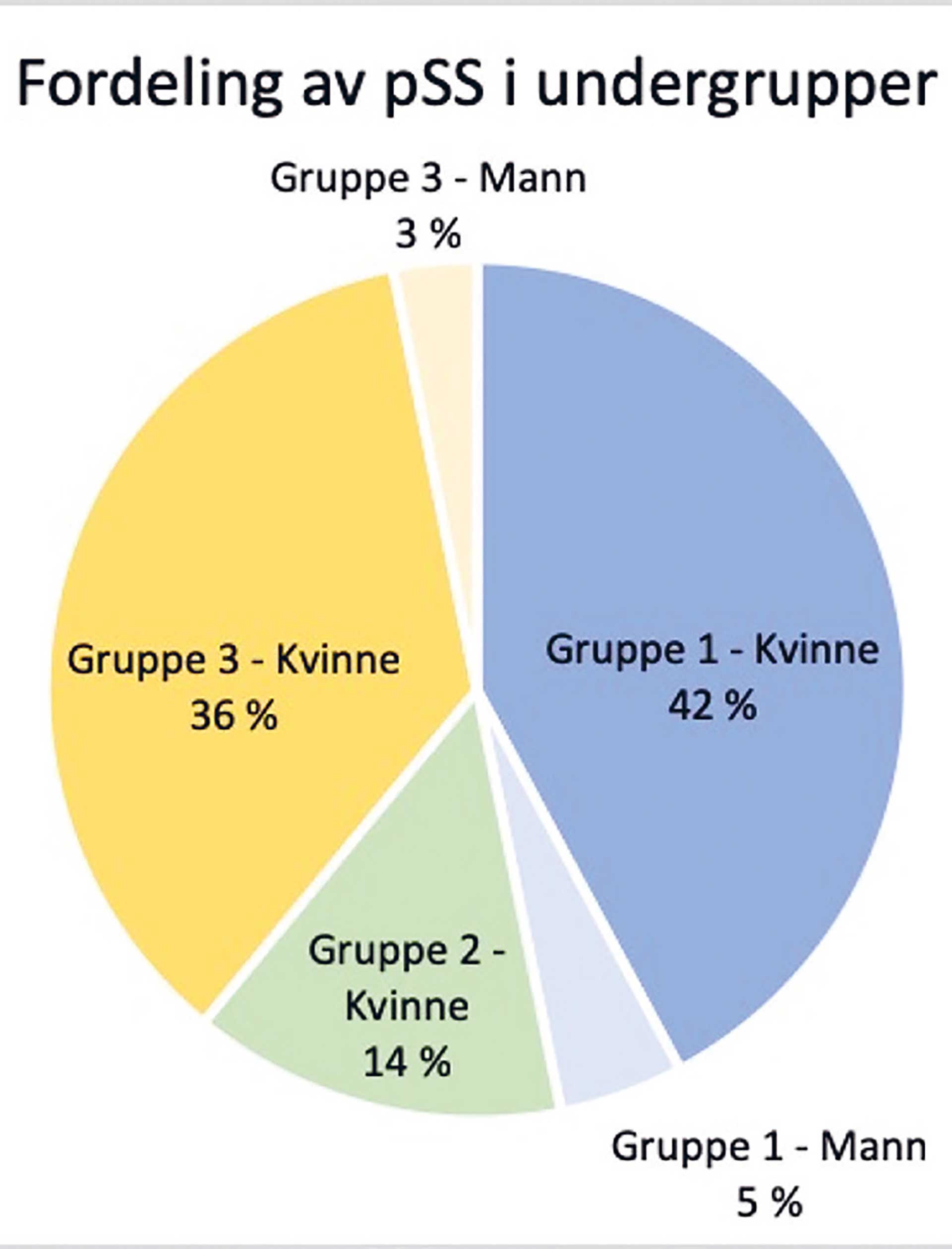
Figur 3. Prosentvis fordeling av pasienter med primært Sjögrens syndrom (pSS) i undergruppene 1-3. Andelen menn angitt i lysere valør.
Aldersspredningen i materialet
Flesteparten av de henviste pasientene var kvinner i aldersgruppen 50–59 år. For menn var det flest pasienter i gruppen 30–39 år (figur 4). Det bemerkes at det var få menn i utvalget, og de var i hovedsak yngre enn kvinnene. I gruppen pSS pasienter var kvinnene i alder fra 23 til 84 år, med gjennomsnittlig alder 52,3 år. Menn med pSS var fra 30 til 80 år, og hadde gjennomsnittlig alder 48,2 år. Relativt sett var det flest kvinner i alderen 20–29 år som hadde positiv biopsi (67 %), mens det i de andre aldersgruppene var 15–26 % med positiv biopsi. Blant mennene var det bare tre pasienter med positiv biopsi; to i alderen 30–39 år og en i alderen 70+ år.
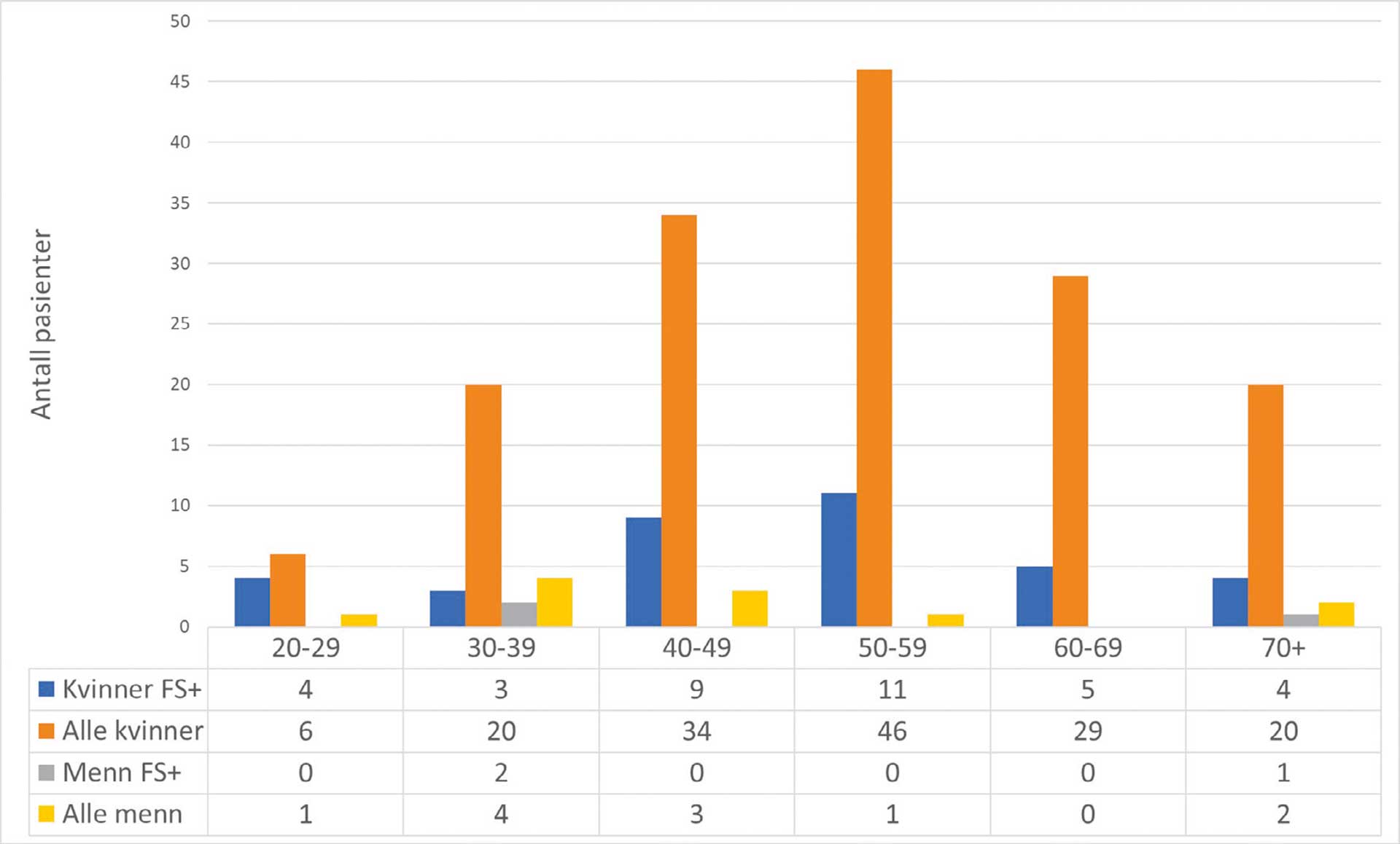
Figur 4. Aldersfordeling. De oransje søylene viser aldersfordeling over alle henviste kvinner, mens de blå søylene viser aldersfordelingen av kvinner med positivt fokus score (FS+) i spyttkjertelbiopsi. Tilsvarende verdier for menn er angitt med gul søyle for alle henviste menn, og grå søyle for menn med positivt fokus score.
Diskusjon
Studien beskriver biopsifunn hos pasienter henvist for utredning av pSS ved Det odontologiske fakultetet, Universitetet i Oslo. Pasientenes alder og kjønn ble også vurdert.
Av de 166 henviste pasientene hadde 39 pasienter positiv biopsi, det vil si fokus score ≥1. Blant disse ville 14 pasienter ikke blitt klassifisert som pSS uten spyttkjertelbiopsi. Det var langt flere seropositive (SSA+) enn seronegative (SSA-) pasienter som også hadde positiv biopsi. Flesteparten av de henviste pasientene hadde en negativ biopsi og endte opp i gruppen non-SS. Likevel må det understrekes at non-SS gruppen har uttalte plager med tørrhet og nedsatt generell og oral helserelatert livskvalitet og bør i større grad hjelpes av helsevesenet (15).
I vårt materiale ble det funnet 16 GC+ blant de totalt 39 pSS pasientene med positiv biopsi. Dette (41 %) er en god del høyere forekomst enn det litteraturen viser, blant annet fra en pSS cohort i Bergen der GC ble påvist hos 20–25 % av pSS pasienter (11, 14, 16, 17). Forskjellen kan forklares ved at pasientmaterialet vårt er forholdsvis lite og kan representere tilfeldig økt forekomst av GC. Et interessant funn var at 8 GC+ biopsier ble registrert blant de 19 seropositive pasientene som allerede hadde en pSS diagnose før biopsi. Dette understreker betydningen av biopsi også hos seropositive pasienter. Ettersom tilstedeværelse av GC har blitt forbundet med økt risiko for utvikling av lymfom, er dette noe som bør tas med ved vurdering av pasientens prognose og oppfølging. Litteraturen beskriver at sykdomsprofilen er annerledes hos pasienter med GC-liknende strukturer sammenliknet med pSS pasienter uten GC (11–14). Ifølge studier er tilstedeværelse av GC assosiert med høyere FS, økt mengde autoantistoff (12), proinflammatoriske cytokiner i serum og klinisk mer alvorlig sykdom (14). I vårt materiale fant vi generelt høyere FS i GC+ biopsier sammenliknet med GC- biopsier, noe som tilsvarer funn fra andre studier (14). Med mindre det foreligger mistanke om malignitet er det ikke vanlig å gjenta biopsi, og det er også etisk sett vanskelig å anbefale det. I vårt materiale anbefalte patolog ved ett tilfelle tett oppfølging samt ny biopsi etter 2 år på grunn av høy FS og GC+.
Det er få menn i utvalget, noe som samsvarer med at 9 av 10 pasienter med pSS er kvinner. Mennene i vårt materiale fikk diagnosen i noe yngre alder enn kvinnene. Studier viser at menn oftere er seropositive og har et mer alvorlig sykdomsforløp enn kvinner. Interstitiell lungesykdom og lymfom er eksempler på manifestasjoner som oftere ble sett hos menn over tid i en studiepopulasjon på nærmere 1000 (18). Den største gruppen av kvinner i vårt materiale ble henvist i aldersgruppen 50–59 år. Absolutt sett hadde flere positiv biopsi i gruppen 50–59 år, mens relativt sett var det flest i gruppen 20–29 år. Dette stemmer ifølge litteraturen som beskriver at sykdommen oftest rammer postmenopausale kvinner.
De seronegative kvinnelige pasientene i utvalget fikk diagnosen cirka 5 år senere enn pasientene med positiv biopsi. Det er generelt en stor aldersspredning i utvalget. Høy alder kan gi naturlige degenerative forandringer i spyttkjertlene som atrofi og fettinfiltrasjon. Det har i studien ikke vært mulig å skille naturlige aldersforandringer og manifestasjoner av den autoimmune sykdomsprosessen. Vår forskning har vist at både fettinfiltrasjon og atrofi av spyttkjertelvev kan være utbredt også hos yngre pSS pasienter (19).
En styrke ved denne studien er at samme operatør har utført biopsiene (JLJ), og at vevsprøvene er analysert av én oralpatolog (KS). Histopatologisk evaluering av en spyttkjertelbiopsi kan variere fra patolog til patolog, og ved seleksjon av materiale til forskning er det en styrke at patologer enten er kalibrerte eller at det er samme patolog som analyserer hele materialet for å sikre konsistent evaluering. Pasientene var i hovedsak henvist fra revmatologer i Oslo-regionen. En styrke i dette er at pasientene var relativt likt utredet, men svakheten er at gruppen ikke nødvendigvis er representativ.
Konklusjon
Utredning og oppfølging av pasienter med Sjögrens syndrom illustrerer godt nødvendigheten av nært tverrfaglig samarbeid mellom ulike spesialiteter innen medisin og odontologi. En gjennomgang av vårt materiale i Oslo viser at de fleste pSS-pasientene var seropositive og kunne ha fått pSS diagnosen uten positiv spyttkjertelbiopsi. Imidlertid, vil spyttkjertelbiopsien si noe om grad av sykdom i målorganet hos pasienter som i utgangspunktet oppfylte tilstrekkelig antall kriterier. Spyttkjertelbiopsi er derfor et viktig verktøy innen forskning, diagnostikk og oppfølging av pSS pasienter.
Bidragsytere
TS: designet studien, analyserte data, skrev manuset; LA: designet studien og skrev manuset, KS: analyserte spyttkjertelbiopsiene og skrev manuset, JLJ: designet studien, utførte biopsitaking og skrev manuset.
Referanser
Jonsson R, Bolstad AI, Brokstad KA, Brun JG. Sjogren’s syndrome--a plethora of clinical and immunological phenotypes with a complex genetic background. Ann N Y Acad Sci. 2007; 1108:433-47.
Jonsson R, Vogelsang P, Volchenkov R, Espinosa A, Wahren-Herlenius M, Appel S. The complexity of Sjogren’s syndrome: novel aspects on pathogenesis. Immunol Lett. 2011; 141(1):1-9.
Bolstad AI, Skarstein K. Epidemiology of Sjogren’s Syndrome-from an Oral Perspective. Curr Oral Health Rep. 2016; 3(4): 328-36.
Nakamura H, Kawakami A. What is the evidence for Sjogren’s syndrome being triggered by viral infection? Subplot: infections that cause clinical features of Sjogren’s syndrome. Curr Opin Rheumatol. 2016; 28(4): 390-7.
Tashbayev B, Rusthen S, Young A, Herlofson BB, Hove LH, Singh PB, et al. Interdisciplinary, Comprehensive Oral and Ocular Evaluation of Patients with Primary Sjogren’s Syndrome. Sci Rep. 2017; 7(1): 10761.
Gerdin EW, Einarson S, Jonsson M, Aronsson K, Johansson I. Impact of dry mouth conditions on oral health-related quality of life in older people. Gerodontology. 2005; 22(4): 219-26.
Vitali C, Bombardieri S, Jonsson R, Moutsopoulos HM, Alexander EL, Carsons SE, et al. Classification criteria for Sjogren’s syndrome: a revised version of the European criteria proposed by the American-European Consensus Group. Ann Rheum Dis. 2002; 61(6): 554-8.
Shiboski CH, Shiboski SC, Seror R, Criswell LA, Labetoulle M, Lietman TM, et al. 2016 American College of Rheumatology/European League Against Rheumatism Classification Criteria for Primary Sjogren’s Syndrome: A Consensus and Data-Driven Methodology Involving Three International Patient Cohorts. Arthritis Rheumatol. 2017; 69(1): 35-45.
Aqrawi LA, Galtung HK, Guerreiro EM, Ovstebo R, Thiede B, Utheim TP, et al. Proteomic and histopathological characterisation of sicca subjects and primary Sjogren’s syndrome patients reveals promising tear, saliva and extracellular vesicle disease biomarkers. Arthritis Res Ther. 2019; 21(1): 181.
Fisher BA, Jonsson R, Daniels T, Bombardieri M, Brown RM, Morgan P, et al. Standardisation of labial salivary gland histopathology in clinical trials in primary Sjogren’s syndrome. Ann Rheum Dis. 2017; 76(7): 1161-8.
Haacke EA, van der Vegt B, Vissink A, Spijkervet FKL, Bootsma H, Kroese FGM. Germinal centres in diagnostic labial gland biopsies of patients with primary Sjogren’s syndrome are not predictive for parotid MALT lymphoma development. Ann Rheum Dis. 2017; 76(10): 1781-4.
Jonsson MV, Skarstein K, Jonsson R, Brun JG. Serological implications of germinal center-like structures in primary Sjogren’s syndrome. J Rheumatol. 2007; 34(10): 2044-9.
Theander E, Vasaitis L, Baecklund E, Nordmark G, Warfvinge G, Liedholm R, et al. Lymphoid organisation in labial salivary gland biopsies is a possible predictor for the development of malignant lymphoma in primary Sjogren’s syndrome. Ann Rheum Dis. 2011; 70(8): 1363-8.
Risselada AP, Looije MF, Kruize AA, Bijlsma JW, van Roon JA. The role of ectopic germinal centers in the immunopathology of primary Sjogren’s syndrome: a systematic review. Semin Arthritis Rheum. 2013; 42(4): 368-76.
Tashbayev B, Garen T, Palm O, Chen X, Herlofson BB, Young A, et al. Patients with non-Sjogren’s sicca report poorer general and oral health-related quality of life than patients with Sjogren’s syndrome: a cross-sectional study. Sci Rep. 2020; 10(1): 2063.
Kroese FG, Abdulahad WH, Haacke E, Bos NA, Vissink A, Bootsma H. B-cell hyperactivity in primary Sjogren’s syndrome. Expert Rev Clin Immunol. 2014; 10(4): 483-99.
Salomonsson S, Jonsson MV, Skarstein K, Brokstad KA, Hjelmstrom P, Wahren-Herlenius M, et al. Cellular basis of ectopic germinal center formation and autoantibody production in the target organ of patients with Sjogren’s syndrome. Arthritis Rheum. 2003; 48(11): 3187-201.
Ramírez Sepúlveda JI, Kvarnström M, Eriksson P, Mandl T, Norheim KB, Johnsen SJ, et al. Long-term follow-up in primary Sjögren’s syndrome reveals differences in clinical presentation between female and male patients. Biol Sex Differ. 2017; 8(1): 25.
Skarstein K, Aqrawi LA, Oijordsbakken G, Jonsson R, Jensen JL. Adipose tissue is prominent in salivary glands of Sjogren’s syndrome patients and appears to influence the microenvironment in these organs. Autoimmunity. 2016; 49(5): 338-46.
English summary
Evaluation of salivary gland biopsies as a part of the assessment of Sjögren’s syndrome.
In the period June 2011 to December 2018, 166 patients with symptoms of dry mouth and dry eyes were referred to the Faculty of Dentistry in Oslo for salivary gland biopsy as a part of the assessment of primary Sjögren’s syndrome (pSS). The purpose of the study was to investigate the prevalence of positive salivary gland biopsies in this patient group and also evaluate the age distribution. Only 7% of the patients were men. The women were referred most frequently in the age group 50-59 years and most positive biopsies were found in this group. The incidence of pSS was 39%. Among these pSS patients, 61% had a positive salivary gland biopsy. There were far more patients with a positive salivary gland biopsy among those who presented with serum anti-SSA autoantibodies (55%) compared to the seronegative patients where only 8% had a positive salivary gland biopsy. Findings in the salivary gland tissue may partly indicate how further medical attention should be arranged. The salivary gland biopsy will still be an important tool in the medical examination of pSS in anticipation of better, preferably non-invasive tests.
Samuelsen T, Aqrawi LA, Skarstein K, Jensen JL. Evaluering av spyttkjertelbiopsier ved utredning av Sjögrens syndrom. Nor Tannlegeforen Tid. 2021;132:988-94. doi:10.56373/2021-11-3
Korresponderende forfatter: Janicke Liaaen Jensen, E-post: jljensen@odont.uio.no
Akseptert for publisering 08.08.2021
Artikkelen har gjennomgått ekstern faglig vurdering.
Samuelsen T, Aqrawi LA, Skarstein K, Jensen JL. Evaluering av spyttkjertelbiopsier ved utredning av Sjögrens syndrom. Nor Tannlegeforen Tid. 2021; 131: 988-94.
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Samuelsen T, Aqrawi LA, Skarstein K, Jensen JL. Evaluering av spyttkjertelbiopsier ved utredning av Sjögrens syndrom. Nor Tannlegeforen Tid. 2021;132:988-94. doi:10.56373/2021-11-3
