CRISPR: En metode til anvendelse i næste generations genterapier
Hovedpunkter
CRISPR – et let tilgængeligt, simpelt og billigt forskningsværktøj.
CRISPR som gen-editerings værktøj i bioteknologisk- og biomedicinskforskning.
CRISPR-teknikken som næste generations gen-terapi.
CRISPR/Cas9, herefter forkortet CRISPR, er en molekylærbiologisk teknik, der gør det muligt at foretage ændringer i cellers arvemasse, altså at editere i generne. Metoden tillader, at man meget præcist kan finde et bestemt sted i cellens DNA og her klippe DNA’et over og/eller erstatte det med et veldefineret stykke DNA. Metoden gør det muligt at behandle patienter med sygdomme, der har en genetisk baggrund, og er desuden et fantastisk forskningsværktøj, som tillader studier i laboratoriet af forskellige geners betydning for cellers vækst og funktion.
Geneditering med CRISPR er én af en række beslægtede, men dog forskellige, teknikker, som har det til fælles, at de giver mulighed for at introducere en præcis ændring af en forudbestemt position i arvemassen, altså at «gen-editere». CRISPR-teknikken adskiller sig fra tidligere metoder ved, at den i udgangspunktet er let tilgængelig, er billig og bygger på et relativt simpelt (enkelt) princip. I det følgende vil der blive gjort kort rede for udviklingen af CRISPR, hvorfor teknikken kom til at revolutionere forskningen inden for alle grene af «life science» (livsvitenskap) og det potentiale, CRISPR-teknikken giver håb for som næste generations genterapeutiske behandling af patienter med genetiske sygdomme.
Det har længe været et stort ønske blandt forskere at kunne foretage kontrollerede og specifikke ændringer i cellers arvemasse for derved at kunne studere og helbrede sygdomme. Et synligt bevis herpå er, at flere af de sidste mange årtiers Nobelpriser er givet til forskere for udvikling i sådanne metoder (1) og senest i år for udvikling af CRISPR til editering af gener. (https://www.nobelprize.org/prizes/chemistry/2020/press-release/).
CRISPR, som står for Clustered Regularly Interspaced Short Palindromic Repeats, er betegnelsen for et bakterielt genområde, som koder for de komponenter, der bruges til præcist at udføre ændringer i cellers arvemasse. Før opdagelsen af CRISPR havde metoderne til geneditering været behæftet med manglende præcision og/eller anvendelse af meget ressourcekrævende procedurer. Dette ændrede sig med udviklingen af de såkaldte «nuklease-baserede» genediteringsteknikker; zinc fingers (ZFN), transcription activator-like effector nucleases (TALEN) og Meganuklease sidst i 1990’erne (2). Disse nukleaser er enzymer, der klipper DNA-strengen over, hvorved de ligesom CRISPR forårsager dobbeltstrengsbrud (begge de to DNA-strenge, som arvemassens DNA består af, klippes over) på et forudbestemt sted i arvemassen (figur 1). Vi kan som forskere udnytte de fire før nævnte (ZFN, TALEN, Meganukleaser og CRISPR) molekylære gensakse til at «klippe» et specifikt sted i DNA’et i celler. Metoderne giver herved forskere mulighed for at designe deres gensaks til at klippe på et forudbestemt sted i genomet, hvorved man effektivt og præcist kan ændre, fjerne eller indsætte DNA-sekvenser i cellers arvemasse. Endvidere har alle førnævnte gen-editeringsteknikker vist sig anvendelige på hele organismer af forskellig oprindelse, lige fra planter, insekter og fisk til mennesker (3-6). Grundet CRISPR’s simple (enkle) virkemekanisme stilles der særligt store forhåbninger til teknologiens anvendelse i genterapeutiske sammenhænge i mennesker (7).
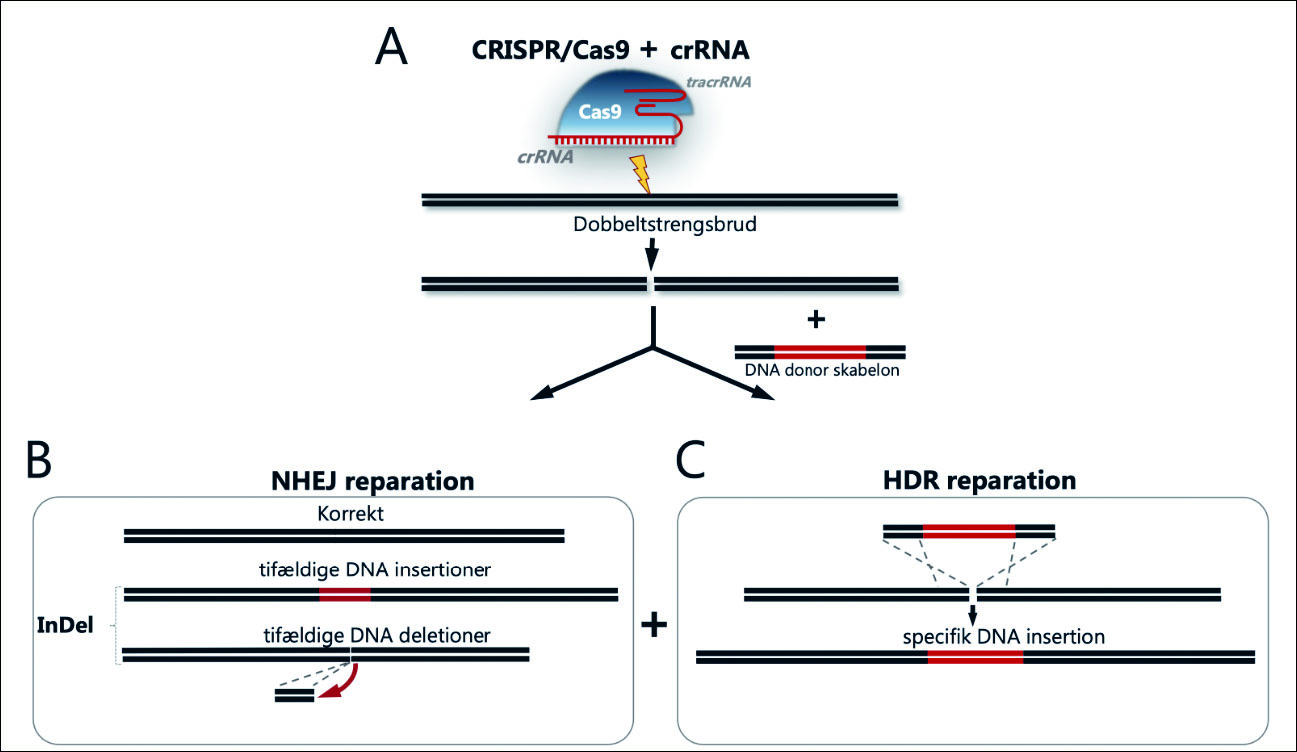
Figur 1. Primære udfald efter CRISPR/Cas9-induceret editering.
A: CRISPR/Cas9-editering foregår ved, at Cas9-nukleasen binder sig til gRNA. Når Cas9/gRNA-komplekset overføres eller udtrykkes i celler, dirigeres komplekset via gRNA-sekvensen til et defineret sted i arvemassen, hvor det forårsager et dobbeltstrengsbrud.
B: Dobbeltstrengsbruddet er således det primære udfald efter CRISPR/Cas9-editering og repareres af cellens eget reparationsapparat, som overvejende består af non-homologous end joining (NHEJ) eller homology directed repair (HDR). I CRISPR/Cas9-sammenhænge fører NHEJ til fejlagtig reparation, hvor der indsættes eller fjernes DNA i dobbeltstrengsbrudsstedet (såkaldte InDel’s), som kan føre til geninaktivering (knockout).
C: Ved HDR-medieret editering tilføres celler et stykke »reparations«-donor-DNA sammen med CRISPR/Cas9, som så via de homologe sekvenser (flankerer det med rødt angivne donor-DNA) indsættes i dobbeltstrengsbrudsstedet.
(Skabelon = sjablong på norsk)
Hvordan virker CRISPR?
I bakterier bruges CRISPR-systemet som forsvar mod infektion af bakteriofager (en type virus, der angriber bakterier). CRISPR-genregionen i bakteriers arvemasse koder for både de funktionelle nukleaseproteiner, som kan betragtes som molekylære «DNA-sakse», der udøver DNA-klipningen (kaldet Cas-proteiner, forkortelse for CRISPR-associerede proteiner) og de associerede CRISPR RNA-molekyler, som specifikt genkender DNA-positioner i bakteriofagens arvemassen som en slags GPS. Jennifer Doudna og Emmanuelle Charpentier (8) beskrev som de første den molekylære virkningsmekanisme for de komponenter, som CRISPR lokus fra bakterien Streptococcus pyogenes koder for. Et af disse er nukleaseproteinet, Cas9, herefter kaldt SpCas9. SpCas9 nukleasen kan klippe i DNA på et selvbestemt sted og er dirigeret af et nuklease-associeret CRISPR RNA-kompleks, som består af et CRISPR RNA (crRNA) molekyle, som specifikt genkender det ønskede genomiske lokus og et transaktiverende CRISPR RNA (tracrRNA) (se Faktaboks: Begreber). Det revolutionerende ved SpCas9 opstod, da uafhængige forsøg i 2013 viste, at SpCas9-funktionaliteten kunne overføres fra bakterier til eukaryote celler, deriblandt menneskeceller (9-11). SpCas9 er siden da blevet forskeres foretrukne genetiske værktøj, som gør os i stand til nemt og præcist at ændre på celler, væv og organismers gener. I det følgende ser vi på det molekylære princip, hvorved SpCas9 fungerer.
SpCas9 er til dato den mest velbeskrevne nuklease. Specificiteten af, hvor SpCas9-saksen skal klippe, bestemmes udelukkende af det associerede crRNA-molekyle (GPS’en), der ved genetisk sekvensmatch mellem crRNA og en given DNA-sekvens via baseparring er i stand til at dirigere saksen hen til det sted i arvemassen, hvor der skal klippes af SpCas9-nukleasen. Både SpCas9 og det nødvendige crRNA-molekyle kan nemt fremstilles i laboratoriet og/eller erhverves fra forskellige firmaer, der er specialiseret i udviklingen af disse produkter. Samtidig muliggør den efterhånden meget præcise kortlægning af et utal genomer fra forskellige organismer, deriblandt menneskets genom, at forskere nemt kan finde den sekvens, der gør det muligt at designe crRNA-molekylet, så SpCas9/crRNA-komplekset klipper lige præcis der, hvor man vil have det. Letheden, hvorved CRISPR/SpCas9 virker sammenholdt med det faktum, at forskere i genediteringsfeltet har gjort deres genediteringsreagenser tilgængelige for andre forskere via non-profit organisationen Addgene (https://www.addgene.org/crispr/), har bidraget til, at CRISPR i den grad har «demokratiseret» den genteknologiske forskning i alle grene af akademi og life science. De reagenser, der er nødvendige for udførelsen af CRISPR/SpCas9, kan erhverves fra bl.a. Addgene, hvilket muliggør, at genediteringsforsøg kan igangsættes af alle typer forskningsgrupper og uden store økonomiske omkostninger.
Begreber
Geneditering:
Genredigeringsteknik, som involverer cellulære DNA-reparationsmekanismer til introduktion af positionsspecifikke ændringer i et eller flere gener.
CRISPR:
Clustered regularly interspaced short palindromic repeats (CRISPR) er betegnelsen for et lokus, som findes i op imod 50 % af alle bakterier. CRISPR-lokus findes kun i bakterier, og i Streptococcus pyogenes indeholder det genetiske lokusgenet kodende for et nukleaseprotein kaldet Cas9 (CRISPR-associerede protein 9, SpCas9) og RNA-molekylerne crRNA (CRISPR-RNA) og tracrRNA (transactivating CRISPR-RNA). crRNA og tracrRNA går sammen og danner et kompleks og associerer sig med Cas9-nukleaseproteinet. Det aktive molekylære CRISPR/Cas9-nukleasekompleks består således af Cas9-nuklease, kompleksbundet til crRNA;tracrRNA-komplekset. SpCas9-nukleaseproteinet består af to domæneområder, et der under givne omstændigheder er i stand til at binde en specifik DNA-sekvens i arvemassen (kaldet REC-domænet), og den anden del indeholder evnen til at kunne klippe DNA’et og fører til dobbeltstrengsbruddet (nukleasedomænet kaldet NUC). Når REC-domænet associerer sig med crRNA-molekylet, muliggør 20 baser indeholdt i crRNA’et genkendelse af den tilsigtede specifikke DNA-sekvens i arvemassen. Desuden indeholder NUC-domænet et område, som genkender en specifik DNA-triplet-sekvens kaldet PAM-sekvensen (5’-NGG-3’, hvor N kan være en vilkårlig base), som skal være til stede i det område, hvortil SpCas9/crRNA skal binde og klippe. Når SpCas9/crRNA’et derefter har fundet og bundet sig til det eftersøgte DNA-område indeholdende de 20 baser, som genkendes af crRNA-sekvensen plus PAM-sekvens, udløses NUC-domænets evne til at klippe DNA’et, hvilket fører til et dobbeltstrengsbrud af DNA’et. Dobbeltstrengsbruddet repareres derefter udelukkende af det cellulære DNA-reparationsapparat.
Det primære resultat efter gen-editering
Et dobbeltstrengsbrud kan under normale cellulære omstændigheder effektivt repareres korrekt af cellens reparationsapparat. De to dominerende cellulære reparationssystemer er non-homolog end joining (NHEJ) og homologi-dirigeret reparation (HDR), som virker på helt forskellige måder (3) (Fig. 1). NHEJ er en effektiv reparationsmekanisme, der sammensætter DNA-ender efter et dobbeltstrengsbrud, men kan under ekstraordinære omstændigheder, som eksempelvis når SpCas9/crRNA vedvarende forårsager dobbeltstrengsbrud på samme position i arvemassen, forårsage mutationer i form af indsættelse eller elimination af nukleotider på reparationsstedet. De SpCas9/crRNA-forårsagede mutationer betegnes ved henholdsvis insertioner og deletioner (InDels). Gener, der koder for proteiner, aflæses som kodons, bestående af tripletter af tre nukleotider, der samlet koder for de aminosyrer, som proteiner udgøres af. Når der således indsættes eller fjernes nukleotider i SpCas9/crRNA-editerede gener, forskydes den protein-kodende del af genet, og der opstår et skift i læserammen («frame shift»), der fører til inaktivering af genfunktion, også betegnet som «knockout» af genet (Fig. 1). Populært kan man sige, at der kommer «stavefejl» i genet, som så ikke kan aflæses korrekt i forbindelse med cellens produktion af protein, hvorved proteinet ikke kan laves korrekt og går til grunde i cellen.
HDR er i udgangspunktet en nøjagtig og fejlfri reparationsmekanisme baseret på tilstedeværelsen af en homolog DNA-sekvens, der anvendes som skabelon (sjablong) til at reparere dobbeltstrengsbruddet. Mekanismen kræver, at enderne af DNA-skabelonen er identiske med enderne af dobbeltstrengsbruddet, således at enderne har overlappende og ens DNA-sekvenser mellem de to DNA-stykker. Man kan således» «snyde» cellens HDR-apparat til at indsætte et selvvalgt DNA-stykke placeret mellem de homologe DNA-sekvenser, identiske med det område i arvemassen, hvor man vil indsætte den selvvalgte DNA-sekvens. En sådan indsætning har vist sig at være mest effektiv, når man først laver et genediteringsinduceret dobbeltstrengsbrud, eksempelvis med SpCas9/sgRNA, hvorefter indsætningen af den selvvalgte gensekvens sker i brudstedet via de homologe sekvenser og ved hjælp af det cellulære HDR-reparationsapparat.
Sammenfattende så resulterer CRISPR/SpCas9 geneditering i mangel på tilstedeværelse af en selvvalgt DNA-sekvens i to mulige reparationsudfald af dobbeltstrengsbruddet; 1) reparation, hvor proteinfunktionen bibeholdes eller 2) forkert reparation med deraf følgende inaktivering/ «knockout» af genfunktion. I tilstedeværelse af en selvvalgt DNA-sekvens eksisterer disse udfaldsmuligheder sammen med muligheden for HDR-medieret integration af den selvvalgte DNA-sekvens på dobbeltstrengsbrudstedet (Fig. 1).
Udfordringer ved terapeutisk anvendelse af crispr/spcas9
Trods det, at CRISPR utvivlsomt har revolutioneret forskningen, er der endnu en række betragtninger, der skal afdækkes, før CRISPR/SpCas9 kan anvendes generelt, sikkert og præcist i terapeutiske sammenhænge. Det er således endnu uklart, hvorvidt CRISPR/SpCas9 under givne omstændigheder kun klipper der, hvor man har til hensigt, at der skal klippes i arvemassen, eller om der også klippes på ikke tilsigtede steder, et begreb kaldet «off-target» kløvning. Et tiltag rettet mod nedbringelse af «off-target» -effekter søger forskere at opnå ved at forbedre SpCas9’s specificitet ved optimering af proteinets sekvenssammensætning (12). Et andet endnu uklart forhold vedrører, hvorvidt CRISPR/SpCas9 dobbeltstrengsbruddet fører til uopdagede strukturelle ændringer i arvemassen, et forhold som er påpeget i nylige studier (13). Endelig så forestår (framstår) effektiv introduktion af CRISPR-reagenserne til de rette celler og væv som den nok største udfordring for terapeutisk anvendelse af geneditering som genterapi. For nærværende er de foretrukne leveringsmetoder baseret på enten virale eller non-virale strategier. Udfordringen består her i, at både non-virale og viralt baserede metodikker endnu ikke i tilstrækkelig grad er vævsspecifikke. De viralt baserede metoder er baseret på genvektorer afledt fra bl.a. retrovirus, lentivirus, og adeno-associeret virus, som alle er karakteriseret ved at besidde en høj transduktionseffektivitet (høj evne til at inficere celler), og mange af disse er godkendt til klinisk anvendelse. Dog er risikoen for malign transformation af editerede celler (cancerudvikling) som følge af integration af den virale vektor i værtscellens arvemasse en fortsat bekymring. Særligt dette forhold taler for en fortsat udvikling af de non-virale leveringsteknologier, som både nedsætter bekymringerne i forhold til sikkerhed og et ukontrolleret immunrespons ved levering in vivo (14,15).
I det følgende gives eksempler på de første anvendelser af nuklease-baseret genterapi, hvor sigtet i alle tre eksempler har været opnåelse af geneditering medieret «knockout-effekten» i patientceller.
Epidermolysis Bullosa (EB)-typer
Epidermolysis bullosa simplex (EBS), hvor bullae opstår i epidermis, dvs. over basalmembranen (BM).
Junctional EB (JEB), hvor bullae opstår i basalmembranen.
Dystrofisk EB (DEB), hvor bullae opstår i den øverste del af dermis.
Kindler syndrom (KS), hvor bullae opstår flere steder i huden.
Alle kan have orale manifestationer.
I snit fødes 1 barn/år i Danmark med EB (19).
I Norge er det tilsvarende forekomst. Se Senter for sjeldne diagnoser, Oslo universitetssykehus (https://bit.ly/3kWWRAz)
De første eksempler på klinisk anvendelse af geneditering baseret på genterapi
Geneditering er som tidligere nævnt ikke kun begrænset til CRISPR/SpCas9, men omfatter også ZFNs og TALENs. Begge disse metoder har succesfuldt og som de første været anvendt i terapeutiske sammenhænge. Det første kliniske studie baseret på geneditering var baseret på anti-HIV-behandling af HIV-positive patienter (16). Studiet viste, at ZFN-medieret ex vivo «knockout«/inaktivering af HIV co-receptorgenet CCR5 i blodceller effektivt forhindrer HIV-reinfektion af reintroducerede editerede CCR5-negative blodceller i patienten. Det andet kliniske genediteringseksempel var inden for cancerimmunterapifeltet (17). I dette studie vistes, at man ved elimination/ «knockout» af bestemte T-celle-overfladeproteiner i ex vivo-fremstillede T-celler var i stand til mere effektivt at dræbe cancerceller. Disse T-celler, såkaldte CAR-T-celler, modificeres yderligere således, at de på celleoverfladen udtrykker rekombinante receptormolekyler, der specifikt er rettet mod cancercellen. Dette studie lagde ydermere grund til anvendelse af et allogent/universelt, såkaldt «off the shelf«, celleterapiprodukt.
Endnu et eksempel på klinisk anvendelse af CRISPR-baseret genterapi er netop rapporteret. Det terapeutiske sigte i dette studie var genetablering af funktionelt hæmoglobin i en af de hyppigst forekomne monogenetiske potentielt livstruende sygdomme, som skyldes enkelt nukleotid-mutationer i genet, som koder for ß-globin. Studiet beskriver anvendelse af CRISPR-baseret elimination/ «knockout» af genet BCL11A. BCL11A genproduktet nedsætter normalt tilstedeværelsen af føtal γ-globin i røde blodceller. En reduceret cellulær BCL11A tilstedeværelse vil dermed føre til øget γ-globin, som er i stand til at genetablere funktionen af dysfunktionel haemaglobin i seglcelleanæmi hos ß-globin-patienter. I studiet beskrives anvendelsen af denne strategi for henholdsvis en beta-thalassemi- og en seglcelleanæmi-patient fulgt over en 12 måneders periode, som viste vedvarende forhøjede føtal-γ-globin-niveauer i hele perioden og i begge patienter (6).
Klinisk relevans
CRISPR har været en afgørende og sand «game changer» for en lang række vigtige opdagelser i grundvidenskabelig akademisk og «life science”-forskning. (norsk: livsvitenskap)
CRISPR-medieret editering består af tre enkelte og let tilgængelige komponenter, Cas9, crRNA og tracrRNA som i et kompleks muliggør, at stort set enhver sekvens i enhver organismes arvemasse kan editeres helt ned til mindste enhed, dvs. enkelt nukleotid-niveau.
Specificiteten af Cas9 udgøres udelukkende af de 20 nukleotider, der indgår i crRNA-enheden, og Cas9 kan derfor med lethed reprogrammeres til at genkende en vilkårlig sekvens blot ved ændring af sekvensen af de 20 nukleotider i crRNA-molekylet. Der er derfor knyttet store forhåbninger til, at CRISPR kan bane vejen for en række nye terapier, hvor sigtet er at korrigere for gendefekter i patienter, der fører til alvorlige sygdomme.
Teknikkens enorme terapeutiske potentiale illustreres bedst ved de over 45 igangværende kliniske fase 1 og 2-afprøvninger af CRISPR/Cas9-baserede terapier indenfor så forskellige indikationer som cancer, blodsygdomme, infektionssygdomme, øjensygdomme m.fl. For yderligere information og overblik over de igangværende kliniske gen-editeringsstudier henvises til crisprmedicinenews.com (https://crisprmedicinenews.com/clinical-trials/crispr-cas-clinical-trials/).
Forsøg med brug af crispr-teknologi relateret til orale patologiske tilstande
Iblandt de mange forsøg, der for tiden udføres for generelle sygdomme, findes også sygdomme, der direkte kan afficere mundhulen. Et eksempel på dette er epidermolysis bullosa (EB) (se Faktaboks: Epidermolysis Bullosa). EB er en bulløs lidelse, som er karakteriseret ved dårlig tilhæftning af epitelet til de underliggende bindevæv, dvs. et ustabilt epitel. Den dårlige tilhæftning opstår på grund af mutationer i generne, der koder for epitelcellers cytoskeletproteiner, adhæsionsproteiner eller gener relateret til basal lamina-proteiner (Faktaboks: Epidermolysis Bullosa). EB findes i forskellige former: en recessiv dystrofisk (RDEB), en dominant dystrofisk, en junctional og en simplex form, og alle disse former kan have orale manifestationer. Ved den recessive dystrofiske form ses ofte mutationer i Collagen7A1-genet. Collagen 7 er et protein, som er essentielt i basallamina mellem bindevæv og epitel, og et dårligt eller ikke fungerende Collagen 7 medfører en ikke fungerende basallamina og dermed dårlig tilhæftning af epitelet til bindevævet. Patienterne får store bullae og sår ved let berøring, indtag af føde, tandbørstning m.m. Patienterne får malformationer/misdannelser på grund af ardannelse på huden og dør ofte tidligt grundet infektioner gennem hud og mave-tarm-kanalen. Dental hygiejne er smertefuldt og slimhindelæderende. EB er en genetisk lidelse med store konsekvenser.
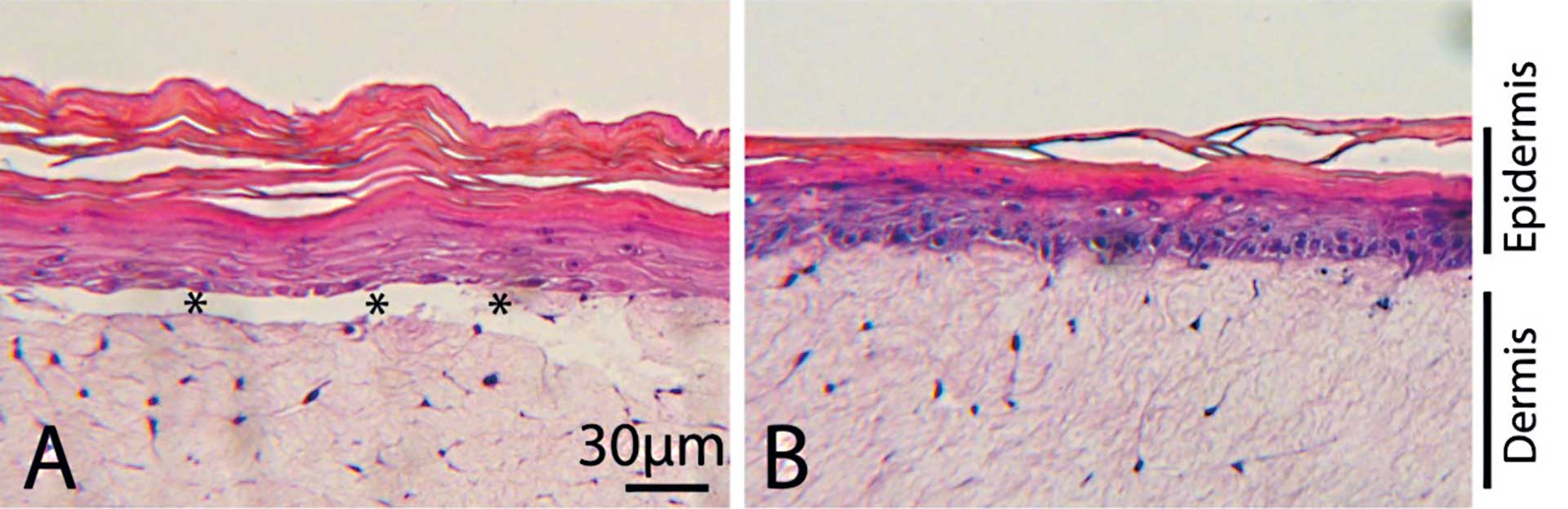
Figur 2. Editering af humane celler til vævsdannelse
A: Kunstig hud (organotypisk hudmodel) lavet med normale keratinocytter og fibroblaster fra EB-patient. Epidermis slipper ved basalmembranen og danner bulla.
B: Kunstig hud lavet med normale keratinocytter og genetisk korrigerede fibroblaster. Epidermis adhærerer til dermis som i rask hud. Stjerner viser bulla.
På Department of Pediatrics, University of Minnesota i USA har Mark Osborn, Jacub Tolar og deres gruppe længe arbejdet for at forbedre behandlingen af EB-patienter og finde en mulig kur mod sygdommen. En af de metoder, de har undersøgt, er at bruge CRISPR-teknologien til at korrigere i patienternes gener, så deres celler igen kan lave et funktionelt Collagen 7 for derved at sikre, at epitelet bedre kan hænge fast. De har dyrket fibroblaster fra patienterne, og ved brug af CRISPR-baseeditering korrigeret det ikke-funktionelle COLL7A1-gen i laboratoriet. Disse fibroblaster har de så testet i mus og set, at de kan lave en fin basal lamina med et funktionelt collagen 7-protein. På Odontologisk Institut i København har vi etableret en model for hud eller mundslimhinde, som kan dyrkes i laboratoriet og bruges til at teste funktionen af proteiner i et væv udenfor kroppen. Vi har derfor i samarbejde med Mark Osborn og Jacub Tolar afprøvet, om disse celler også kan virke i et humant væv udenfor kroppen (18) (figur 2). På figuren ses til venstre et billede med de syge celler, hvor epitel og bindevæv ikke hænger sammen, og til højre et billede med de genetisk korrigerede celler, hvor epitel og bindevæv hænger fint sammen. Dette studie giver store forhåbninger om mulig behandling for EB-patienter ved brug af geneditering. De raske celler kan gives tilbage til patienterne og vil langsomt overtage de syge celler lokalt. Editeringen kan også foretages i stamceller fra knoglemarven og transplanteres tilbage til patienten. Herved vil de korrigerede celler langsomt overtage alle fibroblaster i EB-patienten.
Konklusioner
De programmerbare nukleasebaserede genediteringsteknikker har vist sig at have et kæmpe potentiale i en række forskningsfelter, herunder basal, bioteknologisk og biomedicinsk forskning. Forskningsresultater med disse teknikkers anvendelse har demonstreret væsentlige bidrag i udviklingen af terapeutiske strategier for en række forskelligartede humane sygdomme, hvor CRISPR/Cas-metodikken særligt har vist sig som effektivt at kunne editere specifikke genloci, hvilket skaber forhåbning for dets anvendelse som næste generations genterapi (se Faktaboks: Klinisk relevans).
Referanser
THE NOBEL PRIZE. Barbara McClintock Facts. (Set August 2021). Tilgængelig fra: URL: (https://www.nobelprize.org/prizes/medicine/1983/mcclintock/facts/
Chandrasegaran S, Carroll D. Origins of Programmable nucleases for genome engineering. J Mol Biol. 2016; 428: 963-89.
Bennett EP, Petersen BL, Johansen IE et al. INDEL detection, the «Achilles heel” of precise genome editing: a survey of methods for accurate profiling of gene editing induced indels. Nucleic Acids Res. 2020; 48: 11958-81.
Lonowski LA, Narimatsu Y, Riaz A et al. Genome editing using FACS enrichment of nuclease-expressing cells and indel detection by amplicon analysis. Nat Protoc. 2017; 12: 581-603.
Carballar-lejarazú R, Kelsey A, Pham TB et al. Digital droplet PCR and IDAA for the detection of CRISPR indel edits in the malaria species Anopheles stephensi. Biotechniques. 2020; 68: 172-9.
Frangoul H, Altshuler D, Cappellini MD et al. CRISPR-Cas9 gene editing for sickle cell disease and β-thalassemia. N Engl J Med. 2020; 384: 252-60.
Porteus MH. A new class of medicines through DNA editing. N Engl J Med. 2019; 380: 947-59
Jinek M, Chylinski K, Fonfara I et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Scienc.e 2012;337:816-21.
Cong L, Ran FA, Cox D et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 2013; 339: 819-23.
Mali P, Esvelt KM, Church GM. Cas9 as a versatile tool for engineering biology. Nat Methods. 2013; 10: 957-63.
Cho SW, Kim S, Kim JM et al. Targeted genome engineering in human cells with the Cas9 RNA-guided endonuclease. Nat Biotechnol .2013; 31: 230-2.
Vakulskas CA, Dever DP, Rettig GR et al. A high-fidelity Cas9 mutant delivered as a ribonucleoprotein complex enables efficient gene editing in human hematopoietic stem and progenitor cells. Nat Med. 2018; 24: 1216-24.
Kosicki M, Tomberg K, Bradley A. Repair of double-strand breaks induced by CRISPR–Cas9 leads to large deletions and complex rearrangements. Nat Biotechnol.. 2018; 36: 765-71.
Yin H, Kauffman KJ, Anderson DG. Delivery technologies for genome editing. Nat Rev Drug Discov. 2017; 16: 387-99.
Kotterman MA, Schaffer DV. Engineering adeno-associated viruses for clinical gene therapy. Nat Rev Genet. 2014; 15: 445-51.
Tebas P, Stein D, Tang WW et al. Gene editing of CCR5 in autologous CD4 T cells of persons infected with HIV. N Engl J Med. 2014; 370: 901-10.
Qasim W, Zhan H, Samarasinghe S et al. Molecular remission of infant B-ALL after infusion of universal TALEN gene-edited CAR T cells. Sci Transl Med. 2017;9:eaaj2013.
Osborn MJ, Newby GA, McElroy AN et al. Base editor correction of COL7A1 in recessive dystrophic epidermolysis bullosa patient-derived fibroblasts and iPSCs. J Invest Dermatol. 2020; 140: 338-347.
Laimer M, Prodinger C, Bauer JW. Hereditary epidermolysis bullosa. JDDG – J Dtsch Dermatol Ges. 2015; 13: 1125-33.
English summary
Crispr/cas9: A method for use in the next generation gene therapies
CRISPR technology enables modification of genomes by gene editing. The method allows for precise targeting of specific loci in cellular DNA followed by site specific cutting of the DNA and/or integration of a defined piece of DNA. CRIPSR has been shown to enable treatment of patients carrying genetic disease and in addition is a fantastic research tool that allows for research in gene function in relation to cell proliferation and function.
CRISPR based gene editing comprises several related technologies that share the potential of introducing precise modification of desired positions in the genome, known as editing. However, CRISPR distinguishes itself from other editing technologies, by being easily accessible and based on a relatively simple principle. In the following a brief summary of the development of CRISPR is given, why the technology revolutionized research in all aspects of life science and the potential that CRISPR holds as the next generation gene therapy for treatment of patients with genetic disease.
Dabelsteen S, Bennett EP. CRISPR: En metode til anvendelse i næste generations genterapier. Nor Tannlegeforen Tid. 2021;132:890-6. doi:10.56373/2021-10-4
Korresponderende forfatter: Eric Paul Bennett. E-post: epb@sund.ku.d
Akseptert for publisering 6. august 2021
Artikkelen har gjennomgått ekstern faglig vurdering.
Dabelsteen S, Bennett EP. CRISPR: en metode til anvendelse i næste generations genterapier. Nor Tannlegeforen Tid. 2021; 131: 890-6.
Norsk MeSH: CRISPR-Cas-system; Genredigering; Genetisk terapi; Gene-knock-out-teknikker
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Dabelsteen S, Bennett EP. CRISPR: En metode til anvendelse i næste generations genterapier. Nor Tannlegeforen Tid. 2021;132:890-6. doi:10.56373/2021-10-4