Vidar Bakken
CRISPR-Cas: Aktuelle og mulige anvendelser i odontologi
Professor emeritus, dr. odont., Klinisk institutt 2, Det medisinske fakultet, Universitetet i Bergen, Norge
Hovedbudskap
CRISPR-Cas systemet er et effektivt verktøy i redigering av gener i ulike organismer
Teknologien utvikles stadig og har fått mange bruksområder
Strategier for leveranse av verktøy bør bli sikrere
En rekke applikasjoner er under utvikling i fagområdene medisin/odontologi
Etiske vurderinger med klare retningslinjer for bruk av CRISPR-Cas teknologi er nødvendig
«Clustered Regularly Interspaced Short Palindromic Repeats» CRISPR)-Cas systemet ble først oppdaget og beskrevet som adaptiv immunitet i prokaryote organismer. CRISPR-Cas gir beskyttelse mot bakteriofager, plasmider og transposoner ved at korte DNA sekvenser som tidligere infiserte, blir bygd inn i genomet til prokaryote organismer. Bakteriofager gjenkjennes og blir ødelagt med nukleaser ved reinfeksjon. Teknologien ble videreutviklet til et effektivt verktøy til genredigering av eukaryote organismer. Og nå, kun få år etter oppdagelsen vil dette verktøyet bli brukt i mange applikasjoner. Genterapi, regenerasjonmedisin, kreft, infeksjonssykdommer, diagnostikk og vaksineutvikling er aktuelle medisinske områder. Alle disipliner i livsvitenskapene har tatt disse verktøyene i bruk. Det er likevel mange uløste oppgaver som krever at verktøyene blir ytterligere forbedret og at de kan leveres på en sikker måte til de celler og vev CRISPR-Cas anvendes til.
Helt siden oppdagelsen av at genomet bestående av DNA dobbeltspiral, har utvikling av metoder for å manipulere DNA fascinert mange forskere. Resultater fra denne forskningen har på det medisinske området gitt oss verktøy til å forbedre diagnostikk, behandling og forståelse av patogenese for en rekke sykdommer.
Jennifer A. Doudna, Emmanuelle Charpentier og medarbeidere publiserte i 2012 en nøkkelstudie der de beskrev en forbedret utgave av «gensaksen» CRISPR/Cas9 (1). Med denne gensaksen kan arvestoffet i dyr, planter og mikroorganismer relativt enkelt forandres eller redigeres. Doudna og Charpentier fikk Nobelprisen i kjemi i 2020 for dette arbeidet. I løpet av få år har forskningen på CRISPR-Cas ekspandert og videreutvikling av genredigering gir nye muligheter. Selv om det fortsatt er et stykke vei til klinisk anvendelse ser utviklingen til å gå så raskt at mye av dette kan nå klinikken i løpet av få år.
De nye genredigeringsmetodene er kraftfulle og effektive og dette betyr at etiske vurderinger er viktige. Nobelprisvinnerne oppsummerte i 2014 historien bak CRISPR-Cas og sitt viktige bidrag (2). På mindre enn ti år etter dette har tusenvis av vitenskapelige artikler blitt publisert. I det følgende gis det et innblikk i pågående forskning og mulige anvendelser av CRISPR-Cas teknologi i medisinske/odontologiske fagområder.
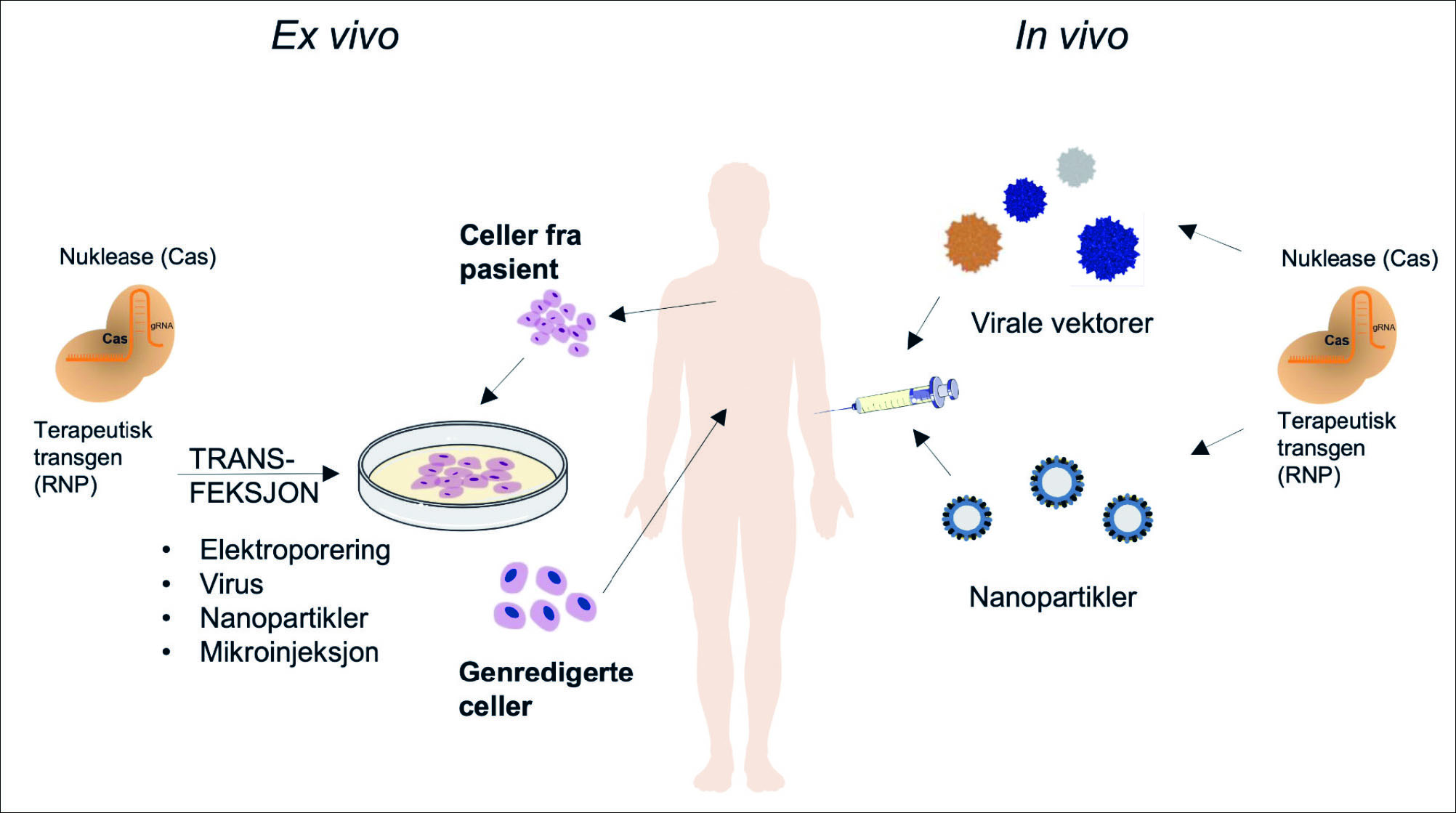
Figur 1. Terapeutisk genredigering med CRISPR-Cas. Genredigering kan skje ex vivo eller in vivo. Celler isoleres fra pasienten og blir transfektert ex vivo med redigeringsverktøyet (gensaksen). Transfeksjon skjer på ulike måter og genredigerte celler kan gis tilbake til pasienten. Blodceller er typiske celler som redigeres ex vivo, mens muskelceller kan behandles direkte in vivo med bruk av virus eller nanopartikler som leveransemetode.
Genredigeringsverktøy
Redskaper til å modifisere gener har vært tilgjengelig i flere tiår. Restriksjonsenzymer ble beskrevet og tatt i bruk for ca. 50 år siden. Restriksjonsenzymer med ulike spesifisiteter ble isolert fra bakterier. Senere konstruerte man genredigeringsverktøyene «Zinc Finger Nucleases» (ZFNs) og «Transcription Activator-Like Effector Nucleases» (TALENs) der forskerne selv kunne bestemme hvor DNA skulle kuttes (3).
For mindre enn ti år siden ble CRISPR-Cas systemet tatt i bruk i genredigering. CRISPR-Cas systemer finnes i domenene Bacteria og Archaea og gir disse mikroorganismene adaptiv immunitet mot bakteriofager, plasmider og transposoner (4,5). Undersøkelser hittil viser at ca. 50 % av bakterier og ca. 90 % av arker har CRISPR-Cas (6). CRISPR-Cas systemet deles inn i to hovedklasser og flere typer og subtyper. Mest brukt og best beskrevet er CRISPR-Cas9, men noen anvendelser krever redigeneringsverktøy med andre egenskaper.
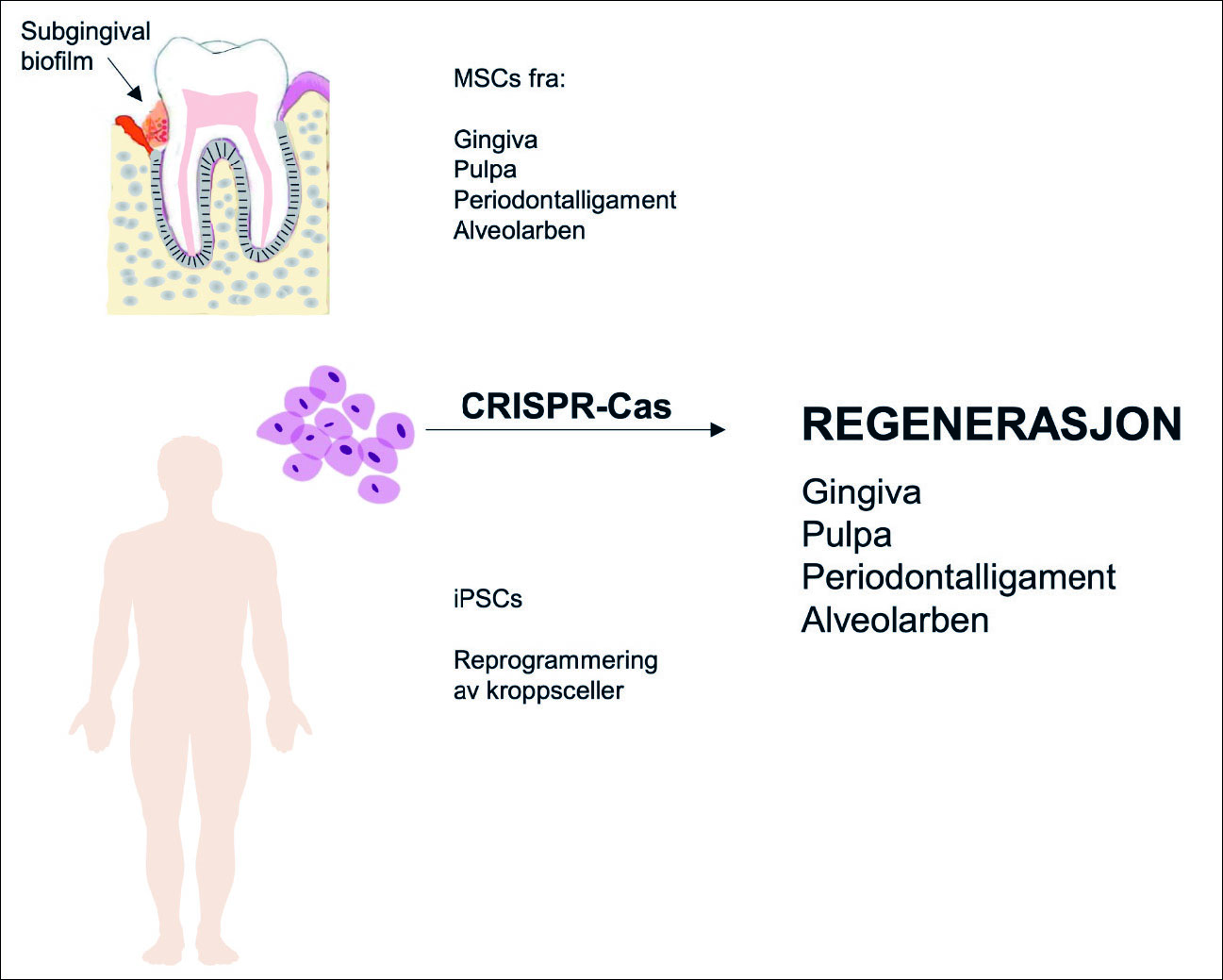
Figur 2. Bruk av CRISPR-Cas i regenerasjon av vev og organer. Vevsspesifikke mesenchymale stamceller (MSCs) kan isolereres fra oralt vev og genredigeres. Andre kroppsceller kan reprogrammeres slik at de blir induserte pluripotente stamceller (iPSCs) som også kan genredigeres og benyttes til regenerasjon. Denne forskningen er i en tidlig fase der CRISPR-Cas er viktige redskaper. Dyremodeller blir brukt for å forstå hvordan vev og organer utvikles og differensieres. På sikt kan denne kunnskapen benyttes i behandling av f.eks. kraniofaciale defekter og i regenerasjon av ulike orale vev og stukturer.
Hvordan brukes genredigeringsverktøyene?
Redigeringsverktøyene må finne veien til genene i cellene som skal redigeres. Leveranse er avhengig av hvilke organismer (dyr, planter, bakterier) og typer vev eller celler som skal redigeres. Videre om dette skjer in vitro, ex vivo eller in vivo. In vitro studier i laboratoriet med celle- og vevskulturer, samt dyremodeller danner grunnlaget for senere kliniske anvendelser. Metoder må standardiseres og optimaliseres. Leveranse av genredigeringsverktøy kan utføres på ulike måter (7,8). Overføring av arvemateriale (DNA og RNA) til animalske celler kalles transfeksjon. Det må lages en åpning i eller penetrasjon av cellemembraner for at arvemateriale skal nå målet. Virus og bakterier gjør dette på sine egne elegante måter når celler infiseres, og bruk av virus er en av måtene som vi også kan benytte. Metodene for leveranse deles inn i hovedkategoriene nonvirale og virale. Nonvirale metoder kan videre deles inn i kjemisk baserte, ikke-kjemisk baserte og partikkelbaserte metoder. I virale metoder benyttes ulike virus til transfeksjon.
CRISPR-Cas teknologien har på kort tid blitt anvendt for påvisning og behandling av genetiske sykdommer, kreft og infeksjonssykdommer (7,9). I det følgende gis noen eksempler på dette.
Genetiske sykdommer og misdannelser
Arvelige sykdommer kan være komplekse, men noen av de vanligste genetiske sykdommene skyldes mutasjoner i et enkelt gen. Eksempler på slike er Huntingtons sykdom, cystisk fibrose, sigdcelleanemi og Duchennes muskeldystrofi (DMD). DMD er en av de vanligste arvelige muskelsykdommene. Genredigering med CRISPR-Cas kan utføres på ulike måter. Sigdcelleanemi kan behandles ved å genredigere hemapoietiske eller progenitorceller ex vivo, mens for DMD skjer behandling av myogene celler direkte, in vivo (10). Dette er eksempler på terapeutisk genregulering av somatiske celler (figur 1). Kjønnsceller kan også redigeres og gi arvelige endringer i eggceller, spermier og embryoer. Dette blir gjort med dyr og planter, mens bruk av denne genredigeringsteknologien hos mennesket er gjenstand for omfattende diskusjon der etiske aspekter må avklares.
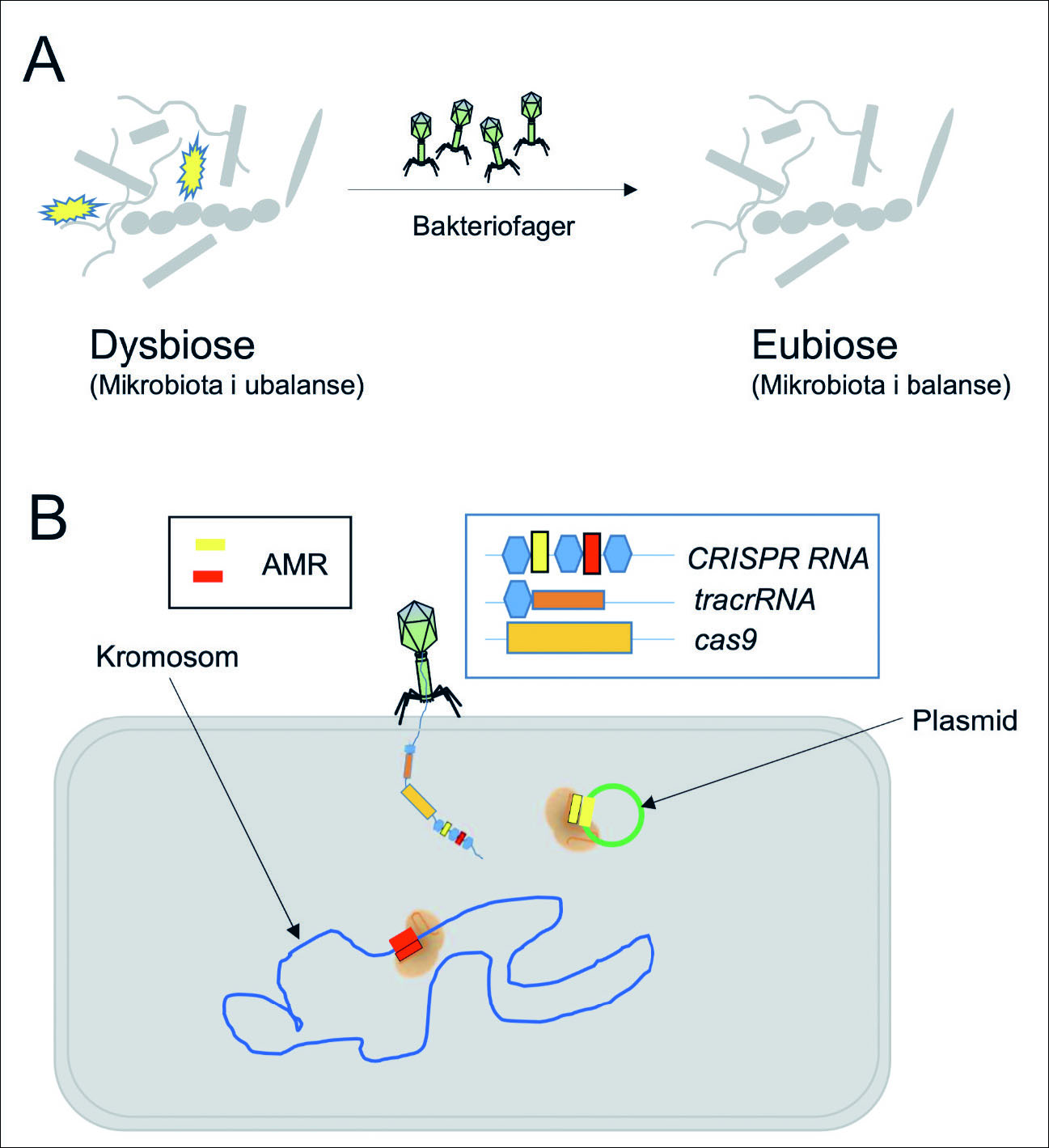
Figur 3. Eliminasjon av patogene bakterier og bekjempelse av antimikrobiell resistens.
A: Ved orale lidelser som karies og periodontitt vil det være ubalanse (dysbiose) i bakteriesammensetningen i biofilmen. For å opprette balanse (eubiose) kan aktuelle patogene mikroorganismer (gule) fjernes selektivt med CRISPR-Cas redigerte bakteriofager.
B: Bakteriofager kan også redigeres med CRISPR-Cas slik at andre uønskede bakterier fjernes. Dette kan spesielt benyttes mot bakterier med antimikrobiell resistens (AMR). AMR kan være kodet fra bakteriekromosomet (blått) eller på et plasmid (grønt).
Regenerasjon av vev og organer
CRISPR-Cas kan benyttes til å studere gener som eksempelvis er involvert i kraniofacial utvikling, inkludert hvordan defekter oppstår. Dette er stort sett til nå prekliniske studier der ulike dyremodeller er tatt i bruk (11). I denne forskningen tenker man også på muligheten for terapi med dannelse av nytt vev for å korrigere/rette opp kraniofaciale defekter med stamcellebehandling. Flere typer stamceller benyttes, pluripotente embryonale stamceller (ESCs) eller induserte pluripotente stamceller (iPSCs). Vevsspesifikke mesenchymale stamceller (MSCs) som er påvist i alveolarben, periodontalligament og i tannpulpa har fått spesiell oppmerksomhet (figur 2). Genredigering av MSCs med CRISPR-Cas vil være nyttige redskaper i behandling av kraniofaciale, orale/dentale og periodontale defekter (12,13).
Kreft
De fleste former for kreft er komplekse sykdommer der flere gener er involvert i patogenesen. Det kan være flere mutasjoner som fører til aktivering av onkogener og inaktivering eller endring av tumorsuppressorgener. Et eksempel er mutasjoner i tumorsuppressorgen p53 som medfører at kreftceller overlever og deler seg. Genet p53 er et av de viktigste genene ved kreft og er mutert i omlag halvparten av krefttilfellene hos mennesket. Det er involvert i kontroll av cellesyklus, apoptose og opprettholdelse av genetisk stabilitet. Små mengder p53 protein (TP53 = TumorProtein p53) er til stede i celler under normale forhold, i store mengder for å begrense skader som skjer i celler. Forsøk med CRISPR-Cas9 har demonstrert at onkogener kan inaktiveres og mutasjoner i tumorsuppressorgener kan repareres slik at vekst av tumorceller stanser. Terapeutisk genredigering er utfordrende (14-16).
Et av de klassiske kjennetegnene ved kreft («hallmarks of cancer») er at tumorceller på ulike måter unngår å bli gjenkjent og angrepet av immunsystemet. Immunterapi med økt T-cellerespons kan gjøres ved at T-lymfocytter isolert fra blod, genredigeres ex vivo til å uttrykke rekombinante kimære antigenresptorer (chimeric antigen receptors = CAR). Cellene som føres tilbake til pasienten kalles CAR T celler som vil binde seg til kreftceller og aktivere T-celler hos pasienten. Dette kalles CAR T cellebehandling og har vist seg særlig vellykket til behandling av leukemier og lymfomer, men det arbeides videre med å etablere CAR T cellebehandling av faste tumorer (16).
Infeksjoner/inflammasjoner – karies og periodontitt
Karies og periodontitt er blant de vanligste biofilmassosierte infeksjonssykdommer hos mennesket. Periodontitt er kompleks med inflammatoriske/immunologiske vertresponser som også kan være assosiert med systemisk lidelser. Behandling kan være rettet mot bakterier som er utløsende faktor og/eller direkte mot inflammatorisk respons som kan gi vevsskade.
En rekke ulike CRISPR-Cas systemer har blitt identifisert i det orale mikrobiom (17). Dersom likevekten (homeostasen) i det orale mikrobiom blir forstyrret (dysbiose) kan uønskede mikroorganismer gjøre skade slik at sykdommer som f.eks. karies og periodontitt oppstår (18). Eliminasjon av nøkkelbakteriearter som Porphyromonas ginigivalis i en dysbiotisk oral biofilm kan gi et bakteriesamfunn i dynamisk likevekt (figur 3A) og redusere eller hindre inflammasjon. Dette høres enkelt ut, men flere typer mikroorganismer og vertsresponser er aktuelle i patogenesen og gjør komplekse sykdommer som periodontitt vanskelig å behandle.
Flere stategier vil nok være nødvendige i behandlingen av periodontitt.
CRISPR-Cas i det orale mikrobiom
Det orale mikrobiom består av et stort antall ulike bakteriearter. Det nøyaktige antall er ikke helt klart, men 700-1000 arter nevnes i litteraturen.
CRISPR-Cas systemer er utbredt i oral mikrobiota (19,20). Bakterier som assosieres med karies og periodontitt er spesielt interessante. Streptococcus mutans danner syrer og ekstracelulære polysakkarider (EPS) som er viktige virulensfaktorer i kariesutvikling. Genet gtf koder for enzymet glukosyltransferase som lager EPS. Gong et al. (2018) genredigerte gtf slik at syntesen av EPS ble nedsatt. Dette kan være en metode for å påvirke (fjerne, redusere) S. mutans biofilm (21).
P. gingivalis er en anaerob Gram-negativ bakterie i subgingival biofilm og betegnes som en såkalt «nøkkelpatogen» i utviklingen av periodontitt. Denne bakterien bidrar som nevnt til dysbiose. P. gingivalis assosieres også med flere systemiske sykdommer. Disse relasjonene er komplekse, men inflammasjon er viktig i denne sammenheng. Ulike klasser og typer av CRISPR-Cas systemer er påvist i P. gingivalis (22,23). CRISPR-Cas ser ut til å øke ved periodontitt, men mer kunnskap er nødvendig for å forklare hvilken betydning dette har for sykdomsutviklingen (se nedenfor). Genredigering for å fjerne P. gingivalis kan bli en del av terapien mot periodontitt og andre assisosierte sykdommer i fremtiden (figur 3A og B).
CRISPR-Cas som redskap i immunmodulering
CRISPR-Cas9 er et av redskapene som er benyttet for å skru av/fjerne gener i modellorganismer (f.eks. dyremodell med mus). Flere typer av CRISPR-Cas kan påvirke molekyler/signalstoffer i reaksjonsveier i kroppsceller som knyttes til inflammasjon. Dette kan være molekyler som øker/hemmer inflammasjon eller kan ha andre effekter i patogenesen. Detaljert kunnskap om dette kan danne grunnlag for målrettet og persontilpasset behandling (presisjonsmedisin) av sykdommer som periodontitt, på engelsk kalt «precision periodontics» (24, 25).
Antimikrobielle midler
Antimikrobiell resistens (AMR) er et økende problem globalt. Selv vanlige bakterieinfeksjoner som til nå enkelt har blitt behandlet, kan bli umulig å kurere dersom AMR utvikles mot de midlene vi har tilgjengelig i dag. Behovet for nye og effektive antimikrobielle midler er svært stort.
Ulike strategier blir benyttet for å utvikle nye antimikrobielle midler (26,27). Eksempler på neste generasjon antimikrobielle midler kan være peptider (syntetiske og naturlige), bakteriofagterapi, bakteriociner (giftstoffer laget av bakterier), antistoffer og spesielt lovende er nukleinsyre-baserte antimikrobielle midler med bruk av CRISPR-Cas teknologien. CRISPR-Cas er svært interessesant og viktig fordi bakterier med AMR kan fjernes selektivt. En utfordring er å finne ut hvordan CRISPR-Cas best kan fraktes inn til målet, i dette tilfellet inn i bakterien. Bakteriofager kan benyttes (figur 3B). Det stilles også store forventninger til bruk av nanopartikler for transport av andre spesifikke legemidler (28).
CRISPR-Cas systemer kan også konstrueres slik at spesifikke patogene genotyper eller epidemiologiske isolater blir eliminert med programmert bakteriedød (29). Dermed kan man unngå å bruke bredspektrede antibiotika og opprettholde en beskyttende kommensal mikroflora (eubiose) (30,31).
Etiske aspekter
Verktøyene for genredigering har blitt så kraftige og effektive at etiske forskrifter er nødvendige. Bekymringene er spesielt store når det gjelder endring av arvestoff i embryoer og kjønnsceller fordi slike endringer arves. «Designer babies» der foreldrene kan velge egenskaper på barnet som skal fødes er fullt mulig. Dette kan være kjønn, farge på øyne, hår og hud, økt intelligens, høyde mm. Eksperter og ansvarlige myndigheter og organisasjoner globalt (International Sunmmit on Human Genome Editing) fraråder og fordømmer at genredigering brukes på denne måten. Genredigering på embryoer og kjønnsceller kan likevel skje i forskningsøyemed, beskrevet som en «translational pathway» (32).
Vi ser allerede nå hvilken betydning terapeutisk genredigering har og vil få for kliniske anvendelser. Verktøy og metoder blir bedre og sikrere. Genredigering av somatiske celler ex vivo eller in vivo ved behandling av ulike sykdommer vil ha stor betydning.
Konklusjoner
Det er nesten utrolig at utviklingen av nye verktøy for genredigering har gått så fort og funnet veien til så mange ulike applikasjoner. Nye og mer presise CRISPR-Cas verktøy blir utviklet. I tillegg til redigering av gener ved å kutte dobbelttrådet DNA kan nye verktøy endre byggeklossene, basene i DNA og regulere gener slik at de kan skrus av/undertrykkes eller skrus på/aktiveres eller tilføre nye egenskaper med stor presisjon.
Vi kan forvente at det høye tempoet i CRISPR-Cas forskningen vil gi ny kunnskap om patogenese, diagnostikk, og behandling av en rekke sykdommer i de nærmeste årene.
Om illustrasjoner
Illustrasjoner er delvis utformet med Servier Medical Art Templates som er lisensiert under Creative Commons Attribution 3.0 Unported License; https://smart.servier.com
Referanser
Jinek M, Chylinski K, Fonfara I, Hauer M, Doudna JA, Charpentier E. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 2012; 337: 816-821.
Doudna JA, Charpentier E. The new frontier of genome engineering with CRISPR-Cas9. Science. 2014; 346: 1258096, DOI: 10.1126/science.1258096
Gaj T, Gersbach CA, Barbas III CF. ZFN, TALEN, and CRISPR/Cas-based methods for genome engineering. Trends Biotechnol. 2013; 31: 397-405.
Barrangou R, Fremaux C, Deveau H, Richards M, Boyaval P, Moineau S et al. CRISPR provides acquired resistance against viruses in prokaryotes. Science. 2007; 315: 1709-1712.
Makarova KS, Wolf YI, Iranzo J, Shamakov SA, Alkhnbashi OS, Brouns SJJ et al. Evolutionary classification of CRISPR-Cas systems: A burst of class 2 and derived variants. Nat Rev Microbiol. 2020; 18: 67-83.
Hille F, Richter H, Wong SP, Bratovic M, Ressel S, Charpentier E. The biology of CRISPR-Cas: Backward and forward. Cell. 2018; 172: 1239-1259.
Haasteren van J, Li J, Scheideler OJ, Murthy N, Schaffer DV. The delivery challenge: Fulfilling the promise of therapeutic genome editing. Nat Biotechnol. 2020; 38: 845-855.
Yip BH. Recent advances in CRISPR/Cas9 delivery strategies. Biomolecules. 2020; 10: 839.
Araldi RP, Khalil C, Grignet PH, Teixeira MR, de Melo TC, Módolo DG et al. Medical applications of clustered regularly interspaced short palindromic repeats (CRIPSR/Cas) tools: A comprehensive overview. Gene. 2020; 745: 144636.
Doudna JA. The promise and challenge of therapeutic genome editing. Nature. 2020; 578: 229-236.
Yu N, Yang J, Mishina Y, Giannobile WV. Genome editing: A new horizon for oral and craniofacial research. J Dent Res. 2019; 98: 36-45.
Buduru SD, Gulei D, Zimta A-A, Tigu AB, Cenariu D, Berindan-Neagoe I. The potential of different origin stem cells in modulating oral bone regeneration processes. Cells. 2019; 8: 29.
Zheng C, Chen J, Liu S, Jin Y. Stem cell-based bone and dental regeneration: A view of microenvironmental modulation. International J Oral Science. 2019; 11: 23.
Zeballos MA, Gaj T. Next-generation CRISPR technologies and their applications in gene and cell therapy. Trends Biotechnol. Available online 1 December 2020:
https://doi.org/10.1016/j.tibtech.2020.10.010.Cox DBT, Platt JP, Zhang F. Therapeutic genome editing: Prospects and challenges. Nat Med. 2015; 21: 121-131.
Azangou-Khyavy M, Ghasemi M, Khanali J, Boroomand-Saboor M, Jamalkhah M, Soleimani M et al. CRISPR/Cas: From tumour gene editing to T cell-based immunotherapy of cancer. Frontier. Immunonol. 2020; 11: 2062.
Lamont RJ, Koo H, Hajishengallis G. The oral microbiota: Dynamic communities and host interactions. Nat Rev Microbiol. 2018; 16: 745-759.
Gong T, Zeng J, Tang B, Zhou X, Li Y. CRISPR-Cas systems in oral microbiome: From immune defense to physiological regulation. Mol Oral Microbiol. 2020; 35: 41-48.
Rho M, Wu Y-W, Tang H, Doak TG, Ye Y. Diverse CRISPRs evolving in human microbiomes. PLoS Genet. 2012; 8: e1002441.
Münch PC, Franzosa EA, Stecher B, McHardy AC, Huttenhower C. Identification of natural CRISPR systems and targets in the human microbiome. Cell Host Microbe. 2021; 29: 94-106.
Gong T, Tang B, Zhou X, Zeng J, Lu M, Guo X et al. Genome editing in Streptococcus mutans through self-targeting CRISPR arrays. Mol Oral Microbiol. 2018; 33:440-449.
Burmistrz M, Dudek B, Staniec D, Martinez JIR, Bochtler M, Potempa J et al. Functional analysis of Porphyromonas gingivalis W83 CRISPR-Cas systems. J Bacteriol. 2015; 197: 2631-2641.
Chen T, Olsen I. Porphyromonas gingivalis and its CRISPR-Cas system. J Oral Microbiol. 2019; 11: 1638196.
Barbour A, Glogauer J, Grinfeld L, Memar RO, Fine N, Tenenbaum H et al. The role of CRISPR-Cas in advancing precision periodontics. J Periodont Res. 2021; 00:1-8. https://doi.org/10.1111/jre.12846
Moghadam F, LeGraw R, Velazquez JJ, Yeo NC, Xu C, Park J et al. Synthetic immunomodulation with CRISPR super-repressor in vivo. Nat Cell Biol. 2020; 22: 1143-1154.
de la Fuente-Nunez C, Torres MDT, Mojica FJM, Lu TK. Next-generation precision antimicrobials: towards personalized treatment of infectious diseases. Curr Opin Microbiol. 2017; 3: 95-102.
Porteus MH. A new class of medicines through DNA editing. N Engl J Med 2019; 380: 947-959.
Verma R, Sahu R, Sing DD, Egbo TE. A CRISPR/Cas9 based polymeric nanoparticles to treat/inhibit microbial infections. Semin Cell Dev Biol. 2019; 96: 44-52.
Beisel CI, Goma AA, Barrangou R. A CRISPR design for next-generation antimicrobials. Genome Biol. 2014; 15:516.
Kiga K, Tan X-E, Ibarra-Chávez R, Watanabe S, Aiba Y, Sato’o Y et al. Development of CRISPR-Cas13a-based antimicrobials capable of sequence-specific killing of target bacteria. Nature Communications 2020; 11: 2934, https://doi.org/10.1038/s41467-020-16731-6
Pursey E, Sünderhauf D, Gaze WH, Westra ER, van Houte S. CRISPR-Cas antimicrobials: Challenges and future prospects. PLoS Pathogens. 2018; 14: e 1006990, https://doi.org/10.1371/journal.ppat.1006990
National Academies of Sciences, Engineering, and Medicine. 2019. Second International Summit on Human Genome Editing: Continuing the Global Discussion: Proceedings of a Workshop—in Brief. Washington, DC: The National Academies Press. doi: https://doi.org/10.17226/25343
English summary
Bakken V.
CRISPR-Cas: Actual and possible applications in dentistry
Nor Tannlegeforen Tid. 2021; 131: 898-904.
The Clustered Regularly Interspaced Short Palindromic Repeats (CRISPR) -Cas system was first discovered and described as adaptive immunity in prokaryotic organisms. CRISPR-Cas provides protection against bacteriophages, plasmids and transposons by incorporating short DNA sequences that previously infected, into the genome of the prokaryotic organisms. Bacteriophages are recognized and destroyed by nucleases upon reinfection. The technology was further developed into an effective tool for genome editing of eukaryotic organisms. And now, just a few years after the discovery, this tool will be used in many applications. Therapeutic genome editing, regenerative medicine, cancers, infectious diseases, diagnostics and vaccine development are relevant medical areas. All disciplines in the life sciences will use these tools. However, there are many unsolved problems that require the tools to be further improved and that they can be delivered in a safe way to the cells and tissues for which CRISPR-Cas will be used.
Korresponderende forfatter: Vidar Bakken, e-post: vidar.bakken@uib.no
Akseptert for publisering den 6. august 2021
Artikkelen har gjennomgått ekstern faglig vurdering.
Bakken V. CRISPR-Cas: Aktuelle og mulige anvendelser i odontologi. Nor Tannlegeforen Tid. 2021; 131: 898-904.
Norsk MeSH: CRISPR-Cas-system; Genredigering; Genetisk terapi; Mikrobiom; Munnhulesykdommer