Myasthenia gravis og orale utfordringer
Myasthenia gravis er en sjelden autoimmun sykdom karakterisert ved fluktuerende muskelsvekkelse og -utmattelse. Pasienter kan ha et komplisert sykdoms- og behandlingsbilde som kan gi utfordringer for tannhelsepersonell og stille krav til kunnskap om sykdommen. Tannlegen står i en unik situasjon blant helsepersonell i å kunne diagnostisere sykdommen tidlig. I dag har økt kunnskap og behandlingsmetoder ført til at disse pasientene har bedre forutsetninger, tannbehandling kan også utføres trygt, men likevel er det en rekke utfordringer knyttet til rutinemessig tannbehandling. Det presenteres her en kasuistikk om en pasient med talevansker som kom til studentklinikken på Det odontologiske fakultet, Universitetet i Oslo. Denne kasuistikken er et eksempel på udiagnostisert myasthenia gravis og tannlegens rolle.
Kasus
En 65 år gammel mann ønsket en undersøkelse ved Det odontologiske fakultets klinikker grunnet tale- og spisevansker (henholdsvis dysartri og dysfagi). Pasienten hadde blitt behandlet ved klinikken for kronisk periodontitt og fått utlevert trådklammerprotese både i over- og underkjeven tre måneder tidligere (figur 1a,b). Pasienten lurte på om disse vanskene kunne skyldes trådklammerprotesen. Ved behandlingsstart hadde pasienten lommedybder på 6–9 mm med blødning ved sondering som ble redusert til ≤ 5 mm etter systematisk depurasjon. Videre ble han anbefalt vedlikeholdsbehandling hver tredje måned. Pasienten tok Simvastatin og Albyl-E profylaktisk etter mistanke om blodpropp i hjernen i 2017. Klinisk undersøkelse viste utydelig tale, sikling, manglende evne til å lukke underkjeven, ptose (hengende øyelokk) og noe mimikkfattig venstre ansiktshalvdel. Pasienten måtte løfte underkjeven med hånden sin for å lukke den, og med en gang han fjernet hånden, falt den ned igjen. Disse symptomene hadde ifølge pasienten vært progredierende. Talevanskene var såpass uttalte ved undersøkelsen at kommunikasjon måtte foregå skriftlig. Pasienten var ikke i stand til å spise annet enn bløt og flytende kost. Symptomene presenterte seg akutt cirka to uker tidligere. Pasienten har sett utviklingen litt an ettersom han hadde hatt en lignende episode året før, men opplevde da spontan forbedring etter tre uker. I den forbindelse ble det rekvirert MR som ikke viste tegn til nytt, men tegn til tidligere infarkt. Undersøkelse av kjeveleddene ga mistanke om luksasjon grunnet en tydelig preurikulær grop ved palpasjon venstre side, og kjeveleddene ble reponert av en spesialist i oral medisin og oral kirurgi. Det ble rekvirert et panoramarøntgen for å undersøke kjeveleddenes posisjon og potensielle patologiske prosesser. Panoramarøntgenbildet avdekket ikke ytterligere patologiske funn og antydet normale kjeveleddsrelasjoner (figur 2). Pasientens symptomer forble derimot upåvirkede. Intraoral undersøkelse viste begrenset bevegelighet av tungen. Protesene hadde god tilpasning og retensjon, og ingen bløtvevsinterferenser ble registrert.
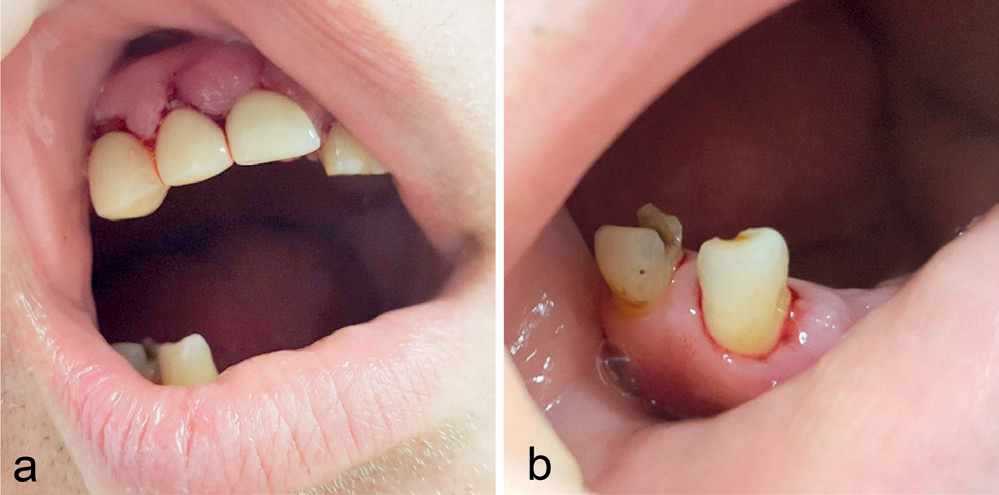
Figur 1. a,b: Ved behandlingsstart hadde pasienten flere dype lommer med blødning og få gjenværende tenner. Pasienten har samtykket til publisering av bilder og holder selv i leppene.
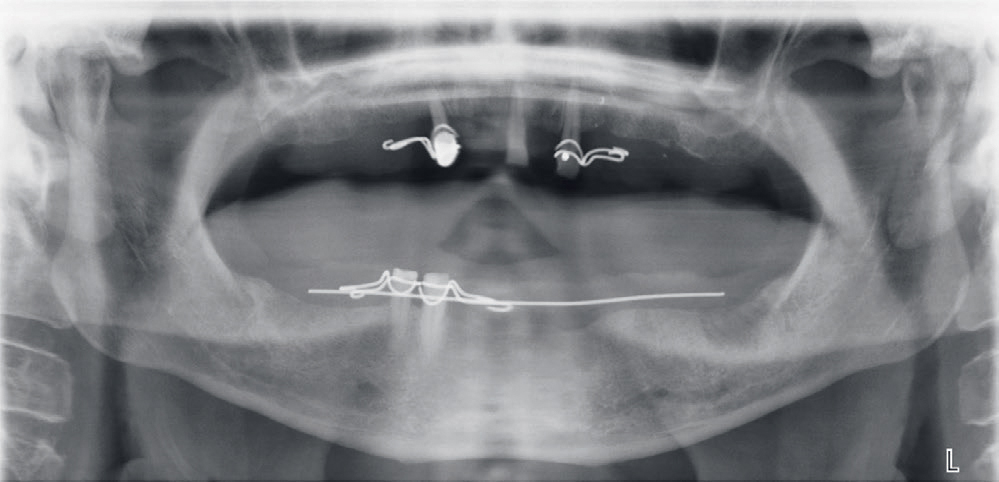
Figur 2. Panoramarøntgen med trådklammerprotese. Legg merke til normale kjeveleddsrelasjoner og anatomiske forhold. Det kan også sees at broen i overkjeven er fjernet siden behandlingsstart, og det uttalte bentapet på de resterende overkjevetennene.
Pasientens symptombilde ga mistanke om blodpropp, nevrologisk sykdom eller svulst, og han ble dermed henvist videre til utredning ved Ahus universitetssykehus. Under innleggelse for utredning utviklet pasienten gradvis parese av proksimale deler av overekstremitetene og måtte mates via sonde grunnet aspirasjonsfare og redusert svelgeevne. Diagnosen myasthenia gravis ble stilt. Etter behandling med pyridostigmin og prednisolon forsvant symptomene gradvis.
Pasienten har samtykket til publisering av bilder.
Mysthenia gravis
Myasthenia gravis (MG) er en sjelden autoimmun sykdom som rammer neuromuskulære synapser, karakterisert ved fluktuerende muskelsvekkelse og -utmattelse. Vanskeligheter med eller manglende evne til å lukke kjeven kan være et typisk funn ved MG. I dag har økt kunnskap og behandlingsmetoder ført til at disse pasientene har mye bedre utsikter enn hva de hadde tidligere (1). Likevel er det en rekke utfordringer knyttet til rutinemessig tannbehandling av pasienter med MG.
Epidemiolgi
Globalt sett har sykdommen en prevalens på 150 per million, og det er om lag 700 personer med MG i Norge. Den årlige insidensen er på 7 per million (2). Typisk er det kvinner i 20–30 årene og menn i 50–60 årene som rammes, men alle aldersgrupper kan få tilstanden. Prevalensen og insidensen gjelder dog kun seropositive, det kan derfor spekuleres å være et høyere antall tatt i betraktning mulige udiagnostiserte pasienter.
Patogenese
MG er en autoimmun sykdom med antistoffer som angriper acetylkolinreseptorer ved den neuromuskulære endeplaten (3). Dette antas å føre til en redusert tilgjengelighet av acetylkolinreseptorene, som i tur hemmer signaltransmisjon og muskelkontraksjon (4). Disse antistoffene kan måles hos 80–90 % av pasientene og regnes å være den diagnostiske gullstandarden. Imidlertid finnes også MG-pasienter med normale verdier av acetylkolinreseptorer i blodet som indikerer at antallet funksjonelle acetylkolinreseptorer ikke fullt ut forklarer alvorlighetsgraden av sykdommen (1). Diagnosen stilles også på klinisk og anamnestisk grunnlag, eller ved administrasjon av acetylkolinesterase-inhibitorer som neostigmin og påfølgende symptombedring. Spesialiserte nevrofysiologiske tester, som repetitiv nervestimulering og enkeltfiberelektromyografi, er viktige i diagnosen av pasienter uten antistoffer (5, 6). Etiologien er uavklart. En andel av pasientene med MG har også et tymom som ofte gror sakte og sjeldent metastaserer, men kan kreve kirurgisk fjerning (7). Tymektomi viser dessuten å ha en positiv innvirkning på sykdomsbildet ved MG (8). Thymus har vært diskutert å være involvert i sykdomsutviklingen (9). MG er assosiert med økt risiko for flere autoimmune sykdommer inkludert Graves sykdom, revmatoid artritt, og systemisk lupus erythematosus (10).
Klinisk bilde
Det typiske bildet er svakhet i tverrstripet muskulatur med muskeltretthet som forverres ved gjentakende muskelbruk. Typisk er også at symptomene er mildest om morgenen og forverres utover dagen (1). I 85 % av tilfellene er initialfasen preget av ptose og dobbeltsyn grunnet svekkelse av de ekstraokulære musklene. Hos 80 % av disse utvikles gjerne en generalisert MG, hos de resterende tilfellene vil symptomene fortsette å være lokalisert til det okulære, okulær MG. I 15 % av tilfellene er initialfasen og dermed primærsymptomene preget av vanskeligheter med tygging, dysfagi og dysartri (1). Som konsekvens av svekket tyggeapparat kan dette føre til vekttap, spesielt hos eldre voksne (11). I tillegg kan en uvanlig stemme manifestere seg grunnet svekkede leppebevegelser og bløt gane (12). En komplikasjon av MG er en forverring av muskelsvakhet som eventuelt resulterer i respirasjonssvikt, myasten krise, som krever intubasjon og mekanisk ventilering (13).
Orale utfordringer
Tannlegen kan være den første til å møte en pasient med udiagnostisert MG. Tannlegen kan fange opp symptomer særlig relatert til det stomatognatiske systemet, som svelge-, tale- og tyggevansker, redusert bittkraft eller en hengende underkjeve og manglende evne til å lukke denne selv (14–16). I tillegg gir MG redusert tungekraft i sideretning (17), som også kan gi treg svelgefunksjon (18), og en typisk myasteni-tunge, med atrofi og longitudinelle furer, kan av og til observeres (19). Differensialdiagnostikk mellom MG og TMD ved symptomer som begrenset gapeevne bør også vurderes da rekvirering av en bittskinne til en MG-pasient kan forverre muskelsvakhet i tyggeapparatet (15). Vanskeligheter med muskelsvakhet i hender og overekstremitetene kan vanskeliggjøre intraoralt renhold, og en plutselig økning av plakkforekomst bør derfor også undersøkes med tanke på underliggende MG (16). Redusert retensjon av avtagbare proteser, da spesielt helproteser, kan være tidlig tegn på MG, da retensjon av disse krever en viss grad av muskulær koordinasjon for adekvat retensjon og vakuumeffekt (20), samtidig vil dårlig tilpassede proteser kunne føre til at pasienten raskere blir muskeltrett. MG kan medføre en rekke utfordringer for tannhelsepersonellet, og pasientene selv, i forhold til behandling.
Tannbehandling kan kreve forbehold. Det er fordelaktig å gjøre seg kjent med pasientens alvorlighetsgrad og symptomer av MG-sykdommen. I de fleste tilfeller er symptomene velkontrollerte og stabile, med mild neuromuskulær involvering, slik at mesteparten av tannbehandling kan utføres trygt uten spesialutstyr. En sykehusbasert klinikk med tilgang til intubasjon og respirasjonsassistanse bør prioriteres for pasienter med alvorlig grad av MG, eller som i tillegg til mild MG har uttalt tannbehandlingsangst eller behøver omfattende oralkirurgiske inngrep. For pasienter som skal gjennomgå omfattende oralkirurgiske inngrep og med alvorlig grad av MG, vil preoperativ plasmatilførsel, plasmaferese, kunne vurderes som et alternativ. Dette er som en korttids immunterapi å regne, der acetylkolinreseptor-antistoffer fjernes fra sirkulasjonen (16).
Tannbehandling anbefales tilrettelagt over flere korte morgenøkter for å unngå at muskelsvakhet akkumuleres utover dagen, muskelstyrken er også som oftest best tidlig på dagen (1). Ved undersøkelse og behandling av en MG-pasient kan det være fordelaktig å benytte seg av en bitekloss for å redusere stresset i tyggeapparatet, samtidig bør det innføres periodiske pauser for pasienten til å hente seg inn igjen. Administrasjon av antikolinesterase per os ca. 90 minutter før tannbehandling kan vurderes for å maksimere effekten utover i behandlingsseansen for økt nakke- og oral funksjon, men dette bør eventuelt gjøres i samarbeid med pasientens fastlege eller behandlende nevrolog. En nesten-oppreist posisjon i stolen er å foretrekke for å redusere risikoen for regurgitasjon. Svakhet i de supraglottiske konstriktormusklene som forsegler den laryngeale inngangen og hypersalivasjon er bivirkninger av antikolinesterasemedikamenter, og dermed øker risikoen for å aspirere saliva og andre væsker. Å isolere arbeidsfeltet med kofferdam, samt aktivt bruk av sug er tiltak som kan minske risikoen for aspirasjon av saliva, andre væsker eller partikler (16).
En pasient med MG bruker med stor sannsynlighet medikamenter som kan ha konsekvenser for odontologisk behandling. Antikolinesteraser, som pyridostigmin, forbedrer muskelfunksjonen ved å redusere effekten til kolinesterase og dermed forlenges virkningen til acetylkolin i synapsene (21). Glukokortikoider som prednisolon og immunsuppressive midler som ciklosporin er hyppig brukt i behandling av MG (22, 23). Sistnevnte kan gi medikamentindusert gingival overvekst. I tillegg er både lymfoid follikulær hyperplasi i thymus og thymom assosiert med immundysregulering via T-celler (24). MG-pasienter, spesielt dersom thymisk abnormalitet er tilstede eller de går på høydose steroidbehandling, kan ha en økt risiko for opportunistiske infeksjoner og forsinket sårtilheling (16). Derfor bør det vurderes antibiotikaparaply.
Enkelte medikamenter brukt i odontologien kan gi mulige komplikasjoner ved å forverre muskelsvakhet eller ved å interferere med respirasjon (16). Paracetamol og NSAIDs kan administreres trygt (16). Lokalanestesi har blitt rapportert å kunne ha en forsterkende effekt av neuromuskulærblokkerende medikamenter (16, 25), men det foreligger ikke litteratur som dokumenterer slike negative konsekvenser av lokalanestesi i klinisk odontologisk sammenheng. Ettersom MG-pasienter går på antikolinesterase-medikamenter, vil esterbaserte lokalanestesimidler, eller artikain (ester-amid), kunne ha lengre virkningstid og økt risiko for systemisk toksisitet. Enkelte antibiotika kan ha lignende inhiberende effekt av acetylkolin fra den presynaptiske membranen (16).
Myasthenia gravis regnes som en sjelden medisinsk tilstand (SMT) som kan gi rett til Helfo-stønad av tannbehandling. Myasthenia gravis står på A-listen under SMT, som gir vedkommende stønadsrett til all nødvendig tannbehandling. Pasientens rettigheter gjelder fra datoen diagnosen blir stilt.
Konklusjon
Myasthenia gravis er en varig neuromuskulær sykdom, karakterisert ved fluktuerende muskelsvekkelse og -svakhet. Et komplisert sykdomsbilde som kan affisere ansikts- og oral muskulatur kan gi tannhelsepersonell flere behandlingsutfordringer. Kjennskap til sykdommen kan gi tannleger et fortrinn i å oppdage Myasthenia gravis på et tidlig tidspunkt.
Referanser
Grob D, Brunner N, Namba T, Pagala M. Lifetime course of myasthenia gravis. Muscle Nerve. 2008; 37: 141–9.
Heldal AT, Owe JF, Gilhus NE, Romi F. Seropositive myasthenia gravis: a nationwide epidemiologic study. Neurology. 2009; 73: 150–1.
McGrogan A, Sneddon S, de Vries CS. The incidence of myasthenia gravis: a systematic literature review. Neuroepidemiology. 2010; 34(3): 171–83.
Vincent A, Leite MI, Farrugia ME, Jacob S, Viegas S, Shiraishi H, et al. Myasthenia gravis seronegative for acetylcholine receptor antibodies. Ann N Y Acad Sci. 2008; 1132: 84–92.
Gilhus NE, Tzartos S, Evoli A, Palace J, Burns TM, Verschuuren JJGM. Myasthenia gravis. Nat Rev Dis Primer. 2019; 5: 30.
Chiou‐Tan FY, Gilchrist JM. Repetitive nerve stimulation and singlefiber electromyography in the evaluation of patients with suspected myasthenia gravis or Lambert–Eaton myasthenic syndrome: Review of recent literature. Muscle Nerve. 2015; 52: 455–62.
Okumura M, Fujii Y, Shiono H, Inoue M, Minami M, Utsumi T, et al. Immunological function of thymoma and pathogenesis of paraneoplastic myasthenia gravis. Gen Thorac Cardiovasc Surg. 2008; 56: 143–50.
Gilhus NE. Myasthenia gravis. N Engl J Med. 2016; 375: 2570–81.
Fujii Y. The thymus, thymoma and myasthenia gravis. Surgery today. 2013; 43: 461–6.
Fang F, Sveinsson O, Thormar G, Granqvist M, Askling J, Lundberg IE, et al. The autoimmune spectrum of myasthenia gravis: a Swedish population‐based study. J Intern Med. 2015; 277: 594–604.
Oosterhuis H. Clinical aspects. Myasthenia gravis: CRC Press Boca Raton; 1993. p. 13–42.
Bottomley WK, Terezhalmy GT. Management of patients with myasthenia gravis who require maxillary dentures. J Prosthet Dent. 1977; 38: 609–14.
Wendell LC, Levine JM. Myasthenic crisis. Neurohospitalist. 2011; 1: 16–22.
Weijnen FG, van der Bilt A, Kuks JB, van der Glas HW, Oudenaarde I, Bosman F. Masticatory performance in patients with myasthenia gravis. Arch Oral Biol. 2002; 47: 393–8.
Sasakura Y, Kumasaka S, Takahashi T, Shindo J. Myasthenia gravis associated with reduced masticatory function. Int J Oral Maxillofac Surg. 2000; 29: 381–3.
Tamburrini A, Tacconi F, Barlattani A, Mineo TC. An update on myasthenia gravis, challenging disease for the dental profession. J Oral Sci. 2015; 57: 161–8.
Weijnen F, Kuks J, Van Der Bilt A, Van Der Glas H, Wassenberg M, Bosman F. Tongue force in patients with myasthenia gravis. Acta Neurol Scand. 2000; 102: 303–8.
Weijnen F, Van Der Bilt A, Wokke J, Wassenberg M, Oudenaarde I. Oral functions of patients with myasthenia gravis. Ann N Y Acad Sci. 1998; 841: 773–6.
Zouvelou V, Rentzos M, Toulas P, Evdokimidis I. Myasthenic tongue. Neuromuscul Disord. 2012; 22: 289–90.
Gallagher DM, Erickson KL, Genkins G. Current concepts in the surgical treatment of patients with myasthenia gravis. J Oral Surg. 1981; 39: 30–4.
Thanvi BR, Lo TC. Update on myasthenia gravis. Postgrad Med J. 2004; 80(950): 690–700.
Johns T. Long‐term corticosteroid treatment of myasthenia gravis. Ann N Y Acad Sci. 1987; 505: 568–83.
Tindall RS, Phillips JT, Rollins JA, Wells L, Hall K. A Clinical Therapeutic Trial of Cyclosporine in Myasthenia Gravis a. Ann N Y Acad Sci. 1993; 681: 539–51.
Berrih-Aknin S, Le Panse R. Myasthenia gravis: a comprehensive review of immune dysregulation and etiological mechanisms. J Autoimmun. 2014; 52: 90–100.
Matsuo S, Rao DB, Chaudry I, Foldes FF. Interaction of muscle relaxants and local anesthetics at the neuromuscular junction. Anesth Analg. 1978; 57(5): 580–7.
Korresponderende forfatter: Anders Verket, Institutt for klinisk odontologi. Det odontologiske fakultet, Universitetet i Oslo. E-post: anderver@odont.uio.no
Artikkelen har gjennomgått ekstern faglig vurdering.
Godtatt for publisering 08.02.2020
Skallevold HE, Verket A. Myasthenia gravis og orale utfordringer. Nor Tannlegeforen Tid. 2020; 130: 614–7
Norsk MeSH: Myasthenia gravis; Periodonti; Kjeveledd; Lokalanestesi; Kasusrapporter
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Skallevold HE, Verket A. Myasthenia gravis og orale utfordringer. Nor Tannlegeforen Tid. 2020;131:614-7. doi:10.56373/2020-8-6