Endodontiska infektioner och allmänhälsa
DDS, forskarstuderande. Avdelningen för endodonti, Institutionen för Odontologi, Sahlgrenska Akademin, Göteborgs Universitet, Göteborg, Sverige.
DDS, PhD, lektor. Avdelningen för endodonti, Institutionen för Odontologi, Sahlgrenska Akademin, Göteborgs Universitet, Göteborg, Sverige.
DDS, PhD, docent. Avdelningen för oral medicin, Karolinska institutet, Stockholm, Sverige.
DDS, PhD, lektor. Avdelningen för oral maxillofacial radiologi, Institutionen för Odontologi, Sahlgrenska Akademin, Göteborgs Universitet, Göteborg, Sverige.
DDS, PhD, docent. Avdelningen för endodonti, Institutionen för Odontologi, Sahlgrenska Akademin, Göteborgs Universitet, Göteborg, Sverige.
Frågan om det finns ett samband mellan kroniska orala infektionstillstånd och allmänhälsa har intresserat människan i decennier. Karies och parodontit är de två vanligaste patologiska tillstånden i munhålan. Fokus har mestadels legat på parodontit och dess eventuella koppling till olika systemiska sjukdomar. Många studier ger stöd för ett samband mellan parodontit och exempelvis hjärt-kärlsjukdom, stroke, diabetes, prematur födsel och låg födselvikt. Sambandet mellan inflammationer av endodontiskt ursprung och allmänsjukdomar har inte utretts i lika stor utsträckning. Trots olikheterna i patogenes och lokalisation så finns det likheter mellan marginal och apikal parodontit. De båda sjukdomarna har en jämförlig bakterieflora och associeras med ökade mängder inflammatoriska cytokiner i blodet. På samma sätt som marginal parodontit har visats ha ett samband med olika systemiska sjukdomar, är det tänkbart att ett liknande samband existerar för apikal parodontit. Hittills har framför allt samband med hjärt-kärlsjukdom och diabetes mellitus studerats. Den här artikeln ger en teoretisk bakgrund för mekanismer med vilka endodontiska inflammationstillstånd kan tänkas ha inverkan på hjärt-kärlsjukdom respektive diabetes mellitus, följt av en genomgång av resultaten från kliniska studier. Andra sjukdomar med eventuell koppling till endodontiska inflammationstillstånd behandlas kortfattat i ett avslutande stycke.
Klinisk relevans
Trots bättre tandhälsa utförs årligen ett stort antal rotbehandlingar på grund av tandvärk eller andra tecken på inflammation eller infektion i tandpulpan. Påvisade samband mellan endodontiska sjukdomstillstånd och allmänsjukdomar som diabetes och hjärt-kärlsjukdom är svaga och osäkra. Åtgärder för att förebygga karies och tandtrauma, samt att när det är påkallat utföra rotbehandlingar av god kvalitet, så att förekomsten av endodontiska infektioner minskar motiveras väl utifrån ett odontologiskt perspektiv. Det finns gott vetenskapligt stöd för att friska tänder och god munhälsa främjar god livskvalitet. Ifall frånvaro från endodontiska infektioner också bidrar till en minskad risk för allmänsjukdomar är i dagsläget osäkert.
Introduktion
Endodontisk infektion och apikal parodontit
Karies är världens vanligaste, icke smittsamma, infektionssjukdom. Den är multifaktoriell, men kosten, den enskilda individens mottaglighet och förekomst av syrabildande bakterier är de viktigaste faktorerna. Syrorna som bildas i placket som ansamlas på emaljen bryter ner tandens hårdvävnader, så att munhålebakterier kan etablera sig i dentinet. Redan tidigt i processen uppstår en inflammationsreaktion i tandpulpan, pulpit. En endodontisk infektion kan beskrivas som en bakteriell kolonisation av pulparummet och rotkanalsystemet och uppstår först när skadorna i tandens emalj och dentin blivit så omfattande att pulpan blivit kraftigt inflammerad eller till stora delar har gått i nekros.
Apikal parodontit är en inflammation i den periradikulära vävnaden i anslutning till rotkanalernas mynningar och bildas som ett svar på infektionen i rotkanalsystemet. Aktivering av immunsystemets olika komponenter utgör i de flesta fall ett effektivt hinder för fortsatt spridning av infektionen. Det periapikala benet resorberas för att ersättas med en vävnad rik på blodkärl och med ett stort innehåll av förvarsceller av olika typer. På en röntgenbild tecknar sig en bendestruktion, oftast kring rotspetsen. Diagnosen ställs med hjälp av anamnes, klinisk undersökning inklusive en undersökning av pulpans vitalitet samt det röntgenologiska utseendet. Det är vanligt att apikal parodontit är asymtomatisk och upptäcks först i samband med en rutinundersökning.
Symtomatisk apikal parodontit karakteriseras av smärta och ömhet från den aktuella tanden och inte sällan en lokal svullnad. Symtomen kan komma akut eller smygande och orsakas av att balansen mellan immunsystemets etablerade försvar och de mikrobiologiska angreppsfaktorerna rubbats. Abscessbildning eller spridning av infektionen med feber och allmänpåverkan förekommer. I värsta fall kan spridningen ge upphov till livshotande tillstånd.
Trots att den orala hälsan i Sverige idag är betydligt bättre än vad den tidigare varit så genomförs i storleksordningen 250 000 rotbehandlingar i landet varje år (1). Prognosen för behandlingen är i allmänhet god där den absoluta majoriteten av tänderna förväntas bli symtomfria och kunna vara i funktion under lång tid utan tecken på kvarstående infektion. Det finns dock fall där delar av infektionen blir kvar i rotkanalssystemet och den apikala parodontiten kvarstår trots utförd rotbehandling. En sådan form av sjukdomen är oftast asymtomatisk och kronisk, eftersom den inte sällan både förblir oupptäckt och obehandlad.
Prevalensen av apikal parodontit varierar i olika studier. Det kan förklaras med olika ålder på de studerade populationerna, i vilket land studierna genomförts samt olika metoder och kriterier för bedömning av röntgenbilder. I en översiktsartikel rapporterades 5% av alla inkluderade tänder uppvisa röntgenologiska tecken på apikal parodontit (2). Stor skillnad råder mellan redan rotbehandlade tänder och obehandlade tänder, där förekomst av apikala bendestruktioner hos rotfyllda tänder var 36%, mot enbart 2% hos obehandlade tänder. Epidemiologiska tvärsnittsstudier utförda i Skandinavien rapporterar om en frekvens av apikal parodontit vid alla rotfyllda tänder i storleksordningen 25- 50% (3, 4, 5).
Kronisk inflammation och systemiska sjukdomar
Synen inom tandvården och medicinen på apikal parodontit som en härd (ett fokus) av kronisk infektion och inflammation med eventuella kopplingar till olika systemiska sjukdomar har varierat över tid. Att endodontiska infektioner kan ge upphov till mycket lidande i form av lokal värk och svullnad och att abscesser under ogynnsamma omständigheter kan sprida sig till bihålor, ögat och svalget är väl känt. Men, kan apikal parodontit som ett fokus av bakterier och kronisk inflammation också via blodkärl och lymfa » i tysthet» ha kopplingar till olika systemiska sjukdomar? Kan den endodontiska infektionen, förutom att orsaka tandvärk och tandförlust, även negativt påverka den allmänna hälsan?
Marginal parodontit har hittills varit den mest studerade orala sjukdomen gällande samband med systemiska sjukdomar. Diabetes mellitus har setts ge ökad risk för att drabbas av parodontit samt påverka sjukdomens allvarlighetsgrad. Samtidigt kan parodontit i sig ha inverkan på diabetes och den glykemiska kontrollen. Det tycks alltså existera ett dubbelriktat samband mellan parodontit och diabetes. Ett samband har även setts mellan parodontit och hjärt-kärlsjukdom, där individer med parodontit har visats löpa större risk att utveckla hjärt-kärlsjukdom (6). En studie som jämförde hjärtinfarktpatienter med en ålders, köns och geografiskt matchad kontrollgrupp fann att parodontit var vanligare hos hjärtinfarktpatienter än friska. Parodontit rapporterades ge en ökad risk att drabbas av hjärtinfarkt (7).
Marginal parodontit respektive och apikal parodontit har olika etiologi och patogenes. Där apikal parodontit är ett immunologiskt svar på en, oftast karies-orsakad, infektion i pulpan beror marginal parodontit snarare på en ekologisk obalans mellan befintliga bakterier och individens immunförsvar vilket orsakar en kronisk inflammation och vävnadsnedbrytning. Interaktionen mellan bakterierna och immunförsvaret avgör allvarlighetsgraden av sjukdomen och olika individer förefaller vara olika mottagliga. Trots olikheterna mellan marginal och apikal parodontit så uppvisar båda tillstånden även en hel del likheter. Båda sjukdomarna är lokaliserade till tandens parodontium och bakteriefloran är likartad med övervägande Gram-negativa anaeroba bakterier. Frisättning av bakterieprodukter, så som endotoxiner, leder till immunologisk produktion av inflammatoriska mediatorer, exempelvis olika cytokiner (8). Ett samband mellan apikal parodontit och andra sjukdomar, på samma sätt som för parodontit, är därför tänkbar och sannolik. Det finns idag flera publicerade studier, både djurmodeller och humanstudier, som beskriver samband mellan apikal parodontit och olika systemiska sjukdomar (9).
Några svårigheter med att studera samband mellan apikal parodontit och systemiska sjukdomar
Inom parodontologin finns det väletablerade metoder att sammanfatta de olika skadorna och diagnoserna för enskilda tänder och ytor till en sammanvägd parodontal diagnos för den enskilde individen. Sjukdomstillståndet apikal parodontit har inte på samma sätt beskrivits på individnivå. Det är tänkbart att belastningen av endodontisk orsakad inflammation också skulle kunna anges på ett liknande sätt. För detta måste dock ett antal ställningstaganden göras, exempelvis om antalet apikala lesioner ska ställas i förhållande till antalet kvarvarande tänder och om lesionernas storlek ska ges betydelse. Annat att fundera på är om obehandlade infekterade tänder ska särskiljas från redan rotfyllda tänder med kvarstående tecken på infektion. Kanske ska rotfyllda tänder, oavsett förekomst av apikal parodontit eller ej, rentav räknas med i den totala inflammatoriska belastningen, eftersom man kan förmoda att de flesta rotfyllda tänder någon gång haft en inflammerad eller infekterad pulpa.
En annan betydande svårighet är att sjukdomen apikal parodontit oftast diagnosticeras utifrån röntgenbilder. Det finns därför risk både för över- och underdiagnostik något som också är beroende på röntgenmetod som kommer till användning och kvaliteten på röntgenbilderna. En fullt ut pålitlig bedömning av de periapikala vävnaderna skulle kräva kirurgiskt uttagna biopsier från tändernas apikalområden, vilket av förståeliga skäl är både praktiskt och etiskt nästan omöjligt att utföra. Det kommer också alltid att finnas risk för observatörsvariationer vid bedömningen av bilderna.
En undersökning som avser att utreda ett samband mellan endodontiska infektioner och låt oss säga hjärtinfarkt behöver minst två grupper av individer. En grupp som får eller har haft, i det här fallet hjärtinfarkt, och en kontrollgrupp som inte får eller inte har haft hjärtinfarkt. Nu ska dessa grupper jämföras avseende exponering av endodontiska infektioner, förekomst av apikal parodontit och antal tänder som har rotfyllts. När det gäller allt annat, som ålder, kön och andra sjukdomar, bostadsort och så vidare ska grupperna vara så lika som möjligt. Det finns i princip två metoder för att kunna få två jämförbara grupper; randomisering och matchning.
De statistiska analysmetoder som används ska kunna ta hänsyn till störfaktorer (confounders) dvs. variabler som påverkar relationen mellan de två tillstånd som studeras. Låt oss ta ett exempel. Ett frekvent intag av socker är en påtaglig riskfaktor för karies men kan också på sikt leda till övervikt, som i sin tur höjer risken för att utveckla diabetes Typ II, som i sin tur är en riskfaktor för hjärt-kärlsjukdom. Karies är också den bakomliggande faktorn för de flesta pulpaskador och därmed också till apikal parodontit. I en studie där ett samband mellan apikal parodontit och hjärt-kärlsjukdom uppmätts kan relationen kanske helt eller delvis vara beroende på den gemensamma bakomliggande faktorn; högt sockerintag. I de statistiska analyserna behöver man därför, så långt det är möjligt justera för sådana tänkbara störande faktorer.
Även om det är nästan omöjligt att genomföra studier som helt saknar felkällor så kan resultaten och de slutsatser som presenteras vara välgrundade. Men det är angeläget att läsa vetenskapliga rapporter med ett kritiskt öga. Det finns numer ganska många studier som tyder på ett samband mellan endodontiska infektioner och olika systemiska tillstånd. Men, även om ett samband mellan apikal parodontit och exempelvis hjärt-kärlsjukdom rapporteras i allt fler studier, behöver det inte nödvändigtvis betyda att det ena leder till det andra, eller tvärtom. Orsakssamband är som regel mycket svåra att fastställa (10).
Endodontisk infektion och hjärt-kärlsjukdom
Hjärt-kärlsjukdom sjukdom är ett samlingsbegrepp för sjukdomar som drabbar cirkulationsorganen och blodkärl. Ateroskleros, åderförkalkning, är den huvudsakliga orsaken. Det är den enskilt största dödsorsaken i Sverige och sett till hela världen. Riskfaktorerna är välkända; stigande ålder, kön, rökning, diabetes och höga kolesterolvärden. Kroniska inflammatoriska processer som till exempel reumatiska sjukdomar har visat sig som ännu en riskfaktor. Många rapporter tyder också på att dålig munhälsa, och då i första hand parodontit men i tilltagande omfattning även inflammationer av endodontiskt ursprung förefaller vara ytterligare en riskfaktor.
Främst tre mekanismer med vilka orala infektionstillstånd potentiellt kan ha inverkan på kardiovaskulär sjukdom är tänkbara (se även Figur 1);
Spridning av infektion från munhålan till andra områden via bakteriemi
Frisättning av bakterieprodukter (endotoxiner)
En spridning av inflammatoriska mediatorer som orsakar ett systemiskt inflammatoriskt svar med ökad inflammatorisk belastning
Övergående bakteriemi efter ingrepp i munnen, exempelvis rotbehandling, är en tänkbar orsak till förekomsten av orala bakterier i andra delar av kroppen, t.ex. kranskärlsregionen i hjärtat. Bakterierna elimineras i regel snabbt men kan för predisponerade patienter utgöra en potentiell risk (11).
Ateroskleros utvecklas när vita blodkroppar tränger in i endotelet i kroppens artärer och tillsammans med kolesterol bildar aterosklerotiska plack. Samtidigt som det leder till trängre artärer med minskat blodflöde finns även risk för trombosbildning i samband med ruptur av de aterosklerotiska placken. En kronisk inflammation, exempelvis från en endodontisk infektion, riskerar att bidra till plackbildning och ruptur (12).
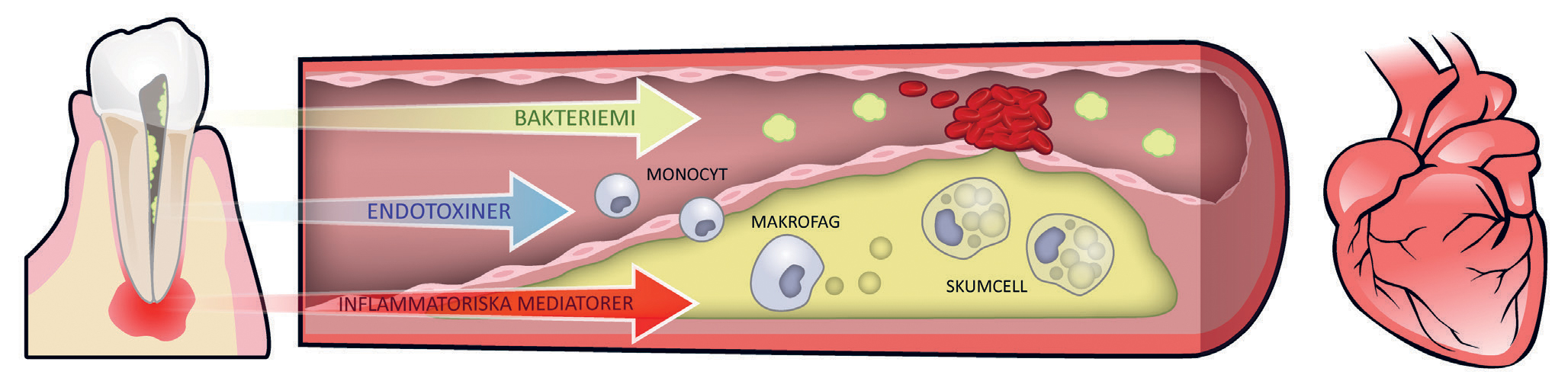
Figur 1. Tre tänkbara mekanismer som orala infektionstillstånd kan ha inverkan på systemiska sjukdomar, exempelvis hjärt-kärlsjukdom. Bakteriemi där mikroorganismerna sprids via cirkulationen till avlägsna organ, exempelvis till hjärtklaffarna. Frisättning av endotoxiner och inflammatoriska mediatorer som bland annat bidrar till aktivering och migration av monocyter genom endotelet samt destabilisering och ruptur av det aterosklerotiska placket med resulterande trombos-bildning.
Fall- och epidemiologiska studier
Ett orsakssamband mellan apikal parodontit och hjärt-kärlsjukdom har inte kunnat påvisas, men enligt flera studier kan en association mellan tillstånden ändå vara trolig. Studierna är allt som oftast tvärsnittsstudier eller fall-kontrollstudier och de endodontiska faktorer som studeras varierar. Till exempel används självrapporterad historik av endodontisk behandling och inte sällan registrering av rotfyllningar och apikala lesioner på röntgenbilder. Beroende variabel är ofta känd hjärt-kärlsjukdom men även status från datortomografier eller blodanalyser förekommer. Historik av endodontisk behandling (13) och röntgenologiska tecken på apikal parodontit har kunnat associeras med hjärt-kärlsjukdom (14, 15). Även förekomst av två eller fler rotfyllningar kunde visa en sådan association (16). Sambandet mellan förekomst av apikal parodontit och hjärt-kärlsjukdom tycks vara mer uttalat hos yngre, med en möjlig förklaring att äldre med tiden drabbas av andra riskfaktorer för sjukdomen, varefter apikal parodontit inte längre blir utmärkande (14). Ett ytterligare intressant fynd är att obehandlad apikal parodontit kunnat kopplas till högre grad av ateroskleros, bedömd genom datortomografi och angiografi (17, 18), men utan att något sådant samband sågs för rofyllda tänder med apikal parodontit (17, 19). Blodanalyser av individer med kronisk asymtomatisk apikal parodontit kunde dock visa högre nivåer av blodmarkörer, en möjlig indikation på ökad systemisk inflammatorisk belastning (20). En svensk studie, som enbart inkluderade kvinnor, kunde inte se något samband mellan förekomst av apikal parodontit och kardiovaskulär sjukdom (21). I tabell 1 ges en översikt av studier inom området endodontiska infektioner och hjärt-kärlsjukdom.
Sammanfattningsvis tycks en positiv association mellan apikal parodontit och kardiovaskulär sjukdom vara trolig. Kvaliteten på evidensen förblir dock ännu på en moderat till låg nivå och ett orsakssamband kan inte påvisas (22). Den tilltagande mängden av rapporter om en positiv korrelation motiverar dock fortsatta forskningsinsatser på området för att om möjligt bättre klarlägga korrelationens natur.
Endodontisk infektion och diabetes mellitus
Diabetes mellitus är en metabolisk störning till följd av dysfunktion hos β-cellerna i bukspottskörteln och bristfällig insulinsekretion och/eller insulinresistens. Det huvudsakliga kännetecknet utgörs av höga blodsockervärden, hyperglykemi (23).
Tre huvudsakliga rubbningar råder vid diabetes;
Försämrad funktion i det medfödda immunförsvaret
Hyperglykemi
Förekomst av dysfunktionella proteiner
Det finns möjliga mekanismer med vilka diabetes mellitus kan predisponera för kronisk inflammation, ökad mottaglighet för infektioner och minskad läkningsförmåga. Ökad frisättning inflammatoriska mediatorer och minskad frisättning tillväxtfaktorer främjar utvecklingen av kroniska inflammationstillstånd och reducerad vävnadsreparation. Minskad införsel av syre och näring till följd av kärlväggsförtjockning, i sin tur en effekt av hyperglykemin, kan ge mer uttalad progression av apikala lesioner (24, 25). Förekomst av skadliga sammansättningar av proteiner och socker (så kallade dysfunktionella proteiner) rapporteras kunna reducera benbildning och ge försämrad periapikal läkning (26). Nedsatt benomsättning och sårläkning kan öka förekomsten av kronisk apikal parodontit hos diabetiker, något flera studier verkar indikera.
En låggradig inflammation förefaller kopplad till utvecklingen av diabetes. Tänkbart är därför att apikal parodontit bidrar till det inflammatoriska tillståndet som råder vid diabetes och möjligtvis även ökad insulinresistens och dålig glykemisk kontroll (27, 28).
Kliniska djurstudier
Histologiska analyser på djurmodeller visar skillnader i inflammationsgrad och storleken på de apikala lesionerna vid diabetes. Förhöjd kariesrisk (29), apikala lesioner av större storlek (30) samt förhöjda nivåer av inflammatoriska mediatorer i blodanalyser (31) rapporteras.
Fall- och epidemiologiska studier
Kliniska och epidemiologiska studier utförda på människa har studerat sambandet mellan olika endodontiska variabler och diabetes. De huvudsakliga studerade endodontiska variablerna är:
Prevalensen av apikal parodontit hos diabetiker
Prevalensen av rotbehandlade tänder hos diabetiker
Behandlingsutfallet av rotbehandlingar hos diabetiker
Redan 1963 rapporterades att en stor andel av patienter med odontogena infektioner även var diabetiker (32). Senare studier rapporterar även högre förekomst av apikal parodontit hos diabetiker (33, 34) men likväl finns studier som inte kunnat visa skillnad mellan diabetiker och friska (35).
Förekomsten av rotfyllningar har inte visats vara större hos diabetiker än friska (33, 34, 35). Behandlingsutfallet efter en rotbehandling hos diabetiker kan studeras med två variabler; förekomst av rotfyllda tänder med kvarstående apikal parodontit eller frekvensen extraktioner av rotfyllda tänder. Med helstatus och panoramaröntgen har rapporterats fler rotfyllda tänder med apikal parodontit hos diabetiker (36, 37). Andra studier har inte sett något sådant samband (33, 35). Flera av de rotfyllda tänder som registrerats med apikal parodontit kan också vara under pågående läkning. Frekvensen extraktioner av rotfyllda tänder rapporteras skilja sig mellan diabetiker och friska (38, 39) och diabetes skulle därför kunna utgöra en riskfaktor för extraktion efter rotbehandling (40).
Sammanfattningsvis pekar resultaten från befintliga studier mot ett associationssamband mellan diabetes och apikal parodontit. Många studier rapporterar att diabetes är kopplat till en ökad förekomst av apikal parodontit.
Evidens tycks finnas för att det föreligger sämre prognos för rotbehandlingar hos diabetiker med fördröjd läkning och större risk att den rotbehandlade tanden går förlorad. Det finns även teoretiskt tänkbara mekanismer genom vilka apikal parodontit bidrar till den metaboliska dysfunktionen som råder vid diabetes. Prospektiva epidemiologiska studier behövs för att bättre förstå förhållandet mellan diabetes och apikal parodontit.
Endodontisk infektion och andra systemiska sjukdomar
Njursjukdom
En tvärsnittsstudie fann mer apikal parodontit och fler rotfyllda tänder hos njursjuka patienter jämfört med friska kontroller. Antalet tänder med apikal parodontit kunde även kopplas till urea-nivåer uppmätta i serum. Hittills finns inga belägg för ett orsakssamband men fynden väcker frågan ifall behandling av apikal parodontit ska ingå som en del i behandlingen av patienter med njursjukdom (41).
Graviditetskomplikationer
Marginal parodontit har visats utgöra en risk för prematur födsel och låg födselvikt. Inflammatoriska mediatorer ökar produktionen av prostaglandiner som associeras med låg födselvikt. Röntgenologiska tecken på apikal parodontit hos mödrar som genomgått prematur födsel med låg födselvikt hos fostret rapporteras (42). En annan studie undersökte sambandet mellan apikal parodontit och graviditetstoxikos (tidigare benämnt havandeskapsförgiftning) och fann i större utsträckning åtminstone en tand med apikal parodontit hos drabbade mödrar (43).
Leversjukdom
Levercirros, eller skrumplever, är ett tillstånd av ökad mängd bindvävsinlagring i levern, ofta orsakad av alkoholkonsumtion eller hepatit-infektion. Långvarig inflammation och cytokinfrisättning är också känt för att aktivera celler i levern till bildning av kollagen. Levertransplantation är en accepterad behandling men den immunosuppression som krävs predisponerar för infektioner. En eller fler tänder med apikal parodontit var mer frekvent förekommande hos levertransplanterade patienter. Rotfyllda tänder däremot registrerades i mindre utsträckning hos patienter jämfört med kontroller (44).
Blodsjukdomar
Patienterna med blodrubbningar, så som hemofili och von Willebrands sjukdom, uppvisade i en studie fler apikala radiolucenser, men även färre rotfyllda tänder. Fler studier krävs där grupperna matchas på välkända riskfaktorer för apikal parodontit exempelvis karies, koronal restauration och traumahistorik (45).
Studiedesign |
Provstorlek |
Resultat |
|
|---|---|---|---|
Frisk et al. 2003 (21) |
Tvärsnittsstudie |
1056 kvinnor |
Ingen association mellan endodontiska variabler och kardiovaskulär sjukdom |
Caplan et al. 2006 (14) |
Fall-kontroll |
708 män |
Samband mellan apikal parodontit och kardiovaskulär sjukdom, speciellt hos yngre |
Joshipura et al. 2006 (13) |
Kohort |
34 683 män och kvinnor |
Stark association mellan självrapporterad historia av endodontisk behandling och kardiovaskulär sjukdom |
Caplan et al. 2009 (16) |
Tvärsnittsstudie |
6651 män och kvinnor |
Samband mellan självrapporterad endodontisk behandling hos deltagare med ≥25 tänder och kardiovaskulär sjukdom |
Willershausen et al. 2009 (47) |
Fall-kontroll |
250 män och kvinnor |
Hjärtinfarktpatienter uppvisade fler endodontiska infektioner |
Segura-Egea et al. 2010 (48) |
Tvärsnittsstudie |
91 män och kvinnor |
Inget samband mellan endodontisk behandling och högt blodtryck |
Segura-Egea et al. 2011 (49) |
Fall-kontroll |
100 män och kvinnor |
Högre prevalens av endodontiska infektioner och rotbehandlingar hos patienter som röker och har högt blodtryck |
Pasqualini et al. 2012 (15) |
Fall-kontroll |
100 män och kvinnor |
Samband mellan antalet apikala parodontiter och kardiovaskulär sjukdom |
Costa et al. 2014 (18) |
Tvärsnittsstudie |
103 män och kvinnor |
Dubbelt så hög prevalens av endodontiska infektioner hos patienter med kardiovaskulär sjukdom |
Petersen et al. 2014 (17) |
Retrospektiv kohort |
531 män och kvinnor |
Åderförkalkning var större hos patienter med obehandlad apikal parodontit |
An et al. 2016 (50) |
Fall-kontroll |
364 män och kvinnor |
Patienter med apikal parodontit hade större sannolikhet att ha kardiovaskulär sjukdom |
Liljestrand et al. 2016 (19) |
Tvärsnittsstudie |
508 män och kvinnor |
Samband mellan apikal parodontit och kardiovaskulär sjukdom |
Gomes et al. 2016 (51) |
Retrospektiv kohort |
278 män och kvinnor |
Endodontisk infektion är en oberoende riskfaktor för kardiovaskulär sjukdom |
Virtanen et al. 2017 (52) |
Tvärsnittsstudie |
120 män och kvinnor |
Samband mellan apikal parodontit och kardiovaskulär sjukdom |
Garrido et al. 2019 (20) |
Tvärsnittsstudie |
55 män och kvinnor |
Samband mellan apikal parodontit och serumnivåer av inflammatoriska mediatorer |
Sammanfattande slutsatser
Det aktuella kunskapsläget, tyder på ett relativt svagt samband mellan endodontiska inflammations- och infektionstillstånd och systemiska sjukdomar. Biologiskt är ett sådant samband fullt möjligt och de tre tänkbara mekanismerna är via spridning av bakterier från den infekterade rotkanalen, spridning av endotoxiner och frisättning av inflammatoriska mediatorer som ger en förhöjd inflammatorisk belastning på kroppen. Intresset för frågan har vuxit de senaste åren. Mest studerat är kopplingen till hjärt-kärlsjukdom och diabetes mellitus och resultaten tycks tyda på ett associationssamband, men ett orsakssamband har inte påvisats. Sambanden mellan orala och systemiska sjukdomstillstånd är sannolikt mycket komplexa, där tillstånden i sig är multifaktoriella och det därför finns stor risk för störande faktorers påverkan i de studier som utförts. Behovet av rotbehandlingar är, trots en bättre tandhälsa i många länder, alltjämt stort. Bara i Sverige görs i storleksordningen en kvarts miljon rotfyllningar årligen och majoriteten av alla rotbehandlingar påbörjas akut för behandling av ett symtomatiskt tillstånd (46). Rotbehandlingar möjliggör med andra ord idag att många patienter avhjälps från smärta och kan behålla sina tänder. Men, det är uppenbart att det finns mer att göra, kanske framför allt i kariesprevention, för att minska behovet av rotbehandlingar. Om sådana insatser är framgångsrika skulle tandvärk, orala abscesser, nödvändiga rotbehandlingar, tandextraktioner och omfattande restaureringar orsakade av sjukdomar i pulpan och de periapikala vävnaderna kunna reduceras. Om en minskning av förekomsten av endodontiska inflammations- och infektionstillstånd också skulle kunna förbättra den allmänna hälsan, i termer av till exempel färre fall av diabetes eller hjärt-kärlsjukdom, är i dagsläget osäkert. Det kommer att krävas ytterligare stora forskningsinsatser för att eventuellt kunna dra säkra slutsatser.
Att förebygga karies och tandtrauma och därmed minska behovet av rotbehandlingar samt när det ändå är påkallat, utföra rotbehandlingar med god kvalitet så att incidensen och prevalensen av endodontiska infektioner och behovet av tandextraktioner minskar kan motiveras väl utifrån ett inskränkt odontologiskt perspektiv. Det finns gott vetenskapligt stöd för att en god munhälsa befrämjar god livskvalitet. Om frånvaro av orala endodontiska infektioner dessutom minskar risken för ett antal allvarliga och vanliga allmänsjukdomar så gör det ju inte saken sämre.
Referenser
Fransson H, Dawson VS, Frisk F, Björndal L, EndoReCo, Kvist T. Survival of Root-filled Teeth in the Swedish Adult Population. J Endod. 2016; 42: 216–20.
Pak J, Fayazi S, White SN. Prevalence of Periapical Radiolucency and Root Canal Treatment: A Systematic Review of Cross-sectional Studies. J Endod. 2012; 38: 1170–6.
Kirkevang LL, Orstavik D, Hörsted-Bindslev A, Wenzel A. Periapical status and quality of root fillings and coronal restorations in a Danish population. Int Endod J. 2000; 33: 509–15.
Skudutyte-Rysstad R, Eriksen HM. Endodontic status amongst 35-year-old Oslo citizens and changes over a 30-year period. Int Endod J. 2006; 39: 637–42.
Frisk F, Hugoson A, Hakeberg M. Technical quality of root fillings and periapical status in root filled teeth in Jönköping, Sweden. Int Endod J. 2008; 41: 958–68.
Pizzo G, Guiglia R, Russo LL, Campisi G. Dentistry and internal medicine: from the focal infection theory to the periodontal medicine concept. Eur. J. Intern. Med. 2010; 21: 496–502.
Ryden L, Buhlin K, Ekstrand E, de Faire U, Gustafsson A, Holmer J, Kjellstrom B, Lindahl B, Norhammar A, Nygren Å, Näsman P, Rathnayake N, Svenungsson E, Klinge B. Periodontitis Increases the Risk of a First Myocardial Infarction: A Report From the PAROKRANK Study. Circulation. 2016; 133; 576–83.
Segura-Egea JJ, Martin-González J, Castellanos-Cosano L. Endodontic medicine: connections between apical periodontitis and systemic diseases. Int Endod J. 2015; 48: 933–51.
Khalighinejad N, Aminoshariae R, Aminoshariae A, Kulid JC, Mickel A, Fouad AF. Association between Systemic Diseases and Apical Periodontitis. J Endod. 2016; 42: 1427–34.
Caplan DJ. Epidemiologic issues in studies of association between apical periodontitis and systemic health. Endodontic Topics. 2004; 8: 15–35.
Debelian GJ, Olsen I, Tronstad L. Systemic diseases caused by oral microorganisms. Dent Traumatol. 1994; 10: 57–65.
Hansson GK: Atherosclerosis, inflammation and coronary artery disease. N Engl J Med 2005; 352: 1685–95.
Joshipura KJ, Pitiphat W, Hung HC, Wilet WC, Colditz GA, Douglass CW. Pulpal Inflammation and Incidence of Coronary Heart Disease. J Endod. 2006; 32: 99–103.
Caplan DJ, Chasen JB, Kral EA, Cai J, Kang S, Garcia RI, Offenbacher S, Beck JD. Lesions of Endodontic Origin and Risk of Coronary Heart Disease. J Dent Res. 2006; 85: 996–1000.Pasqualini D, Bergandi L, Palumbo L, Borraccino A, Dambra V, Alovisi M, Migliaretti G, Ferraro G, Ghigo D, Bergerone S, Scotti N, Aimetti M, Berutti E. Association among Oral Health, Apical Periodontitis, CD14 Polymorphisms, and Coronary Heart Disease and Middle-aged Adults. J Endod. 2012; 38: 1570–77.
Caplan DJ, Pankow JS, Cai J, Offenbacher D, Beck JD. The relationship between self-reported history of endodontic therapy and coronary heart disease in the Atherosclerosis Risk in Communities Study. J Am Dent Assoc. 2009; 140: 1004–12.
Petersen J, Glaßl EM, Nasseri P, Crismani A, Liger AK, Schoenherr E, Bertl K, Glodny B. The association of chronic apical periodontitis and endodontic therapy with atherosclerosis. Clin Oral Invest. 2014; 18: 1813–23.
Costa THR, Neto JA, de Oliveira AEF, Maia MFL, Almeida AL. Association between Chronic Apical Periodontitis and Coronary Artery Disease. J Endod. 2014. 40; 164–7.
Liljestrand JM, Mäntylä P, Paju S, Buhlin K, Kopra KAE, Persson GR, Hernandez M, Nieminen MS, Sinisalo J, Tjäderhane L, Pussinen PJ. Association of Endodontic Lesions with Coronary Artery Disease. J Dent Res. 2016; 95: 1358–65.
Garrido M, Cárdenas AM, Astorga J, Quinlan F, Valdés M, Chaparro A, Carvajal P, Pussinen P, Humán-Chipana P, Jalil JE, Hernández M. Elevated Systemic Inflammatory Burden and Cardiovascular Risk in Young Adults with Endodontic Apical Lesions. J Endod. 2019; 45: 111–15.
Frisk F, Hakeberg M, Ahlqwist M, Bengtsson C. Endodontic variables and coronary heart disease. Acta Odontol Scand. 2003; 61: 257–62.
Berlin-Broner Y, Febbraio M, Levin L. Association between apical periodontitis and cardiovascular diseases: a systematic review of the literature. Int Endod J. 2017; 50: 847–59.
Mealey BL, Oates TW. Diabetes Mellitus and Periodontal Diseases. J Periodontol. 2006; 77: 1289–1303.
Lima SMF, Grisi DC, Kogawa EM, Franco OL, Peixoto VC, Goncalves Júnior JF, Arruda MP, Rezende TMB. Diabetes mellitus and inflammatory pulpal and periapical disease: a review. Int Endod J. 2013; 46: 700–9.
Iacopino AM. Periodontitis and Diabetes Interrelationships: Role of Inflammation. Ann Periodontol. 2001; 6: 125–37.
Tanaka K, Yamaguchi T, Kaji H, et al. Advanced glycation end products suppress osteoblastic differentiation of stromal cells by activating endoplasmic reticulum stress. Biochem Biophys Res Commun 2013; 438: 463–67.
Segura-Egea JJ, Martin-González J, Castellanos-Cosano L. Endodontic medicine: connections between apical periodontitis and systemic diseases. Int Endod J. 2015; 48: 933–51.
Montoya-Carralero JM, Saura-Pérez M, Canteras-Jordana M, Morata-Murcia IM. Reduction of HbA1c levels following nonsurgical treatment of periodontal disease in type 2 diabetics. Med Oral Patol Oral Cir Bucal. 2010; 15: 808–12.
Kodama Y, Matsuura M, Sano T, Nakahara Y, Ozaki K, Narama I, Matsuura T. Diabetes enhances dental caries and apical periodontitis in caries-susceptible WBN/KobSlc rats. Comp Med. 2011; 61: 53–9.
Fouad A, Barry J, Russo J, Radolf J, Zhu Q. Periapical lesion progression with controlled microbial inoculation in a type I diabetic mouse model. J Endod.. 2002; 28: 8–16.
Cintra LTA, Samuel RO, Facundo ACS, Prieto AKC, Sumida DH, Bomfim SRM, Souza JC, Dezan-Júnior E, Gomes-Filho JE. Relationships between oral infections and blood glucose concentrations or HbA1c levels in normal and diabetic rats. Int Endod J. 2014; 47: 228–37.
Bender IB, Seltzer S, Freedland J. The relationship of systemic diseases to endodontic failures and treatment procedures. Oral Surg Oral Med Oral Pathol. 1963; 16: 1102–15.
Seguera-Egea JJ, Jiménez-Pinzón A, Ríos-Santos JV, Velasco-Ortega E, Cisneros-Cabello R, Poyato-Ferrera M. High prevalence of apical periodontitis amongst type 2 diabetic patients. Int Endod J. 2005; 38: 564–69.
Marotta PS, Fontes TV, Armada L, Lima KC, Rocas IN, Siqueira JF. Type 2 diabetes mellitus and the prevalence of apical periodontitis and endodontic treatment in an adult Brazilian population. J Endod. 2012; 38: 297–300.
Britto LR, Katz J, Guelmann M, Heft M. Periradicular radiographic assessment in diabetic and control individuals. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2003; 96: 449–52.
Foud AF, Burleson J. The effect of diabetes mellitus on endodontic treatment outcome: data from an electronic patient record. J Am Dent Assoc. 2003; 134: 43–51.
López-López J, Jané-Salas E, Estrugo-Devesa A, Velasco-Ortega E, Martín-González J, Segura-Egea JJ. Periapical and endodontic status of type 2 diabetic patients in Catalonia, Spain: a cross-sectional study. J Endod. 2011; 37: 598–601.
Doyle SL, Hodges JS, Pesun IJ, Baisden MK, Bowles WR. Factors affecting outcomes for single-tooth implants and endodontic restorations. J Endod. 2007; 33: 399–402.
Ng YL, Mann V, Gulabivala K. A prospective study of the factors affecting outcomes of non-surgical root canal treatment: part 2: tooth survival. Int Endod J. 2011; 44: 610–25.
Wang CH, Chueh LH, Chen SC, Feng YC, Hsiao CK, Chiang CP. Impact of diabetes mellitus, hypertension, and coronary artery disease on tooth extraction after non-surgical endodontic treatment. J Endod. 2011; 37: 1–5.
Khalighinejad N, Aminoshariae A, Kulild JC, Sahly K, Mickel A. Association of End-stage Renal Disease with Radiographically and Clinically Diagnosed Apical Periodontitis: A Hospital-based Study. J Endod. 2017; 43: 1438–41.
Leal ASM, Oliveira AEF, Brito LMO, Lopes FF, Rodrigues VP, Lima KF, Martins CA. Association between Chronic Apical Periodontitis and Low-birth-weight Preterm Births. J Endod. 2015; 41: 353–7.
Khalighinejad N, Aminoshariae A, Kulild JC, Mickel A. Apical Periodontitis, a Predictor Variable for Preeclampsia: A Case-control Study. J Endod. 2017; 43: 1611–4.
Castellanos-Cosano L, Machuca-Portillo G, Segura-Sampedro JJ, Torres-Lagares D, López-López J, Velasco-Ortega E, Segura-Egea JJ. Prevalence of apical periodontitis and frequency of root canal treatments in liver transplant candidates. Med Oral Patol Oral Cir Bucal. 2013; 18: 773–9.
Castellanos-Cosano L, Machuca-Portillo G, Sánchez-Dominquez B, Torrés-Lagares D, López-López J, Segura-Egea JJ. High prevalence of apical periodontitis amongst patients with inherited coagulation disorders. Haemophilia. 2013; 19: 110–5.
Wigsten E, Jonasson P, EndoReCo, Kvist T. Indications for root canal treatment in a Swedish county dental service: patient- and tooth-specific characteristics. Int Endod J. 2019; 52: 158–68.
Willershausen B, Kasaj A, Wilershausen I, Zahorka D, Briseño B, Blettner M, Genth-Zotz S, Münzel T. Association between Chronic Dental Infection and Acute Myocardial Infarction. J Endod. 2009; 35: 626–30.
Segura-Egea JJ, Jimenez-Moreno E, Calvo-Monroy C, Ríos-Santos JV, Velasco-Ortega E, Sánchez-Domínguez B, Castellanos-Cosano L, Llamas-Carreras JM. Hypertension and Dental Periapical Condition. J Endod. 2010; 36: 1800–04.
Segura-Egea JJ, Castellanos-Cosano L, Velasco-Ortega E, Ríos-Santos JV, Llamas-Carreras JM, Machuca G, López-Frías FJ. Relationship between Smoking and Endodontic Variables in Hypertensive Patients. J Endod. 2011; 37: 764–7.
An GK, Morse DE, Kunin M, Goldberg RS, Psoter WJ. Association of Radiographically Diagnosed Apical Periodontitis and Cardiovascular Disease: A Hopsital Records-based Study. J Endod. 2013; 42: 916–20.
Gomes MS, Hugo FN, Hilgert JB, Sant’Ana Filho M, Padilha DMP, Simonsick EM, Ferrucci L, Reynolds MA. Apical periodontitis and incident cardiovascular events in the Baltimore Longitudinal Study of Ageing. Int Endod J. 2016; 49: 334–42.
Virtanen E, Nurmi T, Söder P, Airila-Månsson S, Söder B, Meurman JH. Apical periodontitis associates with cardiovascular diseases: a cross-sectional study from Sweden. BMC Oral Health. 2017; 17: 107.
English summary
Sebring D, Jonasson P, Buhlin K, Lund H, Kvist T.
Endodontic infections and general health
Nor Tannlegeforen Tid. 2020; 130: 104–11
The current state of knowledge indicates a relatively weak relationship between endodontic infections and inflammatory conditions and systemic diseases. The possible biologic mechanisms include spread of bacteria and endotoxins as well as production of inflammatory mediators leading to an increased systemic inflammatory burden. Up till now the most extensively studied associations are the ones to cardiovascular disease and diabetes. However, whether observed relationships are causal is highly uncertain. The issue is undoubtedly complex and the multifactorial nature of the conditions increases the risk for confounding factors.
Despite general improvement in oral health the need for endodontic treatment remains high. Root canal treatments alleviate many patients from pain and allow long-term retention of compromised teeth.
Further improved prevention of caries and increased quality of endodontic treatment when such is still necessary would reduce the number of patients with infections and inflammatory conditions in the pulp and periradicular tissues. A lot of suffering could be avoidedand resources could be saved.
Whether less caries and less endodontic infections would also improve the general health remains unclear. More research efforts are needed for conclusions to be reliably drawn on the connections between endodontic infections and systemic diseases.
Korrespondens: Dan Sebring, Avdelningen för endodonti, Institutionen för Odontologi, Sahlgrenska Akademin, Box 450, 40 530 Göteborg, Sverige. E-post: dan.sebring@gu.se
Accepterad för publicering 10 juni 2019.
Sebring D, Jonasson P, Buhlin K, Lund H, Kvist T. Endodontiska infektioner och allmänhälsa. Nor Tannlegeforen Tid. 2020; 130: 104–11
Artikkelen har gjennomgått ekstern faglig vurdering.
MeSH: Infeksjon; Helse; Endodonti