Orofacial granulomatose og Crohns sykdom – et klinisk kasus og en litteraturgjennomgang
Hovedbudskap
Orofacial granulomatose kan være forløper eller første tegn på Crohns sykdom
Klinikere må kjenne til ulike karakteristika og symptomer ved disse tilstandene. De kan variere fra pasient til pasient og ligne mer banale oralmedisinske forandringer
Tannleger og tannpleiere har en viktig rolle ved å sikre tidlig diagnostikk av sykdommer som initialt kan manifestere seg i munnhulen
Orofacial granulomatose (OFG) og Crohns sykdom (CD) er to kroniske betennelsestilstander med flere likhetstrekk og har en mulig sammenheng. Begge er karakterisert ved kronisk granulomatøs inflammasjon der OFG manifesterer seg i munn- og ansiktsregionen, mens CD kan affisere hele intestinaltraktus fra munnhule til anus. OFG er kjennetegnet ved blant annet hovne lepper, angulær keilitt, hyperplastisk gingiva, ulcerasjoner og slimhinnefolder, mens CD også gir smerter i tarm, diaré og vekttap. Begge tilstander kan gi økt morbiditet. Selv om etiologien er ukjent, er hypersensitivitet, atopi og allergi ofte sett i sammenheng med OFG. En uhensiktsmessig immunreaksjon sees både ved OFG og CD, og ved CD kan det skyldes en ubalanse i tarmen hos genetisk disponerte individer.
Det er rapportert at personer som først får diagnosen OFG, kan utvikle CD mange år senere. Det er derfor viktig å kjenne til tidlige symptomer, tegn og manifestasjoner på OFG/oral CD, og tannlege/tannpleier spiller en sentral rolle i å identifisere dette tidlig.
Orofacial granulomatose (OFG) er en sjelden, kronisk betennelsestilstand som rammer munnhule, leppe og det periorale området. Selv om OFG ikke er livstruende, fører tilstanden ofte til økt morbiditet på grunn av hevelse av lepper, gingival hyperplasi og/eller smertefulle sår eller erytem (1). Betegnelsen orofacial granulomatose ble introdusert i 1985 for å beskrive granulomatøse tilstander begrenset til ansikt og munnhule uten tegn eller symptomer i andre organer (2). Crohns sykdom (CD) er derimot en inflammatorisk tilstand som stedvis kan ramme alle deler av mage-tarm-kanalen fra munnhule til anus. Som regel er slimhinnen på overgangen mellom tynntarm og tykktarm affisert, men inflammasjonen kan også kun være lokalisert til spesifikke avsnitt i magetarmkanal. Symptomer er magesmerter, diaré, nedsatt appetitt og vekttap. Sykdommen kan gi alvorlige komplikasjoner og smertebildet gir redusert livskvalitet (3). Minst en fjerdedel av pasientene har hatt intestinal kirurgi/tarmreseksjon innen de fem første årene av sykdommen, hyppigst blant de som var affisert i distale del av tynntarm (4).
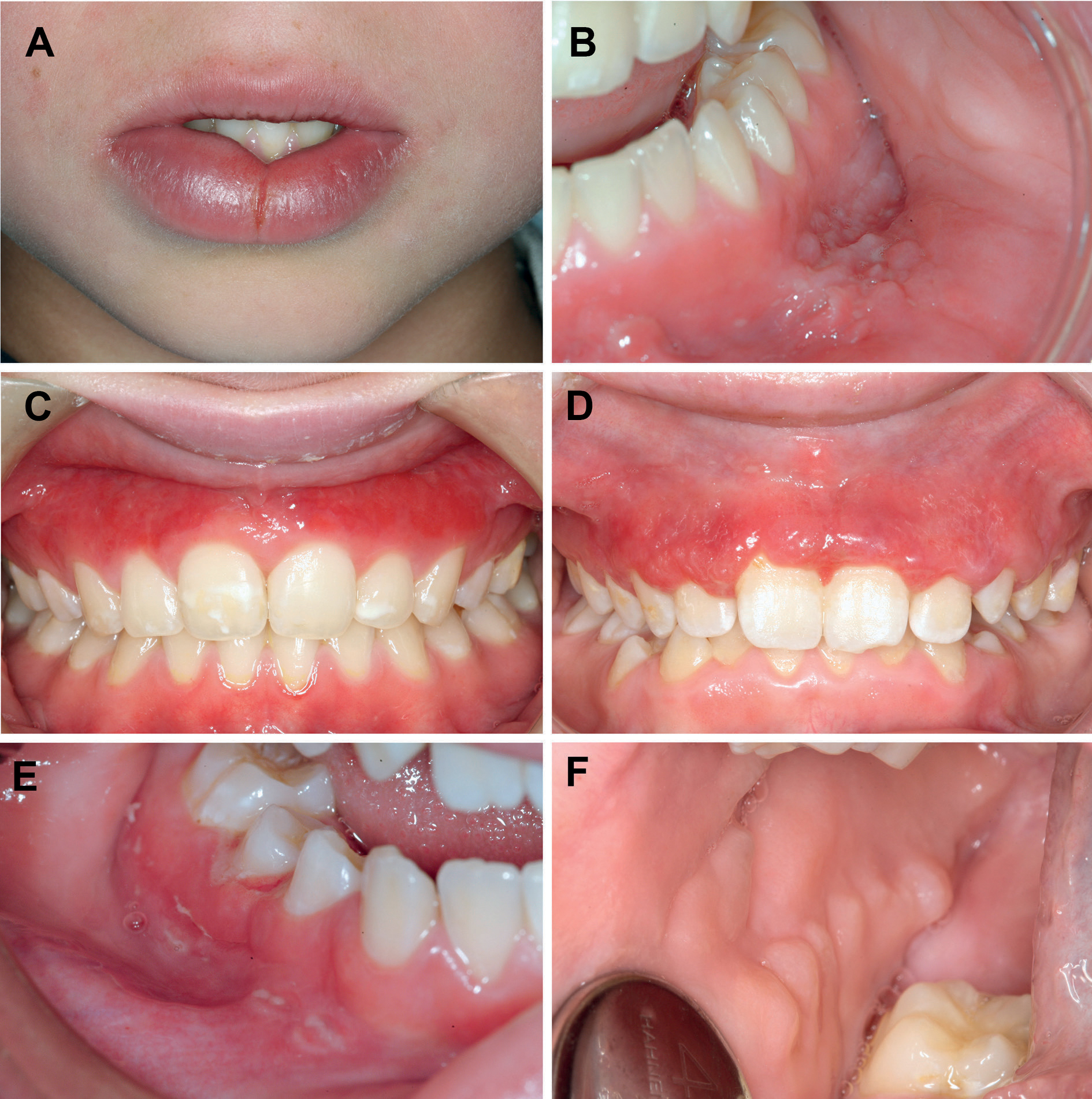
Figur 1. Eksempler på mulig oral manifestasjon ved både orofacial granulomatose (OFG) og Crohns sykdom (CD) der fem av seks fikk diagnostisert CD 1–13 år etter OFG diagnose. Hevelse i underleppe med midtlinjefissur (A); Slimhinnefolder i overgangsfold underkjeve (B); Gingivalt erytem overkjeve (C); Ødematøs og hyperplastisk gingiva overkjeve (D); Ulcerasjon i overgangsfold og på gingiva regio 45 (E), Brostensmønster i høyre kinnslimhinne (F). (Gjengitt fra referanse 36 under Creative Commons-lisens)
Sammenhengen mellom OFG og CD er fortsatt uklar. Det er ikke klarlagt om det er to forskjellige sykdommer, om OFG er en tidlig manifestasjon av CD eller om det er samme tilstand med ulik lokalisasjon i fordøyelseskanalen (5,6). Det er ikke mulig å skille OFG og oral CD klinisk. Heller ikke histopatologisk undersøkelse av Hematoksylin- og Eosinfargede snitt kan skille disse sykdommene, men det er beskrevet immunologiske og genetiske forskjeller (6–8).
Selv om flere studier antyder at OFG og CD er to forskjellige tilstander (5,6,9,10), viser andre studier at så mange som 40–50 % av unge pasienter med OFG enten får stilt en CD diagnose på samme tidspunkt som OFG-diagnosen eller at de utvikler CD på et senere tidspunkt (11–13). Ettersom både OFG og CD ofte blir oppdaget i ung alder, kan OFG være et tidlig tegn på CD eller også en undergruppe av CD (11,13,14). Derfor er det viktig å være klar over at de orale manifestasjoner ved OFG kan være et tidlig tegn på CD.
Årsaken til OFG og CD er fortsatt ukjent, men studier tyder på at den er sammensatt og multifaktoriell (1,7,8,10,15). Ved OFG kan allergi eller hypersensitivitet være utløsende faktorer ettersom både atopi og kontaktallergi er observert hos mange OFG pasienter med eller uten samtidig CD (16–19). Det er vist at en diett fri for benzoater (E210-E219) og kanel eller kanelderivater har gitt bedring av de orale symptomer hos mer enn 50 % av pasienter med OFG (20,21). Men også andre tilsetningsstoffer er sett i sammenheng med OFG, i likhet med andre fødeemner som sjokolade og smaksstoffer i mat eller tannkrem (10,13,16,22,23). For øvrig synes det å være en arvelig komponent, og infeksiøse agens kan heller ikke utelukkes (1,10,15).
Typiske ekstraorale funn er hovne lepper med fissurering, angulær keilitt og perioralt erytem. Intraoralt sees granulomatøs gingivitt (gingivale hyperplasier), ulcerasjoner (langsgående sår og fissurer i overgangsfold eller sår på keratinisert slimhinne), slimhinnefolder og brostensmønster i kinn (7,27). Dette er kliniske manifestasjoner som i seg selv ikke er spesifikke for OFG og oral CD. For eksempel kan erytem i ansikt, angulær keilitt og leppehevelse være relatert til atopisk dermatitt eller en allergisk reaksjon. Gingival hyperplasi og ulcerasjoner kan ses ved gingivitt og aftøs stomatitt, og disse er heller ikke patognomonisk for OFG eller oral CD (1,11). For å skille OFG og oral CD fra ulike differensialdiagnoser bør vevet undersøkes histologisk med tanke på forekomst av ikke-nekrotiserende granulomer (6,11).
Selv om etiologien er ukjent også når det gjelder utviklingen av CD, antar man at en ukjent ytre initierende faktor kan medføre en uhensiktsmessig immunologisk reaksjon hos genetisk disponerte individer (8). Det er også rapportert at antibiotikabruk eller endringer i kosten kan medvirke til en mikrobiell ubalanse i tarmen slik at immunresponsen endres (28).
Forekomsten av CD øker i den vestlige verden, spesielt i Nord-Europa og Nord-Amerika (4,29,30). Omtrent en tredel av alle CD-tilfeller manifesterer seg hos barn og unge under 20 år og oral CD er rapportert å være til stede i mer enn 40 % av barna på diagnosetidspunktet for intestinal CD (30). Ettersom OFG er en sjelden tilstand finnes det ingen epidemiologiske data. Karakteristiske trekk ved tilstanden er hovedsakelig basert på kohorter og kasus-serier (7,13,27,32–34). Men som ved CD, synes det å være en økning i forekomsten av OFG hos barn og unge i den vestlige del av verden (11,13,35). En prevalens så høy som 0,8 % er blitt antydet i en keltisk befolkning (27). Og en nylig spørreundersøkelse (QuestBack) blant norske tannleger og tannpleiere i 13 fylker, viste at ca. halvparten hadde hørt om OFG og oral CD. Litt over 20 % mente de mest sannsynlig hadde hatt pasienter med kliniske trekk som samsvarte med intraorale bildeeksempler, hvorav seks er vist i figur 1 (36).
De orale forandringene vist i figur 1 er manifestasjoner som både kan sees ved OFG og CD. Det er derfor essensielt at klinikere er kjent med både OFG og CD, og at tannhelsepersonell så tidlig som mulig sender pasientene til utredning. Erfaringsmessig henvises nå flere pasienter til Det odontologiske fakultet i Oslo for utredning av OFG/oral CD enn tidligere. Dette kan enten skyldes økt forekomst eller økt oppmerksomhet rundt tilstanden.
Hensikten med den påfølgende kasuistikken er å vise diagnostiske utfordringer ved OFG/oral CD.
Kasus
Pasienten, en ellers frisk gutt på 13 år, klaget over smerter i munn og sårhet i munnviker etter avsluttet kjeveortopedisk behandling. Intraoral undersøkelse viste gingivale ulcerasjoner distalt for tann 46 (figur 2a), bilateral angulær keilitt (figur 2b) og ulcerasjoner i ganen (figur 3). Spising var smertefullt, og han hadde sluttet å spille et blåseinstrument på grunn av symptomene.
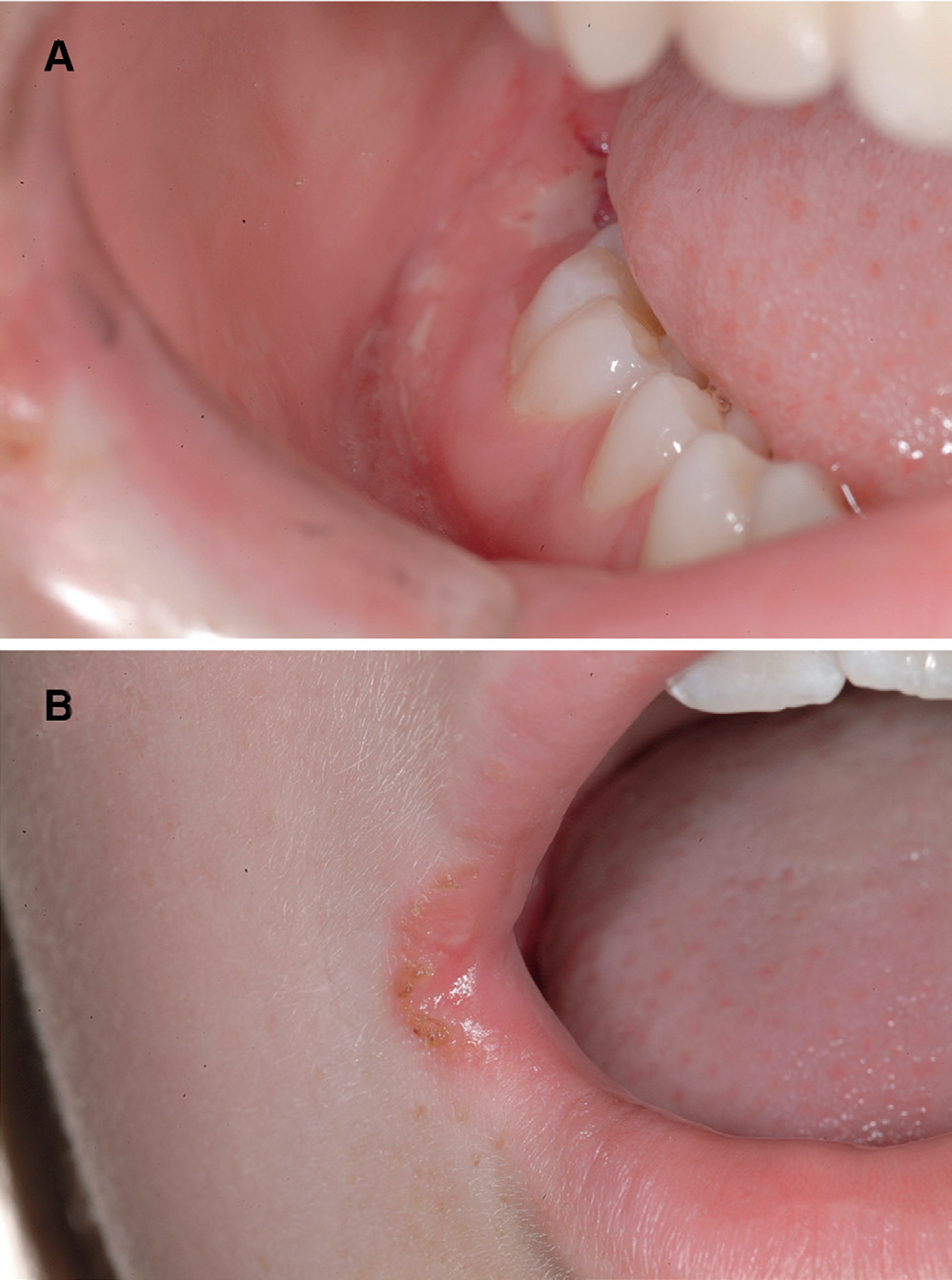
Figur 2. Intraorale sår på festet gingiva (A) og Angulær keilitt i høyre munnvik (B).
Mikrobiologiske prøver viste oppvekst av Staphylococcus aureus både i sårene i gane og i munnvik. Hematologisk undersøkelse avdekket jernmangelanemi, men for øvrig var det ingen hematologiske avvik eller tegn på malabsorpsjon. Ettersom ulcerasjonene på keratinisert slimhinne ikke samsvarte med aftøs stomatitt og ingen uvaner eller annen ytre årsak kunne avdekkes, ble en tentativ OFG diagnose satt. Lokal behandling med fucidinsyre og jerntilskudd ble iverksatt. Ulcerasjonene tilhelte før den avtalte timen for planlagt biopsi.
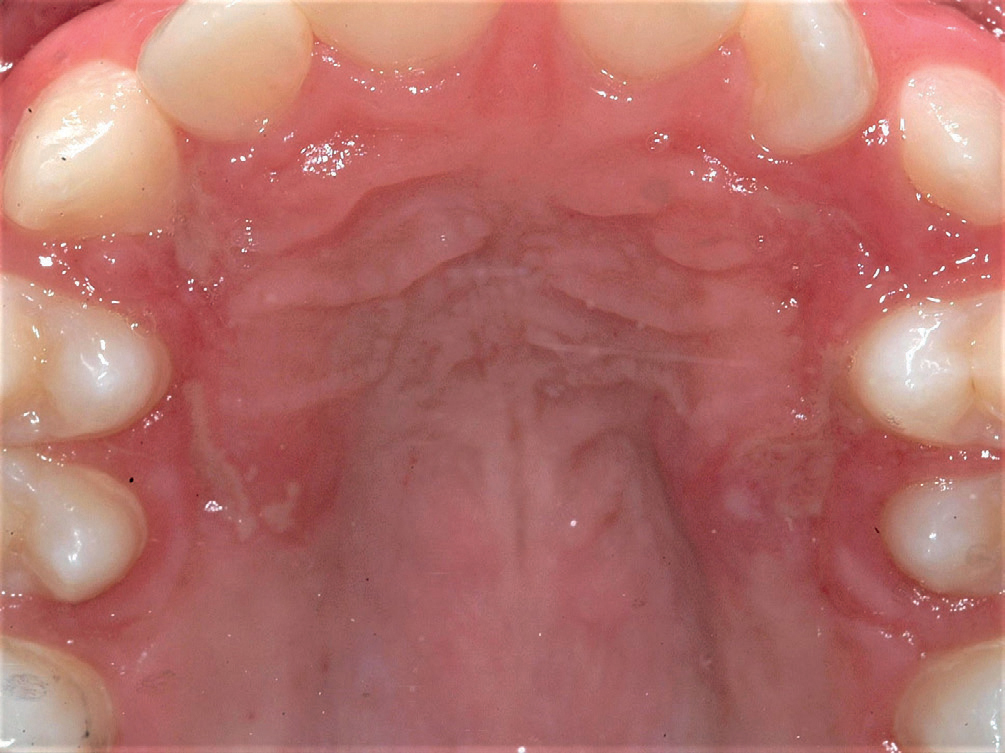
Figur 3. Ulcerasjoner palatinalt 13–15 og 23–25.
Tre år senere, ved seksten-års-alder, opplevde pasienten en plutselig forverring og økt morbiditet. Dette på grunn av utvikling av en gingival hyperplasi i overkjevens front i tillegg til oral og intestinal smerte som gikk ut over matinntaket. Biopsi tatt fra gingival hyperplasi i regio 13, viste kronisk granulomatøs inflammasjon. Pasienten ble henvist til Akershus universitetssykehus (A-Hus) HF med henblikk på utredning for CD. Epikrise beskrev normale verdier på fekaltest og blodprøver og at det ikke hadde vært magesmerter de siste uker. Videre utredning med skopiundersøkelse og biopsitaking fra hele gastrointestinaltraktus samt MR tynntarm, viste heller ingen forandringer, med unntak av et lite granulom fra colon transversum som var så lite at det ut fra epikrisen ikke ga diagnosen CD.
Pasienten hadde tidligere blitt informert om sammenhengen mellom mulig hypersensitivitetreaksjon utløst av benzoater (E210–219) og kanelderivater ved OFG og hadde forsøkt å unngå disse stoffene uten nevneverdig effekt.
Ett år senere, ved 17-års alder, hadde pasienten sluttet å smile pga. gingival hyperplasi, spesielt et ødematøst område rundt frenulum labialis (figur 4a). Munnhygienen var god. På dette tidspunktet tok han månedlige blodprøver og jevnlige fekalprøver hos lege på grunn av intestinale plager med diaré. Samtidig forskrev legen Imurel® (Azathioprin) 50 mg daglig i tre måneder. Mageproblemene ble mindre uttalt, men den gingivale hyperplasien besto. En biopsi fra frenulektomien viste igjen en kronisk granulomatøs inflammasjon. Pasienten ble regelmessig fulgt opp på A-Hus og fortsatte med Imurel-behandling, men til tross for mage-tarm-problemene, ble han ikke diagnostisert med CD.
Ved 22-års alder hadde han siste konsultasjon ved Avd. for pedodonti og atferdsfag. Han hadde fortsatt noen symptomer fra mage-tarm, men ingen endelig CD diagnose. Han følte seg ofte trøtt, men hadde ikke lenger intraorale manifestasjoner (figur 4b).
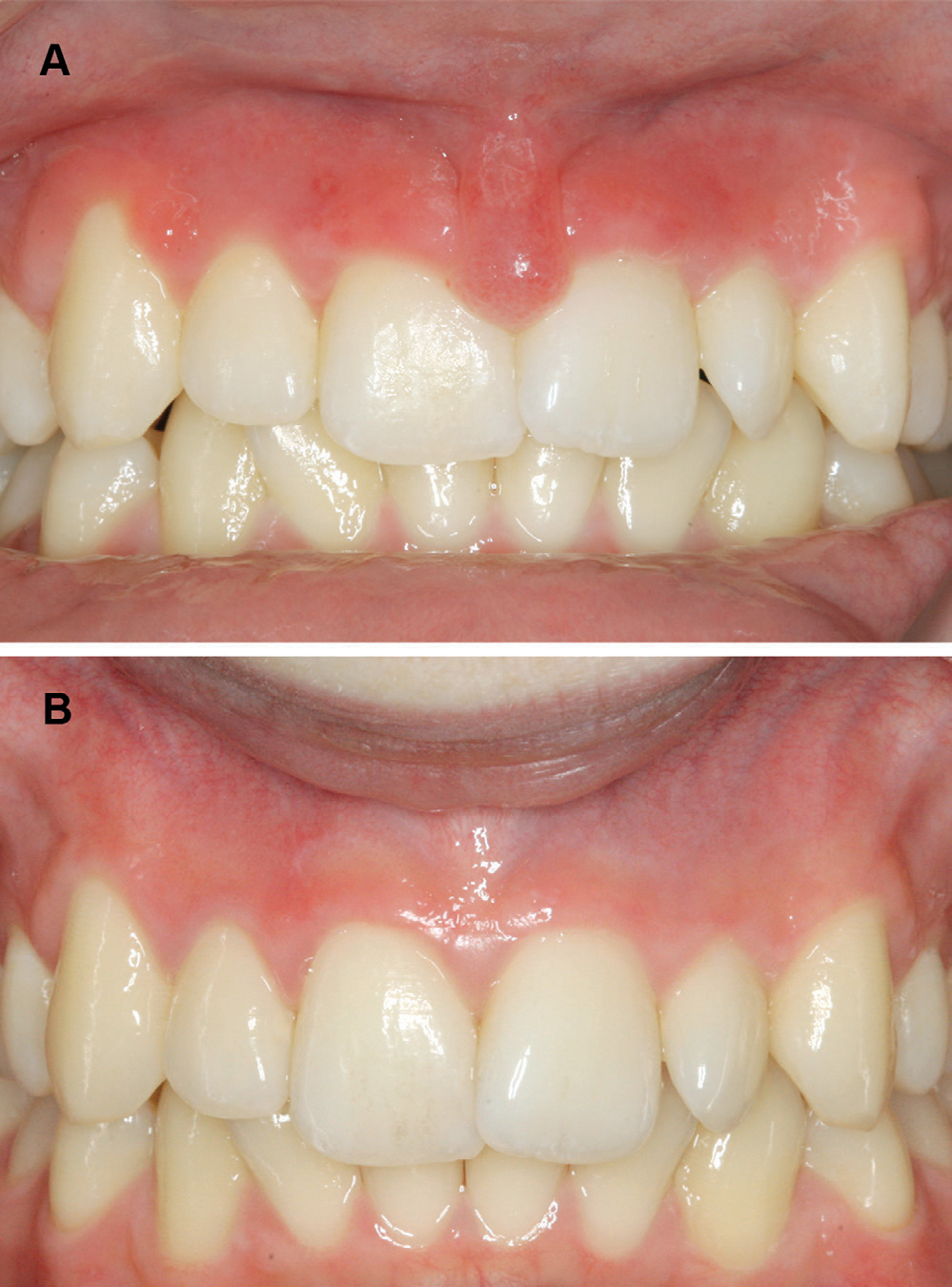
Figur 4. Gingival hyperplasi og ødematøst labial frenulum ved 17-års-alder (A); Frisk oral mukosa ved 22 år (B).
Diskusjon
Dette kasuset bekrefter at første tegn til OFG kan være intraorale sår på keratinisert slimhinne som i tillegg kan være infisert med gule stafylokokker (37). Likeledes er det et eksempel på hvor vanskelig det kan være å stadfeste en eventuell CD diagnose selv om symptomer fra GI er til stede. Immunmodulerende behandling kan likevel være et alternativ både for å redusere systemiske, men også intraorale symptomer. Ifølge pasientens lege og Felleskatalogen kan det ta flere uker/måneder før medikamentell effekt, noe dette tilfellet viste da heller ikke seks måneders behandlingsperiode var fullt ut tilstrekkelig til å slå ned de intraorale symptomene. Imidlertid ble den gingivale hyperplasien holdt i sjakk og residiverte ikke etter frenulektomien.
Både OFG og CD har et intermitterende forløp med rolige og mer akutte perioder. Tidlig diagnose er viktig for å kunne gi tilpasset behandling. CD kan som nevnt, ramme hele tarmkanalen fra munnhule til endetarmsåpning. Ved diagnosetidspunktet har omtrent 40 % av alle med CD, sykdom i kolon alene, 30 % er affisert i både tynn- og tykktarm, og 30 % har kun sykdom i tynntarm (38). Tynntarmen er lang, 4–5 m med innbuktninger, folder og tarmtotter og ikke alltid tilgjengelig for endoskopi. Sykdommen opptrer også flekkvis slik at en biopsi ikke nødvendigvis alltid vil være representativ. Diagnosen baseres derfor på en kombinasjon av kliniske symptomer, endoskopiske funn og bildediagnostikk. MR er ofte nyttig i kartlegging av CD da dette kan avdekke sykdom i tynntarm (38). Selv om denne pasienten ikke hadde fått en CD diagnose ved siste konsultasjon ved Klinikk for allmenn odontologi barn, fikk han systemisk behandling som ved CD og hadde god effekt av det.
Denne pasienthistorien illustrerer både utfordringer ved diagnostikk og oppfølging av pasienter med OFG/oral CD. Tannhelsepersonell spiller en vesentlig rolle for at pasienter med symptomer på OFG blir henvist for utredning av mulig CD. Erfaringsmessig kan disse pasientene bli kasteballer i helsesystemet fordi symptomene og de kliniske funnene ikke gir grunnlag for å stille en CD diagnose. Persisterende symptomer hos barn/tenåringer gjør at pasientene må følges slik at de ikke faller mellom to stoler, eksempelvis i overgangen barn/voksen. Her må tannhelsepersonell følge opp.
Klinikeren må huske på at pasienter med orofacial granulomatose (inkludert orale manifestasjoner av Crohns sykdom) står på diagnoselisten for sjeldne medisinske tilstander.
Takk
Takk til pasientene som har gitt sitt skriftlige samtykke til publisering og bruk av bilder, og til pasienten som også har samtykket til kasuistikken.
Det er ingen interessekonflikter knyttet til manuskriptet
Referanser
Al-Hamad A, Porter S, Fedele S. Orofacial Granulomatosis. Dermatol Clin. 2015; 33: 433–46.
Wiesenfeld D, Ferguson MM, Mitchell DN, MacDonald DG, Scully C, Cochran K, et al. Oro-facial granulomatosis--a clinical and pathological analysis. Q J Med. 1985; 54: 101–13.
Claar RL, van Tilburg MAL, Abdullah B, Langer S, Sherif D, Whitehead WE, et al. Psychological Distress and Quality of Life in Pediatric Crohns Disease: Impact of Pain and Disease State. J Pediatr Gastroenterol Nutr. 2017; 65: 420–4.
Hovde O, Moum BA. Epidemiology and clinical course of Crohns’s disease: results from observational studies. World J Gastroenterol. 2012; 18: 1723–31.
Sanderson J, Nunes C, Escudier M, Barnard K, Shirlaw P, Odell E, et al. Oro-facial granulomatosis: Crohns’s disease or a new inflammatory bowel disease? Inflamm Bowel Dis. 2005; 11: 840–6.
Zbar AP, Ben-Horin S, Beer-Gabel M, Eliakim R. Oral Crohns’s disease: is it a separable disease from orofacial granulomatosis? A review. J Crohns Colitis. 2012; 6: 135–42.
Gale G, Ostman S, Rekabdar E, Torinsson Naluai A, Hogkil K, Hasseus B, et al. Characterisation of a Swedish cohort with orofacial granulomatosis with or without Crohns’s disease. Oral Dis. 2015; 21: e98–104.
Hullah EA, Escudier MP. The mouth in inflammatory bowel disease and aspects of orofacial granulomatosis. Periodontol. 2000. 2019; 80: 61–76.
Challacombe SJ. Oro-facial granulomatosis and oral Crohns disease: are they specific diseases and do they predict systemic Crohns disease? Oral dis. 1997; 3: 127–9.
Grave B, McCullough M, Wiesenfeld D. Orofacial granulomatosis--a 20-year review. Oral dis. 2009; 15: 46–51.
Lazzerini M, Bramuzzo M, Ventura A. Association between orofacial granulomatosis and Crohns’s disease in children: systematic review. World J Gastroenterol. 2014; 20: 7497–504.
Rowland M, Fleming P, Bourke B. Looking in the mouth for Crohns’s disease. Inflamm Bowel Dis. 2010; 16: 332–7.
Saalman R, Mattsson U, Jontell M. Orofacial granulomatosis in childhood-a clinical entity that may indicate Crohns’s disease as well as food allergy. Acta Paediatr. 2009; 98: 1162–7.
Gale G, Sigurdsson GV, Ostman S, Malmborg P, Hogkil K, Hasseus B, et al. Does Crohns’s Disease with Concomitant Orofacial Granulomatosis Represent a Distinctive Disease Subtype? Inflamm Bowel Dis. 2016; 22: 1071–7.
Tilakaratne WM, Freysdottir J, Fortune F. Orofacial granulomatosis: review on aetiology and pathogenesis. J Oral Pathol Med. 2008; 37: 191–5.
Armstrong DK, Biagioni P, Lamey PJ, Burrows D. Contact hypersensitivity in patients with orofacial granulomatosis. J Contact Dermat. 1997; 8: 35–8.
Fitzpatrick L, Healy CM, McCartan BE, Flint SR, McCreary CE, Rogers S. Patch testing for food-associated allergies in orofacial granulomatosis. J Oral Pathol Med. 2011; 40: 10–3.
Patel P, Brostoff J, Campbell H, Goel RM, Taylor K, Ray S, Lomer M, Escudier M, Challacombe S, Spencer J, Sanderson J. Clinical evidence for allergy in orofacial granulomatosis and inflammatory bowel disease. Clin Transl Allergy. 2013; 15: 26. Doi: 10.1186/2045–7022–3–26
Wray D, Rees SR, Gibson J, Forsyth A. The role of allergy in oral mucosal diseases. QJM. 2000; 93: 507–11.
Campbell HE, Escudier MP, Patel P, Challacombe SJ, Sanderson JD, Lomer MC. Review article: cinnamon- and benzoate-free diet as a primary treatment for orofacial granulomatosis. Aliment Pharmacol Ther. 2011; 34: 687–701.
White A, Nunes C, Escudier M, Lomer MC, Barnard K, Shirlaw P, et al. Improvement in orofacial granulomatosis on a cinnamon- and benzoate-free diet. Inflamm Bowel Dis. 2006; 12: 508–14.
Campbell H, Escudier MP, Brostoff J, Patel P, Milligan P, Challacombe SJ, et al. Dietary intervention for oral allergy syndrome as a treatment in orofacial granulomatosis: a new approach? J Oral Pathol Med. 2013; 42: 517–22.
Taibjee SM, Prais L, Foulds IS. Orofacial granulomatosis worsened by chocolate: results of patch testing to ingredients of Cadbury’s chocolate. Br J Dermatol 2004; 150: 595.
Oliver AJ, Rich AM, Reade PC, Varigos GA, Radden BG. Monosodium glutamate-related orofacial granulomatosis. Review and case report. Oral Surg Oral Med Oral Pathol 1991; 71: 560–4.
Sweatman MC, Tasker R, Warner JO, Ferguson MM, Mitchell DN. Oro-facial granulomatosis. Response to elemental diet and provocation by food additives. Clin Allergy. 1986; 16: 331–8.
Patton DW, Ferguson MM, Forsyth A, James J. Oro-facial granulomatosis: a possible allergic basis. Br J Oral Maxillofac Surg. 1985; 23: 235–42.
McCartan BE, Healy CM, McCreary CE, Flint SR, Rogers S, Toner ME. Characteristics of patients with orofacial granulomatosis. Oral Dis. 2011; 17: 696–704.
Ananthakrishnan AN. Environmental risk factors for inflammatory bowel diseases: a review. Dig Dis Sci. 2015; 60: 290–8.
Molodecky NA, Soon IS, Rabi DM, Ghali WA, Ferris M, Chernoff G, et al. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review. Gastroenterology. 2012; 142: 46–54.e42; quiz e30.
Sjoberg D, Holmstrom T, Larsson M, Nielsen AL, Holmquist L, Ekbom A, et al. Incidence and clinical course of Crohns’s disease during the first year – results from the IBD Cohort of the Uppsala Region (ICURE) of Sweden 2005–2009. J Crohns Colitis. 2014; 8: 215–22.
Harty S, Fleming P, Rowland M, Crushell E, McDermott M, Drumm B, et al. A prospective study of the oral manifestations of Crohns’s disease. Clin Gastroenterol Hepatol. 2005; 3: 886–91.
Al Johani K, Moles DR, Hodgson T, Porter SR, Fedele S. Onset and progression of clinical manifestations of orofacial granulomatosis. Oral Dis. 2009; 15: 214–9.
Haaramo A, Alapulli H, Aine L, Saarnisto U, Tuokkola J, Ruuska T, et al. Detailed Follow-up Study of Pediatric Orofacial Granulomatosis Patients.J Pediatr Gastroenterol Nutr. 2017; 65: 388–93.
Mignogna MD, Fedele S, Lo Russo L, Lo Muzio L. The multiform and variable patterns of onset of orofacial granulomatosis. J Oral Pathol Med. 2003; 32: 200–5.
Campbell H, Escudier M, Patel P, Nunes C, Elliott TR, Barnard K, et al. Distinguishing orofacial granulomatosis from Crohns’s disease: two separate disease entities? Inflamm Bowel Dis. 2011; 17: 2109–15.
Skaare AB, Hovden ES, Herlofson BB, Soland TM. Orofacial granulomatosis: a questionnaire study among Norwegian dental clinicians. Eur Arch Paediatr Dent. 2020. doi: 10.1007/s40368–020–00511–3.
Gibson J, Wray D, Bagg J. Oral staphylococcal mucositis: A new clinical entity in orofacial granulomatosis and Crohns’s disease. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2000; 89: 171–6.
https: //indremedisineren.no/2016/08/inflammatorisk-tarmsykdom-diagnostikk-og-behandling/
English summary
Orofacial granulomatosis and Crohns Disease – a report of a case and review of the literature
Orofacial granulomatosis (OFG) and Crohns disease (CD) are two chronic inflammatory granulomatous conditions with several similar characteristics and a possible relationship. They can both manifest themselves in the oral and perioral areas while CD also can manifest itself in the rest of the gastrointestinal tract. The main characteristics for OFG is swollen lips, gingival hyperplasia, ulcerations and mucosal tags. These manifestations can also be seen in CD although intestinal pain, diarrhea and weight loss often are the first symptoms. Although the aetiology is unknown, hypersensitivity, atopy and allergy are often observed, particularly in patients with OFG. In both conditions, an inappropriate immune response to an environmental stimulus is seen, and in CD an intestinal microbial dysbiosis may also play a role in genetically disposed individuals. It is not fully known whether they are different disease entities or the same condition with different involvement of the gastrointestinal tract. It is reported that persons first diagnosed with OFG may develop CD after several years. It is therefore important that dental clinicians are familiar with the oral signs and manifestations of OFG and oral CD playing a crucial role in early detection and diagnosis.
Skaare AB, Herlofson BB, Søland TM. Orofacial granulomatose og Crohns sykdom – et klinisk kasus og en litteraturgjennomgang. Nor Tannlegeforen Tid. 2020;131:914-20. doi:10.56373/2020-11-5
Korresponderende forfatter: Anne B Skaare, Avdeling for pedodonti og atferdsfag, Institutt for klinisk odontologi, Postboks 1109 Blindern, 0317 Oslo. E-post: anne.skaare@odont.uio.no
Artikkelen har gjennomgått ekstern faglig vurdering.
Akseptert for publisering 16.09.2020
Skaare AB, Herlofson BB, Søland TM. Orofacial granulomatose og Crohns sykdom – et klinisk kasus og en litteraturgjennomgang. Nor Tannlegeforen Tid. 2020; 130: 914–20
Norsk MeSH: Orofacial granulomatose; Crohns sykdom; Kasusrapporter; Differensialdiagnose
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Skaare AB, Herlofson BB, Søland TM. Orofacial granulomatose og Crohns sykdom – et klinisk kasus og en litteraturgjennomgang. Nor Tannlegeforen Tid. 2020;131:914-20. doi:10.56373/2020-11-5