Sammenheng mellom diabetes mellitus Type 2 og periodontal sykdom
* Disse forfatterne har bidratt likeverdig til artikkelen.
Sammendrag
Diabetes mellitus er en folkesykdom med økende forekomst på verdensbasis. Diabetikere er derfor en pasientgruppe vi ofte møter på en tannklinikk. Det foreligger mye forskning på effekt av diabetes på oral helse. Blant orale tilstander som er undersøkt med tanke på assosiasjon til diabetes, er sammenhengen mellom periodontitt og diabetes Type 2 veletablert og evidensbasert.
Periodontitt og diabetes mellitus er begge inflammasjonsbaserte sykdommer, og vertens inflammatoriske respons antas å være underliggende mekanisme ved begge tilstander. En toveis sammenheng er blitt foreslått. En dysbiotisk biofilm i gingivalområdet kan indusere en inflammatorisk respons i periodontalt vev, som hos en disponert pasient kan aksellerere og føre til festetap. Hos diabetikere kan hyperglykemi forverre periodontal inflammasjon og bidra til svekket tilheling av inflammert vev. Motsatt, en effekt av periodontal sykdom på diabetes kan heller ikke utelukkes.
Denne oversiktsartikkelen omhandler den økte risikoen for periodontal og peri-implantat inflammasjon og redusert vevstilheling hos pasienter med hyperglykemi. Det biologiske grunnlaget for dette blir drøftet. Nødvendigheten av grundig periodontal støttebehandling blir understreket.
Hovedbudskap
Ved Type 2 diabetes mellitus (T2DM) er periodontitt tydelig assosiert med dårligere glykemisk kontroll.
Forverrede periodontale tilstander viser sammenheng med komplikasjoner ved diabetes.
Vellykket ikke-kirurgisk periodontal behandling kan redusere HbA1c-nivå ved T2DM. Det er utilstrekkelige data for å konkludere ved Type 1 diabetes mellitus (T1DM).
Det er rapportert sammenheng mellom endret glykemisk status ved T2DM og endringer i den periodontale mikrofloraen, men det er ikke evidens for årsakssammenheng.
Ved T2DM vil ikke tilleggsbruk av antibiotika redusere HbA1c utover det som oppnås ved scaling og rotplanering.
Periodontitt hos diabetikere har ikke en spesifikk diagnose, men diabetes betraktes som en viktig modifiserende faktor. Glykemisk status inngår i det diagnostiske graderingssystemet for periodontitt.
Faktaboks
Kliniske råd
Spør pasienter om deres glykemiske kontroll (blodsukker).
Informér pasienter med diabetes og prediabetes om den økte risikoen for periodontitt og at det er viktig med regelmessig vedlikeholdsbehandling.
Diabetikere bør inngå i et forebyggende behandlingsprogram og bli undersøkt jevnlig med hensyn til periodontale endringer. Grundig støttebehandling er spesielt viktig for periodontittpasienter med diabetes.
Peri-implantitt og manglende osseointegrering synes å være vanligere hos diabetikere med dårlig glykemisk kontroll enn hos ikke-diabetikere. Hvis pasientene har en velregulert diabetes er det ikke påvist forskjell.
Diabetes
Diabetes mellitus er en kronisk metabolsk sykdom karakterisert ved økt glukosenivå i blod – hyperglykemi. Type 1 (T1DM) og type 2 (T2DM) diabetes mellitus er de vanligste typene, fordelt med ca. 10 % og 90 %, respektivt (1). T1DM skyldes autoimmun ødeleggelse av β-celler i bukspyttkjertelen, noe som fører til mangelfull produksjon av insulin. T2DM skyldes at β-cellene har redusert evne til å produsere tilstrekkelig mengde insulin for å opprettholde normal-glykemi og/eller økt cellemotstand overfor endogent insulin. Hyperglykemi er skadelig for mange kroppsfunksjoner og er forbundet med direkte og indirekte medisinske komplikasjoner.
Diabetes overvåkes vanligvis ved å måle andel av glykert hemoglobin i blod, HbA1c. Glukose er bundet irreversibelt til hemoglobin i røde blodceller i hele deres livstid, som er ca. 120 dager. HbA1c – «langtids blodsukker» – gjenspeiler gjennomsnittlig blodsukker i løpet av de seneste 2–3 månedene. Måleenheten for HbA1c er nylig blitt endret fra prosent til millimol (mmol) glykert hemoglobin pr. mol hemoglobin, slik at enheten nå er mmol/mol. HbA1c ≥ 48 mmol/mol (≥ 6,5 %) i to separate prøver indikerer T2DM.
Prevalens av diabetes og periodontitt
Diabetes og periodontitt er begge vanlige kronisk inflammatoriske tilstander. Forekomsten varierer mellom folkegrupper, kjønn og aldersgrupper, og også med sykdomsdefinisjon og metoder for å innhente data. I 2010 var alvorlig periodontitt den sjette mest prevalente helsetilstanden i verden og affiserte omtrent 11 % av den voksne befolkningen globalt sett (1). Insidensen (tilvekst av sykdom) ventes å øke på grunn av økt levealder og at folk beholder tennene lengre. På verdensbasis affiserer diabetes mer enn 425 millioner personer i aldersgruppen 20–79 år, og årlig vil anslagsvis 9 millioner nye tilfeller av diabetes bli diagnostisert (2). Selv om prevalensen av diabetes øker, viste en ny studie at det var en synkende insidens av T2DM i Norge i perioden 2009–2014, med en årlig reduksjon på 10.1 % (3).
Gjensidig relasjon mellom periodontitt og diabetes?
Det er foreslått en toveis sammenheng mellom diabetes og periodontitt, altså at diabetes øker risikoen for periodontitt, og omvendt. Epidemiologiske studier har vist at diabetes er en risikofaktor for periodontitt, og periodontitt er blitt kalt «den sjette komplikasjonen av diabetes» (4). Periodontitt er vanligere hos diabetikere. Tall fra USA på personer i alderen 65 år og høyere viste at 83 % av diabetikere hadde periodontitt, mens andelen var 73 % for ikke-diabetikere (5). Andre har funnet at risikoen for periodontitt var omtrent tre ganger høyere enn for ikke-diabetikere (6).
Dårlig kontrollert diabetes er sterkere assosiert med periodontitt enn en godt kontrollert tilstand, og øker risikoen for at det oppstår eller utvikles periodontitt med 86 % (7). Diabetikere har større marginalt bentap enn ikke-diabetikere (8). Personer med prediabetes, d.v.s. HbA1c-nivåer på 42–47 mmol/mol (6,0–6,4 %), risikerer å utvikle diabetes, og alvorlighetsgrad av periodontalt festetap er på nivå mellom det diabetikere og normalglykemiske personer har (9).
Diabetikere har mer alvorlig periodontitt enn ikke-diabetikere (5), men effekt av periodontitt på diabetes er ikke like klar. Det synes som om diabetes er vanligere hos pasienter med periodontitt enn hos periodontalt friske. I en studie ble det beregnet at prevalens av diabetes hos personer med friske periodontale forhold var 9,6 %, mens tallet for de med periodontitt var 13,1 % (10). Dessuten har periodontittpasienter med behov for periodontal kirurgi 19 % høyere risiko for å få diabetes innen to år sammenlignet med pasienter som ikke trenger periodontal kirurgi (11). Periodontitt er assosiert med forhøyede nivåer av HbA1c og fastende blodglukose, og dårligere glykemisk kontroll (12), hvorved periodontal nedbrytning forverres og effekten av periodontal behandling blir svekket (13).
Manglende tenner eller periodontitt har blitt koblet til økt fare for utvikling av diabetes (14–16). I en stor studie over to tiår med oppfølging av ikke-diabetiske menn og kvinner i alderen 25–74 år ble det vist at periodontitt var en uavhengig prediktor for utvikling av diabetes (16). Dette ble bekreftet i en nyere kohortstudie der det ble funnet at moderat til alvorlig periodontitt var en uavhengig prediktor for utvikling av T2DM i gruppen av menn i alderen 58–72 år (15).
Samlet sett er det betydelig evidens for at det er en uavhengig assosiasjon mellom diabetes og periodontitt. Imidlertid er de fleste studiene som rapporterer om assosiasjon mellom diabetes og periodontitt utformet som tverrsnittsundersøkelser. Det er derfor behov for flere prospektive longitudinelle studier for å styrke den vitenskapelige evidensen for årsakssammenhenger (17). Dessuten er det viktig å være klar over at nesten ingen studier tar hensyn til andre orale inflammasjonstilstander, slik som periapikale patologiske tilstander med endodontisk utspring.
Peri-implantitt relatert til diabetes
I meta-analyser er det vist at diabetes mellitus er en risikofaktor for peri-implantitt, mens dårlig glykemisk kontroll ikke har sammenheng med peri-implantat mukositt (18). Prevalensen av peri-implantitt øker med økende konsentrasjon av HbA1c. Pasienter med hyperglykemi er to til tre ganger mer utsatt for å utvikle peri-implantitt sammenlignet med ikke-diabetikere (18–20). Det er også studier der diabetes mellitus ikke er rapportert som en risikofaktor for peri-implantitt (21, 22). På grunn av få studier og tidligere mangel på allment akseptert definisjon av peri-implantitt, er den vitenskapelige evidens begrenset.
Patogenese
Diabetes er sterkt koblet til mikrovaskulære tilstander (diabetisk nefropati, nevropati og retinopati) og også til makrovaskulære komplikasjoner (kardiovaskulær sykdom, slag) (23). Hyperglykemi over lang tid har skadelige effekter på endotelceller ved at det blir tykkere mikrovaskulær basalmembran, dårligere elastisitet i karene og redusert lumen med påfølgede sirkulatoriske konsekvenser. Langsommere proliferasjon av fibroblaster og redusert kollagensyntese kombinert med økt kollagenaseaktivitet forårsaker økt degradering av kollagen. Inflammatorisk respons kan bli svekket på grunn av dysfunksjon av nøytrofile celler, hemmet kjemotakse, fagocytose og adhesjon. Dette leder til økt risiko for infeksjon (figur 1). Den viktigste patologiske mekanismen ved makrovaskulær sykdom er aterosklerose som antas å være et resultat av kronisk inflammasjon.

Figur 1. Molekylære og cellulære reaksjoner ved hyperglykemi.
Hvilke biologiske mekanismer kobler diabetes til periodontal sykdom?
Periodontitt og diabetes mellitus er begge kroniske inflammasjons-baserte sykdommer, der vertens inflammatoriske reaksjoner antas å være underliggende mekanisme for de fleste av de påvirkbare risikofaktorene i begge tilstander.
Periodontitt karakteriseres ved nedbrytning av bindevev, periodontalt festetap og resorpsjon av alveolært ben (figur 2). Sykdommen er initiert av dysbiotisk mikroflora i dental biofilm (24) som leder til at tennenes støtteappparat ødelegges hos personer som er disponert for periodontitt. Derfor er dentalt plakk en nødvendig, men ikke tilstrekkelig faktor for å utløse periodontitt. Det er samvirkningen mellom patogene bakterier og vertens inflammatoriske respons som bestemmer utfallet (25).
Periodontale bakterier og/eller deres nedbrytningsprodukter er i stand til å penetrere vertsvev og utløse en kompleks medfødt-adaptiv immunologisk interaksjon. En systemisk inflammatorisk respons mot subgingivale bakterier fører til systemisk forhøyede nivåer av pro-inflammatoriske mediatorer, slik som interleukin (IL)-1β, IL-6, C-reaktivt protein (CRP), tumor nekrose faktor alfa (TNFα), reseptoraktivator av nukleær faktor kappaB-ligand (RANKL)/osteoprotegerin (OPG) forholdet, og oksygen-metabolitter (figur 2) (17, 26). Forhøyet nivå av disse cytokinene og markørene som fremmer insulinresistens er også til stede ved ukontrollert diabetes, hvor det er påvist en kvantitativ sammenheng med glykemisk kontroll. Pasienter med både periodontitt og diabetes har høyere nivåer av proinflammatoriske mediatorer sammenlignet med de som har bare periodontitt. Forhøyede proinflammatoriske faktorer systemisk og i gingiva hos pasienter med dårlig kontrollert diabetes antyder at det foreligger en biologisk mekanisme som kan forverre periodontitt.
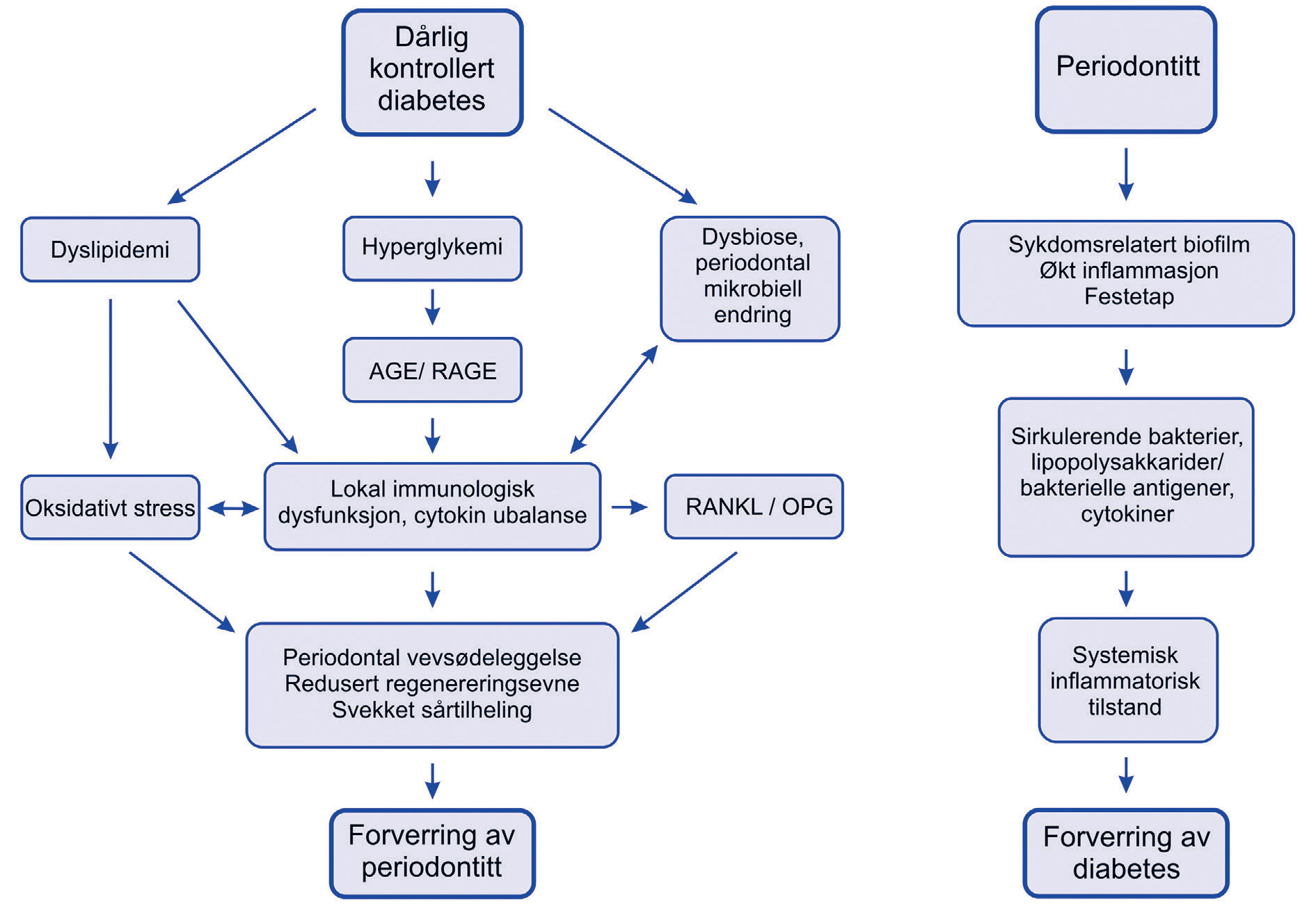
Figur 2. Mulige konsekvenser av hyperglykemi på periodontal tilstand med forverring av periodontitt hos en disponert person, samt mulig effekt av periodontitt på diabeteskontroll. AGE: avanserte glykerte endeprodukter; RAGE: Reseptor for AGE; RANKL: Reseptoraktivator av nukleær faktor kappaΒ-ligand; OPG: osteoprotegerin. (Modifisert fra Polak and Shapira, 2018 (17)).
Dyreforsøk og cellekulturstudier såvel som studier på mennesker, viser klart at hyperglykemiske tilstander forsterker proinflammatorisk respons i periodontiet (17). Det er imidlertid begrenset evidens for at det biologiske miljø ved periodontitt påvirker kontroll av diabetes.
Avanserte glykerte endeprodukter (AGE)
En viktig kronisk effekt av hyperglykemi er den irreversible ikke-enzymatiske glykeringen av proteiner og lipider der det dannes såkalte avanserte glykerte endeprodukter (AGE) (5, 17). Monosakkarider slik som glukose, fruktose og glyseraldehyd kan reagere ikke-enzymatisk med aminogrupper i proteiner, lipider og nukleinsyrer slik at det dannes senescente («foreldede») makromolekyler, AGE. AGE-modifikasjoner endrer den strukturelle integriteten og funksjonen av forskjellige typer av makromolekyler, og har betydelig effekt på samspillet mellom celle-celle, celle-matriks og matriks-matriks (27). Reseptoren for AGE, RAGE, finnes på overflaten av mange celletyper slik som monocytter, makrofager og endotelceller, og interaksjon mellom AGE og RAGE er vist å fremkalle oksidativt stress, inflammatoriske, trombotiske og fibrotiske reaksjoner i mange slags celler. Det resulteter i økt permeabilitet av blodkar, økt produksjon av proinflammatoriske cytokiner, økt osteoklast-aktivitet og redusert evne til regenerering. AGE-modifiserte makromolekyler blir i liten grad metabolisert og skilt ut fra kroppen og forårsaker en hyperreaktiv inflammatorisk tilstand. Binding av AGE til kollagen kan forverre periodontal inflammasjon og komplisere reparasjon av periodontalt vev, særlig hos diabetikere med dårlig glykemisk kontroll.
Subgingival mikroflora ved diabetes
Pasienter med T2DM kan ha høyere konsentrasjoner av glukose i gingivalvæske (gingival crevicular fluid – GCF). Følgelig kan det forventes en endret bakteriell populasjon i slikt glukose-rikt miljø. Nye sekvenseringsteknikker og identifikasjonsmetoder har avslørt noen forskjeller i subgingival mikrobiell profil ved periodontal sykdom med og uten T2DM (28). Molekylære periodontale mikrobiomstuder indikerer en mulig assosiasjon mellom endret glykemisk status ved T2DM og endringer i det periodontale mikrobiom, men det er ikke evidens for en kausal sammenheng (17, 29, 30). Enn så lenge må dataene tolkes med en viss forsiktighet fordi tilgjengelige studier viser stor variasjon i bruk av metoder, kasusdefinisjoner, diagnostiske kriterier og mikrobiologiske analyser, og dessuten er det snakk om små-skala studier (28, 31).
Behandling
Effekt av periodontal behandling på pasienter med diabetes
I senere år har effekten av periodontal behandling på reduksjon av HbA1c hos diabetikere blitt undersøkt. I flere randomiserte kontrollerte studier har det blitt observert reduksjon, og effekten av periodontal behandling på hyperglykemi har vært fremmet å tilsvare et ekstra medikament i et diabetesbehandlingsregime (32).
En forutsetning for en kausal effekt av periodontitt på diabetes ville være at behandlingen reduserer hyperglykemi og derved komplikasjoner av diabetes. En nylig publisert studie rapporterte gjennomsnittlig reduksjon i HbA1c fra -0,27 % til -1,03 % etter periodontal terapi (33). Hvorvidt denne effekten består ved 6 måneder eller mer er ukjent, men en annen ny studie har vist en liten forbedring også etter lengre oppfølgingstid (34). Selv om en reduksjon i HbA1c på 1,0 % synes liten, kan det ha betydningsfull klinisk virkning. Hver 1 %-reduksjon i HbA1c har blitt estimert å redusere risikoen for endepunkter av diabeteskomplikasjoner som følger; 21 % for diabetes-relatert død, 14 % for myokardinfarkt og 37 % for mikrovaskulære komplikasjoner (35). Det er viktig å bemerke at studier på effekten av periodontalbehandling på HbA1c ikke er entydige.
Oversiktsartikler om effekt av periodontal behandling på hyperglykemi konkluderer med at flere studier må til for å avdekke sammenhenger. Det synes som om desto mer alvorlig glykemisk tilstand og desto verre periodontal tilstand, jo mer sannsynlig er det at HbA1c reduseres som følge av periodontal terapi på grunn av et større potensial for bedring i sykdomsstatus (34, 36).
Samlet vurdert kan periodontal behandling hos diabetikere forbedre hyperglykemi og til og med forebygge noen av komplikasjonene som er beskrevet her. Den viktigste effekten av periodontal behandling av diabetespasienter er uten tvil en bedre oral helse, at tennene beholdes og at det blir bedre muligheter for oral rehabilitering der det er nødvendig. Dette forbedrer livskvaliteten og gjør glykemisk kontroll enklere. Det er ikke evidens for at det finnes en spesiell periodontal behandlingsmodalitet med tanke på glykemisk kontroll. Derfor bør behandlingen utføres på samme måte som hos ikke-diabetikere. I alle tilfeller må behovet for en systematisk og jevnlig periodontal støttebehandling vektlegges.
Effekt av behandling av hyperglykemi på pasienter med periodontitt
Periodontal sykdom har negativ innvirkning på livskvalitet og kan føre til tanntap (37), og glykemisk kontroll er et viktig mål ved grundig periodontal behandling. At glykemi spiller en viktig rolle i periodontal sykdom ble nettopp vektlagt i den siste World Workshop on the Classification of Periodontal Diseases. Glykemisk status inngår nå i det diagnostiske graderingssystemet for periodontitt (38). Selv om diabetes er en etablert risikofaktor for periodontal sykdom, er det mangel på kliniske studier som viser at kontroll av diabetes kan forbedre periodontal status. Det er biologisk sett ikke urimelig at en systemisk reduksjon av inflammasjonsmarkører som følge av diabetesbehandling kan redusere periodontal inflammasjon, men kliniske data og evidens mangler. Kliniske studier som kunne belyse dette kan ha etiske utfordringer. Det er imidlertid mekanistisk evidens som kobler hyperglykemisk status til periodontal status (39–41).
Hyperglykemi hos personer med tannimplantater
Diabetes mellitus har tidligere blitt ansett som en kontraindikasjon for innsetting av tannimplantater, og graden av glykemisk kontroll ble vektlagt (42, 43). Det er rapportert en hyppigere forekomst av mislykkede implantater hos personer med T1DM enn hos ikke-diabetikere (44, 45). Andre har ikke kunnet bekrefte dette (8). I dag er det flere studier som indikerer at tannimplantater er en sikker behandling for diabetikere, særlig når det er god vedlikeholdbehandling (46).
Konklusjon
Periodontitt og diabetes mellitus er vanlige kroniske tilstander der inflammasjon er hovedaktøren for samvirkningen mellom dem. Diabetes øker utvilsomt risikoen for periodontitt mens innvirkningen av periodontitt på glykemisk kontroll er mindre klar. Det er viktig med klinisk forebygging og terapeutisk overvåkning av diabetes og periodontitt.
Referanser
Kassebaum NJ et al. Global burden of severe periodontitis in 1990–2010: a systematic review and meta-regression. J Dent Res. 2014; 93(11): 1045–53.
Ogurtsova K et al. IDF Diabetes Atlas: Global estimates for the prevalence of diabetes for 2015 and 2040. Diabetes Res Clin Pract. 2017; 128: 40–50.
Ruiz PLD et al. Decreasing incidence of pharmacologically and non-pharmacologically treated type 2 diabetes in Norway: a nationwide study. Diabetologia 2018; 61(11): 2310–8.
Loe H. Periodontal disease. The sixth complication of diabetes mellitus. Diabetes Care. 1993; 16(1): 329–34.
Taylor JJ, Preshaw PM, Lalla E. A review of the evidence for pathogenic mechanisms that may link periodontitis and diabetes. J Periodontol. 2013; 84(4 Suppl): p. S113–34.
Mealey BL, Ocampo GL. Diabetes mellitus and periodontal disease. Periodontol 2000. 2007; 44: 127–53.
Nascimento GG et al. Does diabetes increase the risk of periodontitis? A systematic review and meta-regression analysis of longitudinal prospective studies. Acta Diabetol. 2018; 55(7): 653–67.
Chrcanovic BR, Albrektsson T, Wennerberg A. Diabetes and oral implant failure: a systematic review. J Dent Res. 2014; 93(9): 859–67.
Lamster IB et al. Periodontal findings in individuals with newly identified pre-diabetes or diabetes mellitus. J Clin Periodontol. 2014; 41(11): 1055–60.
Ziukaite L et al. Prevalence of diabetes among patients diagnosed with periodontitis: A retrospective cross-sectional study. Int J Dent Hyg. 2018; 16(2): 305–11.
Lin SY et al. Association between periodontitis needing surgical treatment and subsequent diabetes risk: a population-based cohort study. J Periodontol. 2014; 85(6): p. 779–86.
Graziani F et al. A systematic review and meta-analysis of epidemiologic observational evidence on the effect of periodontitis on diabetes An update of the EFP-AAP review. J Clin Periodontol. 2018: 45(2): 167–87.
Sanz M et al. Scientific evidence on the links between periodontal diseases and diabetes: Consensus report and guidelines of the joint workshop on periodontal diseases and diabetes by the International Diabetes Federation and the European Federation of Periodontology. J Clin Periodontol. 2018: 45(2): 138–49.
Liljestrand JM et al. Missing Teeth Predict Incident Cardiovascular Events, Diabetes, and Death. J Dent Res. 2015: 94(8): 1055–62.
Winning L et al. Periodontitis and incident type 2 diabetes: a prospective cohort study. J Clin Periodontol. 2017; 44(3): 266–74.
Demmer RT, Jacobs DR Jr, Desvarieux M. Periodontal disease and incident type 2 diabetes: results from the First National Health and Nutrition Examination Survey and its epidemiologic follow-up study. Diabetes Care. 2008; 31(7): 1373–9.
Polak D, Shapira L. An update on the evidence for pathogenic mechanisms that may link periodontitis and diabetes. J Clin Periodontol. 2018; 45(2): 150–66.
Monje A, Catena A, Borgnakke WS. Association between diabetes mellitus/hyperglycaemia and peri-implant diseases: Systematic review and meta-analysis. J Clin Periodontol. 2017; 44(6): 636–48.
Dreyer H et al. Epidemiology and risk factors of peri-implantitis: A systematic review. J Periodontal Res. 2018; 53(5): 657–81.
Aguilar-Salvatierra A et al. Peri-implant evaluation of immediately loaded implants placed in esthetic zone in patients with diabetes mellitus type 2: a two-year study. Clin Oral Implants Res. 2016; 27(2): 156–61.
Dalago HR et al. Risk indicators for Peri-implantitis. A cross-sectional study with 916 implants. Clin Oral Implants Res. 2017; 28(2): 144–50.
Renvert S et al. Factors related to peri-implantitis – a retrospective study. Clin Oral Implants Res. 2014; 25(4): 522–9.
Cade WT. Diabetes-related microvascular and macrovascular diseases in the physical therapy setting. Phys Ther. 2008; 88(11): 1322–35.
Lamont RJ, Koo H, Hajishengallis G. The oral microbiota: dynamic communities and host interactions. Nat Rev Microbiol. 2018; 16(12): 745–59.
Hajishengallis G. Immunomicrobial pathogenesis of periodontitis: keystones, pathobionts, and host response. Trends Immunol. 2014; 35(1): 3–11.
Kocher T et al. Periodontal complications of hyperglycemia/diabetes mellitus: Epidemiologic complexity and clinical challenge. Periodontol 2000, 2018. 78(1): p. 59–97.
Yamagishi SI, Matsui T. Role of Hyperglycemia-Induced Advanced Glycation End Product (AGE) Accumulation in Atherosclerosis. Ann Vasc Dis. 2018; 11(3): 253–8.
Liu LS et al. Differences in the subgingival microbial population of chronic periodontitis in subjects with and without type 2 diabetes mellitus-a systematic review. Clin Oral Investig. 2018; 22(8): 2743–62.
Graves DT, Correa JD, Silva TA. The Oral Microbiota Is Modified by Systemic Diseases. J Dent Res. 2019; 98(2): 148–56.
Longo PL et al. Glycaemic status affects the subgingival microbiome of diabetic patients. J Clin Periodontol. 2018; 45(8): 932–40.
Demmer RT et al. The subgingival microbiome, systemic inflammation and insulin resistance: The Oral Infections, Glucose Intolerance and Insulin Resistance Study. J Clin Periodontol. 2017; 44(3): 255–65.
Chapple IL, Genco R, Working group 2 of joint EFP/AAP workshop. Working group 2 of joint, Diabetes and periodontal diseases: consensus report of the Joint EFP/AAP Workshop on Periodontitis and Systemic Diseases. J Clin Periodontol. 2013; 40 Suppl 14: S106–12.
Madianos PN, Koromantzos PA. An update of the evidence on the potential impact of periodontal therapy on diabetes outcomes. J Clin Periodontol. 2018; 45(2): 188–95.
Merchant AT et al. Effect of Long-Term Periodontal Care on Hemoglobin A1c in Type 2 Diabetes. J Dent Res. 2016; 95(4): 408–15.
Stratton IM et al. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective observational study. BMJ. 2000; 321(7258): 405–12.
Quintero AJ et al. Effect of two periodontal treatment modalities in patients with uncontrolled type 2 diabetes mellitus: A randomized clinical trial. J Clin Periodontol. 2018; 45(9): 1098–106.
Buset SL et al. Are periodontal diseases really silent? A systematic review of their effect on quality of life. J Clin Periodontol. 2016; 43(4): 333–44.
Papapanou PN et al. Periodontitis: Consensus report of workgroup 2 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Clin Periodontol. 2018; 45 Suppl 20: S162-S170.
Kurtis B et al. IL-6 levels in gingival crevicular fluid (GCF) from patients with non-insulin dependent diabetes mellitus (NIDDM), adult periodontitis and healthy subjects. J Oral Sci. 1999; 41(4): 163–7.
Engebretson SP et al., Gingival crevicular fluid levels of interleukin-1beta and glycemic control in patients with chronic periodontitis and type 2 diabetes. J Periodontol. 2004; 75(9): 1203–8.
Duarte PM et al. Diabetes modulates gene expression in the gingival tissues of patients with chronic periodontitis. Oral Dis. 2007; 13(6): 594–9.
Javed F, Romanos GE. Impact of diabetes mellitus and glycemic control on the osseointegration of dental implants: a systematic literature review. J Periodontol. 2009; 80(11): 1719–30.
Marchand F et al. Dental implants and diabetes: conditions for success. Diabetes Metab. 2012; 38(1): 14–9.
Alsaadi G et al. Impact of local and systemic factors on the incidence of late oral implant loss. Clin Oral Implants Res. 2008.; 19(7): 670–6.
Daubert DM et al. Prevalence and predictive factors for peri-implant disease and implant failure: a cross-sectional analysis. J Periodontol. 2015; 86(3): 337–47.
Kotsakis GA et al. A systematic review of observational studies evaluating implant placement in the maxillary jaws of medically compromised patients. Clin Implant Dent Relat Res. 2015; 17(3): 598–609.
English summary
A cross-link between diabetes mellitus type II and periodontal disease
Diabetes mellitus is a frequently occurring disease and its prevalence is dramatically rising worldwide. Diabetic patients are commonly encountered in the dental office. Extensive research has been conducted to explore the impact of diabetes on oral health. Among oral diseases examined for a possible relationship to diabetes, the association of periodontal disease with diabetes mellitus type 2 is well established and is based on high quality evidence.
Periodontitis and diabetes mellitus are both inflammation-based diseases, and host inflammatory response is considered as the main mechanism underlying most of the modifiable risk factors in both conditions. A two-way relationship is proposed. A dysbiotic biofilm in the gingival area may induce an inflammatory response in the surrounding periodontal tissue, which in a susceptible host can accelerate and eventually result in loss of attachment. In a diabetes patient hyperglycemia can aggravate the periodontal inflammation and contribute to reduced repair of inflamed tissue. Conversely, an effect of periodontitis on diabetes control cannot be ruled out.
The increased risk of periodontal and peri-implant inflammation and impaired tissue healing in patients with hyperglycemia are among the issues elaborated in this review, in addition to discussing the biological background. The need for a careful supportive periodontal therapy is underscored.
Bunæs DF, Verket A, Aass AM, Bolstad AI. Sammenheng mellom diabetes mellitus Type 2 og periodontal sykdom. Nor Tannlegeforen Tid. 2020;131:10-6. doi:10.56373/2020-1-4
Korresponderende forfatter: Anne Isine Bolstad, Institutt for klinisk odontologi, Årstadveien 19, NO-5009 Bergen, Norge; e-post: anne.bolstad@uib.no
Akseptert 10. juni 2019.
Artikkelen har gjennomgått ekstern faglig vurdering.
Bunæs DF, Verket A, Aass A-M, Bolstad AI. Sammenheng mellom diabetes mellitus Type 2 og periodontal sykdom. Nor Tannlegeforen Tid. 2020; 130: 10–6
Nøkkelord (norsk MeSH): Diabetes; Hyperglykemi; Diabeteskomplikasjoner; Kronisk marginal periodontitt; Molekylærbiologi; Mikrobiota
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Bunæs DF, Verket A, Aass AM, Bolstad AI. Sammenheng mellom diabetes mellitus Type 2 og periodontal sykdom. Nor Tannlegeforen Tid. 2020;131:10-6. doi:10.56373/2020-1-4