Infektionshygiejnens rolle i forebyggelse af antibiotikaresistens
Spredning af resistente og multiresistente bakterier er et verdensomspændende problem, hvis forebyggelse kræver en indsats fra internationalt til lokalt niveau. De seneste år er der formuleret internationale og nationale strategier til forebyggelse af spredningen af resistente bakterier, og et af målene omhandler forbedret infektionskontrol gennem effektive hygiejniske tiltag. I de vestlige lande drejer det sig især om tiltag i sundhedsvæsnet, herunder på tandklinikker.
Undersøgelser har påvist multiresistens i enkelte Enterobacteriaceae og Enterococcus stammer fra mundhulen og en række tilfælde af MRSA (methicillin-resistente Staphylococcus aureus). Ligeledes er der påvist overførsel af MRSA på tandklinikken og endda efterfølgende sygdomsudvikling. Resistens hos bakterier i normalfloraen i mundhulen er også et stigende problem. Forebyggelsen af smittespredning skal tilrettelægges, så overførsel fra såvel mundhule som hud og hænder forhindres. Dette opnås ved basale hygiejnerutiner inkluderende korrekt håndhygiejne og anvendelse af personlige værnemidler. Desuden skal der ud over rengøring, desinfektion og sterilisation af instrumenter og udstyr fokuseres på forebyggelse af reservoirdannelse med resistente bakterier på klinikken gennem grundig rengøring og overfladedesinfektion. Kort sagt drejer også forebyggelse af spredning af resistente bakterier sig om en fornuftig tilrettelæggelse af alle arbejdsgange og optimal efterlevelse af de generelle infektionshygiejniske retningslinjer ved undersøgelse og behandling af alle patienter på tandklinikken.
Hovedpunkter | |
|---|---|
· |
I internationale og nationale strategier til forebyggelse af spredning af resistente bakterier er et af målene forbedret infektionskontrol. |
· |
Blandt de multiresistente bakterier der i disse år spredes i de nordiske lande er især MRSA blevet påvist og overført på tandklinikker. |
· |
Spredning af resistente bakterier på tandklinikken forebygges mest effektivt ved at opretholde et højt hygiejnisk niveau ved al tandbehandling. |
· |
De generelle infektionshygiejniske tiltag omfatter håndhygiejne, anvendelse af personlige værnemidler samt rengøring, desinfektion og sterilisation af instrumenter, udstyr og inventar. |
Udvikling og spredning af resistente og i særdeleshed multiresistente bakterier er et verdensomspændende problem og udgør i dag den største trussel mod det moderne sundhedsvæsen. Følgelig kræver en forandring af denne udvikling såvel en international som en national indsats, der ultimativt gennemføres på lokalt plan. Det internationale samfund har erkendt problemstillingen, og på FN´s generalforsamling i 2016 tilsluttede medlemslandene sig en politisk erklæring, hvor alle forpligter sig til at udarbejde nationale handlingsplaner på grundlag af WHO´s Global Action Plan on Antimicrobial Resistance fra 2015 (1). Heri formuleres fem strategiske mål, der skal resultere i, at vi også «i lang tid fremover kan behandle og forebygge infektionssygdomme med effektiv og sikker medicin, der er kvalitetssikret, anvendes ansvarligt og er tilgængelig for alle, der har behov herfor». WHO´s fem mål omhandler henholdsvis 1) forbedret erkendelse og 2) viden på området, 3) infektionskontrol gennem effektive hygiejniske tiltag, 4) optimering af antibiotikaforbruget i både human og veterinær medicin og endelig 5) investering i udvikling af ny medicin, vacciner og diagnostiske metoder. Disse mål er siden udmøntet i nationale handlingsplaner i de nordiske lande med mere konkrete beskrivelser af mål for forskellige indsatsområder, de såkaldte «One Health» strategier. One Health begrebet indebærer, at antibiotikaresistens bekæmpes ved at påvirke alle indgående aspekter og aktører (2 - 4).
Infektionshygiejniske indsatsområder
Fokus for nærværende artikel er de indsatsområder, der omhandler forbedret hygiejne. En række undersøgelser og rapporter har fastlagt, at infektionshygiejniske tiltag kan minimere spredningen af resistente mikroorganismer og dermed reducere risikoen for bærertilstande og infektioner og følgelig behovet for anvendelse af antibiotika. I særdeleshed er det slået fast, at håndhygiejne er det mest effektive tiltag til at forebygge både direkte og indirekte overførsel af resistente mikroorganismer i sundhedsvæsnet (figur 1) (5 - 11). Derudover kan personalets klinikbeklædning ligesom kontaminerede overflader og genstande på klinikken være vigtige smittekilder (12, 13). I den omfattende engelske rapport «Tackling drug-resistant infections globally» fra 2016, hvis anbefalinger er helt i tråd med WHO´s mål, angives, at indsatsen på hygiejneområdet vil variere fra land til land. I udviklingslande er det nødvendigt først at fokusere på at forbedre de basale hygiejniske forhold i form af adgang til rent drikkevand og velfungerende sanitære forhold. I den vestlige del af verden drejer det sig i højere grad om at reducere bærertilstande og infektioner, bl.a. forårsaget af resistente bakterier, i sundheds- og plejesektoren. Og for os alle gælder, at vi kan bidrage til at bekæmpe spredning af infektioner ved god håndhygiejne (14). I de nordiske One Health strategier for forebyggelse af antibiotikaresistens indgår ligeledes målsætninger, hvis fokus er at reducere smittespredning og forebygge infektioner i sundhedssektoren; og i den svenske og norske handlingsplan er tandplejen endda nævnt eksplicit. Blandt de specifikke tiltag der tilskyndes til at tage i anvendelse er udstrakt brug af god håndhygiejne, personlige værnemidler, rengøring og desinfektion (2, 3, 15).
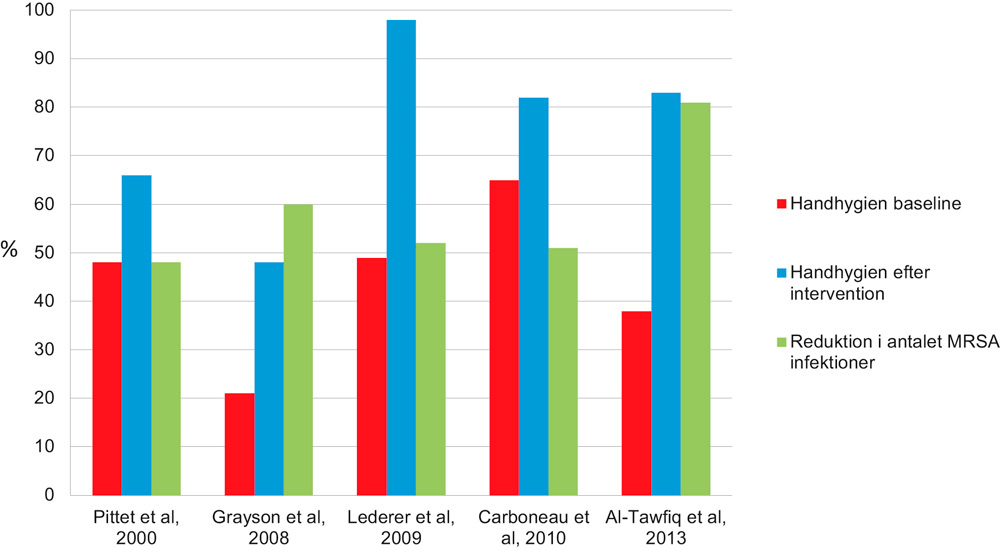
Figur 1. Håndhygiejne og MRSA infektionerEksempler på studier over efterlevelse af håndhygiejne før og efter intervention samt den procentuella reduktion i antallet af MRSA-infektioner efter forbedret håndhygiejne (ref. 7 - 11)
I de nordiske lande har der længe været fokus på resistente bakterier, i særdeleshed methicillin-resistente Staphylococcus aureus (MRSA), vancomycin-resistente enterokokker (VRE), extended-spectrum beta-lactamase- (ESBL) producerende Enterobacteriaceae samt carbapenemase-producerende organismer (CPO). Alle lande har haft udbrud med disse bakterier og har derfor de seneste år udarbejdet retningslinjer for forebyggelse af spredning af resistente bakterier (16 - 19). Et land - Finland - har udarbejdet en samlet retningslinje for alle de multiresistente bakterier (20), og Sverige har fornylig udarbejdet en fælles screeningsvejledning for alle resistente bakterier (21). Da der findes mange forskellige antibiotikaresistente bakterier med fælles smitteveje, giver det god mening at udarbejde samlede vejledninger for opsporing og forebyggelse af dem alle.
Fælles for de infektionshygiejniske retningslinjer i de nordiske lande er, at forebyggelse af smittespredning med resistente bakterier først og fremmest beror på efterlevelse af de generelle infektionshygiejniske forholdsregler i alle situationer, da man ofte ikke ved, om en given patient kan være bærer af en eller flere resistente bakterier. Dette gælder også for almen tandbehandling på almindelige klinikker. Når diagnosen er kendt og/eller ved behandling af særligt syge og svækkede patienter, vil man - især ved indlæggelse på hospital hvor der er ekstra høj risiko for yderligere spredning - ofte anvende supplerende tiltag som isolation på enestue med eget toilet/bad.
Spredningen af resistente bakterier i sundhedsvæsnet forøger ikke bare risikoen for alvorlige og sværtbehandlelige infektioner, den forøger også udgifterne til sundhedsvæsnet betragteligt. Det er for eksempel beregnet, at for hver dollar, der satses på at stimulere til efterlevelse af god infektionshygiejne, genereres en mere end tyvefold reduktion i udgifterne (22).
Resistente bakterier på tandklinikken
Resistens over for diverse antibiotika er påvist i en lang række af mundhulens over 700 forskellige bakteriearter, og dette har givet anledning til diskussion af mundhulens rolle som reservoir for spredning af resistensgener (23, 24). Enkelte studier har tillige påvist multiresistens i orale bakterier, specielt ESBL (extended spectrum betalactamase) i Prevotella arter (25, 26). Ved dentale infektioner er især resistens over for penicillin og klindamycin et stigende problem. Derimod er metronidazolresistens sjælden. Et relativt nyt studie fra Sverige indikerer, at bærertilstand med penicillin- og amoxicillinresistente orale streptokokker kan være betydeligt mere udbredt i mundhulen en hidtil antaget (27). Hertil kommer at resistente bakteriearter, der ikke normalt er hjemmehørende i mundhulen, kan kolonisere både mundhulen og svælget. Under undersøgelse og behandling på tandklinikken kan disse bakterier spredes mellem patienter og personale og til omgivelserne og potentielt give anledning til smitsomme sygdomme. Herudover er der risiko for spredning af resistente bakterier fra patienters hud og personalets hænder, hvis de rette infektionshygiejniske procedurer ikke efterleves. Dette gælder i særdeleshed MRSA, der typisk koloniserer huden samt næsen og evt. svælget.
Forekomsten af en række resistente bakterier har generelt været stigende i de nordiske lande de senere år. Ud over MRSA gælder det først og fremmest ESBL- og carbapenemase-producerende Enterobacteriaceae som Klebsiella og Escherichia coli samt Enterococcus arter såsom vancomycin-resistente Enterococcus faecalis (28). Enterobacteriaceae og Enterococcus hører sædvanligvis til i tarmkanalen, men kan også af og til isoleres fra mundhulen, især under behandling med antibiotika. Det er desuden almindeligt, at tarmbakterier findes som en del af den transiente mikroflora på hænderne. Endvidere isoleres Enterococcus faecalis jævnligt fra rodkanaler, der responderer dårligt på behandling. Flere studier har de senere år undersøgt, om der kunne findes multiresistente isolater blandt disse bakteriearter fra mundhulen (tabel 1). I fire undersøgelser fra henholdsvis Sverige, Norge og USA isoleredes i alt 223 Enterococcus faecalis-stammer fra en vifte af orale infektioner (29 - 32). En del af isolaterne viste resistens over for forskellige antibiotika, men ingen var resistente over for vancomycin (29 - 31). I en portugisisk undersøgelse af supragingival plaque hos 46 patienter med ortodontisk apparatur og 55 kontroller fandtes multiresistens hos tre E. faecalis og et E. coli isolat i testgruppen (33). En mindre norsk undersøgelse af supragingival plaque fra raske bærere af ESBL-producerende E. coli i tarmen fandt en enkelt ESBL-producerende Enterobacteriacea, men ingen ESBL-producerende orale bakterier (34). For Enterobacteriaceae i øvrigt har enkelte studier rapporteret om ESBL-producerende stammer i mundhulen hos ældre og svækkede personer, men der er så vidt vides endnu ingen rapporter om orale infektioner med disse bakterier eller overførsel på tandklinikker (35).
Reference |
Population |
Undersøgelse |
Resultater |
|---|---|---|---|
Sun J et al. 2009 (24) |
2839 patienter med marginal parodontitis (MP) og 21 med apikal parodontitis (AP) (Norge) |
Subgingival plaque og rodkanalprøver us. for Enterococcusog resistens ved dyrkning og molekylærbiologiske metoder |
Enterococcus isoleret fra 106 (3,7 %) af MP patienter og 2 (9,5 %) af AP patienter.49 % isolater resistente for tetracyklin, 8 % for erythromycin, men 0 % for ampicillin og vancomycin. |
Dahlén G et al. 2012 (25) |
820 patienter med dybe eller slimhindeinfektioner (Sverige) |
Indsendte prøver us. for Enterococcusog resistens ved dyrkning, PCR og molekylærbiologiske metoder |
61 Enterococcus isoleret fra 18 patienter med dybe og 43 patienter med slimhindeinfektioner. Alle isolater var resistente for clindamycin, men følsomme for amoxicillin og vancomycin. |
Rams TE et al. 2013 (26) |
2764 patienter med marginal parodontitis (USA) |
Subgingival plaque us. for Enterococcusog resistens ved dyrkning |
Enterococcus isoleret fra 47 (1,7 %) af patienter. 53 % isolater resistente for tetracyklin, 26 % for erythromycin, men 0 % for ampicillin og vancomycin |
Poeta P. et al 2009 (28) |
46 patienter med og 55 uden fast ortodontisk apparatur (Portugal) |
Supragingival plaque us. for E. coli og Enterococcus og resistens ved dyrkning og PCR |
E. coli eller Enterococcus isoleret fra 9 af 46 orto.pt, men ingen pt. uden fast apparatur. Resistens for visse antibiotika i alle isolater; 4 isolater var multiresistente. |
Søraas A et al. 2014 (29) |
17 pt. bærere af ESBL-producerende E. coli i tarmen (Norge) |
Supragingival plaque og fæces us. for ESBL-producerende bakterier ved dyrkning og PCR |
Ingen orale bakterier med ESBL. En oral ESBL-producerende Enterobacteriacea |
Staphylococcus aureus kan af og til isoleres fra mundhulen hos både børn og voksne, men udgør typisk kun en lille andel af mikrofloraen. Den anses for at tilhøre den transiente mikroflora og ikke den residente normalflora i mundhulen. Forekomsten synes at stige med alderen og ved tilstedeværelse af proteser og især protesestomatitis. MRSA synes at følge samme mønster med størst forekomst hos ældre og svækkede personer samt børn. Flere undersøgelser har påvist MRSA fra bl.a. saliva og dental plaque, dog oftest kun hos en begrænset andel af de undersøgte personer (36, 37). Fire nyere undersøgelser viser samme tendens (Tabel 2). I Grækenland isoleredes S. aureus i 18 % af prøver fra subgingival plaque og tungen fra 154 patienter, men der blev ikke fundet MRSA (38). I England fandt en undersøgelse af 200 protesebærere MRSA hos henholdsvis 1 % af ambulante og 12 % af indlagte patienter (39). En italiensk undersøgelse fandt S. aureus hos 3 af 15 patienter med pyogene infektioner, men ingen hos 21 raske kontroller. Der blev ikke isoleret MRSA, men én multiresistent S. epidermidis (40). Endelig isoleredes to MRSA stammer blandt 62 S. aureus isolater fra forskellige orale infektioner i Sverige og én fra 70 patienter i Thailand, mens der ikke blev fundet MRSA blandt 25 raske bærere af S. aureus i mundhulen i Sverige (41).
Reference |
Population |
Undersøgelse |
Resultater |
|---|---|---|---|
Koukos et al. 2015 (33) |
154 patienter med sunde parodontale forhold (SU), gingivitis (GI) og marginal parodontitis (MP) (Grækenland) |
Tungeskrab og subgingival plaque us. for S. aureus og MRSA ved PCR |
S. aureus isoleret fra 27 (18 %) af patienterne (både SU, GI og MP).Ingen MRSA. |
Lewis et al. 2015 (34) |
100 ambulante og 100 indlagte protesebærere (England) |
Prøver fra protesebasis us. for S. aureus og MRSA ved dyrkning |
S. aureus isoleret fra 27 (27 %) af ambulante og 33 (33 %) af indlagte patienter.MRSA isoleret fra 1 (1 %) af ambulante og 12 (12 %) af indlagte patienter |
Buonavoglia A et al. 2010 (35) |
15 patienter med pyogene infektioner og 21 raske kontroller (Italien) |
Pus / slimhindeskrab us. for Staphylococcus species, resistens og MRSA ved dyrkning og PCR |
Staphylococcus species isoleret fra 1 (5 %) af raske og 6 (40 %) af pt. med pyogene infektioner.Ingen MRSA, men en multiresistent S. epidermidis. |
Blomquist et al. 2015 (36) |
1050 patienter med orale infektioner og 56 raske kontroller (Sverige)374 patienter (Thailand) |
Skrab fra infektion /saliva / tungeskrab us. for S. aureus og MRSA ved dyrkning og PCR |
S. aureus isoleret 62 svenske patienter, heraf 2 MRSA, og 25 raske kontroller, heraf ingen MRSA.S. aureus isoleret fra 70 thailandske patienter, heraf 1 MRSA |
Overførsel af resistente bakerier på tandklinikken
Et begrænset antal studier har påvist overførsel af resistente bakterier på tandklinikken. Hovedparten af undersøgelserne har fokuseret på spredning af MRSA, til dels på grund af udbredt screening for denne bakterie. Detektion af netop MRSA udelukker således ikke, at overførsel af andre resistente bakterier kan forekomme, men indikerer snarere at det er en mulighed.
For at belyse risikoen for overførsel af MRSA til personalet under tandbehandling har flere studier undersøgt for MRSA-bærertilstand hos tandlæger og især studerende og fundet varierende resultater. Flere mindre studier fandt ingen MRSA-positive, ligesom der i en dansk undersøgelse ikke blev isoleret MRSA blandt 267 undersøgte tandlæger og -studerende (36, 37). I to undersøgelser fra USA isoleredes MRSA fra henholdsvis 3 % og 21 % af de undersøgte tandlæger, mens tre nyere studier fandt MRSA hos 20 % i Mexico, 3 % i Italien og 3 - 6 % i Syd Korea. I nogle af disse studier tydede resultaterne på en, om end omdiskuteret, stigende tendens til kolonisation i forhold til antal år med klinisk arbejde (42 - 44). I en af undersøgelserne blev der tillige undersøgt for MRSA på forskellige overflader på tandklinikken, og et af isolaterne herfra var identisk med et isolat fra en studerende, hvilket sandsynliggør overførsel på tandklinikken (42). MRSA blev isoleret fra 8 % af overfladeprøverne og på 4 af 7 klinikker. Også andre studier har påvist MRSA på overflader på tandklinikken samt på aftryk og gipsmodeller, dog oftest kun i beskedent omfang (36, 45, 46). Et svensk studie viste, at røntgensensorer hyppigt var kontaminerede med orale bakterier og i mindre grad med S. aureus (47). Desværre indgik der ikke resistensbestemmelse i denne undersøgelse, men den understreger udfordringerne med at undgå smittespredning via udstyr på tandklinikken. I en undersøgelse af MRSA-stammers overlevelse på overflader på tandklinikken blev der fundet en hurtig reduktion af disse (> 90 % efter 15 minutter), men overlevelse af enkelte stammer i flere måneder. Ifølge forfatterne indebærer dette en begrænset risiko for infektion, men en betydelig risiko for kolonisation og spredning til samfundet (48).
Enkelte rapporter har vist, at MRSA også kan overføres til patienter på tandklinikken og ultimativt medføre sygdomsudvikling. I Danmark afslører det nationale MRSA-overvågningsprogram, at en MRSA-positiv tandlæge har overført MRSA til i alt ti personer omfattende hans familie, patienter og personale på klinikken, dog uden at der udvikledes sygdom som følge heraf (37). I en undersøgelse fra Japan, hvor der blev isoleret MRSA fra overflader på tandklinikken, blev MRSA-infektion (6 patienter) eller -kolonisation (2 patienter) med identiske stammer samtidig påvist fra 8 af 140 konsekutive patienter på klinikken. Det positive element i dette studie var, at der efter en periode med revision af og træning i de infektionshygiejniske procedurer på klinikken ikke kunne isoleres MRSA fra hverken overflader på klinikken eller fra nogen af de efterfølgende 117 undersøgte patienter (49). Sidst men ikke mindst viste en rapport fra England, at to patienter udviklede orale infektioner med MRSA, der var overført fra tandlægens hænder. Da tandlægen efterfølgende blev behandlet og begyndte at bruge handsker rutinemæssigt, blev der ikke længere påvist MRSA på klinikken eller hos hans patienter (50).
Forebyggelse af spredning af resistente bakterier på tandklinikken
Ovenstående rapport fra England peger på et centralt element i forebyggelse af smittespredning på klinikken, nemlig anvendelse af personlige værnemidler, især handsker (50). Ved tilstedeværelse af MRSA i mundhulen eller svælget vil anvendelse af kirurgisk maske/mundbind og briller ved risiko for sprøjt og aerosoldannelse ligeledes være relevant. Anvendelse af personlige værnemidler sammen med optimal håndhygiejne forebygger både direkte og indirekte kontaktsmitte samt luftbåren smitte. Helt generelt er håndhygiejne den væsentligste faktor til at forebygge smittespredning; og for resistente bakteriers vedkommende har en række undersøgelser gennemført i hospitalsvæsnet slået fast, at tiltag, der forbedrer personalets håndhygiejne, reducerer overførsel og udvikling af infektioner med MRSA (51). Både hænder, håndled og evt. underarme bliver kontaminerede under klinisk arbejde, og når handsker tages af (52, 53). Derfor er det en forusætning, at kliniktøjet har korte ærmer, så der kan udføres korrekt hånddesinfektion og evt. håndvask inden og direkte efter arbejde med patienter eller kontaminerede instrumenter, udstyr og inventar.
Et andet væsentligt element i smitteforebyggelse er at forhindre reservoirdannelse af bakterier, herunder resistente bakterier i miljøet. Dette forebygges ved grundig rengøring og overfladedesinfektion og evt. afdækning af overflader, inventar mv. Her har flere rapporter vist, at intensivering af rengøringsprocedurer kan reducere forekomsten af MRSA og stoppe udbrud på hospitaler (54). I den ovenfor refererede undersøgelse fra Japan, hvor overførsel af MRSA på tandklinikken blev stoppet, lå fokus netop på at nedbringe kontamination af overflader på klinikken med tiltag som formindsket brug af trefunktionssprøjte, afdækning af kontakter og lign. (49). Fejlagtig teknik ved overfladedesinfektion, såsom utilstrækkelig gennemvædning af kluden med desinfektionsmiddel, kan bidrage til, at bakteriemængden forøges i stedet for at reduceres, og at bakterier spredes mellem forskellige overflader på klinikken (55).
Ovennævnte hygiejniske tiltag er sammen med rengøring, desinfektion og sterilisation af instrumenter, udstyr osv. grundpillerne i de generelle - eller procedurerelaterede - infektionshygiejniske retningslinjer, som anvendes ved alle former for undersøgelse og behandling på tandklinikken. Sådan har det været, siden HIV bredte sig i 1980´erne, og man erkendte, at alle personer kan være potentielle smittekilder. De senere år har fremkomsten af multiresistente bakterier og andre mikroorganismer, som er svære at udrydde, imidlertid betydet, at nogle lande igen har indført supplerende retningslinjer ved forekomst af særlige mikroorganismer. I hospitalsregi og evt. andre lokaliteter, hvor syge og svækkede personer med størst risiko for at udvikle alvorlige infektioner behandles, anvendes screening for udvalgte resistente bakterier og isolation af bærere. På almindelige tandklinikker drejer det sig især om anvendelse af de allerede nævnte infektionshygiejniske principper som personlige værnemidler og overfladedesinfektion, og ikke mindst håndhygiejne. De specifikke retningslinjer varierer lidt fra land til land, men fælles for alle er at fokusere på en fornuftig tilrettelæggelse af alle arbejdsgange med optimal efterlevelse af de generelle infektionshygiejniske retningslinjer ved alt klinisk arbejde. Dette er den mest effektive fremgangsmåde til at forebygge spredning af mikroorganismer, kendte såvel som ikke erkendte, ikke resistente såvel som resistente.
English summary
Preventing antibiotic resistance by infection control
Spread of resistant and multi-resistant bacteria is a problem of worldwide concern, and prevention calls for an international as well as a local effort. Recently, international and national strategies for preventing spread of resistant bacteria have been developed, and one of the goals is to improve infection control through efficient hygienic efforts. In the western part of the world the efforts should especially include health services including dental clinics.
Studies have identified a few multi-resistant Enterobacteriaceae and Enterococcus species in the oral cavity but a number of MRSA (methicillin-resistant Staphylococcus aureus). Also transmission of MRSA and even subsequent infection have been proven. Resistance in the resident oral microflora is also an increasing problem. Preventing such incidents must include blocking bacterial transmission from the oral cavity as well as the skin and hands. This is achieved by basic hygiene measures including performing correct hand hygiene procedures and use of personal protective equipment. Further, apart from cleaning, disinfection and sterilization of dental instruments interventions like cleaning and surface disinfection to prevent building up reservoirs of resistant bacteria at the dental clinic should be in focus. Shortly, preventing spread of resistant bacteria is achieved by an optimal inclusion of the guidelines for general infection control when planning and performing treatment of all patients at the dental clinic.
Larsen T, Kjerulf A, Lund B. Infektionshygiejnens rolle i forebyggelse af antibiotikaresistens. Nor Tannlegeforen Tid. 2019;130:0-0. doi:10.56373/2019-3-6
Referencer
World Health Organization 2015. Global action plan on antimicrobial resistance. http: //www.wpro.who.int/entity/drug_resistance/resources/global_action_plan_eng.pdf (set 04122017).
Sundheds- og Ældreministeriet og Miljø- og Fødevareministeriet 2017. One health strategi mod antibiotikaresistens. http: //www.sum.dk/~/media/Filer %20- %20Publikationer_i_pdf/2017/Antibiotika-One-Health-Strategy/DK-One-Health-05072017 - 5.pdf (set 04122017).
REGERINGEN, Socialdepartementet. Protokol III: 6 Strategi för arbetet mot antibiotikaresistens. Sverige 2016 - 4 - 21. http: //www.regeringen.se/49b7ad/contentassets/e53b9bcbc38b49d993c5391cc9ac652e/regeringsbeslut_strategi_antibiotikaresistens.pdf (set 08012018)
HELSE- OG OMSORGSDEPARTEMENTET. Nasjonal strategi mot Antibiotikaresistens 2015 - 2020. Oslo, Norge 2015. Publikasjonskode: I1164. https: //www.regjeringen.no/contentassets/5eaf66ac392143b3b2054aed90b85210/strategi_antibiotikaresistens_230615.pdf (set 08012018)
Dar OA, Hasan R, Schlundt J, Harbarth S, Caleo G, et al. Antimicrobials: access and sustainable effectiveness 4. Exploring the evidence base for national and regional policy interventions to combat resistance. Lancet. 2016; 387: 285 - 95.
WORLD HEALTH ORGANIZATON. Evidence of hand hygiene to reduce transmission and infections by multidrug resistant organisms in health-care setting. WHO 2014.
Pittet D, Hugonnet S, Harbarth S, Mourouga P, Sauvan V, Touveneau S, et al. Effectiveness of a hospital-wide programme to improve compliance with hand hygiene. Infection Control Programme. Lancet. 2000; 14; 356(9238): 1307 - 12.
Grayson ML, Jarvie LJ, Martin R, Johnson PD, Jodoin ME, McMullan C, et al. Significant reductions in methicillin-resistant Staphylococcus aureus bacteraemia and clinical isolates associated with a multisite, hand hygiene culture-change program and subsequent successful statewide roll-out. Med J Aust. 2008; 188: 633 - 40.
Lederer JW Jr, Best D, Hendrix V. A comprehensive hand hygiene approach to reducing MRSA health care-associated infections. Jt Comm J Qual Patient Saf .2009; 35: 180 - 5.
Carboneau C, Benge E, Jaco MT, Robinson M. A lean Saf, 2009 team increases hand hygiene compliance and reduces hospital-acquired MRSA infections by 51 %. J Healthc Qual. 2010; 324: 61 - 70.
Al-Tawfiq JA, Abed MS, Al-Yami N, Birrer RB. (2013). Promoting and sustaining a hospital-wide, multifaceted hand hygiene program resulted in significant reduction in health care-associated infections. Am J Infect Control. 2013; 41: 482 - 6.
Haun N, Hooper-Lane C, Safdar N. Healthcare personnel attire and devices as fomites: A systematic review. Infect Control Hosp Epidemiol. 2016; 37: 1367 - 73.
Boyce JM. Environmental contamination makes an important contribution to hospital infection. J Hosp Infect. 65 Suppl 2: 50 - 54, 2007.
O´Neill J. The review on antimicrobial resistance 2016. Tackling drug-resistant infections globally: Final report and recommendations. https: //amr-review.org/sites/default/files/160518_Final %20paper_with %20cover.pdf (set 04122017).
HELSE- OG OMSORGSDEPARTEMENTET. Handlingsplan mot antibiotikaresistens i helsetjenesten. Oslo, Norge 2015. Publikasjonskode: I-1171 B. https: //www.regjeringen.no/contentassets/915655269bc04a47928fce917e4b25f5/handlingsplan-antibiotikaresistens.pdf (set 08012018)
SUNDHEDSSTYRELSEN. Forebyggelse af spredning af MRSA. Vejledning. 3. udgave. København 2016. https: //www.sst.dk/da/sygdom-og-behandling/smitsomme-sygdomme/mrsa/~/media/430A2A77872E479FA9EBC42A5E053BFC.ashx (set 15122017)
FOLKEHELSEINSTITUTTET. Enterokokkinfeksjon (inkl. vankomycinresistente enterokokker, VRE) - veileder for helsepersonell. Oslo 2010, opdateret 2017. http: //www.fhi.no/nettpub/smittevernveilederen/sykdommer-a-a/enterokokkinfeksjon-inkl.-vankomyci/ (set 23012018)
FOLKHÄLSOMYNDIGHETEN. ESBL-producerande tarmbakterier. Kunskapsunderlag med förslag till handläggning för att begränsa spridningen av Enterobacteriaceae med ESBL. Stockholm 2014. https: //www.folkhalsomyndigheten.se/contentassets/f4df42e7e643414ba3499a9ee1801915/esbl-producerande-tarmbakterier.pdf (set 23012018)
SUNDHEDSSTYRELSEN. Vejledning om forebyggelse af spredning af CPO. København 2018. https: //www.sst.dk/da/sygdom-og-behandling/smitsomme-sygdomme/~/media/52D5C295BCEA48E6BC596C0083367FF3.ashxset (set 05092018)
Kolho E, Lyytikäinen O. Ohje moniresistenttien mikrobien tartunnantorjunnasta. Terveyden JA, Hyvinvoinnin Laithos 2014. http: //www.julkari.fi/bitstream/handle/10024/116266/URN_ISBN_978 - 952 - 302 - 260 - 7.pdf?sequence=1
FOLKHÄLSOMYNDIGHETEN. Screening för antibiotikaresistenta bakterier. Rapport från en arbetsgrupp med representanter från smittskydd och vårdhygien 2016 - 17. Stockholm 2017. https: //www.folkhalsomyndigheten.se/contentassets/8f56681b343b46b9a48f13c0b1774e82/screening-resistenta-bakterier-02307 - 2017.pdf (set 23012018)
Chen YC, Sheng WH, Wang JT, Chang SC, Lin HC, Tien KL et al. Effectiveness and limitations of hand hygiene promotion on decreasing healthcare-associated infections. PloSOne. 2011; 6: e27163.
Roberts AP, Mullany P. Oral biofilms: a reservoir of transferable, bacterial, antimicrobial resistance. Expert Rev Anti Infect Ther. 2010; 8: 1441 - 50.
Dupin C, Tamanai-Shacoori Z, EhrmannE, Dupont A, Barloy-Hubler F et al. Oral gram-negative anaerobic bacilli as a reservoir of ?-lactam resistance genes facilitating infections with multiresistant bacteria. Int J Antimicrob Agents. 2015; 45: 99 - 105.
Kim S-M, Kim HC, Lee S-WS. Characterizaton of antibiotic resistance determinants in oral biofilms. J Microbiol. 2011; 49: 595 - 602.
Fernández-Canigia L, Cejas D, Gutkind G, Radice M. Detection and genetic characterization of ?-lactamases in Prevotella intermedia and Prevotella nigrescens isolated from oral cavity infections and peritonsilar abscesses. Anaerobe. 2015; 33: 8 - 13.
Khalil D, Hultin M, Rashid MU, Lund B. Oral microflora and selection of resistance after a single dose of amoxicillin. Clin Microbiol Infect. 2016; 22: 949.e1 - 949.e4.
European Centre for Disease Prevention and Control. Surveillance of antimicrobial resistance in Europe 2016. Annual Report of the European Antimicrobial Resistance Surveillance Network (EARS-Net). Stockholm: ECDC; 2017. https: //ecdc.europa.eu/sites/portal/files/documents/AMR-surveillance-Europe-2016.pdf (set 08012018)
Sun J, Song X, Kristiansen BE, Kjæreng A, Willems RJL et al. Occurrence, population structure and antimicrobial resistance of enterococci in marginal and apical periodontitis. J Clin Microbiol. 2009; 47: 2218 - 25.
Dahlén G, Blomquist S, Almståhl A, Carlén A. Virulence factors and antibiotic susceptibility in enterococci isolated from oral mucosal and deep infections. J Oral Microbiol. 2012; 4: 10855.
Rams TE, Feik D, Mortensen JE, Degener JE, van Winkelhoff AJ. Antibiotic susceptibility of periodontal Enterococcus faecalis. J Periodontol. 2013; 84: 1026 - 33.
Vidana R, Billström H, Sullivan Å, Ahlquist M, Lund B. Enterococcus faecalis infection in root canals - host-derived or exogenous source? Letters in Applied Microbiology. 2011; 52: 109 - 15.
Poeta P, Igrejas G, Goncalves A, Martins E, Araújo C et al. Influence of oral hygiene in patients with fixed appliances in the oral carriage of antimicrobial-resistant Escherichia coli and Enterococcus isolates. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2009; 108: 557 - 64.
Søraas A, Olsen I, Sundsfjord A, Handal T, Bjørang et al. Extended-spectum beta-lactamase-producing bacteria are not detected in supragingival plaque samples froem human fecal carrieres of ESBL-procucing Entorobacteriaceae. J Oral Microbiol. 2014; 6: 24026.
Laheij AMGA, Kistler JO, Belibasakis GN, Välimaa H, de Soet JJ, European Oral Microbiology Workshop (EOMW) 2011. Healthcare-associated viral and bacterial infections in dentistry. J Oral Microbiol 2012; 4: 17659.
Petti S, Polimeni A. Risk of methicillin-resistant Staphylococus aureus transmission in the dental healthcare setting: A narrative review. Infect Control Hosp Epidemiol. 2011; 32: 1109 - 15.
Larsen T, Kjerulf A, Petersen A, Larsen AR. Multiresistente stafylokokker på tandklinikken. Tandlægebladet. 2012; 116: 952 - 7
Koukos G, Sakellari D, Arsenakis M, Tsalikis L, Slini T et al. Prevalence of Staphylococus aureus and methicillin-resistant Staphylococus aureus (MRSA) in the oral cavity. Arch Oral Biol. 2015; 60: 1410 - 15.
Lewis N, Parmar N, Hussain Z, Baker G, Green I et al. Colonisation of dentures by Staphylococus aureus and MRSA in out-patient and in-patient populations. Eur J Clin Microbiol Infect Dis. 2015; 34: 1823 - 6.
Buonavoglia A, Latronico F, Greco MF, D´Abramo M, Marinaro M, Mangini F, Corrente M. Methicillin-resistant staphylococci carriage in the oral cavity: a study conducted in Bari (Italy). Oral Dis. 2010; 16: 465 - 8.
Blomquist S, Leonhardt Å, Arirachakaran P, Carlen A, Dahlén G. Phenotype, genotype, and antibiotic susceptibility of Swedish and Thai oral isolates of Staphylococcus aureus. J Oral Microbiol. 2015; 7: 26250.
Roberts MC, Soge OO, Horst JA, Ly KA, Milgrom P. Methicillin-resistant Staphylococus aureus from dental school clinic surfaces and students. Am J Infect Control. 2011; 39: 628 - 32.
Baek YS, Baek S-H, Yoo Y-J. Higher nasal carriage rate of methicillin-resistant Staphylococus aureus among dental students who have clinical experience. JADA. 2016; 147: 348 - 53.
Petti S, Kakisina N, Volgenant CMC, Messano GA, Barbato E et al. Low methicillin-resistant Staphylococus aureus carriage rate among Italian dental students. Am J Infect Control. 2015; 43: e89-e91.
Khairella AS, Wasfi R, Ashour HM. Carriage frequency, phenotypic, and genotypic characteristics of methicillin-resistant Staphylococus aureus isolated from dental health-care personnel, patients, and environment. 2017 www.nature.com/scientificreports 7: 7390 DOI: 10.1038/s41598 - 017 - 07713 - 8.
Egusa H, Watamoto T, Abe K, Kobayashi M, Kaneda Y et al. Analysis of the persistent presence of opportunistic pathogens on patient-derived dental impressions and gypsum casts. Int J Prosthodont. 2008; 21: 62 - 8.
Khalil D, Hultin M, Fredriksson EH, Sjögren E, Lundholm P, Lund B. Intraoral radiographic sensors: a possible source of bacterial transmission in the dental office. J Hosp Infect. 2016; 94: 362 - 3. doi: 10.1016/j.jhin.2016.09.003. Epub 2016 Sep 9. No abstract available.
Petti S, Giusti M, Moroni C, Polimeni A. Long-term survival curve of methicillin-resistant Staphylococus aureus on clinical contact surfaces in natural-like conditions. Am J Infect Control. 2012. DOI: 10.1016/j.ajic.2011.11.02
Kurita H, Kurashina K, Honda T. Nosocomial transmission of methicilin resistant Staphylococus aureus via the surfaces of the dental operatory. Br Dent J. 2006; 201: 297 - 300.
Martin MV, Hardy P. Two cases of oral infection by methicillin-resistant Staphylococus aureus. Br Dent J. 1991; 170: 63 - 4.
Marimuthu K, Pittet D, Harbarth S. The effect of improved hand hygiene on nosocomial MRSA control. Antimicrob Res Infect Control. 2014; 3: 34.
WHO guidelines on hand hygiene in health care. 2009. ISBN 9789241597906.
Socialstyrelsen. Att förebygga vårdrelaterade infektioner- Ett kunskapsunderlag. Stockholm 2006.
Dancer SJ. The role of environmental cleaning in the control of hospital-aquired infection. J Hosp Infect. 2009; 73: 378 - 85.
Vidana R, Sillerstroöm E, Ahlquist M, Lund B. Potential for nosocomial transmission of Enterococcus faecalis from surfaces in dental operatories. Int J Endodontic Infect. 2015; 48: 518 - 27.
Korresponderende forfatter: Tove Larsen, Tandlægeskolen, Københavns Universitet, Nørre Alle 20, DK - 2200 København N, Danmark. E-post: tla@sund.ku.dk Artikkelen har gjennomgått ekstern faglig vurdering.Larsen T, Kjerulf A, Lund B. Infektionshygiejnens rolle i forebyggelse af antibiotikaresistens. Nor Tannlegeforen Tid. 2019; 129: 244 - 51
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Larsen T, Kjerulf A, Lund B. Infektionshygiejnens rolle i forebyggelse af antibiotikaresistens. Nor Tannlegeforen Tid. 2019;130:0-0. doi:10.56373/2019-3-6