Kontrol og bekæmpelse af dental biofilm
Der bliver udfoldet stor aktivitet i at opdage og udvikle nye stoffer, teknologier og metoder, som kan eliminere, hindre eller kontrollere dannelse af dental biofilm. Inden for odontologien benyttes antimikrobielle stoffer og diverse behandlinger til at eliminere og/eller kontrollere bakterier og bakteriel biofilm. Dentale materialer kan indeholde stoffer med antimikrobielle egenskaber, som har til hensigt at hindre biofilmdannelse. Desuden kan patienter dagligt benytte sig af antimikrobielle midler til forebyggelse af sygdomme, som er associeret med dental biofilm. Rationalet for denne anvendelse af antimikrobielle stoffer er, at mekanisk biofilmkontrol ikke er tilstrækkelig til at hindre udvikling eller progression af sygdom. Daglig brug af antimikrobielle midler kan imidlertid øge selektionspresset for resistens mod de aktive stoffer og eventuelt kryds- og koresistens mod andre antimikrobielle og antibiotiske stoffer. Daglig brug af antimikrobielle midler til forebyggelse af sygdom, som er associeret med dental biofilm, bør derfor begrænses. Midlerne bør kun benyttes, når mekanisk rengøring og adfærdsændringer ikke er tilstrækkelige til at forebygge og kontrollere oral sygdom hos den enkelte patient. Denne artikel giver en kort oversigt over midler til kontrol samt nyere teknologier og strategier til kontrol og/eller bekæmpelse af dental biofilm.
Klinisk relevans | |
|---|---|
· |
Nye teknologier, stoffer og metoder, som skal hindre dannelse af biofilm og dræbe bakterier i biofilm, bliver løbende markedsført. Der er et højt forbrug af antimikrobielle stoffer til forebyggelse af sygdomme, som er associeret med dental biofilm. Brugen af antimikrobielle stoffer kan over tid medføre krydsresistens og/eller koresistens mod klinisk vigtige antibiotika. |
Det er beskrevet, at over 700 bakteriearter kan kolonisere mundhulen; men ikke alle vil være til stede hos alle individer til enhver tid. Det unikke ved mundhulen er, at både slimhinde og hårdtvæv er tilgængelige for kolonisering af bakterier. Derudover vil dentale materialer udgøre særlige habitater for bakterierne. Slimhinden afskalles kontinuerligt og bliver stadig rekoloniseret. På tænderne og på oralt eksponerede dentale materialer kan bakterier derimod kolonisere, proliferere og danne biofilm. Allerede i slutningen af 1600-tallet opdagede Antonie van Leeuwenhoek centrale egenskaber ved biofilm, især deres iboende modstandsdygtighed mod antimikrobielle midler. Der skulle gå flere hundrede år, før biofilm blev et accepteret begreb. I dag er biofilm et helt centralt område inden for mikrobiologien og sygdomslæren, da kroniske infektioner ofte skyldes bakterier, som vokser i en biofilm. Inden for klinisk odontologi går det meste af tiden med at forebygge eller reparere følger af ændret økologi i dental biofilm. De bakterier, som danner biofilm, er en del af vor normalflora. Caries og marginal parodontitis er sygdomme med multifaktoriel ætiologi. Mængden af biofilm er ikke det eneste, som har betydning for sygdomsudviklingen; men mængden af biofilm i kombination med andre faktorer som bl.a. kosten og mængden og sammensætningen af spyttet er af betydning. Både caries og parodontal sygdom er associeret med dental biofilm, som har ændret økologi. Denne ændring favoriserer fremvækst og dominans af bakteriearter med specifikke egenskaber. Formålet med biofilmkontrol bliver derfor at hindre udvikling af en biofilm, som kan medføre sygdom.
Denne artikel giver en kort oversigt over midler til brug ved kontrol samt nyere teknologier og strategier til kontrol og/eller bekæmpelse af dental biofilm (figur 1).
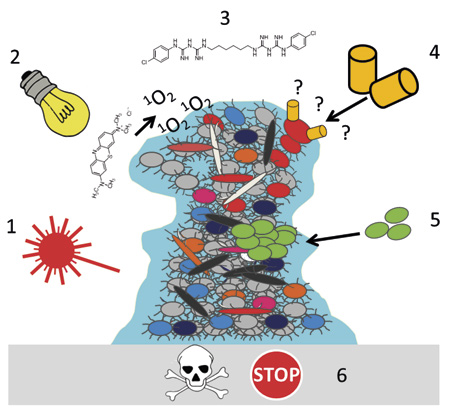
Figur 1. 1) Antibakteriel effekt af optisk stråling fra laser. Antibakterielle virkningsmekanismer er ikke helt klarlagt, men de kan være fotokemiske, fototermale eller fotoablative afhængig af irradiansen. 2) Antibakteriel fotodynamisk terapi udøver en antibakteriel effekt ved, at synligt lys bliver absorberet af et fotosensibiliserende stof, som kan generere reaktive forbindelser, bl.a. singlet oxygen som vist i figuren (fotokemisk effekt). Desuden kan der være tale om fototermiske effekter. 3) Antimikrobielle forbindelser benyttes bl.a. i mundskyllevæsker for kontrol af dental biofilm. Spekteret af virkningsmekanismer er bredt. 4) Bakterier kommunikerer med hinanden ved hjælp af forskelige signaler, bl.a. for at danne biofilm. Denne kommunikation kan hæmmes, så bakterierne danner mindre biofilm. Denne form for terapi adskiller sig fra traditionelle antimikrobielle virkningsmekanismer ved, at den ikke dræber bakterierne. 5) Probiotiske bakterier kan konkurrere om adhæsion og næring, producere antibakterielle substanser, modulere immunsystemet og ko-aggregere med andre bakterier. 6) Antibakterielle stoffer kan inkorporeres i dentale restaureringsmaterialer, eller overfladen kan modificeres for at hæmme adhæsion af bakterier.
Kontrol af dental biofilm
Grundlaget for kontrol af dental biofilm er stadig mekanisk fjernelse, altså forstyrrelse af biofilmen. Det er ikke muligt at fjerne alle bakterierne på tænderne; men en forstyrrelse af biofilmen vil kunne hindre ændringer i biofilmens økologi og dominans af arter, der er associeret med caries og parodontal sygdom.
Der er rapporteret et højt forbrug af mundskyllemidler (1), og på markedet findes mange forskellige produkter, som hævdes at have en antimikrobiel effekt på dental biofilm. Rationalet bag brugen af sådanne produkter er, at den mekaniske biofilmkontrol ikke er tilstrækkelig til at hindre udvikling eller progression af sygdomme, som er associeret med dental biofilm.
For at antimikrobielle stoffer skal have den tilsigtede effekt, må stofferne nå bakterierne i en aktiv form i tilstrækkelig koncentration og virkningstid. En af egenskaberne ved bakterier, som lever i biofilm, er deres nedsatte følsomhed for antimikrobielle substanser. Bakterier i biofilm kan behøve betydeligt højere koncentration af et antimikrobielt stof end den, der er tilstrækkelig til at dræbe samme mængde fritsvømmende bakterier (2). Dette bidrager til at forklare, hvorfor så få midler faktisk har effekt på den dentale biofilm.
Antimikrobielle mundskyllemidler
Klorheksidin
Klorheksidin har længe været benyttet inden for odontologien for at hindre biofilm og har været den standard, som andre antimikrobielle stoffer sammenlignes med. Klorheksidin har en bred antibakteriel virkning og har desuden antifungal effekt. Høje koncentrationer af klorheksidin er baktericide, mens lavere koncentrationer er bakteriostatiske, afhængig af bakterie- og svampearten. Det har været rapporteret, at to daglige skylninger med 0,2 % klorheksidin vil hindre kolonisering af tandoverflader og reducere antallet af bakterier i saliva med 80 % (3). En nyere systematisk oversigt fandt ingen cariesforebyggende effekt af klorheksidinlak eller -gel hverken hos børn eller unge voksne. Graden af evidens vedrørende effekten blev betegnet som lav (4). En anden systematisk oversigt rapporterede, at brug af klorheksidin som supplement til mekanisk rengøring reducerede biofilmmængde og gingivitis, sidstnævnte hos individer med let grad af gingival inflammation. Graden af evidens blev betegnet som høj (5).
Essentielle olier
Essentielle olier indgår i kosmetik, madvarer og farmaceutiske produkter og har i århundreder været benyttet inden for sundhedsplejen på grund af deres antimikrobielle aktivitet. Essentielle olier har en bred antimikrobiel effekt mod både Gram-positive og Gram-negative bakterier. Den eksakte virkningsmekanisme for de fleste substanser i essentielle olier er ikke klarlagt; men de virker sandsynligvis på membraner og forårsager denaturering af proteiner. En systematisk oversigtsartikel rapporterede, at brug af essentielle olier som supplement til mekanisk rengøring reducerede biofilmmængde og gingivitis (6). En klinisk undersøgelse viste reduceret biofilmmængde og gingivitis ved brug af klorheksidin sammenlignet med essentielle olier i fravær af mekanisk rengøring, undersøgt ved hjælp af en eksperimentel gingivitismodel. Forfatterne rapporterede ingen signifikant effekt af essentielle olier sammenlignet med en negativ kontrol med samme alkoholindhold som de anvendte essentielle olier (7). For yderligere information om mundskyllemidler og antimikrobielle stoffer i tandlægepraksis, se tidligere publiceret oversigtsartikel (8).
Nye muligheder for biofilmkontrol og -bekæmpelse
Interferens med bakteriel kommunikation
Bakterier benytter sig af signaler for at kunne koordinere deres aktivitet. Der har været påvist flere signalsystemer, som bl.a. regulerer biofilmdannelse og virulensudtryk. Dette har medført forøget fokus på og forskning i brug af signalhæmmere for at reducere biofilmdannelse og ekspression af gener, som er associeret med sygdom (9). Denne form for behandling adskiller sig markant fra traditionel antibiotikabehandling, som har til formål at dræbe bakterierne. Ved kontrol af gener, som er involveret i signalering, er formålet at hindre ekspression af gener, der er associeret med biofilm og sygdom. Dette fokus repræsenterer et paradigmeskifte inden for biofilmkontrol. En sådan strategi udøver formentlig et mindre selektionstryk for udvikling af antimikrobiel resistens end traditionelle antibiotika eller antimikrobiel behandling. Foreløbig findes der ikke kommercielle signalforstyrrende produkter på markedet.
Probiotika
Probiotika beskriver anvendelse af levende mikroorganismer, som, når de administreres, medfører en sundhedsgevinst for værten. Bakterier, som tilføres oralt, kan påvirke den orale flora ved konkurrence om adhæsion til overflader og konkurrence om næringsstoffer. Andre observationer er koaggregering med andre arter, dannelse af antibakterielle produkter og modulering af immunsystemet. Mange forskellige bakteriestammer har været undersøgt, især laktobaciller, streptokokker og bifidobakterier. En systematisk oversigtsartikel og meta-analyse (10) har vurderet probiotika til behandling af caries, og forfatterne fandt manglede evidens for at anbefale probiotika til forebyggelse af caries. To oversigtsartikler med meta-analyse (10,11) har vurderet probiotika som supplement til ikke-kirurgisk parodontalbehandling. Begge artikler rapporterer, at brug af probiotika som supplement kan have en tillægseffekt, men at evidensen er mangelfuld, og at der er behov for kliniske langtidsstudier af høj metodologisk kvalitet, før man kan anbefale probiotika til forebyggelse eller behandling af parodontal sygdom (10,11). En anden undersøgelse fandt ingen tillægseffekt ved brug af probiotika sammenlignet med placebo til behandling af peri-implantær mucositis (12).
Antimikrobiel fotodynamisk terapi (aPDT)
Fotodynamisk terapi har længe været kendt inden for medicinsk behandling af bl.a. ikke-melanom hudkræft og forstadier hertil. Der er flere produkter på markedet til odontologisk brug med henblik på at eliminere bakterier. Behandlingen baserer sig på lysaktivering af et fotosensibiliserende stof, altså et molekyle som kan absorbere optisk stråling af en vis bølgelængde. Aktivering genererer reaktive oksygenradikaler og eventuelt andre reaktive molekyler og fotoprodukter, som kan dræbe bakterierne. Antibakteriel fotodynamisk terapi har været anvendt og undersøgt ved behandling af parodontitis og peri-implantitis samt til desinfektion af rodkanalen ved endodontisk behandling. I en meta-analyse (13) af 10 studier, som sammenligner virkningen af PDT som supplement til depuration («scaling» og rodafglatning) ved behandling af marginal parodontitis, blev tillægseffekten af PDT vurderet til at give større klinisk fæstegevinst end depuration alene. Denne effekt blev målt efter mindst seks måneder. Imidlertid blev vurderingen af datausikkerhedsgraden omtalt som moderat. En anden nylig publiceret meta-analyse (14) af 11 undersøgelser sammenlignede også PDT som supplement til depuration ved marginal parodontitis. Forfatterne konkluderede, at der var en forbedring i pochedybde og klinisk fæsteniveau i gruppen som fik PDT plus depuration sammenlignet med kontrolgruppen efter tre måneder. Efter seks måneder var der ingen forskel mellem grupperne.
Antimikrobiel laserbehandling
Der foreligger en systematisk gennemgang og meta-analyse af seks studier vedrørende brug af laser (ikke-kirurgisk) ved peri-implantitis enten som monoterapi eller som supplerende behandling (15). I fem af studierne blev der brugt lasere med to forskellige bølgelængder, lysintensiteter og virkningsmekanismer (16). I én af undersøgelserne blev der brugt PDT med en tredje laser og lysstyrke, som repræsenterede en tredje virkningsmekanisme (15,16). Virkningen af laser alene eller i PDT-sammenhæng var ikke bedre end konventionel behandling. En anden systematisk gennemgang og meta-analyse af behandling af kronisk marginal parodontitis fandt foreløbig ikke tilstrækkelig evidens for at hævde, at brug af laser som supplement til depuration giver et forbedret klinisk resultat (13).
Man har også undersøgt brug af laseranvendelse alene og sammen med PDT til elimination af mikroorganismer i forbindelse med endodontisk behandling. Foreløbig er det småt med gode undersøgelser og evidens for, om disse behandlingsformer vil give et forbedret klinisk resultat ud over virkningen af kemomekanisk behandling (17).
Flere af de undersøgelser, hvor brug af laser indgår, omtaler brug af såkaldte «low level lasers» eller «soft lasers». «Low level» er et begreb uden definition. Disse lasere, som oftest diodelasere med bølgelængder i det synlige og infrarøde område, kan have mindst lige så høj irradians (effekt per overfladeareal af vævet) som lasere, der ikke bliver omtalt med denne betegnelse. Man må ikke lade sig forlede til at tro, at lasere med den misvisende og intetsigende betegnelse «low level» aldrig kan udvise termiske effekter.
Det er et gennemgående træk ved odontologiske undersøgelser, som beskriver brug af laser(e) alene og som lyskilde i PDT, at de er præget af meget forskellige protokoller anvendt på et utal af diagnoser. Det er et internationalt stråleværnprincip, at medicinsk anvendelse af lys skal optimaliseres. Dette gælder for stærke ikke-ioniserende lyskilder, dvs. kilder som under visse forudsætninger kan overskride grænseværdier. Det gælder derfor også for alle de lyskilder, som er beskrevet i de ovennævnte undersøgelser. Vi tilslutter os Xue et al. (14), som efterlyser flere kliniske studier af høj metodologisk kvalitet.
Fyldningsmaterialer med antimikrobielle egenskaber
Sekundær caries er en hovedårsag til, at fyldninger med tiden må udskiftes. Et aktivt forskningsfelt er at inkorporere antimikrobielle stoffer i fyldninger for at hindre bakterieadhæsion og biofilmdannelse. Traditionelle kompositter har beskeden eller ingen antibakteriel effekt. Man har derfor forsøgt at inkorporere antibakterielle stoffer til filler- og partikeldelen af materialet samt til adhæsiv. Den kvartære ammoniumforbindelsen, 12-metakryloyl-oksydodekyl-pyridinibromid (MDPB), er blevet inkorporeret i kommercielt tilgængelig adhæsiv/primer (18). Der er rapporteret antibakteriel effekt in vitro (19). Mange forskellige substaner har været tilsat polymerbaserede fyldningsmaterialer for at tilføre antibakteriel effekt (20); men der efterlyses kliniske studier af høj metodologisk kvalitet for at vurdere effekten over tid (21).
Bakteriel resistens og brug af antimikrobielle substanser
Brugen af antimikrobielle stoffer i dentale, kosmetiske og andre produkter kan medføre, at bakterierne udvikler resistens mod stoffet. Både kryds- og koresistens mod klinisk vigtige antibiotika kan udvikles. Der foreligger bedst dokumentation for udvikling af samtidig resistens mod antibiotika fra studier med kvartære ammoniumforbindelser og triclosan (22). Dette medfører, at brug af antimikrobielle stoffer bør begrænses og kun benyttes, når mekanisk rengøring og ændringer i patientadfærd ikke er tilstrækkelige til at kontrollere oral sygdom.
Konklusion
Der forskes intensivt i at finde nye produkter og strategier til kontrol og/eller elimination af biofilm. Brug af antimikrobielle stoffer for at forebygge dental biofilmdannelse er en strategi, som ikke har fokus på den egentlige udfordring vedrørende sygdomme, som er associeret med dental biofilm. Der bør efter forfatternes opfattelse lægges mere vægt på forebyggelse og ernæring i relation til oral og generel sundhed: Behovet for antimikrobielle midler bør elimineres eller minimeres i de tilfælde, hvor det er muligt at opnå tilsvarende resultater ved ændringer i spisevaner, patientadfærd og mekanisk rengøring.
English summary
Valen H, Bruzell EM, Scheie AA.
Control and eradication of dental biofilm
592-6
There is considerable research activity to discover new compounds and to explore new technologies and methods to kill and/or prevent the formation of dental biofilms. Antimicrobials and other treatments are used in dentistry to eliminate bacteria and bacterial biofilms. Antimicrobial compounds are incorporated into dental materials to inhibit biofilm formation. Antimicrobials are also used by patients for daily prevention of dental biofilm-associated diseases. The rationale for such use of antimicrobials is that the mechanical biofilm control is inadequate to prevent the development or progression of dental diseases. It is important to be aware that the daily use of antimicrobial substances may increase the selective pressure for resistance against the active substances and may lead to cross and co - resistance to other antimicrobial and antibiotic substances. Antimicrobials for daily prevention of dental biofilm-associated diseases should be limited and used only when mechanical cleaning and change in patient behavior is insufficient for disease control. This article gives a brief overview of antimicrobial compounds used for biofilm control and new technologies and strategies to combat dental biofilms.
Litteratur
Särner B, Sundin E, Abdulrahman S et al. Use of different mouthrinses in an adult Swedish population. Swed Dent J. 2012; 36: 53 - 60.
Moskowitz SM, Foster JM, Emerson J et al. Clinically feasible biofilm susceptibility assay for isolates of Pseudomonas aeruginosa from patients with cystic fibrosis. J Clin Microbiol. 2004; 42: 1915 - 22.
Schiott CR. Effect of chlorhexidine on the microflora of the oral cavity. J Periodontal Res. 1973; 12 (Supp): 7 - 10.
Walsh T, Oliveira-Neto JM, Moore D. Chlorhexidine treatment for the prevention of dental caries in children and adolescents. Cochrane Database Syst Rev. 2015: CD008457.
James PHV, Worthington C, Parnell M et al. Chlorhexidine mouthrinse as an adjunctive treatment for gingival health. Cochrane Database Syst Rev. 2017; 3: CD008676.
Stoeken JE, Paraskevas S, van der Weijden GA. The long-term effect of a mouthrinse containing essential oils on dental plaque and gingivitis: a systematic review. J Periodontol. 2007; 78: 1218 - 28.
Preus HR, Koldsland OC, Aass AM et al. The plaque- and gingivitis-inhibiting capacity of a commercially available essential oil product. A parallel, split-mouth, single blind, randomized, placebo-controlled clinical study. Acta Odontol Scand. 2013; 71: 1613 - 9.
Kongstad J, Fiehn NE, Bindslev PH et al. Biocider i tandlægepraksis. Tandlægebladet. 2013; 750 - 8.
LaSarre B, Federle MJ. Exploiting quorum sensing to confuse bacterial pathogens. Microbiol Mol Biol Rev. 2013; 77: 73 - 111.
Gruner D, Paris S, Schwendicke F. Probiotics for managing caries and periodontitis: Systematic review and meta-analysis. J Dent. 2016; 48: 16 - 25.
Martin-Cabezas R, Davideau JL, Tenenbaum H et al. Clinical efficacy of probiotics as an adjunctive therapy to non-surgical periodontal treatment of chronic periodontitis: a systematic review and meta-analysis. J Clin Periodontol. 2016; 43: 520 - 30.
Hallström H, Lindgren S, Widén C et al. Probiotic supplements and debridement of peri-implant mucositis: a randomized controlled trial. Acta Odontol Scand. 2016; 74: 60 - 6.
Smiley CJ, Tracy SL, Abt E et al. Systematic review and meta-analysis on the nonsurgical treatment of chronic periodontitis by means of scaling and root planing with or without adjuncts. J Am Dent Assoc. 2015; 146: 508 - 24.
Xue D, Tang L, Bai Y et al. Clinical efficacy of photodynamic therapy adjunctive to scaling and root planing in the treatment of chronic periodontitis: a systematic review and meta-analysis. Photodiagnosis Photodyn Ther. 2017; 18: 119 - 27.
Kotsakis GA, Konstantinidis I, Karoussis IK et al. Systematic review and meta-analysis of the effect of various laser wavelengths in the treatment of peri-implantitis. J Periodontol. 2014; 85: 1203 - 13.
Bruzell EM, Lill TN. Trygg bruk av laser i tannpleien. In: Holmstrup P, ed. Aktuel nordisk odontologi. København: Munksgaard, 2014; 167 - 82.
Kishen A, Peters OA, Zehnder M et al. Advances in endodontics: Potential applications in clinical practice. J Conserv Dent. 2016; 19: 199 - 206.
Imazato S, Kuramoto A, Takahashi Y et al. In vitro antibacterial effects of the dentin primer of clearfil protect bond. Dent Mater. 2006; 22: 527 - 32.
Cocco AR, Rosa WL, Silva AF et al. A systematic review about antibacterial monomers used in dental adhesive systems: Current status and further prospects. Dent Mater. 2015; 31: 1345 - 62.
Farrugia C, Camilleri J. Antimicrobial properties of conventional restorative filling materials and advances in antimicrobial properties of composite resins and glass ionomer cements-A literature review. Dent Mater 2015; 31: e89 - 99.
Pereira-Cenci T, Cenci MS, Fedorowicz Z et al. Antibacterial agents in composite restorations for the prevention of dental caries. Cochrane Database Syst Rev. 2013; 12: CD007819.
SCENIHR. Assessment of the antibiotic resistance effects of biocides. (Set 2017 juli). Tilgængelig fra: URL: http://ec.europa.eu/health/ph_risk/committees/04_scenihr/docs/scenihr_o_021.pdf.
Korresponderende forfatter: Håkon Valen, e-post: h.v.rukke@niom.no
Artikkelen har gjennomgått ekstern faglig vurdering.
Valen H, Bruzell EM, Scheie AA. Kontrol og bekæmpelse af dental biofilm. Nor Tannlegeforen Tid. 2018; 128: 592-6.
seniorforsker, tandlæge, ph.d., Nordisk Institutt for Odontologiske Materialer, Oslo
seniorforsker, civ.ing., dr.scient, Nordisk Institutt for Odontologiske Materialer, Oslo
professor emeritus, Institutt for oral biologi, Det odontologiske fakultet, Universitetet i Oslo
Artikkelen er først trykket i Tandlægebladet nr. 1, 2018. Valen H, Bruzell EM, Scheie AA. Kontrol og bekæmpelse af dental biofilm. Tandlægebladet. 20018; 122: 34 - 8.