Nye forskningsmetoder på levende dyr gir uante muligheter
Forskere har tradisjonelt studert dødt, fiksert vevsmateriale for å forstå hva som foregår på cellenivå. Dette har sine åpenbare begrensninger. Nyere bildeteknikker som for eksempel computertomografi (CT) og magnetresonanstomografi (MR), kan brukes på levende mennesker og dyr, men mangler tilstrekkelig oppløselighet (både i tid og rom) til å studere enkeltceller. En metode som kombinerer disse to hensyn har til nå manglet. Det har videre vært et behov for å kunne studere cellefunksjoner mens de samtidig påvirkes og manipuleres på ulike måter.
To nye metoder, to-fotonmikroskopi og optogenetikk, løser til sammen nettopp dette problemet. To-fotonmikroskopi har de siste to tiårene blitt en av de viktigste undersøkelsesteknikker for hjerneforskning. Den noe nyere metoden, optogenetikk, ble kåret til «Method of the year 2010» av det anerkjente tidsskriftet Nature Methods og ble i en artikkel i prestisjetunge Science trukket frem som «Breakthrough of the Decade».
Metodene settes i biologisk og historisk kontekst før de diskuteres noe mer i detalj. Deretter drøftes relevansen til vårt eget fagområde, munnhulen.
Hovedbudskap | |
|---|---|
· |
Nye optiske verktøy åpner for forskning på levende dyr (in vivo) |
· |
Optogenetikk gir muligheter for påvirkning og avlesning av cellulære prosesser i sann tid |
· |
To-foton mikroskopi kan brukes til avbildning dypt i optisk tett vev uten vevsskade |
· |
Sammen vil slike nye metoder muliggjøre en langt tettere kobling mellom laboratoriebenk og klinikk |
Fra celle til et levende individ: Man antar at det finnes ca. 200 milliarder celler i en voksen menneskekropp. De minste cellene er bare noen tusendels millimeter store; man må stable et par hundre av dem oppå hverandre for å nå 1 millimeter. De viktigste byggesteinene i kroppens celler er proteinene, og de er kodet for av gener som ligger i cellekjernen. Disse genene og deres produkter, proteinene, er nå for en stor del kartlagt og studert både enkeltvis og samlet («genomics», «proteomics»).
Til nå har man i dyremodeller lykkes med å skru av og på et gen permanent; såkalte «knock-out» og «knock-in» modeller. Resultatet blir at den byggesteinen (det proteinet) som dette genet koder for, er endret eller mangler hos dyret som dermed får betegnelsen «transgent». Allerede i 1974 introduserte Rudolf Jaenisch genimplantasjon (1), men det var først i 1981 at man lyktes med å føre de genetiske endringene videre til avkommet (2). Dette gjorde det mulig å mangfoldiggjøre genmodifiserte dyr til bruk i forskning. Ved hjelp av korte RNA-sekvenser (ribozymer, mikro-RNA, si-RNA eller sh-RNA) kan man også skru av eller på et gen for en kortere tidsperiode, men dessverre med nokså lav effektivitet in vivo (3 - 5). Dette bidrar til å øke forståelsen av genets (og dermed proteinets) funksjon og betydning i dynamiske prosesser som for eksempel dannelse av et organ eller ved utvikling av sykdom. Men genmodifisering er treg i den forstand at forandring av funksjon tar tid og foregår over timer, dager eller måneder. De fleste prosesser i celler og kommunikasjonen mellom dem foregår derimot på millisekunder, og man har til nå ikke hatt noen mulighet til å studere og påvirke slike lynraske forandringer.
Utviklingen fra lysmikroskopet til nye metoder for å studere cellefunksjoner i levende individer
Høyoppløselighetsanalyser har vært forbeholdt lys- og elektronmikroskopering i fikserte vevssnitt. Helt siden middelalderen kjente man til bruk av forstørrelsesglass og luper. De første lysmikroskopene ble sannsynligvis laget i Nederland på 1500-tallet av brillemakere. Ordet mikroskopi ble deretter anvendt av Galileo Galilei fra 1600-tallet og kommer fra det greske «micron» som betyr «liten» og «skopein» som betyr «å se på».
Elektronmikroskop ble utviklet tidlig på 1930-tallet og kan hovedsakelig deles opp i to kategorier: Transmisjonselektronmikroskop (TEM) og skanningelektronmikroskop (SEM) (6). I motsetning til et vanlig mikroskop hvor en sender lysbølger og avbilder det reflekterte lyset, bruker et elektronmikroskop elektroner i avbildningen. Elektroner blir sendt ut fra en wolfram-tråd (figur 1). De blir så akselerert ved hjelp av høy spenning, og bombarderer så prøven. Et transmisjonsmikroskop lar elektronene gå gjennom selve prøven som blir avbildet på en fluorescerende skjerm. I et skanningelektronmikroskop er det en detektor som ser elektronene som blir reflektert fra prøveoverflaten, og gjør det den ser om til et bilde. Med elektroner, som har kortere bølgelengde (rundt 2.5 x 10 - 12 meter) enn vanlig lys, kan man oppnå høyere oppløsning. På den annen side innebærer elektronenes korte bølgelengde at de overfører langt høyere energi til preparatet, og elektronmikroskopi kan derfor kun brukes på fiksert dødt vev. Funksjonelle eller dynamiske bildeopptak i levende dyr og mennesker har tradisjonelt blitt dominert av MR (Magnetisk Resonans), som oppviser en relativt dårlig oppløselighet i både tid og rom (6).
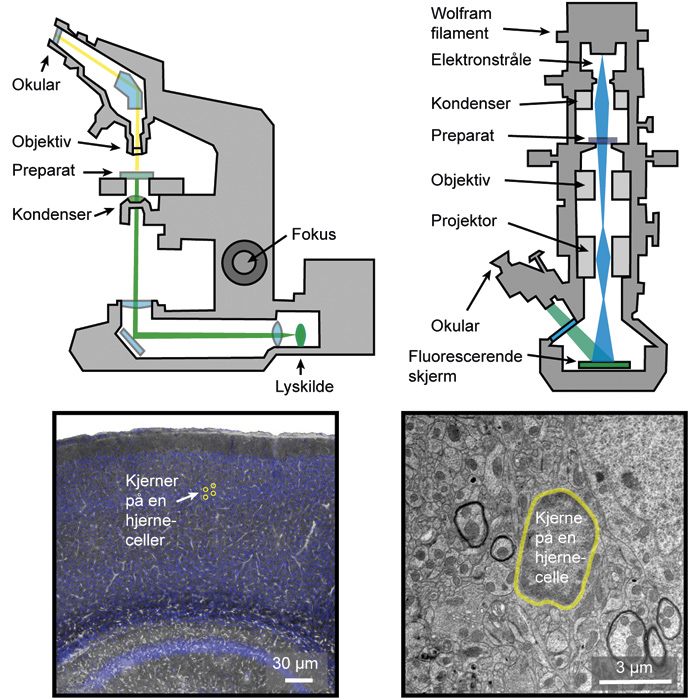
Figur 1. Lysmikroskopi (venstre) og transmisjons-elektronmikroskopi (høyre). Representative bilder er vist nedenfor som demonstrerer forskjellig oppløslighet. Original figur av A.S. Thrane.
Magnetresonanstomografi, oftest forkortet MRI (magnetic resonance imaging) eller MR, er en teknikk for å fremstille bilder av kroppsvev hos mennesker eller dyr. Teknologien måler radiofrekvensbølger som sendes ut når hydrogenatomer (1H, protoner) utsettes for et sterkt magnetfelt som slås av og på i spesielle sekvenser. Fordi hydrogenatomer i forskjellige molekyler oppfører seg på litt forskjellig måte i magnetfeltet, kan man oppnå kontrast mellom for eksempel vev som har mye eller lite fritt vann (H2O) i seg. Vanlig røntgen og computertomografi (CT) gir derimot størst kontrast mellom mineralisert vev (med høy elektrontetthet) og ikke-mineralisert vev (med lav elektrontetthet). Ingen av metodene er imidlertid egnet til å studere mindre strukturer som enkeltceller (se figur 2 for oversikt over oppløsning i tid og rom for de tilgjengelige bildeundersøkelsene).
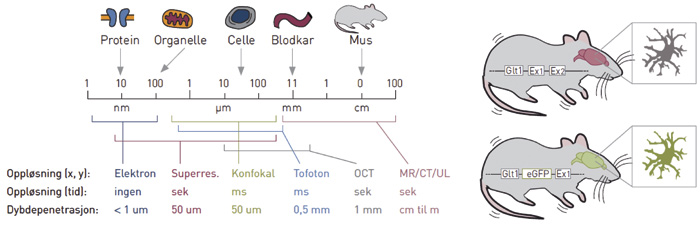
Figur 2. Bildeoppløsning (venstre) og optogenetikk (høyre). Venstre panel: Bildeoppløsning i tid, rom (x, y) og dybde (dybdepenetrasjon). Oversikt over noen av de vanligste teknikkene, inkludert elektronmikroskopi (Elektron), superresolusjonsmikroskopi med lys (Supperres.), konfokalmikroskopi (Konfokal), to-foton mikroskopi (To-foton), «optical coherence tomografi» (OCT) og radiologiske teknikker slik som MR, CT og ultralyd (UL). Til høyre: Et eksempel på optogenetikk, der en «limer inn» genet for «enhanced green fluorescent protein» (eGFP) etter promoteren for genet Glt1, slik at støttecellene i hjernen kalt astrocytter fluorescerer grønt. På tilsvarende måte kan også bakterielle rhodopsin gener limes inn slik at disse cellene kan stimuleres med lys. Gjengitt med tillatelse fra Tidsskrift for Den norske legeforening (20).
To-foton mikroskopi og optogenetikk
To nye metoder; To-foton (7 - 9) og optogenetikk (10 - 12) kombinerer begge disse hensyn og tillater studier av enkeltceller i levende forsøksdyr.
To-foton (eller multi-foton) mikroskopi, gjør med sin høye oppløselighet (submikrometer og millisekund) det mulig å studere de aller minste cellene i detalj (figur 2) (13). Her benyttes en pulserende strøm av lavenergifotoner (lyspartikler med rød eller infrarød bølgelengde) som gjør at man kan studere celler dypt i vevet, og det med en reaksjonsevne (oppløselighet i tid) på millisekunder. Dermed kan svært raske prosesser som for eksempel hvordan nerveimpulser overføres i en synapse, for første gang studeres. Fordi hvert enkelt foton har lav energi (dvs. lang bølgelengde) oppnår man heller ikke så mye eksitasjon av vevet utenfor fokuspunktet, og dermed kan en avbilde et levende våkent eller anestesert forsøksdyr (8).
Allerede i 1930 ble teorien bak to-foton mikroskopi foreslått av Maria Göppert-Meyer i hennes doktoravhandling. Det var derimot ikke før på 1990-tallet at det ble praktisk gjennomførbart (14). Den pulserende laseren oppnår så høy fotonkonsentrasjon i fokuspunktet at to eller flere fotoner kan befinne seg på akkurat samme sted til samme tid. Dette muliggjør at to eller flere fotoner kan reagere med samme molekyl/fluorokrom samtidig og slå sammen sin energi for å eksitere. Derfor kan man bruke lang bølgelengde/lavenergilys, som på grunn av bølgelengden penetrerer dypere i vevet. Andre gjennombrudd innen optiske bildeteknikker slik som akkustooptiske modulatorer har også i senere tid blitt kombinert med to-foton mikroskopi og økt hastigheten på bildeopptaket fra tre bilder per sekund til tusener, og dermed muliggjør avbildning av elektriske enkelt-impulser (figur 3) (13).
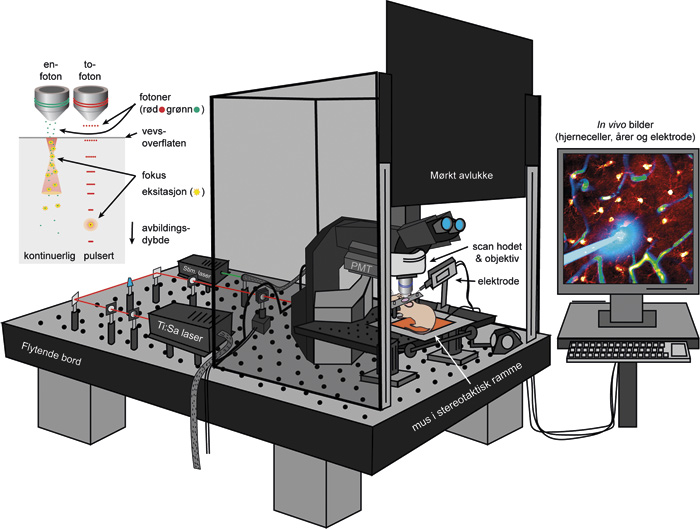
Figur 3. Illustrasjon av prinsippet bak to-foton mikroskopi (høyre) og ett to-foton eksperiment oppsett (venstre) der en bruker både to-foton mikroskop og optogenetikk for å se på hjerneceller i levende mus. Bildet er ment å gi ett overblikk over de forskjellige tekniske elementene, og er ikke en realistisk representasjon av de optiske elementene (e.g. lasere, prismer, dikroiske speil). Forkortelser: photomultiplier tube (PMT). Original figur av A.S. Thrane.
Den andre metoden er optogenetikk (11). Den bruker en kombinasjon av genetikk og optikk til å studere og påvirke aktiviteter i levende celler (for eksempel nevroner), mens dyrene man studerer kan bevege seg fritt rundt. Ordet «optos» stammer fra gresk og betyr «synlig».
Optogenetikk får man til ved å kode «opsin»-gener fra bakterier inn i celler der de ikke ellers skal være. Opsin-gener uttrykkes i all hovedsak kun av tapper og staver i netthinnen hos mennesker og andre pattedyr. Genfamilien som de ulike opsingenene tilhører, er en av de mest kompliserte evolusjonen har klart å skape, men også en av de mest basale. De finnes i alle organismer fra bakterier, til archae, prokarya og eukarya. Lys er et av de fundamentale vilkårene for liv på vår planet (akkurat som vann), og evnen til å kunne sanse og bevege seg mot lyset for eksempel med en flagellum er veldig viktig. Noen bakterier (cyanobakterier som gav opphavet til kloroplastorganellen i alger og planter) bruker også en variant av opsingenet til å lagre lysenergi i karbohydrater ved å slå sammen CO2 og H2O (til senere bruk). Hjerneforskeren Karl Deisseroth brukte i 2005 bakterienes opsingen, som er en lyssensitiv ionekanal, og satte dette inn i nerveceller hos mus (15). Når han slo på lyset strømmet natriumioner (Na+) inn i nervecellene og de ble depolarisert og aktivert. Dette var et gjennombrudd fordi man kunne stimulere eller hemme enkeltceller i levende dyr og se hva som skjedde (figur 4). Andre variasjoner som har blitt forsøkt siden inkluderer lyssensitive G-proteinkoblede reseptorer og kalsium(Ca2+)-kanaler. Det generelle konseptet optogenetikk innebærer ikke bare disse proteinene, men også reporterproteiner slik som GCaMP, som lyser opp når Ca2+ stiger i cellen (16). Begge deler blir viktig fremover.
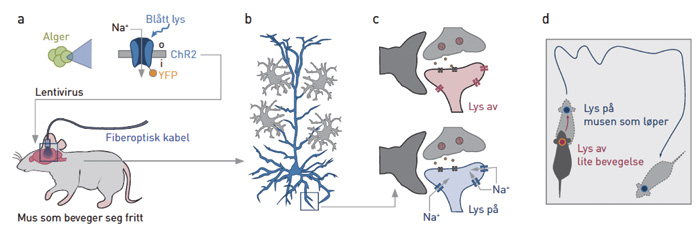
Figur 4. Fjernstyring av mus med optogenetikk. Genet for Channelrhodopsin 2(ChR2) «klippes ut» av alger og «limes inn» i hjerneceller hos mus ved hjelp av en lenti-virusvektor. Musene kan da fjernstyres ved hjelp av en fiberoptisk kabel som appliserer blått lys til en spesifikk hjerneregion (promotor cortex her). Når lyset slås på, vil Na+ strømme inn i nervecellene, og det gjør at musene løper rundt i buret. Forkortelser: «yellow fluorescent protein» (YFP, her brukt som en reporter). Gjengitt med tillatelse fra Tidsskrift for Den norske legeforening (20).
Med optogenetikk kan man også måle resultatene fra cellemanipulasjonen i «sanntid» med millisekunders nøyaktighet. For å oppnå denne graden av presisjon er man avhengig av å kunne registrere elektrisk aktivitet eller bruke biosensorer der fluorescerende proteiner er spleiset sammen med målproteinene. Og alt dette er igjen mulig ved å benytte seg av helt spesielle lysfølsomme proteiner som har evnen til å reagere svært raskt og presist på elektrisk eller biokjemisk stimulering (10).
Har dette relevans for vårt fagområde - tenner og munnhule?
Munnhulen er en integrert del av resten av kroppen, og tenner og spyttkjertler er spesialiserte organer på linje med andre organer i kroppen. De er ikke livsviktige og ligger nær overflaten og de er dermed enklere å studere i forsøksdyr enn mange andre indre organer.
To-foton mikroskopi er godt egnet til å studere bakteriesamspillet i tannens biofilm under friske og patologiske forhold. Kunne man også kode inn fluorescerende proteiner i enkeltbakterier i biofilmen (for eksempel P. gingivalis) og skru av og på bakteriegener med optogenetikk, ville man kunne studere og påvirke dem i deres naturlige miljø; i biofilmen på tannoverflaten. Videre kan det åpne for nye og interessante behandlingsmuligheter av utbredte tannsykdommer som karies og periodontitt. To-foton mikroskopi gjør det også mulig å studere samspillet mellom sentrale celler (immunceller, osteoblaster og osteoclaster) i nedbrytningsprosessen av periodontiet i levende forsøksdyr mens det pågår. Og kanskje kan vi forstå bedre hvorfor det er så uforutsigbart og vanskelig å gjendanne (regenerere) tapt støttevev etter periodontal nedbrytning, og forhåpentlig vil vi få gjort noe med det (17).
Men avansert avbildningsteknologi som to-foton mikroskopi alene er ikke nok for å «avlytte og tolke» disse avanserte «samtalene» mellom celler, som for eksempel å forstå i detalj hvordan T-cellene styrer osteoclastene til økt bennedbrytning rundt tennene ved periodontitt, og hvorfor dette skjer hos noen individer på gitte tidspunkter og ikke hos andre. Metoden bør kombineres med dyremodeller for sykdommen og bruk av transgene dyr der sentrale molekyler som man mistenker er viktig for en bestemt funksjon slås av eller på. Dette kan videre kombineres med verktøy som tillater presis manipulasjon av definerte celler. Bruk av mikro-RNA er en slik mye brukt metode (4). Optogenetikk, der man bruker lyssensitive proteiner som uttrykkes i ønskede målceller og hvis funksjon kontrolleres med lys av bestemt bølgelengde, er imidlertid mye raskere, mer dynamisk og gir derfor helt nye muligheter til å forstå kompliserte celle-interaksjoner og påvirke dem. Vi har så langt benyttet to-foton mikroskopi og optogenetikk i studier av nervesystemet (18 - 20), men andre forskningsområder står nå for tur. Særlig peker kompliserte prosesser som organdannelse, vevsregenerasjon og immunreaksjoner seg ut som gode kandidater.
English summary
New research methods using living animals hold great promise
Researchers have traditionally studied dead fixated tissue to understand biological processes on a cellular level. There are obvious limitations to this approach. Newer clinical imaging techniques such as computer tomography (CT) and magnetic resonance imaging (MRI) can be used to image living animals or patients, but lack the spatiotemporal resolution to study individual cells or subcellular details. Until recently, a technique that allows both the imaging and manipulation of biological processes on a cellular level in living animals has been missing.
Two new methods hold great promise in addressing this problem; two-photon microscopy and optogenetics. Two-photon microscopy has in the last two decades become one of the most important experimental techniques in neuroscience. Optogenetics is a somewhat newer method that can be combined with two-photon imaging, and recently suggested as «Breakthrough of the Decade» in a Science article.
This paper first reviews the historical and biological context of these two methods, before proceeding to discuss their potential relevance for future research in oral biology and pathophysiology.
S. Thrane P, S. Thrane A. Nye forskningsmetoder på levende dyr gir uante muligheter. Nor Tannlegeforen Tid. 2018;128:338-42. doi:10.56373/2018-5-4
Referanser
Jaenisch R, Mintz B. Simian virus 40 DNA sequences in DNA of healthy adult mice derived from preimplantation blastocysts injected with viral DNA. Proc Natl Acad Sci U S A. 1974; 71(4): 1250 - 4.
Gordon JW, Ruddle FH. Integration and stable germ line transmission of genes injected into mouse pronuclei. Science. 1981; 214(4526): 1244 - 6.
Lyngstadaas SP, Risnes S, Sproat BS, Thrane PS, Prydz HP. A synthetic, chemically modified ribozyme eliminates amelogenin, the major translation product in developing mouse enamel in vivo. Embo J. 1995; 14(21): 5224 - 9.
Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell. 1993; 75(5): 843 - 54.
Yu D, Pendergraff H, Liu J, Kordasiewicz HB, Cleveland DW, Swayze EE, et al. Single-stranded RNAs use RNAi to potently and allele-selectively inhibit mutant huntingtin expression. Cell. 2012; 150(5): 895 - 908.
Filler A. The History, Development and Impact of Computed Imaging in Neurological Diagnosis and Neurosurgery: CT, MRI, and DTI. Nature Precedings. 2009; 7(1): 1.
Nikolenko V, Poskanzer KE, Yuste R. Two-photon photostimulation and imaging of neural circuits. Nat Methods. 2007; 4(11): 943 - 50.
Kawakami N, Flugel A. Knocking at the brain's door: intravital two-photon imaging of autoreactive T cell interactions with CNS structures. Semin Immunopathol. 2010; 32(3): 275 - 87.
Christensen DJ, Nedergaard M. Two-photon in vivo imaging of cells. Pediatr Nephrol. 2011; 26(9): 1483 - 9.
Method of the Year 2010. Nature Methods. 2011; 8(1): 1-.
Pastrana E. Optogenetics: controlling cell function with light. Nature Methods. 2011; 8(1): 24 - 5.
Insights of the decade. Stepping away from the trees for a look at the forest. Introduction. Science. 2010 Dec 17; 330(6011): 1612 - 3.
Svoboda K, Yasuda R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 2006; 50(6): 823 - 39.
Denk W, Strickler JH, Webb WW. Two-photon laser scanning fluorescence microscopy. Science. 1990; 248(4951): 73 - 6.
Boyden ES, Zhang F, Bamberg E, Nagel G, Deisseroth K. Millisecond-timescale, genetically targeted optical control of neural activity. Nat Neurosci. 2005; 8(9): 1263 - 8.
Mao T, O'Connor DH, Scheuss V, Nakai J, Svoboda K. Characterization and subcellular targeting of GCaMP-type genetically-encoded calcium indicators. PLoS One. 2008; 3(3): e1796.
Wang HL, Greenwell H, Fiorellini J, Giannobile W, Offenbacher S, Salkin L, et al. Periodontal regeneration. J Periodontol. 2005; 76(9): 1601 - 22.
Rangroo Thrane V, Thrane AS, Wang F, Cotrina ML, Smith NA, Chen M, et al. Ammonia triggers neuronal disinhibition and seizures by impairing astrocyte potassium buffering. Nat Med. 2013; 19(12): 1643 - 8.
Thrane AS, Rangroo Thrane V, Zeppenfeld D, Lou N, Xu Q, Nagelhus EA, et al. General anesthesia selectively disrupts astrocyte calcium signaling in the awake mouse cortex. Proc Natl Acad Sci U S A. 2012; 109(46): 18974 - 9.
Thrane AS, Thrane PS. Fremtiden er lys! Tidsskr Nor Laegeforen. 2016; 136(5): 394 - 5.
Korresponderende forfatter: Alexander S. Thrane, e-post: alexander.thrane@gmail.com
Artikkelen har gjennomgått ekstern faglig vurdering.
Thrane PS, Thrane AS. Nye forskningsmetoder på levende dyr gir uante muligheter. Nor Tannlegeforen Tid. 2018; 128: 338-42.
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
S.
Thrane P, S.
Thrane A. Nye forskningsmetoder på levende dyr gir uante muligheter. Nor Tannlegeforen Tid. 2018;128:338-42. doi:10.56373/2018-5-4