Antibiotikaprofylax - förskrivning som kräver kunskap och eftertanke
Med antibiotikaprofylax menas att man ordinerar antibiotika i syfte att förhindra infektion. Patienten som får antibiotikaprofylax har alltså per definition inte någon pågående infektion. Inom det odontologiska verksamhetsområdet finns det i princip två situationer när det kan vara aktuellt att ge antibiotikaprofylax: a) när ingreppet i sig medför en påtagligt ökad risk för postoperativ infektion eller b) när det hos patienten finns en, eller flera, riskfaktorer som medför stor risk för infektion. Detta är sannolikt det området inom antibiotikaanvändning som har de största vetenskapliga kunskapsluckorna (1). Samtidigt kan omfattande eller felaktig användning av antibiotikaprofylax påtagligt inverka på den totala mängden förskrivning av antibiotika inom det odontologiska verksamhetsområdet (2). Ur ett såväl nationellt som internationellt perspektiv går åsikter starkt isär vad som skadar patienten mest, okritisk användning av antibiotikaprofylax eller undanhållande av densamma. Oavsett åsikt, måste all antibiotikaanvändning som baseras på rutin, tradition och/eller konsensus omvärderas och diskuteras i ljuset av den ökande antibiotikaresistensen. Så även antibiotikaprofylax.
Hovedbudskap | |
|---|---|
· |
Det finns ett tydligt samband mellan antibiotikaförskrivning och utveckling av antibiotikaresistens. |
· |
All antibiotikaanvändning, inkluderande profylax, ska vara välgrundad och hållas till ett minimum. |
· |
Indikationer för antibiotikaprofylax kan vara en infektionskänslig patient eller ett ingrepp som medför stor risk för infektion utan antibiotikaskydd. |
· |
Det finns väldigt få absoluta indikationer för antibiotikaprofylax. |
· |
Patientens sammanlagda riskfaktorer måste beaktas inför beslut om det är indicerat med antibiotikaprofylax. |
Preparatval, dos, duration och timing
Preparatval
Vid val av preparat behöver man känna till vanliga bakteriella agens för den infektion man vill förebygga, deras naturliga känslighet för olika preparat, preparatets farmakokinetik och -dynamik samt resistensläget i det geografiska området man befinner sig. Ett rimligt empiriskt förstahandsbeslut idag, i de Nordiska länderna, är att som antibiotikaprofylax ordinera amoxicillin. Detta preparat har utmärkt effekt på de bakterier som vanligen orsakar orala infektioner, och till skillnad från penicillin-V, en hög och förutsägbar absorption samt en duration som täcker in tiden för ett genomsnittligt dentoalveolärt ingrepp. Är patienten allergisk mor penicillin blir valet mer komplicerat. Tänkbara alternativ är klindamycin, cefalosporin, tetracyklin eller makrolider. Samtliga dessa preparat är att betrakta som kompromisser med sina sinsemellan inneboende för- och nackdelar, kontraindikationer och begränsningar. I Sverige, Norge och Danmark rekommenderas klindamycin vid penicillinallergi. Fördelarna är god effekt på de flesta bakterier som orsakar orala infektioner. Nackdelar är dock påtagliga ekologiska störningar på den normala mikrofloran samt en ökande resistensproblematik (3). I Finland rekommenderas cefalosporin i första hand förutsatt att patienten inte haft en anafylaktisk reaktion på penicillin (4). Resonemanget bakom detta är att risken för korsallergi mellan penicillin och cefalosporin anses som liten. Finns anamnestiska uppgifter på anafylaktisk reaktion är det klindamycin som gäller även i Finland. I stora drag kan sägas att cefalosporin har samma nackdelar som klindamycin. Tetracyklin och makroliden erytromycin rekommenderas inte i något Nordiskt land på grund av den stora resistensproblematiken och omfattande ekologiska störningar i den skyddande normala mikrobiotan. Erytromycin har dessutom en relativt dålig effekt på anaerober, mindre bra penetration i ben och uppvisar interaktioner med många andra läkemedel (5). Som alternativ till profylax, där målet är fakultativa orala streptokocker, rekommenderas i Danmark den nyare makroliden claritromycin vid vissa tillstånd, eftersom den ekologiska störningen blir mindre uttalad än vid användning av erytromycin (6).
En annan aspekt på preparatval är ingrepp i gränsområdet mellan odontologi och medicin. En vanlig missuppfattning inom medicin är att orala infektioner orsakas av samma bakterier som ger övre- och nedre luftvägsinfektioner, vilket kan leda till suboptimalt preparatval. Här har tandläkaren ett ansvar att upplysa om vad som gäller ur ett odontologiskt perspektiv, vid multidiciplinärt omhändertagande av infektioner.
Dos
Forskning saknas för vad som är den optimala dosen. Trenden är att den reduceras i nyare rekommendationer. Dock anses ofta att det är mer skadligt att ligga för lågt än för högt och profylaxdosen är därför av tradition högre än dosen vid behandling. Den vanligen rekommenderade dosen på 2 gram amoxicillin säkrar en baktericid koncentration i vävnad och blodbanan både under och timmarna efter ett ingrepp. Vid en-dosregim, framförallt peroralt, är dessutom risken för toxicitet mycket låg. Klindamycindosen som vanligtvis rekommenderas vid penicillinallergi är 600 mg.
Duration och timing
Undersökningar visar att det vanligaste felaktiga beteendet (atferd) när det gäller ordination av antibiotikaprofylax tycks vara att förlänga durationen utöver operationsdagen (1, 7). Idag finns ingen forskningsstudie av hög kvalité som rättfärdigar ett sådant förfarande (8 - 10). Tyvärr förekommer det däremot en del systematiska översikter, behäftade med allvarliga vetenskapliga metodfel, som påstår det motsatta. Det finns däremot indikationer på att så kallad «förlängd profylax» kan öka risken för postoperativ infektion (11,12). Ett annat mindre vanligt, men lika felaktigt, beteende är att inleda antibiotikaprofylaxen några dagar innan ett ingrepp med motiv att ge «en steady-state av antibiotika i vävnaden». Det bygger på ett helt felaktigt antagande att antibiotika skulle bete sig på samma sätt som vissa andra läkemedel, vilket inte är fallet. Antibiotikaprofylax skall ges som en preoperativ dos. Peroralt administreras dosen ca 1 timme innan planerat ingrepp for att säkra optimal koncentration vid operationsstart (13). Om operationstiden överstiger cirka 3 timmar kan man överväga att upprepa dosen för att täcka in hela operationstiden. När operationen är avslutad upphör relevansen att tillämpa antibiotikaförskrivning i infektionsförebyggande syfte (hensikt).
Risker och kontraindikationer
Kroppens alla ytor som är i kontakt med omvärlden, inklusive hela magtarmkanalen, är täckt av bakterier, vår så kallade normala mikrobiotia. Sammansättningen av den normala mikrobiotian har kunnat kopplas till en rad sjukdomar och tillstånd. Hälsa är korrelerat till en mikrobiotia med stor diversitet, det vill säga att det finns många olika bakteriearter. All antibiotikaanvändning ger en så kallad selektion, vilket innebär att känsliga bakterier avdödas och motståndskraftiga överlever och förökas. Det gör att det blir en kraftigt reducerad diversitet, en så kallad ekologisk störning, i vår skyddande normala mikroflora när vi intar antibiotika. Kroppens normala mikrobiota har även många andra viktiga funktioner där kolonisationsresistens anses vara en av de viktigaste. Kolonisationsresistensen innebär ett skydd mot utifrån kommande infektiösa agens som beror på dels konkurrens om näring och bindningsställen men också normalflorebakteriernas produktion av antibakteriella peptider som kan angripa patogener. Antibiotikabehandling stör kolonisationsresistensen och banar därmed väg för nya infektioner. När balansen i vår normal mikrobiota skadas, som vid antibiotikaanvändning, ökar också individens risk att exponering av resistenta bakterier leder till bärarskap. Detta bärarskap innebär att till exempel MRSA eller ESBL blir en del av värdens normala mikroflora. Utöver detta föreligger en risk för interaktion med andra läkemedel och biverkningar som kan vara alltifrån milda övergående besvär till allvarliga, potentiellt livshotande. Samtliga risker med antibiotika är påtagligt reducerade när man använder ett smalspektrigt preparat, det vill säga ett preparat som riktar sig mot ett begränsat antal bakteriearter (figur 1).

Figur 1. Illustration av risken för negativa effekter på värden vid administration av antibiotika. Procentintervallen reflekteras av att effekten varierar mellan olika preparat.
Nyare data indikerar att även en dos av antibiotika ger selektion av resistenta bakterier och ekologisk störning hos normala mikrobiotan (14). Eftersom antalet friska bärare av antibiotikaresistens ökar så kan det idag talas om en individuell risk vid antibiotikaförskrivning. Så kan t ex antibiotikaprofylax teoretiskt utgöra en ökad risk för utveckling av en svårbehandlad antibiotikaresistent infektion om det ges till bäraren, så att de känsliga bakterierna slås ut medan de resistenta tilltar i antal och orsakar infektion (14). Det har till exempel rapporterats fall av den allvarliga Clostridium difficile diarrén efter en profylaktisk dos med klindamycin (15, 16) (figur 2). Vidare har en engelsk registerstudie redovisat ett betydande antal C. difficile infektioner, varav en del med dödlig utgång, efter administrering med klindamycin som profylax (17).
Penicillinallergi
Äkta penicillin-allergi har skattats till att finnas hos färre än 1 % av befolkningen. Misstolkning av icke-allergiska hudutslag och andra typer av biverkningar såsom magtarmbesvär antas ligga till grund för den falskt höga frekvensen av penicillin-allergi som föreligger. Då alla alternativ till penicillin vid orala infektioner är att betrakta som kompromisser är det viktigt att försöka få klarhet i om en angiven allergi verkligen är bekräftad hos läkare. Ofta kan många förväxlingar mellan t ex orolig mage under antibiotika behandling och allergi uppdagas genom att några kontrollfrågor ställs till patienten. Om oklarhet föreligger får patienten betraktas som allergisk tills en utredning hos läkare är utförd. Ett ytterligare motiv att utreda oklar allergi mot antibiotika är att behandling av vissa antibiotikaresistenta infektioner annars kan kompliceras påtagligt. Så har man vid t ex infektion med en ESBL (extended spectrum betalactamase)-producerande bakterie hos en penicillin-allergisk patient förlorat det enda riktigt bra behandlingsalternativet som finns att behandla den aktuella patienten med.
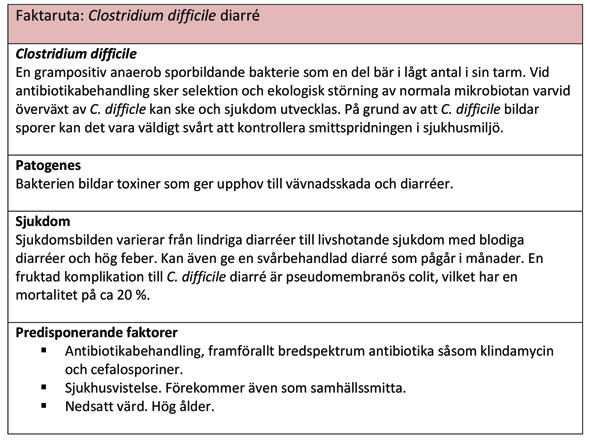
Kort sammanfattning om gastroenterit orsakad av Clostridium difficile.
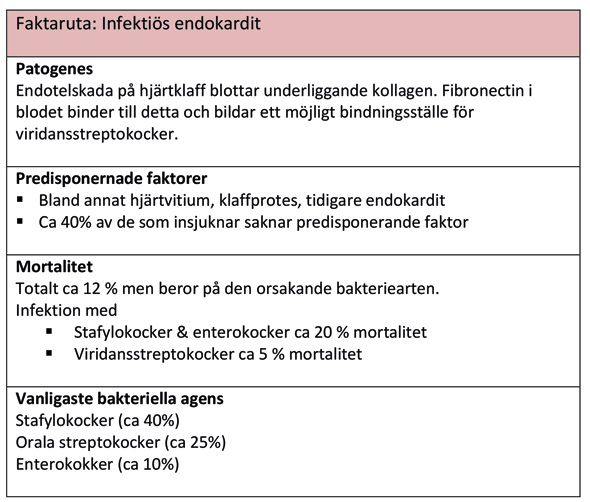
Korta fakta om infektiös endokardit. Frekvensen av orsakande bakteriearter baseras på data från 2016 års rapport från Svenska endokarditregistret.
Antibiotikaprofylax - ett etiskt dilemma?
Med den kunskap vi har idag, och den resistensutvecklingen som föreligger, är det inte acceptabelt att använda antibiotikaprofylax om inte andra infektionsminimerande åtgärder samtidigt är vidtagna. Att genomföra en operation utan steril dukning är till exempel tveksamt ur ett lege artis perspektiv. Om dessutom antibiotikaprofylax brukas vid ett sådant ingrepp föreligger ett påtagligt etiskt problem. Ibland uppstår situationer då ingrepp akut behöver göras på ofullständigt utredd patient eller där timingen i relation till annan pågående behandling, såsom cytostatika eller strålning, måste kompromissas. I dessa lägen kan antibiotikaprofylax utgöra ett viktigt supplement till behandlingen. Det är dock viktigt att i möjligaste mån ha goda rutiner för oral sanering innan operationer och behandlingar som annars medför en ökad risk för infektion när de väl igångsatts, såsom högdos bisfosfonatbehandling, strålbehandling, organtransplantationer, hjärtklaffsoperation och cytostatikabehandling. Att ha ett infektionsminimerande arbetssätt är idag en mycket viktig del av rationell antibiotikaanvändning och därmed hållbar utveckling.
Indikationer
Det finns väldigt få absoluta indikationer för antibiotikaprofylax. En rad tillstånd som traditionellt har diskuterats som möjliga riskfaktorer för infektioner utgående från munhålan betraktas inte längre som indikationer för antibiotikaprofylax (se tabell 1). Indikationer för antibiotikaprofylax kan antingen vara en riskpatient eller ett riskingrepp. Riskingreppet innebär att åtgärden i sig utgör en påtaglig ökad risk för infektion oavsett patientens status. Riskpatienten kännetecknas antingen av patientfaktorer som påtagligt ökar risken för infektion eller där en potentiell infektion utgör en oacceptabel risk för en skör patient (se tabell 1).
Status |
Betydelse ur infektionssynpunkt |
Avsaknad av mjälte (mangler milt) |
Framförallt ökad risk för infektion med kapslade bakterier såsom pneumokocker och Haemophilus influenzae. Då dessa inte orsakar orala infektioner är det ej indicerat med antibiotikaprofylax. |
Bisfosfonatbehandling, låg dos i.v. eller per oralt |
Ingen evidens att profylax är till nytta. Ej indicerat med antibiotikaprofylax. |
Bisfosfonatbehandling i.v. till cancer patienter |
Denna patientkategori har en relativt hög risk för bisfosfonatinducerand käkbensnekros i samband med benskadade ingrepp. Evidens saknas om antibiotika utgör något skydd men på grund av tillståndets allvarlighetsgrad så rekommenderas antibiotikaprofylax inför benskadande ingrepp såsom tandextraktion och dentoalveolär kirurgi. |
Bröstimplantat |
Ej indicerat med antibiotikaprofylax. |
Central venkateter (CVK) |
Framförallt ökad risk för infektion med stafylokocker. Ej indicerat med antibiotikaprofylax inom tandvården. |
Cystisk fibros |
Ej indicerat med antibiotikaprofylax. |
Diabetes, dålig metabolisk kontroll |
Laboratorievärden som indikerar långvarig dålig metabolisk kontroll (HbA1c >7 %, 9 - 12 mmol/L) eller förekomst av grava komplikationer till sjukdom (amputationer, blindhet etc). Antibiotikaprofylax kan vara indicerat. |
Diabetes, välkontrollerad |
Ej indicerat med antibiotikaprofylax. |
Dialysbehandling |
Evidens saknas för samband mellan infektion och munhålan. Ej indicerat med antibiotikaprofylax. |
HIV |
Hos vuxna framförallt ökad risk för svamp och virusinfektioner. Ej indicerat med antibiotikaprofylax. |
Hjärtsjukdom |
Ingen ökad risk för infektioner utgående från munhålan vid kranskärlssjukdom, by-pass opererad, hjärtinfarkt, stenoser, stentar, shuntar, pace-maker eller hjärtflimmer. Ej indicerat med antibiotikaprofylax. |
Hypogammaglobulinemi |
Ej indicerat med antibiotikaprofylax. |
Högdos strålbehandling mot käkben |
Evidens saknas. Stark konsensus att ge antibiotikaprofylax. |
Högrisk för infektiös endokardit |
Medfött cyanotisk hjärtfel, inopererad hjärtklaff samt tidigare genomgången endokardit utgör högriskfaktorer för att utveckla infektiös endokardit. För ställningstagande till antibiotikaprofylax hänvisas till respektive lands nationella riktlinjer. Låg tröskel för att kontakta och rådgöra med patients kardiolog rekommenderas, speciellt vid allvarligare hjärtfel. |
IgA-brist |
Ej indicerat med antibiotikaprofylax. |
Kortison |
Vid långtidsbehandling med >20 mg/dag kan antibiotikaprofylax övervägas. |
Ledprotes |
Framförallt ökad risk för infektion med stafylokocker och andra hudbakterier. Vid väl inläkt protes (>3 månader efter operation), ej indicerat med antibiotikaprofylax. Om nyligen opererard patient skjut om möjligt upp behandlingen eller konsultera patientens läkare. |
Organtransplantation |
Avstå om möjligt invasiv tandbehandling under de 3 - 6 första månaderna efter transplantation. När organet väl är inläkt så ger underhållsbehandlingen ökad risk för framförallt virus- och svampinfektioner. Ej indicerat med antibiotikaprofylax. |
Reumatisk sjukdom, medicinbehandlad |
Ger vanligen en svag immunosuppression. Ej indicerat med antibiotikaprofylax men medicinering bör ställas in i samråd med reumatolog. |
Rökning |
Viss ökad risk för infektioner generellt sett. Ej indicerat med antibiotikaprofylax. Patienten bör rekommenderas rökstopp inför alla typer av kirurgiska ingrepp. |
Solid tumör |
Om utan samtidig tung immunosuppressiv behandling eller neutropeni föreligger ingen indikation för antibiotikaprofylax. |
Övervikt |
BMI >25 - 40 utgör viss ökad risk för infektion. Ej indicerat med antibiotikaprofylax. |
En svår grupp att bedöma är patienter med multipla riskfaktorer, som var och en för sig inte utgör indikation för antibiotikaprofylax, men som tillsammans kan addera upp till en påtaglig risk för infektion. I sådana fall krävs både eftertanke samt kunskap och ansvarig läkare kan behöva kontaktas.
Vid samtliga möjliga indikationer för antibiotikaprofylax gäller att optimerad munhygien och strikt vårdhygien är väl så viktiga faktorer för att förebygga infektion.
Riskingrepp
Ett fåtal ingrepp anses som absoluta indikationer för antibiotikaprofylax. Hit hör frakturkirurgi och ortognatkirurgi (8, 18). Utöver detta kan t ex implantatkirurgi i vissa fall betraktas som ett riskingrepp. Det finns visst stöd i litteraturen för att okomplicerad implantatkirurgi på frisk patient inte utgör någon indikation för antibiotikaprofylax (9, 10). När det gäller benaugmentation saknas evidens, men enligt de svenska konsensusriktlinjerna rekommenderas 2 g amoxicillin preoperativt (18).
Bakteriemi
För vissa riskpatienter gäller att de ska skyddas vid ingrepp som kan orsaka bakteriemi från munhålan. Här bör tydliggöras att man har väldigt lite kunskap om vilka ingrepp detta egentligen rör sig om. De studier som är gjorda på bakteriemier är utförda med olika metoder, visar divergerande resultat samt saknar i allmänhet data på mängden bakterier som kommer ut i blodet. Dessutom vet man inte om det är exponeringsfrekvensen, det vill säga antalet bakteriemier, eller mängden/dosen bakterier som kommer ut i blodet, som har störst betydelse. Att använda synlig blödning som indikation på att bakteriemi föreligger har visat sig vara osäkert. Däremot har undersökningar visat större förekomst av bakteriemier hos patienter med parodontit än hos personer med friska parodontala förhållanden (19). Därför råder det enighet om att gott munhålestatus är det viktigaste skyddet mot bakteriemier. Det är dessutom det enda sättet patienten kan skyddas mot bakteriemier som sker i vardagen t ex vid daglig munvård.
Riskpatienter
Endokarditrisk
Patienter med ökad risk för infektiös endokardit har traditionellt fått antibiotikaprofylax inför invasiva ingrepp, inkluderande tandvård, för att skydda hjärtats endokardium mot bakteriemi. Evidensen för endokarditprofylax är svag och egentligen finns idag inget vetenskapligt bevis på att det är indicerat (20). Mot detta vägs att a 25 - 30 % av endokarditerna orsakas av orala streptokocker som har en speciell benägenhet att binda till det skadade endotelet och där orsaka en vegetation av bakterier (se figur 3). Internationellt har man över tid reducerat indikationerna för endokarditprofylax till att i mitten på 2000-talet endast omfatta patienter med hög risk för endokardit. Dessa högriskfaktorer omfattar kongenitalt cyanotiskt hjärtvitium, inopererad hjärtklaffprotes samt tidigare genomgången endokardit. Storbritannien var först ut att rekommendera att man upphör med endokarditprofylax 2008, följt av Sverige 2012 (18, 19). Beslut att avskaffa endokarditprofylaxen i Sverige skedde i samråd med representanter från Svensk Cardiologförening samt från Svenska infektionsläkarföreningen. I Storbritannien har det på senare år registrerats en ökning i förekomsten av infektiösa endokarditer, vilka man inte med säkerhet kunnat härleda till rekommendationen från 2008 då man upphörde med endokarditprofylax (22, 23). En ökning av endokarditer har under samma tidsperiod också rapporterats från andra länder som inte har avskaffat endokarditprofylaxen, vilket gör epidemiologin svårtolkad (24). I Sverige, har man hittills inte sett någon signifikant ökning av infektiösa endokarditer efter avskaffandet av endokarditprofylaxen (25). Å andra sidan vet man inte helt säkert i vilken utsträckning, och på vilka patienter, riktlinjerna efterlevts i Sverige. Kliniska studier är svåra att utföra då incidensen är så låga att orimligt stora studiepopulationer behövs för att besvara frågan (26). Säkert är dock att det saknas övertygande evidens på antibiotikaprofylaxens roll vid endokarditrisk, och därtill kommer att tillgänglig litteratur tolkas olika. Efter genomgång av nyare publikationer har NICE och Svenska Läkemedelsverket beslutat att inte ändra rekommendationen medan Norge, Finland och Danmark fortsatt rekommenderar endokarditprofylax i överensstämmelse med European Society for Cardiology, det vill säga att ge antibiotikaprofylax till den begränsade gruppen högriskpatienterna (27). Förespråkare för restriktiv hållning menar att det är ologiskt att ge profylax för den bakteriemin som uppstår vid tandvård medan patienten är helt oskyddad mot den dagliga bakteriemin som uppstår vid aktiviteter som tuggning och tandborstning. Gemensamt för alla rekommendationer är att vikten av regelbunden tandvård och god oral hälsa är viktigt för att reducera bakteriemier från munhålan. Tills evidensläget är klarare bör dock de inhemska rekommendationerna följas. För tandläkaren bör också tröskeln för att konsultera patientens kardiolog vara låg, och det är viktigt att titta på den sammanvägda förekomsten av olika riskfaktorer.
Grav immunosuppression
Exakt vad som definierar när gravt nedsatt immunförsvar föreligger är inte helt klart utan är egentligen en glidande skala. I detta avseende menas patienter som har en påtagligt ökad risk för infektioner vid invasiva ingrepp i munhålan. Dessa bör få antibiotikaprofylax inför ingrepp såsom tandextraktion, dentoalveolär kirurgi och subgingival depuration. Detta gäller till exempel patienter med pågående tung immunosuppressiv behandling, vilket kan vara aktuellt de första månaderna efter transplantationer (organ- benmärg- stamcells-) eller vid behandling av en avstötningsreaktion. Lågt antal neutrofila granulocyter (<1,0 x 109/L) till följd av sjukdom eller medicinering eller vid uttalad defekt granulocytfunktion (t ex myelodysplastisk syndrom) bör också betraktas som indikationer för antibiotikaprofylax vid ovan angivna ingrepp.
Framtidens krav på ökad kunskap
Sammanfattningsvis vilar området antibiotikaprofylax i tandvården i stor utsträckning på empiri, erfarenhet och ett kliniskt resonemang. För att möta upp mot dagens behov av rationell antibiotikaanvändning behövs såväl forskning kring förskrivningsmönster, hur skriftliga riktlinjer och rekommendationer omsätts i praktiken och vad som styr klinikerns beslutsfattning, liksom effektivitet och risker med antibiotikaprofylax.
English summary
Prophylactic antibiotics - prescription that requires knowledge and reflection
Antibiotic prophylaxis means prescribing antibiotics with the aim of preventing an infection. The patient who receives antibiotic prophylaxis has therefore, by definition, not an ongoing infection. Within odontology there are basically two circumstances that may require antibiotic prophylaxis: a) when the planned procedure has an inherent high risk for postoperative infection or b) when the patient has one or more risk factors that significantly increases the risk of infection. This is probably the area within antibiotic utilization in dentistry that has the most extensive knowledge-gaps. Concurrently can an extensive or erraneous use of antibiotic prohylaxis substantially influence the total amount of prescribed antibiotics within odontology. Both nationally and internationally it is debated what harms the patient most, uncritical use of antibiotic prophylaxis or strict refrain from the same. Regardless of opinion, all antibiotic usage based on routine, tradition and/or consensus must be redefined and discussed in the light of the increasing antibiotic resistance. This also includes antibiotic prophylaxis.
Lund B, Hultin M, Larsen T. Antibiotikaprofylax - förskrivning som kräver kunskap och eftertanke. Nor Tannlegeforen Tid. 2018;118:916-22. doi:10.56373/2018-11-8
Referenser
Österberg M, Holmlund A, Sunzel B, Tranæus S, Twetman S, Lund B. Knowledge gaps in oral and Maxillofacial Surgery: A Complex Systematic Review. Int J Techn Assess Health Care. 2017; 33(1): 93 - 102.
Khalil D, Hultin M, Andersson Fred L, Parkbring Olsson N, Lund B. Antibiotic prescription patterns among Swedish dentists working with dental implants surgery. Adherence to recommendations. Clin Oral Implants Res. 2015; 26(9): 1064 - 1069.
Kim MK, Chuang SK, August M. Antibiotic Resistance in Severe Orofacial Infections. J Oral Maxillofac Surg. 2017 May; 75(5): 962 - 968. doi: 10.1016/j.joms.2016.10.039. Epub 2016 Nov 9.
Hammasperäiset äkilliset infektiot ja mikrobilääkkeet. Helsinki 2017. www.kaypahoito.fi
Lund B, Skoog G, Götrick B, Blomgren J, Snygg-Martin U. Antibiotika för systemiskt bruk. Tandläkartidningen. 2014; 106(4): 64 - 74.
Dansk Cardiologisk Selskab. Behandlingsvejledning 7. Infektiøs endocarditis. 2017 http://nbv.cardio.dk/endocarditis
Pyysalo M, Helminen M, Antalainen AK, Sándor GK, Wolff J. Antibiotic prophylaxis patterns of Finnish dentists performing dental implant surgery. Acta Odontol Scand. 2014; 72(8): 806 - 10.
Antibiotikaprofylax vid kirurgiska ingrepp. En systematisk litteraturöversikt. SBU, Statens beredning för medicinsk utvärdering. 2000. ISBN 978 - 91 - 85413 - 36 - 2.
Lund B, Hultin M, Tranæus S, Naimi-Akbar A, Klinge B. Complex systematic review - Perioperative antibiotics in conjunction with dental implant placement. Clin Oral Implants Res. 2015; 26 (Suppl. 11), 1 - 14.
Klinge B, Flemming T, Cosyn J, De Bruyn H, Eiser BM, Hultin M, et al. The patient undergoing implant therapy. Summary and consensus statements. The 4th EAO Consensus Conference 2015. Clin Oral Implants Res. 2015; 26 (Suppl. 11), 64 - 67.
Gerlach KL, Pape H-D. Untersuchungen zur Antibiotikaprophy laxe bei der operativen behandlung von Unterkieferfrakturen. Dtsch Z Mund Kiefer Gesichts Chir. 1988; 12: 497.
Giridhar VU. Role of nutrition in oral and maxillofacial surgery patients. Natl J Maxillofac Surg. 2016; 7(1): 3 - 9.
Classen DC, Evans RS, Pestotnik SL, Horn SD, Menlove RL, Burke JP. The timing of prophylactic administration of antibiotics and the risk of surgical-wound infection. N Engl J Med. 1992; 326(5): 281 - 286.
Khalil D, Hultin M, Rashid MU, Lund B. Oral Microflora and Selection of Resistance after a Single Dose of Amoxicillin. Clin Microbiol Infect. 2016; 22(11): 949. e1 - 949.e4.
Balch A, Wendelboe AM, Vesely SK, Bratzler DW. Antibiotic prophylaxis for surgical site infections as risk factor for infection with Clostridium difficile. PLoS ONE. 2017; 12(6): e0179117.
Hansen D, Pollan LD, Fernando H. Fulminant Clostridium difficile colitis: A complication of perioperative antibiotic prophylaxis. J Oral Maxillofac Surg. 2013; 71: 1880 - 1885.
Thornhill MH, Dayer MJ, Prendergast B, Baddour LM, Jones S, Lockhart PB. Incidence and nature of adverse reactions to antibiotics used as endocarditis prophylaxis. J Antimicrob Chemother. 2015; 70: 2382 - 2388.
Allander A, Aronsson B, Baecklund E, Blomgren J, Cherif H, Claesson K, et al. Indikationer för antibiotikaprofylax i tandvården. Information från Läkemedelsverket. 2012; 5: 22 - 35.
https://lakemedelsverket.se/Alla-nyheter/NYHETER-2016/Antibiotikaprofylax-for-att-forebygga-endokardit-i-samband-med-odontologiska-ingrepp/
Forner L, Larsen T, Kilian M, Holmstrup P. Incidence of bacteremia after chewing, tooth brushing and scaling in individuals with periodontal inflammation. J Clin Periodontol. 2006; 33: 401 - 407.
Glenny AM, Oliver R, Roberts GJ, Hooper L, Worthington HV. Antibiotic for the prophylaxis of bacterial endocarditis in dentistry. Cochrane Database Syst Rev. 2013; 10: CD003813.
Thornhill MH, Dayer MJ, Forde JM, Corey GR, Chu VH, Couper DJ, et al. Impact of the NICE guideline recommendation cessation of antibiotic prophylaxis for prevention of infectious endocarditis: before and after study. BMJ. 2011; 3442: d2392.
Dayer MJ, Jones S, Prendergast B, Baddour LM, Lockhart PB, Thornhill MH. Incidence of infective endocarditis in England, 2000 - 13: a secular trend, interrupted time-series analysis. Lancet. 2015; 385(9974): 1219 - 28.
Grape M, Franck-Larsson K. Riktlinjer vid infektiös endokardit: Preliminär uppdatering förespråkar fortsatt restriktiv antibiotikaprofylax. Tandläkartidningen. 2015; 9: 64 - 5.
Svenskt endokarditregister. Årsrapport 2016. http://infektion.net/wp-content/uploads/2017/05/kvalreg_inf_2016_endokardit.pdf
Que YA, Moreillon P. Infective endocarditis. Nat Rev Cardiol. 2011; 8(6): 322 - 36.
Habib G, Lancellotti P, Antunes MJ, Bongiorni MG, Casalta J-P, Del Zotti F, et al. The task force for the management of infective endocarditis of the European Society of Cardiology. 2015 ESC Guidelines for the management of infective endocarditis. Eur Heart J. 2015; 36: 3075 - 123.
Korresponderende forfatter: Bodil Lund, Institutt for klinisk odontologi, Årstadveien 19, 5009 Bergen, Norway. E-post: bodil.lund@uib.no
Artikkelen har gjennomgått ekstern faglig vurdering.
Lund B, Hultin M, Larsen T. Antibiotikaprofylax - förskrivning som kräver kunskap och eftertanke. Nor Tannlegeforen Tid. 2018; 128: 916-22
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Lund B, Hultin M, Larsen T. Antibiotikaprofylax - förskrivning som kräver kunskap och eftertanke. Nor Tannlegeforen Tid. 2018;118:916-22. doi:10.56373/2018-11-8