Antibiotikaresistens - globalt, lokalt, idag och imorgon
Antibiotikaresistens ökar kraftigt över hela världen och är idag ett påtagligt hot mot den moderna sjukvården. Den exakta omfattningen globalt är inte känd, men från områden där man har en övervakning är siffrorna skrämmande. I Europa räknar man med att det dör ca 25 000 personer varje år som en direkt följd av antibiotikaresistens (1). Antalet extra vårddagar på sjukhus i Europa på grund av antibiotikaresistens beräknas uppgå till 2,5 miljoner per år. Motsvarande siffror för till exempel Thailand är 38 000 dödsfall per år och över 3 miljoner extra vårddagar på sjukhus (2). Förutom att mortaliteten för en infektion anses öka med cirka 50 % om bakterien i fråga är resistent, så ökar vårdkostnaderna påtagligt för såväl samhälle som patient. Behandlingen av en antibiotikaresistent-infektion beräknas vara upp till fyra gånger dyrare är en infektion med antibiotikakänsliga bakterier (3). För en indisk lantarbetare kan denna kostnad motsvara lönen för 442 dagars arbete (4). Om en familj i tredje världen insjuknar tvingas man kanske välja att behandla den som kan försörja familjen utanför hemmet, varför det indirekt ökar sårbarheten för flickor och kvinnor. För den drabbade familjen innebär det ökade kostnader för hushållet och minskade inkomster. Förutom dessa kostnader tillkommer samhällskostnader för nedsatt produktivitet och arbetskraft samt minskade skatteintäkter och ökade utgifter för social service.
Hovedbudskap | |
|---|---|
· |
Antibiotikaresistens ökar kraftigt över hela världen och är idag ett påtagligt hot mot den moderna sjukvården. |
· |
Resistensdrivande faktorer kan delas in i antibiotikaförbrukning, vårdhygien, sanitära förhållanden, sjukvårdens infrastruktur och miljöaspekter. |
· |
Ur ett internationellt perspektiv är antibiotikaresistensläget i Norden unikt gynnsamt. |
· |
Antibiotikaförskrivningen i tandvården i de Nordiska länderna utgör mellan 4,6 - 6 % av den totala antibiotikaförbrukningen i primärvården, men det finns indikationer på att detta kan reduceras ytterligare. |
· |
Det är när situationen är som mest gynnsam, såsom i Norden, som det är lättast att förebygga ökning och spridning av antibiotikaresistensen. |
Inom den närmaste 30-årsperioden har det skattats att antalet extremt fattiga kommer att öka med över 28 miljoner som en konsekvens av antibiotikaresistens (5). Om inga åtgärder (tiltak) vidtas antas att globala antalet dödsfall i världen orsakade av antibiotikaresistens år 2050 kommer att uppgå till 10 miljoner per år (5). I samma rapport från Världsbanken beräknas den globala kostnaden för antibiotikaresistens år 2050 bli 100 billioner (100 000 000 000 000) dollar per år. I EU skulle det innebära 23 miljarder dollar årligen i extra vårdutgifter. De sårbara drabbas hårdast redan idag. I Indien räknar man med att det dör cirka 58 000 spädbarn årligen till följd av icke behandlingsbara bakteriella infektioner (6).
Att hoppas på att utveckling av nya antibiotika ska vara vår lösning är att blunda för de åtgärder som faktisk behöver vidtas idag. Historien visar att strax efter introduktionen av ett nytt antibiotikum så uppstår de första resistenta bakteriestammarna. WHO har dessutom gjort en genomlysning av hur många preparat vi kan tänkas få ut på marknaden de närmaste 10 åren. Resultaten är nedslående, endast 8 testsubstanser klassas av WHO som möjliga kandidater för nya antibiotikapreparat (7). För behandling av infektioner med de svåraste resistenserna prövas idag kombinationer, eller cocktails, av befintliga preparat i hopp om att erhålla synergieffekter. En annan strategi för att förlänga effektiviteten hos befintliga antibiotika är att addera med en resistensfaktorblockerare. Exempel på detta är amoxicillin plus klavulansyra, där klavulansyra kan blockera vissa betalaktamaser.
Antikroppar, antimikrobiella peptider och bakteriofagterapi tas ibland upp som möjliga alternativ till antibiotika. Dessa har dock nackdelen att de endast riktar sig mot ett fåtal bakterier och därför inte kan utgöra något alternativ vid behandling av allvarliga infektioner. Det är heller inte känt om det pågår någon utveckling av dessa substanser till läkemedel. Andra problem är att bakteriefager liksom antibiotika kan trigga antibiotikaresistens och antikroppar är dyra och måste användas tidigt under infektionsfasen. Antimikrobiella peptider är instabila, potentiellt toxiska och kan bara användas för lokal behandling (8). Vaccin är viktigt för att förebygga infektioner, men saknas mot flera av våra allvarliga bakteriella infektioner. Därför är varken nya antibiotika, eller alternativ till antibiotika, hela lösningen, utan vi måste titta på hur antibiotikaresistens uppstår och arbeta förebyggande utifrån det faktum att antibiotika är en ändlig resurs.
Orsaker till antibiotikaresistens
Orsaker till resistens kan delas in i förbrukning, hygien, sjukvårdens infrastruktur och miljöaspekter. Resistensdrivande faktorer återfinns i flera av samhällets sektorer och i interaktionen mellan dessa (figur 1). När det gäller förbrukningen så är det framförallt sjukvårdens och veterinärmedicinens överförskrivning, patienter som inte följer ordinationer eller medicinerar sig själva med överblivna preparat och jordbrukets bruk av antibiotika i djurfoder, som är de dominerande orsakerna. Bristande vårdhygien anses vara en viktig del i spridning och ökning av antibiotikaresistenta bakterier. Undermålig aseptik och vårdhygien leder dessutom generellt till en ökning av vårdrelaterade infektioner, vilket i sin tur ökar behovet för att behandla de uppkomna infektionerna med antibiotika. Avsaknad, eller brist på, fungerande mikrobiologiska laboratorier för snabb och korrekt diagnostik och övervakning av resistensläget är också karaktäristiskt för länder där man tappat kontrollen över resistensen. Andra infrastrukturella faktorer som ökar resistens är att antibiotika kan köpas utan recept i stora delar av världen. Dåliga sanitära förhållanden med orent vatten, avsaknad av toaletter och avlopp är starkt resistensdrivande omständigheter. Okontrollerat utsläpp av antibiotika i miljön från antibiotikaproducenter är i vissa delar av världen en bidragande faktor. Man har till exempel i Indien uppmätt antibiotikakoncentrationer i vattenutsläpp från antibiotikafabriker som vida överstiger de koncentrationer man uppnår i blodet vid behandling (9).
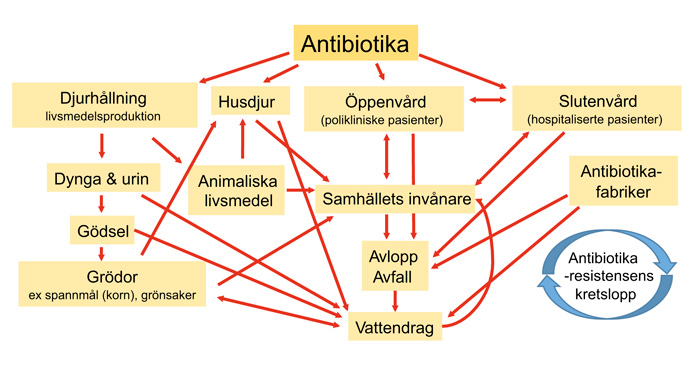
Figur 1. Illustration över sambandet mellan olika sektorer i samhället och antibiotikaresistens. Att arbeta med alla dessa aspekter i kampen mot antibiotikaresistens omfattas av begreppet «One Health».
Vad behöver man göra?
Åtgärder för att motverka antibiotikaresistens innefattar rationell antibiotikaanvändning, det vill säga korrekt indikation, preparat, dos och duration vid varje förskrivning. Patientens ansvar är att ta antibiotika så som det ordinerats och lämna tillbaks överbliven medicin till apoteket. I alla vårdsituationer behöver minutiös vårdhygien tillämpas enligt nationellt och internationellt stipulerade rutiner och principer. En övervakning av resistenssituationen behövs där länder samarbetar för att skapa infrastruktur, identifiera fall och rapportera om resistensläget för att väl underbyggda internationella policybeslut ska kunna fattas. Begreppet «One Health» är centralt och står för att aktörer i multipla sektorer såsom sjukvård, industri, jordbruk och djurhållning samverkar för att förhindra antibiotikaresistens.
Unikt bra läge i Norden
Ur ett internationellt perspektiv är resistensläget i Norden unikt gynnsamt (gunstig). Data från European Centre for Disease Prevention and Control (ECDC) visar till exempel att andelen MRSA (methicillin-resistenta Staphylococcus aureus) 2017 bland kliniska isolat i Norden är mellan 1 - 2,5 % och motsvarande siffra för ESBL (extended spectrum betalactamases) är mellan 5 - 7 % (10). Bortsett från Nederländerna och Island så är andelen MRSA 6 - 44 % i övriga Europa medan ESBL förekomsten är mellan 9 - 76 %, se figur 2 (10). I Norden har man haft en lång tradition av medvetet arbete för att förebygga och hindra utveckling och spridning av antibiotikaresistens genom arbete med nationella rekommendationer, övervakning av epidemiologin, fokus på vårdhygien, smittspårning och screening, restriktiv använding av antibiotika i djurhållning, forskning och utbildningsinsatser. En del vill mena att även såväl klimat, som Nordens geografiska läge, också har haft en betydelse. En nyckelkomponent i vårt gynnsamma läge anses vara den frekventa användningen av fenoximetylpenicillin som förstahandsprepatat för många infektioner, inom såväl medicin som odontologi, istället för mer mikrobiologiskt bredspektriga preparat. Även i Norden visar dock epidemiologin över tid oroande tendenser med ökande andel antibiotikaresistenta infektions-isolat hos en del bakteriearter (11 - 13).
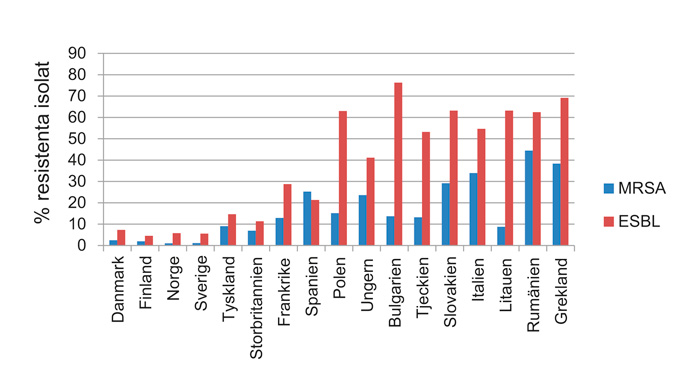
Figur 2. Andelen MRSA respektive ESBL-producerande Klebsiella pneumoniae hos kliniska bakterieisolat från olika Europeiska länder år 2017 (10).
Tandläkare duktiga, men kan bli bättre
Antibiotikaförskrivningen i tandvården i de Nordiska länderna utgör mellan 4,6 - 6 % av den totala antibiotikaförbrukningen i primärvården (11, 12). Detta är bra siffror globalt sett. Internationellt har det uppskattats att tandvården står för mellan 7 - 11 % av antibiotikaförskrivningen (14). Samtliga Nordiska länder har rekommendationer för antibiotikaförskrivning, som speciellt riktar sig mot odontologi (15 - 19). I Finland har man på senare år sett en ökning av förskrivningen i tandvården medan man i Danmark, Norge och Sverige sett en reduktion. Trots det så finns det indikationer på att tandvårdens förskrivning av antibiotika kan förbättras. Till exempel noteras, i både Norge och Sverige, oförklarligt stora geografiska skillnader såväl i förskrivningen som avseende antalet recept per 1000 invånare och vid val av preparat. Även en viss ojämn köns- och åldersfördelning ses. En oväntat hög klindamycinförskrivning ses inom tandvården i både Norge och Sverige. I Norge har dessutom tandvårdens förskrivning av bredspektrumpreparat födubblats under perioden 2004 - 2016, medan den minskning av förskrivningen som noterats de senaste åren nästan uteslutande rör fenoximetylpenicillin. Positivt är att fenoximetylpenicillin trots allt är det preparat som dominerar inom odontologin i alla nordiska länder.
Varför ska vi fortsätta att anstränga oss i Norden?
När en ny typ av antibiotikaresistens uppkommer så är det först en lag-fas, ofta över en relativt lång tidsperiod, som karaktäriseras av att ett fåtal infektioner med bakterien som bär resistensen i fråga och enstaka ofta mindre utbrott av densamma uppstår i sjukhusmiljöer. Under denna fas vet man att åtgärder som restriktiv förskrivning, god vårdhygien och smittspårning är mycket effektiva för att hålla resistensen under kontroll. Vid stringens med dessa åtgärder kan man sannolikt förlänga denna period i det epidemiologiska förloppet. Vid en viss tidpunkt börjar den aktuella resistensen att öka i frekvens och snart är man inne i en snabb, närmast exponentiell, ökning av antalet fall. Väl i denna fas, eller strax innan, börjar också bakterier som bär på den aktuella resistensen att sprida sig i öppenvård och vidare ut i samhället. När en region eller ett land väl kommit in i denna andra fas av smitta är det betydligt svårare att kontrollera och reducera spridningen (figur 3). Norden har det unika läget att förekomsten av resistenstyperna befinner sig i den initiala lag-fasen. Därför har våra ansträngningar extra stor effekt. Det är när situationen är som mest gynnsam, det vill säga i början när det är enstaka utbrott och låga nivåer av bärarskap och resistenta infektioner, som det är lättast att förebygga ökning av den specifika resistensen. Genom restriktiv förskrivning, god vårdhygien och smittspårning kan vi i vår relativt lågendemiska miljö sannolikt påtagligt fördröja resistensutveckling och spridning. Kan vi på det sättet vinna tid, så ökar vi också möjligheten för att ökad kunskap och olika lösningar hinner komma till stånd innan läget är utom kontroll.
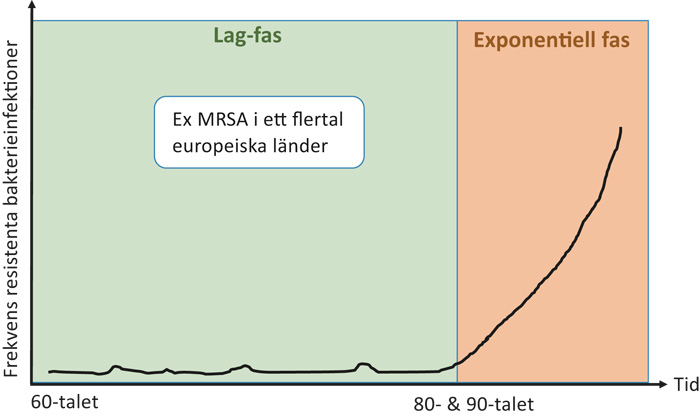
Figur 3. Schematisk illustration över det epidemiologiska förloppet som har kunnat iakttas i omvärlden för flera olika typer av antibiotikaresistens. Här exemplifierats av MRSA som först upptäcktes på 60-talet men som långt senare blev ett uppmärksammat problem.
English summary
Antibiotic resistance - globally, locally, today and tomorrow
Antibiotic resistance is increasing rapidly worldwide and constitutes a substantial threat to the modern health care and patient safety. Resistance driving factors are utilization of antibiotics, hygiene measures in health care, sanitary conditions, the infrastructure of the health care system and environmental factors. The resistance levels in the Nordic countries are uniquely favourable from a global perspective. Through different political initiatives, actions of governmental authorities and WHO, an international collaboration is ongoing between multiple sectors such as health care, industry, animal husbandry and veterinary medicine to counteract and prevent antibiotic resistance. Antibiotic utilization in dentistry in the Nordic countries is low from an international perspective and accounts for approximately 4.6 - 6 % of the antibiotic prescriptions in primary health care. However, there are some indications that the antibiotic usage in dentistry can be further reduced. The possibility to prevent and increase dissemination of antibiotic resistance is most favourable when the prevalence of antibiotic resistance is low, as in the Nordic countries. What we do today will have great implications on tomorrows resistance development.
Lund B, Klinge B, Larsen T, Olsvik Ø, Välimaa H. Antibiotikaresistens - globalt, lokalt, idag och imorgon. Nor Tannlegeforen Tid. 2018;118:886-90. doi:10.56373/2018-11-4
Referenser
The Bacterial Challenge: Time to React. ECDC/EMEA Joint Technical Report 2009.
Pumart P, Phoda V, Thamlikitkul V, Riewpaiboon A, Prakongsai P, Limwattananon S. Health and economic impacts of antimicrobial resistance in Thailand. J Health Serv Res Policy. 2012; 6: 352 - 60.
Cecchini M, Langer J, Slawomirski L. Antimicrobial Resistance in G7 Countries and Beyond: Economic Issues, Policies and Options for Action. OECD, 2015.
Chandy SJ, Naik GS, Balaji V, Jeyaseelan V, Thomas K, Lundborg CS. High cost burden and health consequences of antibiotic resistance: the price to pay. J Infect Dev Ctries. 2014 Sep 12; 8(9): 1096 - 102. doi: 10.3855/jidc.4745.
World Bank. Drug-Resistant Infections: A Threat to Our Economic Future. 2017.
Laxminarayan R, Duse A, Wattal C, Zaidi AK, Wertheim HF, Sumpradit N, Vlieghe E, Hara GL, Gould IM, Goossens H, Greko C, So AD, Bigdeli M, Tomson G, Woodhouse W, Ombaka E, Peralta AQ, Qamar FN, Mir F, Kariuki S, Bhutta ZA, Coates A, Bergstrom R, Wright GD, Brown ED, Cars O. Antibiotic resistance-the need for global solutions. Lancet Infect Dis. 2013; (12): 1057 - 98. doi: 10.1016/S1473 - 3099(13)70318 - 9. Epub 2013 Nov 17.
Antibacterial agents in clinical development: an analysis of the antibacterial clinical development pipeline, including tuberculosis. Geneva: World Health Organization; 2017 (WHO/EMP/IAU/2017.12). Licence: CC BY-NC-SA 3.9 IGO.
Factsheet: Alternatives to antibiotics. www.reactgroup.org.
Larsson DG, de Pedro C, Paxeus N. (2007). Effluent from drug manufactures contains extremely high levels of pharmaceuticals. J Hazard Mater, 30; 148(3): 751 - 5.
European Centre for Disease Prevention and Control. Surveillance Atlas of Infectious Diseases. https://atlas.ecdc.europa.eu/public/index.aspx
Swedres-Svarm 2017. Consumption of antibiotics and occurrence of resistance in Sweden. Solna/Uppsala. ISSN: 1650 - 6332.
NORM/NORM-VET 2016. Usage of Antimicrobial Agents and Occurrence of Antimicrobial Resistance in Norway. Tromsø/Oslo 2017. ISSN: 1502 - 2307 (print)/1890 - 9965 (electronic).
Jalava J, Räisänen K (toim.) Bakteerien mikrobilääkeresistenssi Suomessa, Finres 2016. Terveyden ja hyvinvoinnin laitos. Työpaperi 42/2017. http: //urn.fi/URN: ISBN: 978 - 952 - 302 - 958 - 3
Johnson TM, Hawkes J. (2014). Awareness of antibiotic prescription and resistance in primary dental care. Prim Dent J. 2014 Nov; 3(4): 44 - 7. doi: 10.1308/205016814813877324.
Indikationer för antibiotikaprofylax i tandvården - ny rekommendation. (2012). Information från Läkemedelsverket, 23(5): 22 - 35.
Rekommendationer för antibiotikabehandling i tandvården. (2014). Information från Läkemedelsverket, 25(1): 19 - 30.
National klinisk retningslinje for brug af antibiotika ved tandlægebehandling. (2016). Sundhetsstyrelsen. ISBN: 978 - 87 - 7104 - 786 - 8.
Antibiotikasenteret for primærmedisin. Antibiotikabruk i primærhelsetjenesten. Tannhelse. http://www.antibiotikaiallmennpraksis.no
Antimicrobials in acute dentistry. Current Care Guidelines. Working group set up by the Finnish Medical Society Duodecim and the Finnish Dental Society Apollonia. Helsinki: The Finnish Medical Society Duodecim, 2017 (referred 12.11.2018). Available online at: www.kaypahoito.fi
Korresponderende forfatter: Bodil Lund, Institutt for klinisk odontologi, Årstadveien 19, 5009 Bergen, Norge. E-post: Bodil.lund@uib.no
Artikkelen har gjennomgått ekstern faglig vurdering.
Lund B, Klinge B, Larsen T, Olsvik Ø, Välimaa H. Antibiotikaresistens - globalt, lokalt, idag och imorgon. Nor Tannlegeforen Tid. 2018; 128: 886-90
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Lund B, Klinge B, Larsen T, Olsvik Ø, Välimaa H. Antibiotikaresistens - globalt, lokalt, idag och imorgon. Nor Tannlegeforen Tid. 2018;118:886-90. doi:10.56373/2018-11-4