Det orale mikrobiom - en opdatering for tandplejeteamet
Gennem millioner af år har de mikroorganismer, som lever på vores og andre levende organismers hud- og slimhindeoverflader undergået en såkaldt co-evolution med deres respektive værter. Resultatet af denne parallelle udvikling er, at der er opstået en gensidig afhængighed og et overvejende harmonisk symbiotisk forhold. Nyere forskning gør det klart at vi og vores mikroorganismer (mikrobiom) ikke bør opfattes som separate enheder, men sammen udgør en «superorganisme» eller holobiont, hvor mikrobiomet spiller en væsentlig rolle for vores fysiologi og sundhed. Mundhulen huser det næstmest forskelligartede mikrobielle samfund i kroppen, idet den giver husly til mere end 700 arter af bakterier, der koloniserer tændernes hårde overflader og de orale slimhinder. Muliggjort af de seneste års teknologiske fremskridt, kan man i dag udrede kompleksiteten af det orale mikrobiom, hvilket har givet ny indsigt i mikrobiomets rolle for både sundhed og sygdom. Forstyrrelser af det orale mikrobiom forårsaget af moderne livsstil kan have skadelige konsekvenser for vores generelle og orale sundhed. Ved ubalance (dysbiose) er den fint afstemte ligevægt med det orale økosystem brudt, således at sygdomsfremkaldende bakterier kan manifestere sig og forårsage tilstande såsom caries, gingivitis og parodontitis (periodontitt). For både tandplejeteamet og patienterne er sikringen af et balanceret mikrobiom derfor afgørende for effektivt at opretholde eller genoprette oral sundhed. Målet med denne artikel er at give en opdatering om vores nuværende kendskab til det orale mikrobiom og dets betydning for sundhed og sygdom og at diskutere konsekvenser for moderne tandpleje.
Hovedbudskap | |
|---|---|
· |
Artiklen opsummerer fordelene ved et sundhedsfremmende oralt mikrobiom både for den orale og generelle sundhed. |
· |
Giver en oversigt over betydningen af millioner af års co-evolution mellem mikroorganismer og deres respektive værter, som har ført til gensidig tilpasning og funktionel integration. |
· |
Diskuterer nye teknologier til at karakterisere det orale mikrobiom. |
· |
Diskuterer mekanismer bag dysbiose og konsekvenser for caries og parodontitis. |
· |
Vurderer og diskuterer strategier til at bevare et afbalanceret oralt mikrobiom, som er relevante for tandplejeteamet og patienterne. |
Som alle komplekse flercellede eukaryoter er mennesker ikke selvstændige organismer, men biologiske enheder, der foruden vores egne celler omfatter en lang række mikrobielle symbionter og deres genomer (1). Mikroorganismerne i og på vores kroppe danner et funktionelt organ, der er afgørende for vores sundhed og fysiologi (figur 1). Sammen med vores symbiotiske mikrobielle beboere, danner vi en «superorganisme», eller holobiont. Den mikrobielle komponent i den menneskelige holobiont er betydelig, og i det mindste lig med antallet af vores egne celler (2). Vores mikrobielle samfund omtales som vores mikrobiom, et begreb der blev introduceret af Nobelprismodtageren Joshua Lederberg til at betyde «det økologiske samfund af kommensale, symbiotiske og sygdomsfremkaldende mikroorganismer, der bogstaveligt talt deler pladsen i vores krop og længe har været ignoreret som afgørende for vores sundhed og sygdom» (3). Udviklingen af nye genomiske teknologier, herunder såkaldt «next generation» DNA-sekventering og bioinformatiske analysemetoder, har gjort det muligt at studere og forstå det bidrag det menneskelige mikrobiom yder til vores sundhed. Forskningsinitiativer indenfor det sidste årti, såsom Human Microbiome Project (4) og Metagenomics of the Human Intestinal Tract (MetaHIT) (5), har genereret ressourcer og ekspertise, der er nødvendige for at karakterisere og forstå det menneskelige mikrobiom. Vores viden vil utvivlsomt vokse yderligere med fremtidige initiativer som det nyligt annoncerede National Microbiome Initiative, et partnerskab mellem amerikanske myndigheder, den akademiske verden, velgørende organisationer og den private sektor, som tilsammen har afsat mere end 3,5 milliarder kroner til at støtte denne forskning (6).
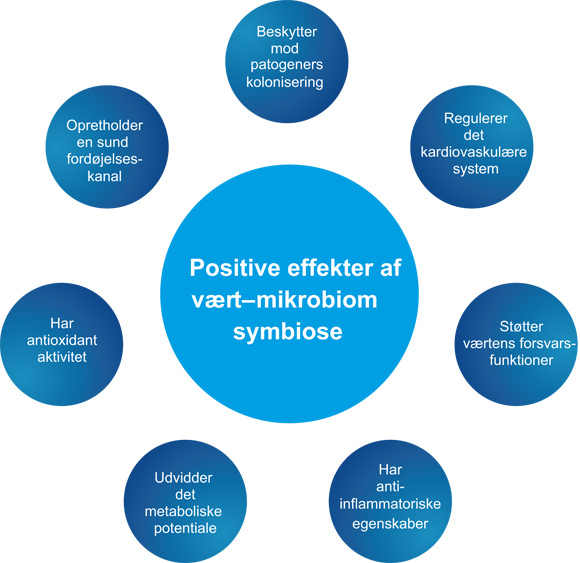
Figur 1. Positive effekter af værts-mikrobiom symbiose.
Vi har lært, at koloniseringen af vores overflader ikke er tilfældig, men udviser stor specificitet som et resultat af millioner af års gensidige tilpasning og funktionelle integration. Samtidigt er forholdet dynamisk og påvirket af mange aspekter af moderne livsstil, såsom kost, rygning og stress. Sådanne eksterne faktorer kan ændre vores mikrobiom og dets egenskaber, og fremkalde en tilstand, hvor det ellers fintunede økosystem ikke længere er i balance. For at løse afledte problemer og opretholde en harmonisk tilstand, der bevarer sundheden og forebygger sygdom, må vi ikke fokusere på værten og dens beboere som separate enheder, men i stedet se holobionten som en enhed.
Munden er en af de tættest koloniserede dele af vores krop. Mange forskellige habitater i mundhulen bidrager til det heterogene mikrobielle samfund, som udgør et vigtigt bindeled mellem oral og generel sundhed. Formålet med denne artikel er at opdatere tandplejeteamet om vores nuværende viden om det orale mikrobioms relation til sundhed og sygdom, at gennemgå, hvordan molekylære metoder til mikrobiel karakterisering har øget vores forståelse, og at diskutere mulige konsekvenser for klinisk praksis. Tabel 1 angiver definitioner af centrale begreber, der anvendes i den efterfølgende tekst.
16S ribosomalt RNA (16S rRNA) |
Et RNA-molekyle (ca. 1500 nukleotider), der er en del af mindre subunit af ribosomet i prokaryoter. 16S rRNA har både velbevarede regioner, fælles for alle prokaryoter, og meget variable regioner, som er unikke for de enkelte arter |
Biofilm |
Samfund af mikroorganismer, der er bundet til en overflade eller til hinanden og indlejret i en matrix af ekstracellulære polymere stoffer (20) |
Bioinformatik |
Anvendelsen af ??beregningsmæssige teknikker til at analysere komplekse biologiske data, såsom genetiske koder |
Co-evolution |
Den parallelle udvikling af interagerende arter |
Mikrobiom kortlægning |
Karakterisering af komplekse mikrobielle samfund vh.a. deres 16S rRNA gensekvenser |
Dysbiose |
En tilstand, hvor det normale mikrobioms sammensætning forstyrres, ofte via eksterne påvirkninger såsom livsstilssygdomme eller medicin (7) |
Epigenetik |
Studiet af ændringer i genekspression, som ikke er forårsaget af ændringer i DNA-sekvensen (96) |
Gen amplifikation |
Opformering af kopier af et gen med laboratoriemetoder til forskningsformål, f.eks. så der er nok kopier af et gen til at tillade gen-sekventering |
Gensekventering |
En laboratoriemetode der kortlægger den nøjagtige rækkefølge af nukleotider i et DNA-molekyle, hvilket gør det muligt for forskerne at dechifrere den genetiske information, som findes i et bestemt DNA-segment (f. eks. 16S rRNA-genet) |
Holobiont |
En værtsorganisme og alle medlemmer af den symbiotiske normale microbiota (1) |
Metagenom analyse |
Analyse af hele den genetiske information i en kompleks population, typisk af mikroorganismer i en miljø- eller værtsprøve. Metagenomet består af genomerne af mange individuelle mikroorganismer |
Metatranscriptom analyse |
Analyse af alle de aktive gener og arter i mikrobiomet (99) |
Mikrobiom |
Summen af ??mikroorganismer, deres genetiske information, og det miljø de interagerer i (7) |
Mikrobiota |
Alle levende mikroorganismer som udgør mikrobiomet (7) |
Next-generation sequencing (NGS) |
En samlebetegnelse for en række forskellige moderne «high throughput» sekventerings- teknologier, som ikke kræver forudgående kloning |
«Operational taxonomic unit» (OTU) |
Grupperingen af ??bakterielle 16S rRNA gensekvenser på basis af deres lighed. Sekvenserne grupperes typisk på basis af en indbyrdes identitet på mellem 97 % og 99 % |
Fænotype |
De observerbare fysiske karakteristika hos en organisme, f.eks. udseende, opførsel eller kliniske præsentation |
Fylogeniske studier |
Undersøgelsen af ??de evolutionære relationer blandt grupper af organismer |
Fylotype |
En samling bakterier defineret ved deres placering i et fylogenetisk træ på basis af f.eks. 16S rRNA-gensekvenser |
Species |
Sammenhængende og distinkt gruppe af bakterier, der er blevet isoleret, dyrket og navngivet |
Symbiose |
To eller flere arter, der lever tæt sammen i et længerevarende forhold til fordel for alle parter(1) |
Vores nuværende forståelse af den biologiske udvikling af mikrobiomet
Der er beviser for, at hjemmehørende mikrober har varetaget metaboliske funktioner hos dyr i mindst 500 millioner år (7). Co-evolution er dokumenteret ved de mange ligheder i sammensætning og organisation af mikrobiomet hos mennesker og andre pattedyr (8). Den evolutionære historie bag forholdet mellem mikroorganismer og mennesker er skitseret i figur 2. Hos mennesker har den fortsatte co-evolution også resulteret i mindre, men vigtige forskelle mellem etniske grupper (9 - 12). Det genetiske materiale i mikrober har fulgt os på vores udvandring fra oprindelsen for den menneskelige race i Afrika og har sammen med humane markører, været brugt til at spore menneskets migrationsruter på jorden (11). Som et eksempel kan detaljerede undersøgelse af stammer af Helicobacter pylori tillade os at skelne mere præcist mellem befolkningsgrupper end en sammenligning af menneskelige genetiske markører (11).
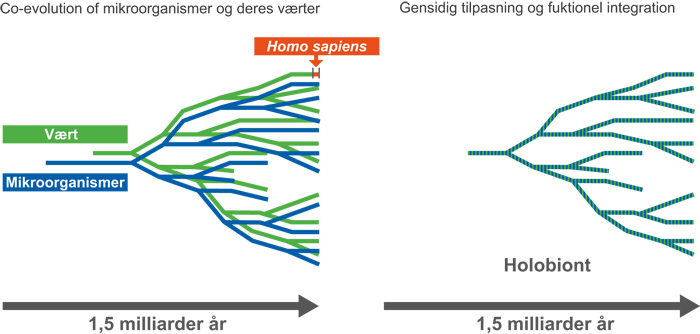
Figur 2. Relationen mellem mikroorganismer og mennesket i historisk perspektiv: Co-evolutionen mellem mikroorganismer (blå linjer) og deres respektive værter (grønne linjer) over en periode på 1,5 milliarder år har resulteret i gensidig tilpasning og funktionel integration som gælder de fleste af de mikroorganismer, som koloniserer vores krops overflader. Selvom mennesket er relativt nyt i denne evolutionære sammenhæng (Homo sapiens, rød linje), er vores forhold til mikroorganismerne et resultat af hele periodens co-evolution.
Gennem menneskets evolution har vores miljø påvirket sammensætningen af vores mikrobiom, i særlig grad i den neolitiske periode, i forbindelse med den industrielle revolution og i moderne tid (13). Brugen af ild, indførelse af landbrug, øget adgang til forarbejdede fødevarer, herunder raffineret sukker, i forbindelse med den industrielle revolution, og udviklingen af antimikrobiel terapi, har med stor sandsynlighed haft en afgørende effekt på sammensætningen af det humane mikrobiom (13).
Ændringer af det orale mikrobiom over tid
En undersøgelse af mikrobielt DNA i tandsten indsamlet fra kranier, som stammer fra tidspunktet omkring overgangen fra jæger-samler samfund til landbrugssamfund og fra den industrielle revolution, har vist en forskydning i sammensætningen af orale bakterier og en reduceret mikrobiel diversitet omkring hvert af disse evolutionære højdepunkter (14). Det er dog rimeligt at påpege, at der er begrænsninger ved mikrobiom undersøgelser baseret på flere tusind år gamle prøver sammenlignet med levedygtige mikrober i moderne prøver (15), og resultaterne skal derfor fortolkes med forsigtighed. Udbredelsen af raffineret sukker som en del af vores kost medførte en genetisk tilpasning af stofskiftet i visse orale bakterier til de nye forhold. For eksempel har Streptococcus mutans været i stand til at konkurrere med andre orale bakteriearter ved at udvikle et forsvar mod øget oxidativt stress og det sure miljø, som er et biprodukt af bakteriens egen nye, effektive kulhydratmetabolisme (16). Denne tilpasning førte til en øget forekomst i mundhulen sammen med andre syre-tolerante arter. Hertil kommer at mennesker, siden den industrielle revolution, er blevet hyppigere udsat for stoffer som tungmetaller, desinfektionsmidler, biocider og antibiotika, der har potentiale til at udrydde eller svække mange mikroorganismer og samtidigt positivt selektere dem, der er resistente overfor de enkelte stoffer (13). Den ændrede orale hygiejnepraksis i slutningen af det 19. århundrede i den industrialiserede verden, primært foranlediget af udgivelsen af Willoughby Millers bog «Microorganisms of the Human Mouth» i 1890, gav en verdensomspændende fremme af tandbørstning og generel oral hygiejne (17). Dette har sandsynligvis også været en vigtig faktor, som har bidraget til ændringer i det orale mikrobioms sammensætning (18). Den moderne overdrevne indtagelse af syrlige drikkevarer og raffineret sukker eller cigaretrygning har yderligere påvirket det orale økosystem (14) i en retning der fører til orale sygdomme som caries, gingivitis og parodontitis.
Det humane mikrobiom er et komplekst økologisk samfund
Vi ved nu, at de mikroorganismer (mikrobiota), der udgør det menneskelige mikrobiom, ikke bare består af encellede organismer, der lever ved siden af hinanden. I stedet danner de stærkt regulerede, strukturelt og funktionelt organiserede fællesskaber knyttet til overflader som biofilm (19), med samarbejder og modsætninger, som bidrager til økologisk stabilitet. Bakterierne i en biofilm kan kommunikere med hinanden ved at producere, detektere og reagere på små diffunderbare signalmolekyler i en proces kaldet «quorum-sensing», som giver reguleret værtskolonisering, biofilm dannelse, forsvar mod konkurrenter og tilpasning til ændringer i miljøet (19). Quorum-sensing aktiviteter i biofilm er også involveret i virulens og det patogene potentiale hos bakterierne, og er derfor en vigtig faktor til at forstå og kontrollere bakterielle infektioner (19), da de øger biofilm-mikroorganismernes tolerance over for værtens forsvar og for antimikrobielle stoffer (20).
Det humane mikrobiom bidrager til afgørende metaboliske, fysiologiske og immunologiske funktioner, inklusive:
differentiering og modning af værtens slimhinder og det tilknyttede immunsystem
fordøjelse og ernæring
energiproduktion
metabolisk regulering og kontrol af fedtoplagring
behandling og afgiftning af miljømæssige kemikalier
vedligeholdelse af hudens og slimhindernes barrierefunktion
udvikling og regulering af immunsystemet og finjustering af dets reaktionsmønster, dvs. balancen mellem pro-inflammatoriske og anti-inflammatoriske processer
forebyggelse af invasion og vækst af sygdomsfremkaldende mikroorganismer (koloniseringsresistens)(21 - 24).
Forstyrrelser i funktion og sammensætning af mikrobiomet kan have betydelige konsekvenser for menneskers sundhed (7).
Sammensætningen af vores mikrobiom viser store forskelle mellem forskellige nicher i kroppen, og store variationer både indenfor og mellem forskellige individer (25). Det er blevet foreslået, at sammensætningen af en persons mikrobiom i tarmen, på huden og i andre dele af organismen kan anvendes som et specifikt mikrobielt «fingeraftryk» (26). Den genetiske variation hos individet er den dominerende kilde til variation i sammensætningen af mikrobiomet. Enæggede tvillinger deler flere ligheder mellem deres tarm-mikrobiom end med deres forældre eller andre søskende (27). Men på trods af variationer i sammensætningen af mikrobiomet mellem individer, er det vigtigt at bemærke, at de overordnede funktionelle egenskaber er relativt stabile (13).
Forskellige steder på kroppen understøtter distinkte mikrobielle samfund på grund af forskelle i de fremherskende biologiske og fysiske egenskaber i det enkelte habitat (25). Kuczynski et al. har demonstreret høj specificitet for de enkelte steder i kroppen (28) Ved hjælp af kun 10 tilfældigt udvalgte sekvenser fra et mikrobiom datasæt, kunne de således kende forskel på de forskellige steder i kroppen, hvorfra prøverne stammede (28). De mest forskelligartede bakterielle populationer er fundet i mavetarmkanalen og i mundhulen (29).
Særlige overvejelser vedrørende det orale mikrobiom
Mundhulen udgør langt fra et homogent miljø hvad angår mikrobiomet, men byder på et stort antal forskelligartede levesteder for mikrobiel kolonisering, såsom tænderne, gingivale pocher, fastbundne gingiva, tungeryggen, kindslimhinder, læber samt den hårde og bløde gane (30). Disse orale levesteder danner et meget heterogent økologisk system, der understøtter væksten af signifikant forskellige mikrobielle samfund (31). Det varme og fugtige miljø i munden er ideelt for vækst af mange mikroorganismer, som foruden værtens kostindtag bliver tilbudt værtsafledte næringsstoffer, såsom spytproteiner, glykoproteiner og gingivalvæske (32). Tænderne er de eneste naturlige overflader i den menneskelige krop, som ikke konstant udskiftes, hvilket giver unikke muligheder for omfattende biofilmdannelse, og dermed en sikker basis for mikrobiel persistens (33). Dentale restaureringer, kroner og broer, implantater og aftagelige proteser udgør yderligere ikke-deskvamerende overflader, der kan påvirke biofilmdannelse og -sammensætning (34 - 36).
Til dato er mere end 700 bakteriearter blevet påvist i mundhuleprøver. Mange af disse kan ikke påvises ved almindelige dyrkningsmetoder (37). Ca. 54 % er navngivne arter, 14 % er unavngivne (men tidligere dyrkede), og 32 % er kun kendt gennem DNA-analysemetoderne, men har aldrig været dyrket (37). Hos det enkelte individ er antallet af bakteriearter dog færre. En detaljeret undersøgelse af ni orale steder hos 26 forsøgspersoner ved hjælp af DNA-sekventering afslørede i gennemsnit 296 bakterier på artsniveau hos hvert individ, mens i alt 557 blev fundet hos de 26 forsøgspersoner (upublicerede data Dr. Floyd Dewhirst, personlig kommunikation).
Erhvervelse af det normale orale mikrobiom
Under fødslen overfører moderen mikroorganismer til barnet og fødselsvejen. Vaginal fødsel eller fødsel via kejsersnit er derfor afgørende for den type mikroorganismer, som et barn initialt bliver eksponeret for (38). Fødselsmetoden påvirker også mangfoldigheden (diversiteten) i det orale mikrobiom senere i et barns liv. Vaginalt fødte børn har således et højere antal arter tre måneder efter fødslen sammenlignet med børn født ved kejsersnit (39). Kosten efter fødslen har også en effekt, idet tre måneder gamle ammede børn viser en højere kolonisering med orale lactobaciller end børn fodret med mælkeerstatning (40). Frembruddet af tænder udgør nye overflader, som kan koloniseres, og er en betydningsfuld økologisk begivenhed i munden på et barn (41). I 3-års alderen har det orale mikrobiom allerede udviklet betydelig kompleksitet, hvilket fortsætter med stigende alder (42). Udskiftning af de primære tænder med et voksent tandsæt ændrer igen det orale mikrobielle miljø væsentligt (31).
Opretholdelse af et sundt oralt mikrobiom
Når det først er etableret, vedligeholdes det orale mikrobiom af værts- og mikrobe-afledte faktorer, der involverer processer, som stadig ikke er fuldt belyste. Bakterier, som indgår i det normale mikrobiom, har både pro- og anti-inflammatoriske aktiviteter, der er afgørende for at opretholde en ligevægt (homeostase) i stærkt koloniserede områder af kroppen såsom mundhulen (43). På grund af immunsystemets samspil med de mikrobielle symbionter i mikrobiomet, er akutte infektioner i mundslimhinden sjældne, trods den tætte mikrobielle kolonisering (44). Betydningen af disse værtmikrobe-interaktioner fremgår tydeligt af observationer hos immunsupprimerede patienter, som kan opleve livstruende virus- og svampeinfektioner i slimhinderne, orale infektioner med ikke-orale arter og systemiske infektioner med normale orale bakterier (45 - 47).
Både spyt og gingivalvæske bidrager med næringsstoffer til den mikrobielle vækst og indeholder komponenter med antimikrobielle aktiviteter (32,48,49). Spyttets betydning for at opretholde oral sundhed er velunderbygget (32). Ud over at lette tygning, synkning (svelging) og tale, og at hjælpe fordøjelsen, indeholder spyt vitale enzymer og proteiner, der hjælper til at opretholde et afbalanceret mikrobiom. Der er blevet påvist op til 108 forskellige arter af mikroorganismer per milliliter spyt, hovedsagelig bakterier afstødt fra slimhindeoverflader, ikke mindst på tungen (50).Foruden at være den primære næringskilde for orale mikroorganismer er spytkomponenter afgørende for udviklingen af et velbalanceret mikrobiom. Et stort antal spytproteiner, herunder sekretorisk immunglobulin A (S-IgA), lactoferrin, lactoperoxidase, lysozym, statherin og histatiner, regulerer direkte og indirekte mikrobiomet og holder det i balance (32). F.eks katalyserer lactoperoxidase produktionen af hypothiocyanit og hydrogenperoxid - et produkt af bakteriel metabolisme, og thiocyanat udskilt med spyttet. Hypothiocyanit udøver direkte antimikrobielle virkninger ved at hæmme den bakterielle glykolyse (51). Andre spytkomponenter med antimikrobielt potentiale er nitrit, udviklet fra kostens nitrater af orale bakterier. Nitrit reduceres yderligere til nitrogenoxid, der kan hæmme væksten af kariogene bakterier og således kan bidrage til beskyttelse mod caries (52).
Proteiner, herunder enzymer, lipider og andre komponenter (kulhydrater, nukleinsyrer), hovedsagelig fra spyt, men også afledt af gingivalvæske, mundslimhinden og bakterier, danner den erhvervede pellikel, som modulerer bindingen af bakterier til tand- og epiteloverflader og beskytter tandoverflader mod syrepåvirkning (53). Enzymer, der hjælper til at regulere balancen i mikrobiomet immobiliseres i den erhvervede pellikel i en aktiv konformation (54). De individuelt sammensatte erhvervede pellikler understøtter bakteriel adhærence til de ikke-deskvamerende tandflader via forskellige specifikke interaktioner. Spyt bidrager ikke kun til at opretholde et miljø, der tillader biofilm at udvikle sig, men modulerer også lagene i biofilmen ved hjælp af talrige proteiner, herunder enzymer, glykoproteiner og mineraler, som kontrollerer biofilmens opbygning og aktiviteter (32,55). Plak-biofilmen løsnes også ved bevægelser af muskler i kinderne og tungen under tale og tygning og ved strømmen af spyt.
Kortlægning af det orale mikrobiom
En række konventionelle metoder er tidligere blevet anvendt til at analysere sammensætningen af det orale mikrobiom, herunder mikroskopi, dyrkningsbaseret analyse, enzymatiske assays og immunassays (56 - 58). Figur 3 giver et overblik over, hvordan mikrobiologiske metoder har udviklet sig gennem årene. Men mange orale bakterier er kræsne og langsomt voksende, kræver komplekse vækstmedier, har specifikke atmosfæriske krav og lange inkubationstider. Mange orale bakterier er strengt anaerobe, og forudsætter omhyggelig prøvetagning, transport og inkubation for at forhindre eksponering til ilt. En dækkende analyse af prøver baseret på dyrkning er vanskelig og kan kun udføres på et mindre antal prøver. Selektive bakteriologiske medier har vist sig nyttige ved studiet af bestemte arter, men har ofte medført en skævvridning af vores forståelse af mikrobiel ætiologi til orale sygdomme, ved at tillægge betydning til arter, der tilfældigvis trives under sådanne dyrkningsbetingelser, mens andre forbliver upåagtede.
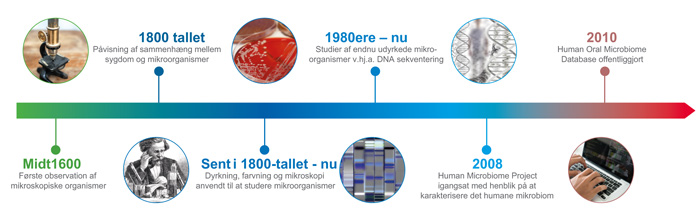
Figur 3. Udviklingen af mikrobiologiske metoder gennem tiden.
Udviklingen af dyrknings-uafhængige metoder har forbedret påvisning af mikroorganismer, inklusive mange arter, som endnu ikke kan dyrkes i laboratoriet (57). Den mest almindelige dyrknings-uafhængig teknik til at analysere komplekse mikrobiomer på, er baseret på 16S ribosomalt RNA (16S rRNA) genet (57). Genet findes i alle prokaryoter og indeholder variable regioner, der er unikke for de enkelte arter og derfor kan anvendes som et middel til identifikation. 16S rRNA-generne i en kompleks prøve kan opformeres ud fra ekstraheret DNA ved hjælp af PCR teknik og sekventeres for derefter at sammenligne de forskellige sekvenser med databaser såsom Human Oral Microbiome Database (37), en ressource som er frit tilgængelige via internettet, og forbinder sekvensdata med fænotypisk, fylogenetiske, kliniske og bibliografiske oplysninger om mikroorganismer, som er fundet i mundhulen. Hvis homologe sekvenser findes i databasen, kan mikroorganismen identificeres, og hvis der ikke er matchende sekvenser i databasen, kan sekvensen tilføjes som information om en hidtil ukendt fylotype.
Den traditionelle metode til 16S rRNA-gensekventering var dyr, besværlig og tidskrævende. Fremkomsten af såkaldte «new generation sequencing» (NGS)-metoder såsom 454 pyro-sekventering (som allerede er under udfasning) og Illumina MiSeq har banet vejen for en massivt øget kapacitet, med op til 27 millioner sekvenser genereret i en enkelt kørsel (sammenlignet med et par hundrede med den traditionelle metode). En mere detaljeret beskrivelse af NGS fremgår af figur 4. Enkelhed og relativt overkommelige NGS har ført til en enorm generering af data og en eksplosion i publikationer, med afledte udfordringer for analyse og fortolkning af data. Det kræver stor omhu at gennemføre NGS undersøgelser bl.a. for at undgå forurening af de kliniske prøver med bakterielt DNA, som kan være til stede i nogle kommercielle kits, laboratoriereagenser og prøve-indsamlingsværktøjer, hvilket kan påvirke resultatet af en undersøgelse betydeligt (59,60). Trods disse forbehold, er NGS et nyttigt værktøj, der giver mulighed for stort anlagte studier af det genetiske materiale i komplekse prøver, og har i høj grad øget vores viden om og forståelse af det orale mikrobiom.
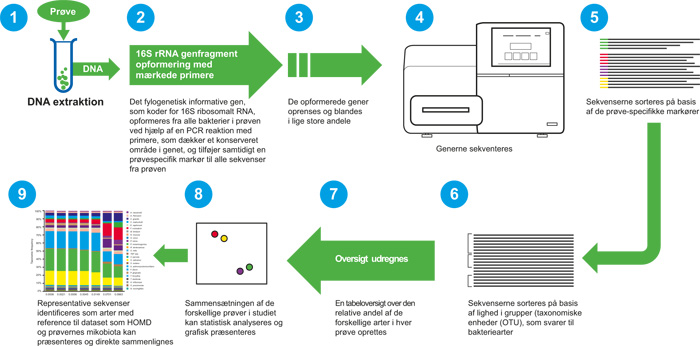
Figur 4. Resumé af proceduren ved kortlægning af mikrobiomer ved hjælp af «next-generation sequencing»
Andre moderne tilgange omfatter såkaldt «metagenomics» og «metatranscriptomics». Mens metagenomics giver indsigt i den hele den genetiske sammensætning (dvs. alle gener) af mikrobielle samfund i en prøve, tillader metatranscriptomics analyser forskerne at studere aktivt udtrykte gener og dermed ændringer i relation til relevante forhold, f.eks. aktiv sygdom (61). Begge metoder er til dato stadig hæmmet af tekniske udfordringer, men vil i fremtiden give gode muligheder for at fremme vores viden om detaljerne i hele det orale mikrobioms genetiske indhold og potentiale og dets metaboliske aktiviteter.
Dyrknings-uafhængige metoder har givet stor indsigt i mangfoldigheden i kroppens mikrobiom, men har ikke overflødiggjort undersøgelser baseret på dyrkning på laboratoriemedier. I øjeblikket er op til en tredjedel af arterne i den orale mikrobiom kun kendt via deres 16S rRNA-gensekvens (62), og der er en aktuel søgen efter metoder til at isolere nogle af de i øjeblikket «ikke-dyrkbare» mikroorganismer (62). Der er gjort fremskridt på dette område, og en ny fremgangsmåde med anvendelse af siderophorer (små, jern-kelaterende forbindelser med høj affinitet, som udskilles af mikroorganismer, såsom bakterier, svampe og af græsser) er blevet udviklet til at lette isoleringen og dyrkningen af hidtil ukendte bakterier (62). Nogle bakterier er afhængige af «hjælpe-stammer» for at kunne dyrkes in vitro, på grund af deres afhængighed af gensidig kommunikation og ernæringsmæssige og/eller signalerings-interaktioner med andre bakterier i de biofilmsamfund, hvor de normalt findes sammen (62).
Anvendelsen af sådanne nye dyrkningsmetoder, sammen med nye molekylærbiologiske og bioinformatiske metoder og øget regnekraft, vil ikke kun udvide vores forståelse af det orale mikrobiom, men vil også hjælpe os med at udtænke interventionsstrategier for at bevare sundhed og undgå sygdom i fremtiden.
Et oralt mikrobiom i ubalance kan være ødelæggende for den generelle sundhed
Det orale mikrobiom bidrager til både den orale og generelle sundhed (figur 1), og tab af det kan have negative effekter hos den enkelte. Et eksempel på dette er virkningen af nitrat-reduktase-udtrykkende orale bakterier, som har vist sig at katalysere omdannelsen af nitrat i kosten til nitrit. I spyt bliver nitrit yderligere omdannet til nitrogenoxid, som foruden antimikrobiel aktivitet har potente vasodilaterende effekter, som spiller en afgørende rolle for opretholdelse af sundhed i hjerte-kar systemet (63). Nitrit stimulerer også mucin-produktionen i mavesækken (64). En beskeden indtagelse af nitrat har vist sig at føre til en reduktion af blodtrykket, hæmning af trombocytfunktionen og nedsat endotel dysfunktion (65). En nylig undersøgelse har vist, at vedvarende indtagelse af nitrater i kosten fremmer den vaskulære funktion hos patienter med hyperkolesterolæmi, hvilket er fundet associeret med en selektion af bakterier i det orale mikrobiom, der er i stand til at reducere nitrit (66). Selvom kostens nitrater er i stand til at øge nitritdannelse, er det også sådan, at nitrogenoxid i væv kan interagere med superoxidradikaler frigivet af immunceller til dannelse af peroxynitrit anioner, som antages at have skadelige effekter på celler, bl.a. ved at forårsage DNA skader (67). Selvom der stadig er en vis uenighed omkring virkningerne af nitrat/nitrit /nitrogenoxid på helbredet, har flere mindre undersøgelser vist, at brugen af klorhexidin-holdige mundskyllevæsker kan reducere koncentrationen af nitrit i både spyt og plasma og føre til en lille stigning i blodtrykket (68 - 70). Disse resultater er interessante, men det er vigtigt at understrege, at der er behov for større undersøgelser som kan bekræfte disse fund, før der kan drages sikre konklusioner.
Dysbiose - det orale mikrobiom ved sygdom
Den komplekse ligevægt mellem medlemmer af mundhulens mikrobiom er afgørende for om en sund tilstand (symbiose) kan opretholdes eller om en tilstand forbundet med sygdom (dysbiose) udvikler sig. Et dysbiotisk mikrobiom er kendetegnet ved, at der er sket forstyrrelser i mangfoldigheden og de relative andele af de forskellige mikroorganismer (7). Samtidigt med at sammensætningen af de mikrobielle samfund i en sund mund er bemærkelsesværdigt stabile efter at mikrobiomet er modnet i barndommen, er forholdet mellem det orale mikrobiom og værten også dynamisk og biologiske ændringer i en persons liv kan påvirke balancen mellem arterne (71). Det gælder fysiologiske ændringer såsom alder, hormonelle forandringer i puberteten og under graviditet, som raske personer oftest kan tilpasse sig uden skader på den orale sundhed (72). På andre tidspunkter, kan det fint afstemte økosystem i munden bliver forstyrret, hvilket medfører en dysbiotisk ændring og et tab af gensidig balance eller mangfoldighed i biofilmen (73), med overvækst af en enkelt eller flere arter resulterende i en øget risiko for sygdom. Faktorer, der kan medføre oral dysbiose omfatter spytkirtel-dysfunktion (dvs. ændringer i spyttets flowhastighed og/eller spyttets sammensætning), insufficient mundhygiejne, gingivitis og livsstilsfaktorer som f.eks. kostvaner og tobaksrygning (74,75). Figur 5a giver en oversigt over faktorer, der kan føre til dysbiose.

Figur 5. A: Årsager til dysbiose. B: En model for dysbiose (adapteret fra Marsh (80)): Ved sundhed har størstedelen af bakterierne et symbiotisk forhold til værten. For enkelhedens skyld er disse mikroorganismer vist i grønt. Potentielt kariogene eller parodontitis-patogene bakterier (vist i rød med stiplede linjer) findes på sunde steder på lave niveauer, der ikke er klinisk relevant; de kan også erhverves fra tætte partnere (transmission), men igen vil deres niveauer være ekstremt lave i forhold til de bakterier, der er forbundet med sundhed. Ved sygdom er der en stigning i antallet og andelen af kariogene eller parodontitis-patogene bakterier, og der kan være en øget biomasse (især ved gingivitis). For at dette kan ske, er hypotesen at der skal være en ændring i lokale miljøforhold (stort økologisk pres), som ændrer konkurrenceevnen hos bakterier i biofilmen og selekterer de arter, der er bedst tilpasset til de nye omgivelser. For at opnå en effektiv og konsekvent sygdomsforebyggelse er det afgørende at de faktorer, der styrer denne selektion, skal erkendes og påvirkes.
Det er nu almindelig anerkendt, at bakteriearter, som historisk er blevet betragtet som orale «patogener», også kan findes i mundhulen i lavt antal ved sundhed, og at oral sygdom opstår som følge af en uhensigtsmæssig ændring i den naturlige balance i mikrobiomet snarere end som følge af udefra kommende «infektion» (71). Ved dysbiose kan disse sygdomsassocierede bakterier udgøre markant større andele end under sunde forhold, hvor de normalt er mere begrænsede og uskadelige komponenter i biofilm (71).
Ændringer i mønsteret af biofilmdannelse kan resultere i dysbiotiske mikromiljøer i de mange forskellige habitater i munden. Specielt de ikke-deskvamerende tandoverflader (inkl. fordybninger, fissurer, approksimalflader og rodoverflader) muliggør akkumulering af mikroorganismer og dannelse af biofilm, især ved insufficient mundhygiejne (76).
Dysbiose som årsag til caries and parodontitis
Gennem tiderne er der blevet fremsat forskellige teorier om forholdet mellem plak og udvikling af tandsygdomme (77). Den «non-specifikke plak-hypotese» har sin oprindelse i det 19. århundrede, men blev yderligere forfinet i løbet af de efterfølgende hundrede år. Oprindeligt var hypotesen, at dentale infektioner var forårsaget af en uspecifik overvækst af alle bakterier i plak. Ydermere var antagelsen, at parodontitis med fæstetab var resultatet af subgingival kolonisering, begunstiget af økologiske ændringer i forbindelse med akkumulering af plak, gingivitis og gingivalt eksudat. Disse ændringer øger antallet af mikroorganismer og ændrer deres relative andele. Dog findes ingen enkelt art, der ikke også er almindeligt til stede på inaktive steder, på aktive steder (78). Da det blev antaget, at enhver tandplak havde potentiale til at forårsage sygdom, blev det konkluderet, at uspecifik mekanisk fjernelse af så meget plak som muligt, for eksempel ved tandbørstning og/eller interdental rengøring, ville være den bedste måde at forebygge sygdom (77).
Forbedring af de laboratoriemæssige metoder muliggjorde efterhånden isolering og karakterising af flere bakteriearter Påvisning af «smitsom» caries i rotteeksperimenter med caries- associerede arter, såsom streptokokker, førte til den «specifikke plak-hypotese», som foreslog, at nogle få arter i det orale mikrobiom var involveret i sygdomsprocessen, og at målrettet eliminering af disse arter med antibiotika kunne helbrede eller forebygge sygdom (oprindeligt caries og senere parodontitis) (77,79). Resultaterne af velkontrollerede kliniske undersøgelser med anvendelse af antibiotika til behandling af såvel caries og parodontitis har imidlertid været skuffende med hensyn til applicering i daglig praksis og omfanget af langsigtede kliniske fordele (77). Disse resultater kan muligvis forklares ved at en stor del af mikroorganismerne ikke kan dyrkes i laboratoriet, og den bias der kan være introduceret ved udelukkende isolering af dyrkbare mikroorganismer.
Efter en fornyet interesse for den non-specifikke plak-hypotese i 1980'erne (78), blev en økologisk plak hypotese foreslået til at forklare sammenhængen mellem det orale mikrobiom, værtsrelaterede miljøfaktorer og orale sygdomme (figur 5b) (80). Væsentlige ændringer i det lokale miljø kan ændre konkurrenceevnen hos de enkelte plak-bakterier, førerende til berigelse af bakterier, der passer bedst til det nye miljø (80). Denne hypotese introducerer det koncept, at sygdomme kan forebygges ikke kun ved direkte at hæmme de formodede «patogener», men også ved at påvirke de miljøfaktorer, som fører til selektering og berigelse af disse bakterier (80). Ved for eksempel caries vil et øget sukkerindtag eller en reduktion i spytsekretionshastigheden resultere i en plak-biofilm, der er udsat for mere regelmæssige og længere perioder med lave pH-niveauer. Dette favoriserer væksten af aciduriske og syretolerante mikroorganismer, på bekostning af bakterier, der trives ved neutrale betingelser eller ligefrem bidrager til pH neutralisering (71,81,82). En moderne model for værts-mikrobe interaktioner i patogenesen for caries er vist i figur 6.
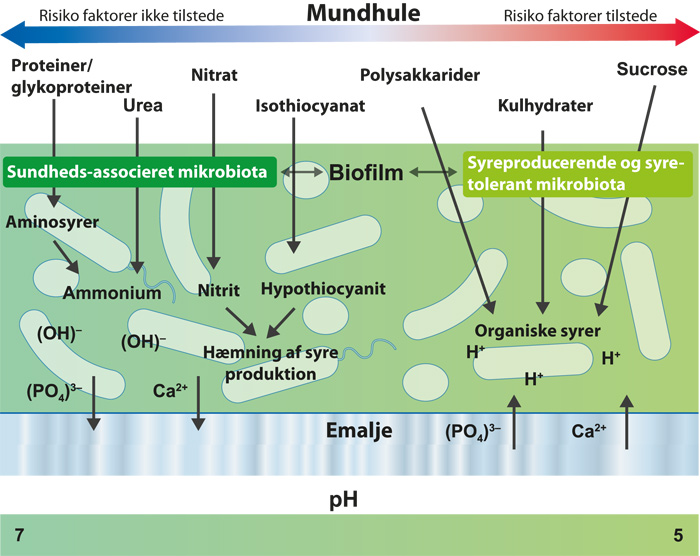
Figur 6. En moderne model for vært-mikrobe interaktioner i patogenesen ved caries (adapteret fra de Soet & Zaura og Takahashi) (51,100). Ved caries fermenteres kulhydrater til organiske syrer (f.eks. mælkesyre), som sænker det lokale pH resulterende i netto demineralisering af tandoverfladen. Dette selekterer effektive syre-producerende og syre-tolerante bakterier (dysbiose). I modsætning hertil er der ved sundhed et mere komplekst og afbalanceret mønster af metabolisme, der inkluderer katabolisme af spytproteiner og glykoproteiner og frigørelse af alkali, der neutraliserer en given syreproduktion. Biofilmen gennemgår multiple pH-cyklusser i løbet af dagen, hvilket resulterer i de- og remineralisering af emalje (vist ved ion afgivelse og tilstrømning ind i emaljen i diagrammet). Hvis fluorid-ioner er til stede i biofilmen, vil F- blive optaget i de overfladiske lag af emaljen under remineraliseringsfasen og dermed bremse demineraliseringen i forbindelse med syreangreb. Kun når der er for mange risikofaktorer (f.eks. ikke tilstrækkelig tid til pH-neutralisering grundet for hyppige mellemmåltider, biofilmen undermættet med fluor, calcium og fosfat, eller lavt spyt flow), vil demineralisering opveje remineralisering og resultere i et netto mineralunderskud og i sidste ende emaljelæsioner.
Den økologiske plak-hypotese blev yderligere forfinet af antagelsen om, at visse mikrobielle patogener, som udgør en begrænset del af mikrobiomet, kan forårsage inflammatorisk sygdom ved at gribe ind i værtens immunmekanismer og dermed inducere en reorganisering af mikrobiomet, som fører til gingivitis og parodontitis (83).
Figur 7 viser en opdateret model for værts-mikrobe interaktioner ved patogenesen af gingivitis og parodontitis (84). Akkumulering af mikroorganismer/biofilm udløser gingivitis. Imidlertid er tilstedeværelsen af biofilm alene ikke tilstrækkeligt til at føre til parodontitis. Det er nu anerkendt, at komplekse vekselvirkninger mellem mediatorer fra immunresponset og biofilmen er nødvendige forudsætninger for sygdomsprogressionen fra gingivitis til parodontitis (84). Et dysbiotisk mikrobielt miljø undergraver værtens respons, så de fleste vævsskader skyldes et uhensigtsmæssigt og ukontrolleret niveau af inflammation (84 - 86). Lokal inflammation som følge af akkumulering af biofilm forårsager en øget strøm af den næringsrige gingivalvæske og potentielt blødning, hvorved miljøet bliver proteinrigt og iltfattigt, hvilket begunstiger væksten af anaerobe bakterier (71). De inflammatoriske forandringer i de parodontale væv giver ideelle muligheder for vækst af obligat anaerobe og protein-afhængige bakterier i de gingivale pocher, hvilket medfører en ændring fra et symbiotisk mikrobiom til dysbiose (71). Inflammations-inducerede mikro-sårdannelser i det poscheepitelet resulterer i lækage af blod (og dermed jern) til pochen. Dette skaber gunstige betingelser for vækst af parodontitis-associerede arter såsom Porphyromonas gingivalis og Aggregatibacter actinomycetemcomitans (87,88). Det dysbiotiske mikrobiom inducerer nedbrydning af de parodontale væv via et dysreguleret værts-inflammatorisk immunrespons, som igen giver nye vævsnedbrydningsafledte næringsstoffer til bakterierne 89). Gennem evolutionen har bakterier lært at drage fordel af næringsstoffer genereret gennem inflammation, og dermed yderligere fremme dysbiose og vævsødelæggelse, hvilket skaber en selvforstærkende patogen cyklus (89).
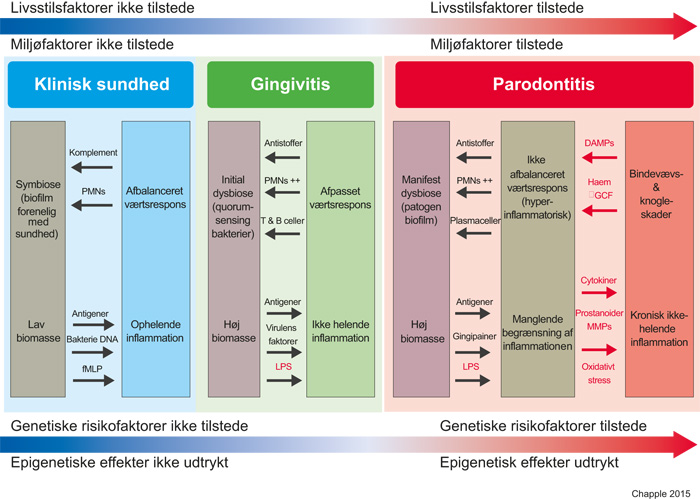
Figur 7. En model for parodontitispatogenese (modificeret efter Meyle & Chapple) (83), som er en videreudvikling af den klassiske model foreslået af Page og Kornman (101). Klinisk sundhed omfattter milde inflammatoriske forandringer, der er forenelige med opretholdelse en normal «sundhedsfremmende» parodontal mikrobiota. Forholdet er symbiotisk og værten lever harmonisk med sine mikroorganismer. Men hvis biofilmen får lov til at akkumulere og ikke regelmæssigt forstyrres/ fjernes, kan der ske en selektion af visse patogene bakterier og en «begyndende dysbiose» udvikler sig. For eksempel kræver Porphyromonas gingivalis jern fra hæm og kan mere effektivt manifestere sig og bidrage til dysbiose fordi lokal inflammation øger tilgængeligt jern via gingival blødning. Ved gingivitis forbliver værtens respons forholdsvist begrænset, men på grund af modningen af biofilmen, bliver inflammationen ikke, som normalt, tidsbegrænset men får kronisk karakter, hvilket yderligere understøtter dysbiosen. Afhængigt af forskellige genetiske, miljømæssige og livsstilsrelaterede risikofaktorer, vil tilstanden hos nogle modtagelige patienter videreudvikle sig til parodontitis. Sidstnævnte er drevet af uforholdsmæssige og overdrevne inflammatoriske immunreaktioner hos værten, der både forårsager de fleste af vævsskadene og samtidigt baner vejen for en manifest dysbiotisk tilstand og mislykket opløsning af den kroniske destruktive inflammation. En ond cirkel, som fastholder uligevægten udvikler sig, men en symbiotisk tilstand kan genoprettes ved regelmæssige og grundige biofilm forstyrrelser for at eliminere inflammationen. DAMP (damage-associated molecular pattern) - skade-associeret molekylært mønster; fMLP - f-Met-Leu-Phe; GCF - gingivalvæske; Gingipainer - proteaser frigjort fra P. gingivalis, som nedbryder centrale elementer af den fysiologiske inflammationsreaktion; LPS - lipopolysakkarid; MMP - matrixmetalloprotease; PMN - neutrofil polymorfkernet leukocyt; Prostanoider - en underklasse af eicosanoider bestående af prostaglandiner (mediatorer af inflammatoriske og anafylaktiske reaktioner), thromboxaner (mediatorer af vasokonstriktion), og prostacykliner (aktive i helingsfasen af inflammation).
Graden, hvormed ophobning af plak fremmer parodontitis, varierer mellem individer efter deres risikoprofil (84). Hos patienter der ikke er disponerede for parodontitis, er det inflammatoriske respons ved gingivitis afpasset og selv-reguleret, men hos disponerede patienter kan flere genetiske, epigenetiske eller patient-relaterede livsstilsfaktorer (tobak, alkohol, kost, dysreguleret diabetes, stress, etc.) udløse en overdrevet, men ineffektiv og kronisk, ukontrolleret inflammation i tændernes støttevæv (84).
Selvom det i dag er veletableret at bestemte mikrobielle samfund udvikles ved sygdom, er det endnu ikke klarlagt, om man kan tale om en «sund mængde» af disse bakterier, som gælder alle individer (90) eller om dette varierer mellem individer på grund af forskellige tærskler for aktivering og/eller dysregulering af værtens respons.
Systemiske konsekvenser af oral dysbiosis
Den beskrevne co-evolution til en harmonisk sameksistens er kun gældende så længe mikroorganismerne forbliver i deres naturlige habitat og er ikke spredes til andre dele af kroppen, hvor de kan forårsage sygdom. Dysbiose ved parodontitis kan være en direkte årsag til bakteriæmi ved at lette den systemiske spredning af orale bakterier (91). En optimal mundhygiejne er derfor afgørende for at begrænse det samlede bakterielle angreb )91,92). Sammenhængen mellem orale patogener og systemiske virkninger er blevet dokumenteret ved en nylig undersøgelse i dyr, der påviste en direkte effekt af peroral dosering af P. gingivalis på sammensætningen af tarmens mikrobiom samt inflammatoriske forandringer i forskellige væv og organer (93). Orale bakterier antages at spille en rolle i en række systemiske sygdomme, herunder kardiovaskulær sygdom, reumatoid arthritis, negative graviditetsudfald, slagtilfælde, inflammatorisk tarmsygdom og kolorektal cancer, pneumoni, meningitis eller hjerneabscesser, lunge-, lever- eller miltabscesser, blindtarmsbetændelse, lungebetændelse og diabetes (30,58,92,94 - 96).
Det er velkendt, at omfattende parodontitis negativt kan påvirke den glykæmiske kontrol hos diabetes patienter og glykæmi hos personer, der ikke har diabetes (94). Alvorlig parodontitis udgør en øget risiko for udvikling af type 2-diabetes, og der er en direkte og dosisafhængig sammenhæng mellem sværhedsgraden af parodontitis og diabetiske komplikationer (94). Der er dog behov for mere forskning for at afgøre, om den parodontale mikrobiota har nogen direkte virkning på diabetes.
Analyse af det orale mikrobiom kan være et nyttigt redskab til at diagnosticere systemiske sygdomme, der har parodontale manifestationer. God mundhygiejne til at styre den samlede mikrobielle belastning er vigtigt for at forhindre spredning til andre steder i organismen (92).
Holobiont begrebet- nuværende og fremtidige implikationer for klinisk praksis
Det komplekse samfund, som det orale mikrobiom udgør, er fintunet gennem millioner af års evolution til harmoniske sameksistens og til at beskytte mod sygdom. Det er af stor betydning for stabiliteten i denne sameksistens at mikrobiomet bevarer sin naturlige mangfoldighed. Moderne livsstil kan imidlertid forstyrre og forrykke den naturlige balance i vores orale mikrobiom, og vores kliniske mål bør være at genskabe den symbiotisk ligevægt med de midler, der er nødvendige og hensigtsmæssige hos den enkelte patient. I denne sammenhæng er det afgørende, at både patienter og sundhedspersonale forstår betydningen af et afbalanceret oralt mikrobiom og dets betydning for oral og systemisk sundhed. Behandlingssessioner bør omfatte forebyggelsesstrategier, såsom råd om mundhygiejne praksis, kost og rygning. Som et første tiltag, bør aktiv bevarelse af sundhed snarere end behandling af sygdom være det primære mål for behandlere og patienter. Sundhedspersonalet kan opnå dette ved at informere patienterne om betydningen af passende livsstilsvalg og effektiv mund hygiejne, der bevarer det orale mikrobiom på et niveau, der er foreneligt med oral sundhed. Denne fremgangsmåde giver mulighed for at de gavnlige egenskaber ved mikrobiomet opretholdes, mens risikoen for tandsygdomme fra overdreven plak-akkumulering reduceres. Hvis der indtræder dysbiose, skal behandlingens mål være at genetablere den tabte harmonisk balance ved at sikre en god mundhygiejne og ved at modificere livsstilsfaktorer som kost og rygning. Vilkårlig brug af antibiotika til behandling af orale sygdomme bør undgås, med henblik på at beskytte det gavnlige orale mikrobiom og for at undgå antibiotikaresistens. Med henblik på kontrol af caries, ud over brugen af fluor, bør der træffes foranstaltninger, der tilskynder et skift væk fra et surt miljø, gennem reduktion i mængden og hyppigheden af forbruget af sukker og syrlige drikke (også selvom sidstnævnte er sukkerfri) eventuelt kombineret med indtag af protein, som kan føre til frigivelse af base. Med hensyn til parodontitis, bør behandlingsstrategier tilstræbe mekanisk reduktion af akkumuleret biofilm ved mekanisk fjernelse af plak til et niveau, der er forenelige med oral sundhed. Dette vil reducere inflammation og det afledte flow af gingivalvæske, og fremme et gunstigt mikromiljø til støtte for dannelsen af et afbalanceret mikrobiom. Hvor det er relevant, bør patienterne også rådgives om rygestop og kontrol af diabetes. En undersøgelse har for nylig vist, at sammensætningen af det subgingivale mikrobiom ved baseline, snarere end brugen af antibiotika, kan forudsige de langsigtede kliniske resultater ved behandling af kronisk parodontitis (97).
Vores nuværende forståelse af dette hastigt udviklende videnskabelige felt understøtter forestillingen om, at klinisk praksis har brug for at skifte fra det historiske fokus på håndtering af caries og parodontitis ved eliminering af mikrobiomet, til et nyt fokus på proaktiv styring af oral sundhed gennem en økologisk tilgang til holobionten. Fremtidige potentielle udviklinger kan omfatte individuel vurdering af mikrobiomet og værtens respons til tidlig påvisning af faktorer der medfører høj risiko, og personlige tilgange til efter dysbiose at genoprette et oralt mikrobiom, der er foreneligt med sundhed - en potentielt forjættende udvikling, der ville have direkte konsekvenser for patientbehandlingen i klinisk praksis.
English summary
The oral microbiome - an update for oral healthcare professionals
For millions of years, our resident microbes have co-evolved and co-existed with us in a mostly harmonious symbiotic relationship. We are not distinct entities from our microbiome, but together we form a "superorganism» or holobiont, with the microbiome playing a significant role in our physiology and health. The mouth houses the second most diverse microbial community in the body, harbouring over 700 species of bacteria that colonize the hard surfaces of teeth and the soft tissues of the oral mucosa. Through recent advances in technology, we have started to unravel the complexities of the oral microbiome and gained new insights into its role during both health and disease. Perturbations of the oral microbiome through modern-day lifestyles can have detrimental consequences for our general and oral health. In dysbiosis, the finely tuned equilibrium of the oral ecosystem is disrupted, allowing disease-promoting bacteria to manifest and cause conditions such as caries, gingivitis and periodontitis. For practitioners and patients alike, promoting a balanced microbiome is therefore important to effectively maintain or restore oral health. This article aims to give an update on our current knowledge of the oral microbiome in health and disease and to discuss implications for modern-day oral healthcare.
Kilian M, Chapple IL, Hannig M, Marsh PD, Meuric V, Lynge Pedersen AM, Tonetti MS, Wade WG, Zaura E. Det orale mikrobiom - en opdatering for tandplejeteamet. Nor Tannlegeforen Tid. 2017;127:398-411. doi:10.56373/2017-5-4
Referencer
Bordenstein SR, Theis KR. Host biology in light of the microbiome: ten principles of holobionts and hologenomes. PLoS Biol 2015; 13: e1002226.
Sender R, Fuchs S, Milo R. Are we really vastly outnumbered? Revisiting the ratio of bacterial to host cells in humans. Cell 2016; 164: 337 - 40.
Lederberg J. 'Ome sweet 'omics-a genealogical treasury of words. The Scientist 2001; 15: 8 - 10.
Turnbaugh PJ, Ley RE, Hamady M, et al. The human microbiome project. Nature 2007; 449: 804 - 10.
MetaHIT Consortium (Metagenomics of the Human Intestinal Tract consortium). 2016. Tilgængelig fra: http: //www.sanger.ac.uk/resources/downloads/bacteria/metahit/.
The White House Office of Science and Technology Policy. Fact sheet: Announcing the National Microbiome Initiative. 2016. Tilgængelig fra: https: //www.whitehouse.gov/sites/whitehouse.gov/files/documents/OSTP %20National %20Microbiome %20Initiative %20Fact %20Sheet.pdf.
Cho I, Blaser MJ. The human microbiome: at the interface of health and disease. Nat Rev Genet 2012; 13: 260 - 70.
Blaser MJ. Who are we? Indigenous microbes and the ecology of human diseases. EMBO Rep 2006; 7: 956 - 60.
Haubek D, Ennibi OK, Poulsen K, et al. Risk of aggressive periodontitis in adolescent carriers of the JP2 clone of Aggregatibacter (Actinobacillus) actinomycetemcomitans in Morocco: a prospective longitudinal cohort study. Lancet 2008; 371: 237 - 42.
Ravel J, Gajer P, Abdo Z, et al. Vaginal microbiome of reproductive-age women. Proc Natl Acad Sci U S A 2011; 108 Suppl 1: 4680 - 7.
Rinaldi A. Tiny travel companions. As microorganisms have accompanied mankind's journeys around the globe, they could help scientists to unravel our past. EMBO Rep 2007; 8: 121 - 5.
Rylev M, Kilian M. Prevalence and distribution of principal periodontal pathogens worldwide. J Clin Periodontol 2008; 35: 346 - 61.
Gillings MR, Paulsen IT, Tetu SG. Ecology and evolution of the human microbiota: fire, farming and antibiotics. Genes (Basel) 2015; 6: 841 - 57.
Adler CJ, Dobney K, Weyrich LS, et al. Sequencing ancient calcified dental plaque shows changes in oral microbiota with dietary shifts of the Neolithic and Industrial revolutions. Nat Genet 2013; 45: 450 - 5.
Costalonga M, Herzberg MC. The oral microbiome and the immunobiology of periodontal disease and caries. Immunol Lett 2014; 162: 22 - 38.
Cornejo OE, Lefebure T, Bitar PD, et al. Evolutionary and population genomics of the cavity causing bacteria Streptococcus mutans. Mol Biol Evol 2013; 30: 881 - 93.
American Dental Association. History of dentistry timeline. 2016. Tilgængelig fra: http: //www.ada.org/en/about-the-ada/ada-history-and-presidents-of-the-ada/ada-history-of-dentistry-timeline.
Marsh PD. Controlling the oral biofilm with antimicrobials. J Dent 2010; 38 Suppl 1: S11-S15.
Li YH, Tian X. Quorum sensing and bacterial social interactions in biofilms. Sensors (Basel) 2012; 12: 2519 - 38.
Donlan RM, Costerton JW. Biofilms: survival mechanisms of clinically relevant microorganisms. Clin Microbiol Rev 2002; 15: 167 - 93.
Donohoe DR, Garge N, Zhang X, et al. The microbiome and butyrate regulate energy metabolism and autophagy in the mammalian colon. Cell Metab 2011; 13: 517 - 26.
Krajmalnik-Brown R, Ilhan ZE, Kang DW, DiBaise JK. Effects of gut microbes on nutrient absorption and energy regulation. Nutr Clin Pract 2012; 27: 201 - 14.
Relman DA. The human microbiome: ecosystem resilience and health. Nutr Rev 2012; 70 Suppl 1: S2-S9.
Relman DA. The human microbiome and the future practice of medicine. JAMA 2015; 314: 1127 - 8.
Costello EK, Lauber CL, Hamady M, et al. Bacterial community variation in human body habitats across space and time. Science 2009; 326: 1694 - 7.
Franzosa EA, Huang K, Meadow JF, et al. Identifying personal microbiomes using metagenomic codes. Proc Natl Acad Sci U S A 2015; 112: E2930 - 8.
Turnbaugh PJ, Hamady M, Yatsunenko T, et al. A core gut microbiome in obese and lean twins. Nature 2009; 457: 480 - 4.
Kuczynski J, Costello EK, Nemergut DR, et al. Direct sequencing of the human microbiome readily reveals community differences. Genome Biol 2010; 11: 210.
Human Microbiome Project Consortium. A framework for human microbiome research. Nature 2012; 486: 215 - 21.
Dewhirst FE, Chen T, Izard J, et al. The human oral microbiome. J Bacteriol 2010; 192: 5002 - 5017.
Xu X, He J, Xue J, et al. Oral cavity contains distinct niches with dynamic microbial communities. Environ Microbiol 2015; 17: 699 - 710.
van 't Hof W, Veerman EC, Nieuw Amerongen AV, Ligtenberg AJ. Antimicrobial defense systems in saliva. Monogr Oral Sci; 2014; 24: 40 - 51.
Marsh PD, Devine DA. How is the development of dental biofilms influenced by the host? J Clin Periodontol 2011; 38 Suppl 11: 28 - 35.
Busscher HJ, Rinastiti M, Siswomihardjo W, van der Mei HC. Biofilm formation on dental restorative and implant materials. J Dent Res 2010; 89: 657 - 65.
Hannig C, Hannig M. The oral cavity--a key system to understand substratum-dependent bioadhesion on solid surfaces in man. Clin Oral Investig 2009; 13: 123 - 39.
Øilo M, Bakken V. Biofilm and dental biomaterials. Materials 2015; 8: 2887 - 900.
Human Oral Microbiome Database (HOMD). 2016. Tilgængelig på: http: //www.homd.org/. Accessed April 2016.
Dominguez-Bello MG, Costello EK, Contreras M, et al. Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns. Proc Natl Acad Sci U S A 2010; 107: 11971 - 5.
Lif HP, Harnevik L, Hernell O, et al. Mode of birth delivery affects oral microbiota in infants. J Dent Res 2011; 90: 1183 - 8.
Holgerson PL, Vestman NR, Claesson R, et al. Oral microbial profile discriminates breast-fed from formula-fed infants. J Pediatr Gastroenterol Nutr 2013; 56: 127 - 36.
Sampaio-Maia B, Monteiro-Silva F. Acquisition and maturation of oral microbiome throughout childhood: An update. Dent Res J (Isfahan ) 2014; 11: 291 - 301.
Crielaard W, Zaura E, Schuller AA, et al. Exploring the oral microbiota of children at various developmental stages of their dentition in the relation to their oral health. BMC Med Genomics 2011; 4: 22.
Devine DA, Marsh PD, Meade J. Modulation of host responses by oral commensal bacteria. J Oral Microbiol 2015; 7: 26941.
Zaura E, Nicu EA, Krom BP, Keijser BJ. Acquiring and maintaining a normal oral microbiome: current perspective. Front Cell Infect Microbiol 2014; 4: 85.
Petti S, Polimeni A, Berloco PB, Scully C. Orofacial diseases in solid organ and hematopoietic stem cell transplant recipients. Oral Dis 2013; 19: 18 - 36.
Soga Y, Maeda Y, Ishimaru F, et al. Bacterial substitution of coagulase-negative staphylococci for streptococci on the oral mucosa after hematopoietic cell transplantation. Support Care Cancer 2011; 19: 995 - 1000.
Diaz PI, Hong BY, Frias-Lopez J, et al. Transplantation-associated long-term immunosuppression promotes oral colonization by potentially opportunistic pathogens without impacting other members of the salivary bacteriome. Clin Vaccine Immunol 2013; 20: 920 - 30.
Grant MM, Creese AJ, Barr G, et al. Proteomic analysis of a noninvasive human model of acute inflammation and its resolution: the twenty-one day gingivitis model. J Proteome Res 2010; 9: 4732 - 44.
Barnes VM, Teles R, Trivedi HM, et al. Acceleration of purine degradation by periodontal diseases. J Dent Res 2009; 88: 851 - 5.
Marsh PD, Do T, Beighton D, Devine DA. Influence of saliva on the oral microbiota. Periodontol 2000 2016; 70: 80 - 92.
Takahashi N. Oral Microbiome Metabolism: From «Who Are They?» to «What Are They Doing?». J Dent Res 2015; 94: 1628 - 37.
Doel JJ, Hector MP, Amirtham CV, et al. Protective effect of salivary nitrate and microbial nitrate reductase activity against caries. Eur J Oral Sci 2004; 112: 424 - 8.
Siqueira WL, Custodio W, McDonald EE. New insights into the composition and functions of the acquired enamel pellicle. J Dent Res 2012; 91: 1110 - 8.
Hannig C, Hannig M, Attin T. Enzymes in the acquired enamel pellicle. Eur J Oral Sci 2005; 113: 2 - 13.
Amerongen AV, Veerman EC. Saliva--the defender of the oral cavity. Oral Dis 2002; 8: 12 - 22.
Krishnan K, Chen T, Paster BJ. A practical guide to the oral microbiome and its relation to health and disease. Oral Dis 2016. Tilgængelig fra: http: //dx.doi.org/10.1111/odi.12509
Zarco MF, Vess TJ, Ginsburg GS. The oral microbiome in health and disease and the potential impact on personalized dental medicine. Oral Dis 2012; 18: 109 - 20.
Pedersen AML (Editor). Oral infections and general health: from molecule to chairside, vol.1 Schweiz: Springer International Publishing, 2016.
Salter SJ, Cox MJ, Turek EM, et al. Reagent and laboratory contamination can critically impact sequence-based microbiome analyses. BMC Biol 2014; 12: 87.
van der HJ, Buijs MJ, Laine ML, et al. Sterile paper points as a bacterial DNA-contamination source in microbiome profiles of clinical samples. J Dent 2013; 41: 1297 - 301.
Gilbert JA, Hughes M. Gene expression profiling: metatranscriptomics. Methods Mol Biol 2011; 733: 195 - 205.
Vartoukian SR, Adamowska A, Lawlor M, et al. In vitro cultivation of 'unculturable' oral bacteria, facilitated by community culture and media supplementation with siderophores. PLoS One 2016; 11: e0146926.
Kapil V, Webb AJ, Ahluwalia A. Inorganic nitrate and the cardiovascular system. Heart 2010; 96: 1703 - 9.
Lundberg JO, Gladwin MT, Ahluwalia A, et al. Nitrate and nitrite in biology, nutrition and therapeutics. Nat Chem Biol 2009; 5: 865 - 9.
Lundberg JO, Carlstrom M, Larsen FJ, Weitzberg E. Roles of dietary inorganic nitrate in cardiovascular health and disease. Cardiovasc Res 2011; 89: 525 - 32.
Velmurugan S, Gan JM, Rathod KS, et al. Dietary nitrate improves vascular function in patients with hypercholesterolemia: a randomized, double-blind, placebo-controlled study. Am J Clin Nutr 2016; 103: 25 - 38.
Chapple IL, Matthews JB. The role of reactive oxygen and antioxidant species in periodontal tissue destruction. Periodontol 2000 2007; 43: 160 - 232.
Woessner M, Smoliga JM, Tarzia B, et al. A stepwise reduction in plasma and salivary nitrite with increasing strengths of mouthwash following a dietary nitrate load. Nitric Oxide 2016; 54: 1 - 7.
Kapil V, Haydar SM, Pearl V, et al. Physiological role for nitrate-reducing oral bacteria in blood pressure control. Free Radic Biol Med 2013; 55: 93 - 100.
Govoni M, Jansson EA, Weitzberg E, Lundberg JO. The increase in plasma nitrite after a dietary nitrate load is markedly attenuated by an antibacterial mouthwash. Nitric Oxide 2008; 19: 333 - 7.
Marsh PD, Head DA, Devine DA. Ecological approaches to oral biofilms: control without killing. Caries Res 2015; 49 Suppl 1: 46 - 54.
Zaura E, ten Cate JM. Towards understanding oral health. Caries Res 2015; 49 Suppl 1: 55 - 61.
Gross EL, Leys EJ, Gasparovich SR, et al. Bacterial 16S sequence analysis of severe caries in young permanent teeth. J Clin Microbiol 2010; 48: 4121 - 8.
Marsh PD, Head DA, Devine DA. Prospects of oral disease control in the future - an opinion. J Oral Microbiol 2014; 6: 26176.
Wu J, Peters BA, Dominianni C, et al. Cigarette smoking and the oral microbiome in a large study of American adults. ISME J 2016 ; 10: 2435 - 46.
Marcotte H, Lavoie MC. Oral microbial ecology and the role of salivary immunoglobulin A. Microbiol Mol Biol Rev 1998; 62: 71 - 109.
Rosier BT, De Jager M, Zaura E, Krom BP. Historical and contemporary hypotheses on the development of oral diseases: are we there yet? Front Cell Infect Microbiol 2014; 4: 92.
Theilade E. The non-specific theory in microbial etiology of inflammatory periodontal diseases. J Clin Periodontol 1986; 13: 905 - 11.
Loesche WJ. Clinical and microbiological aspects of chemotherapeutic agents used according to the specific plaque hypothesis. J Dent Res 1979; 58: 2404 - 12.
Marsh PD. Are dental diseases examples of ecological catastrophes? Microbiology 2003; 149: 279 - 294.
Takahashi N1, Nyvad B. The role of bacteria in the caries process: ecological perspectives. J Dent Res. 2011; 90: 294 - 303.
Liu YL, Nascimento M, Burne RA. Progress toward understanding the contribution of alkali generation in dental biofilms to inhibition of dental caries. Int J Oral Sci 2012; 4: 135 - 40.
Hajishengallis G, Darveau RP, Curtis MA. The keystone-pathogen hypothesis. Nat Rev Microbiol. 2012; 10: 717 - 25.
Meyle J, Chapple I. Molecular aspects of the pathogenesis of periodontitis. Periodontol 2000 2015; 69: 7 - 17.
Darveau RP. Periodontitis: a polymicrobial disruption of host homeostasis. Nat Rev Microbiol 2010; 8: 481 - 90.
Williams RC, Jeffcoat MK, Kaplan ML, et al. Flurbiprofen: a potent inhibitor of alveolar bone resorption in beagles. Science 1985; 227: 640 - 2.
Bramanti TE, Holt SC. Roles of porphyrins and host iron transport proteins in regulation of growth of Porphyromonas gingivalis W50. J Bacteriol 1991; 173: 7330 - 9.
Hajishengallis G. Immunomicrobial pathogenesis of periodontitis: keystones, pathobionts, and host response. Trends Immunol 2014; 35: 3 - 11.
Hajishengallis G. The inflammophilic character of the periodontitis-associated microbiota. Mol Oral Microbiol 2014; 29: 248 - 57.
Schwarzberg K, Le R, Bharti B, et al. The personal human oral microbiome obscures the effects of treatment on periodontal disease. PLoS One 2014; 9: e86708.
Forner L, Larsen T, Kilian M, Holmstrup P. Incidence of bacteremia after chewing, tooth brushing and scaling in individuals with periodontal inflammation. J Clin Periodontol 2006; 33: 401 - 7.
Han YW, Wang X. Mobile microbiome: oral bacteria in extra-oral infections and inflammation. J Dent Res 2013; 92: 485 - 91.
Arimatsu K, Yamada H, Miyazawa H, et al. Oral pathobiont induces systemic inflammation and metabolic changes associated with alteration of gut microbiota. Sci Rep 2014; 4: 4828.
Chapple IL, Genco R. Diabetes and periodontal diseases: consensus report of the Joint EFP/AAP Workshop on Periodontitis and Systemic Diseases. J Clin Periodontol 2013; 40 Suppl 14: S106 - 12.
de Pablo P, Chapple IL, Buckley CD, Dietrich T. Periodontitis in systemic rheumatic diseases. Nat Rev Rheumatol 2009; 5: 218 - 24.
Konig MF, Abusleme L, Reinholdt J, et al. Aggregatibacter actinomycetemcomitans-induced hypercitrullination links periodontal infection to autoimmunity in rheumatoid arthritis. Sci Transl Med 2016; 14; 8: 369ra176.
Bizzarro S, Laine ML, Buijs MJ, et al. Microbial profiles at baseline and not the use of antibiotics determine the clinical outcome of the treatment of chronic periodontitis. Sci Rep 2016; 6: 20205.
Slatkin M. Epigenetic inheritance and the missing heritability problem. Genetics 2009; 182: 845 - 50.
Bikel S, Valdez-Lara A, Cornejo-Granados F, et al. Combining metagenomics, metatranscriptomics and viromics to explore novel microbial interactions: towards a systems-level understanding of human microbiome. Comput Struct Biotechnol J 2015; 13: 390 - 401.
de Soet J.J., Zaura E. Caries: een oplosbare ecologische catastrofe? Quality Practice Mondhygiene 2016; 8: 7 - 11.
Page RC, Kornman KS. The pathogenesis of human periodontitis: an introduction. Periodontol 2000 1997; 14: 9 - 11.
Adresse: Mogens Kilian, Biomedicinsk Institut, Health, Aarhus Universitet, Wilhelm Meyers Allé 4, DK-8000, Aarhus C. E-mail: kilian@biomed.au.dk
Artikkelen har gjennomgått ekstern faglig vurdering.
Kilian M, Chapple ILC, Hannig M, Marsh PD, Meuric V, Pedersen AML, et al. Det orale mikrobiom - en opdatering for tandplejeteamet. Nor Tannlegeforen Tid. 2017; 127: 398-411.
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Kilian M, Chapple IL, Hannig M, Marsh PD, Meuric V, Lynge Pedersen AM, Tonetti MS, Wade WG, Zaura E. Det orale mikrobiom - en opdatering for tandplejeteamet. Nor Tannlegeforen Tid. 2017;127:398-411. doi:10.56373/2017-5-4