Endodontiske materialer - skyllemidler, sealere og obturerende materialer
Rodfyldningen afslutter den klassiske triade i endodontisk behandling: biomekanisk (kemomekanisk) instrumentering, desinfektion og obturation. Hensigten med rodfyldningen er at hindre penetration af bakterier ind til rodkanalen (rodkanalsystemet) og at hindre næringstilførsel og opvækst af tilbageværende bakterier. Rodfyldningens funktioner bliver således at udfylde og tætne kanalen og at dræbe eventuelle mikroorganismer. Dette opnås oftest ved brug af et kernemateriale og en sealer. Kernematerialet fungerer som et stempel, der både udfylder tomrummet og får sealeren til at udfylde rodkanalsystemet. Ud over tæt kontakt til dentin vil sealeren også være i kontakt med periapikalt blødtvæv. Dette medfører, at der stilles både materialetekniske og biologiske krav til sealeren. Rodfyldningen afsluttes med en koronal forsegling for at hindre indtrængen af bakterier koronalt fra. En tæt og fuldstændig rodfyldning bedømt røntgenologisk, med efterfølgende adækvat koronal restaurering, er en pålidelig prædiktor for et vellykket resultat. Artiklen omtaler instrumenteringsteknikker, indføring i de almindeligste skyllemidler samt egenskaber ved kernematerialer og sealere.
Hovedbudskap | |
|---|---|
· |
Hensigten med rodfyldningen er at hindre penetration af bakterier ind til rodkanalen samt at hindre næringstilgang og opvækst af tilbageværende bakterier i kanalen. |
· |
Der findes flere forskellige kerne- og sealermaterialer med forskellige kemiske og biologiske egenskaber. |
· |
En tæt og fuldstændig rodfyldning med koronal forsegling og adækvat restaurering er essentiel for en vellykket behandling. |
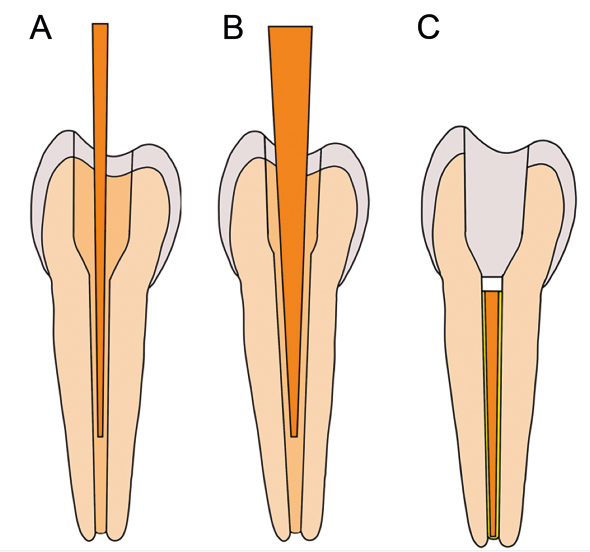
Klassisk manuel instrumentering suppleres med maskinel instrumentering af rodkanalen. Manuelt instrumenteres rodkanalen enten med filing, altså polering fra det apikale til det koronale, eller ved reaming, som er skrabning af dentinen med roterende bevægelse af filen i kanalen. Maskinel instrumentering sker enten ved kontinuerlig rotation eller ved en reciprokerende, frem-og-tilbagebevægelse af filen. Traditionel instrumentering med 2 % stigning og guttaperka tilpasset instrumenteringen sikrer god tilpasning af guttaperkakernen apikalt og minimerer sealermængden. Lateral kondensering længere koronalt skal minimere mængden af sealer; det samme gør varm kondensering af guttaperka. Det er nu almindeligt at anvende en større stigning, typisk 4 %. For instrumenter med samme størrelse ved apex bliver diameteren koronalt meget større end ved 2 %, og dette mindsker behovet for ekstra filing i dette område. I visse tilfælde nærmer man sig den situation, at én point er konform med rodkanalen helt til pulpacavum, og man kan bruge en «single-point»-teknik. Nogle instrumenteringssystemer leder op til en jævn stigning på fx 4 %. Fast stigning har den fordel, at points kan anvendes uafhængigt af instrumentsystemet. Endnu et skridt i retning af optimal præparering kom med såkaldt varierende stigning. Her har instrumenterne varierende (faldende) stigning fra apex til det koronale område. Slutresultatet er en instrumenteret kanal, som har høj stigning i det apikale område, men som ender op med moderat stigning, typisk 4 %, i den koronale del af kanalen. Når stigningen varierer fra apex til det koronale område, passer standardiserede guttaperkapoints ikke til den instrumenterede kanals form, og producenterne leverer guttaperkapoints, som korrelerer med deres instrumenter (figur 1).
Figur 1. Tand A og B viser stiliseret forskel i præparering af rodkanal ved brug af instrumenter med 2 % og 4 % stigning, førstnævntes dimension øges med 0,02 mm/mm, mens sidstnævntes øges med 0,04 mm/mm fra spidsen af filen. I dette tilfælde har kernematerialet en stigning, som er tilpasset stigningen ved præpareringen. Tand C viser en færdig rodfyldt tand, hvor koronal forsegling forstærkes med en prop på 2 - 4 mm af et antibakterielt fyldningsmateriale som IRM (hvid). Denne skal fortrinsvis ligge fra kanalåbningen ned til knogleniveau i direkte kontakt med selve rodfyldningen for at hindre sekundær penetration af bakterier. Med ordet «monoblok» menes en kemisk eller mekanisk binding mellem kernematerialet (orange), sealer (gul) og dentin.
Skyllemidler
I denne oversigtsartikel diskuterer vi kun de almindeligste skyllemidler: natriumhypoklorit (NaOCl), etylendiamintetraeddikesyre (EDTA), klorheksidindiglukonat (CHX) og jod-jodkalium, som anvendes hver for sig og/eller i kombination i forskellige protokoller.
Mekanisk instrumentering alene giver ikke tilstrækkelig reduktion af mikroorganismer til at give en optimal prognose ved apikal parodontitis (1). Den mekaniske rodkanalinstrumentering suppleres derfor med rigelig og grundig tilførsel af forskellige skyllevæsker. Instrumenteringsdelen af rodkanalterapien kaldes derfor en kemomekanisk procedure. Skyllemidler er essentielle for tilfredsstillende rodkanalterapi og opfylder flere vigtige funktioner på grund af deres kemiske og antimikrobielle egenskaber (2). Skyllemidlernes primærfunktion er asepsis i vitale kasus og desinfektion af inficerede rodkanaler.
Rodkanalen må ikke betragtes som et rundt og glat rør, men snarere som et komplekst underjordisk hulesystem med varierende geometrisk tværsnit og sidekanaler. Et rodkanalsystem kan ofte indeholde laterale og accessoriske kanaler (Figur 2), intraradikulære sammenføjninger i form af istmer, udløbere, recesser og utilgængelige apikale yderpunkter med komplicerede deltaer. På grund af denne kompleksitet er store dele af rodkanalsystemet utilgængeligt for rensning med endodontiske instrumenter (3). Et af formålene ved anvendelse af skyllemidler er dermed at nå disse områder bedst muligt for effektivt at opløse og bortspule nekrotisk, inficeret eller vitalt pulpavæv. Dette fordrer brug af applikationsmetoder, som sikrer god adgang apikalt. De forskellige applikationsteknikker og metoder for distribution så vel som aktivering vil ikke blive nærmere beskrevet i denne oversigtsartikel.
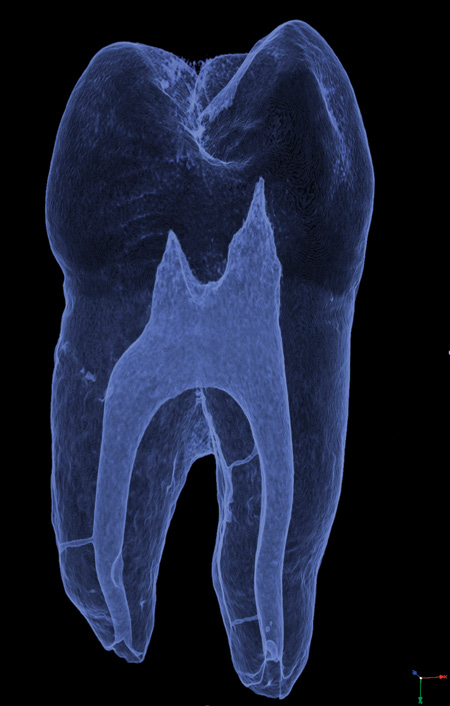
Figur 2. Tredimensional afbildning fra mikro-CT scanning af første permanente præmolar med tre synlige lateralkanaler.
Instrumentering af dentinvæggene i rodkanalsystemet vil danne et såkaldt smearlag (4), som dækker instrumenterede dentinoverflader, og som desuden kan danne propper i dentintubuli (5).
Der findes ingen skyllevæske, som alene indfrier alle de vigtigste egenskaber, man kan ønske sig. Der har været anvendt flere forskellige midler med forskellige protokoller med hensigt på at indfri så mange af de ønskede egenskaber som muligt.
Natriumhypoklorit
NaOCl har været brugt som desinfektionsmiddel i medicinen siden slutningen af 1800-tallet, og inden for endodontien blev det anbefalet som skyllemiddel så tidligt som i 1920 (2). Ud over evnen til at opløse nekrotisk væv har NaOCl en antibakteriel, antifungal og antiviral effekt. Koncentrationen af NaOCl i den opløsning, man benytter ved skylning, har været og er stadig genstand for diskussion, og der foreligger indtil videre ikke konsensus. To kliniske og et in vitro-studie har rapporteret minimal til ingen forskel i antibakteriel effekt af koncentrationer af NaOCl mellem 0,5 % og 5,25 % (6 - 8). Andre in vitro-studier har indikeret forøget antibakteriel effekt og effekt på biofilm ved højere koncentrationer af NaOCl sammenlignet med lavere koncentrationer (9,10). Ud over koncentrationen synes tiden og mængden/volumenet at have betydning (8,11 - 13). Det er rapporteret, at højere koncentrationer, fx 5,25 % NaOCl, opløser væv mere effektivt end lavere koncentrationer (14), og også her synes tiden og mængden/volumenet af opløsningen at have betydning (11). Andre undersøgelser har påvist forøget antimikrobiel og vævsopløsende effekt ved opvarmning af NaOCl-opløsninger. En 1 % opløsning af NaOCl opvarmet til 45°C har vist sig at opløse pulpalt væv lige så effektivt som en 5,25 % NaOCl-opløsning ved 20 °C (13). Koncentrationer af NaOCl på 3 % og 5 % har in vitro vist sig at påvirke dentinens mekaniske egenskaber formentlig gennem opløsning af organisk materiale (15,16); denne virkning sås ikke ved en NaOCl-koncentration på 1 % (15).
På grund af den hurtigt aftagende tilgængelighed på NaOCl over tid anbefales det, at man under instrumentering stadig tilfører nye mængder NaOCl (17). Det anbefales at skylle kun med NaOCl i instrumenteringsfasen.
Det er vist både in vitro og in vivo, at NaOCl er cytotoksisk, og cytotoksiciteten synes at være dosisafhængig (18,19). For at reducere faren for ekstrusion af NaOCl apikalt bør skyllekanylen sidde løst i kanalen, placeres kortere end arbejdslængden og injiceres med forsigtigt tryk. Endvidere bør operatør, medhjælper og patient alle have øjenbeskyttelse.
EDTA
EDTA, som med sin chelerende effekt frigiver Ca2+, blev indført og anbefalet ved endodontisk behandling som et hjælpemiddel i instrumentering af snævre og oblitererede rodkanaler af Nygaard-Østby i 1957 (20). EDTA kan opløse smearlaget og bidrage til at løsne biofilm fra dentinvæggen, hvilket kan øge penetrationen af sealer ind i dentintubuli (2,21 - 23). Den antibakterielle effekt af EDTA anses som marginal. Det har været forsøgt at øge EDTA's evne til at penetrere dentin, reducere overfladespændingen samt øge den antibakterielle effekt ved at tilsætte en kvaternær ammoniumforbindelse (trimetylammoniumbromid) (EDTAC) (24). Med hensyn til koncentration og eksponeringstid anbefales 15 - 17 % EDTA i 1 - 5 minutter (25).
Klorheksidin
Klorheksidin (CHX) er et kationisk molekyle med hydrofile og hydrofobe egenskaber. CHX opløses dårligt i vand og andre opløsningsmidler, og derfor benyttes salte, oftest klorheksidindiglukonat. Det har bred antimikrobiel effekt mod bakterier, svampe, virus med membrankappe og protozoer. CHX har på grund af midlets gode antimikrobielle effekt længe været brugt i odontologien til plakkontrol og som præ- og postoperativt mundskyllemiddel ved oralkirurgiske indgreb. En af CHX's egenskaber er stoffets vedvarende antimikrobielle effekt efter binding og frigivelse fra tandsubstans og slimhinde.
Den antimikrobielle effekt af CHX har in vitro vist sig nogenlunde at svare til 5,25 % NaOCl (26). Dog har en nyere undersøgelse påvist øget antimikrobiel effekt af 6 % NaOCl sammenlignet med 2 % CHX (10). Der er indikationer på, at 2 % CHX som supplement til NaOCl kan reducere mængden af tilbageværende mikroorganismer (27,28).
En ulempe ved CHX er, at det ikke opløser uorganisk materiale og formentlig ikke pulpalt væv (29). Der findes endnu ikke overbevisende kliniske studier, som kan begrunde, at man i praksis anbefaler at erstatte NaOCl med CHX.
Jod - jodkalium
Jod har længe været kendt og benyttet i endodontien som desinfektionsmiddel/antimikrobielt middel. Det benyttes gerne i 2 % jod og 4 % jodkalium til skylning eller som kortvarigt indlæg. Det har været rapporteret in vitro, at jod-jodkalium kombineret med calciumhydroxid har forøget antimikrobiel effekt sammenlignet med calciumhydroxid alene (30,31). En klinisk undersøgelse udført på revisionskasus viste, at brug af 5 % jod-jodkalium i 5 minutter som supplement til instrumentering og skylning med NaOCl reducerede antallet af inficerede tænder fra fem ud af 20 til en ud af 20 (32). En anden undersøgelse sammenlignede residual mikroflora fra tænder med apikal parodontitis behandlet med 5 % jod-jodkalium i 10 minutter som supplement til instrumentering og NaOCl-skylning med indlæg af calciumhydroxid i en uge. Der blev ikke fundet signifikante forskelle mellem de to behandlinger, idet tænder behandlet med 5 % jod-jodkalium og calciumhydroxid-indlæg havde tilbageværende mikroorganismer i henholdsvis 29 % og 36 % af tilfældene (33). Som skyllemiddel er der in vitro rapporteret forøget penetration af jod-jodkalium i dentintubuli og forøget drab af Streptococcus sangunis sammenlignet med 5,25 % NaOCl (34). Sammenlignet med NaOCl har jod-jodkalium begrænset evne til at opløse biofilm og dræbe mikroorganismer i intraoralt inficerede dentinblokke (35).
Interaktioner mellem skyllevæsker
Når man benytter to eller flere medikamenter samtidig, skal man være opmærksom på, at direkte og indirekte interaktioner mellem disse kan forekomme. Der er rapporteret reduceret antibakteriel effekt af NaOCl, når det blandes med EDTA (36). Ved brug af CHX bør dette ikke blandes med hverken NaOCl eller EDTA, da et præcipitat vil dannes (37,38). Ved blanding med NaOCl er påvist dannelse af parakloralanin, som er potentielt kræftfremkaldende (39).
Rodfyldningsmaterialer
Det er fortsat god latin, at rodfyldningens tæthed sikres ved brug af en sealer, som søges presset ud til alle den instrumenterede rodkanals sider og recesser. For at opnå dette må sealeren have passende reologiske egenskaber (flydeegenskaber under påvirkning af tryk, temperatur og tid) og kunne lægge sig ind til kanalvæggene. Den bør endvidere afbinde uden kontraktion, og efter afbinding må den kunne modstå kemisk, biologisk og mikrobiologisk nedbrydning. Det sidste gælder også den eller de points, som indsættes. For at sealeren skal nå ud i alle områder, bruges oftest en kerne af et fast, stabilt og inert stof, i praksis guttaperka eller plast, som virker som et stempel. Anvendelsen af et sådant kernemateriale reducerer også det totale volumen af sealer. Dette anses for gunstigt, fordi sealermaterialet kan være mindre stabilt kemisk, og nogle sealere vil kunne skrumpe ved afbinding (40,41). Kontraktion ved afbinding kan give spalter, som kan tillade indtrængen af mikroorganismer og næringsstoffer langs fyldningen og forårsage periapikal betændelse (42).
Kernematerialer
Guttaperka eksisterer i to krystallinske faser, alfa- og betaguttaperka, hvor betaformen kan omdannes til alfaformen ved tilføring af varme. Konventionelle guttaperkapoints har en matrix af ren betafaseguttaperka på ca. 20 %, ca. 80 % zinkoxid som ganske inert fyldstof og små mængder af blødgøringsmidler, røntgenkontraststoffer og farvestoffer. Denne type suppleres af to varianter. I den ene type er kernen af betaguttaperka omgivet af et lag med alfaguttaperka, som hurtigere bliver blødt under opvarmning, og disse points bruges ved fyldningsteknikker, hvor varme points sættes ned i kanalen under tryk, og periferien af pointen flyder ud og presser sealeren foran sig med formodet bedre udfyldning af pulparummet. Ved den anden variant er guttaperkakernen dækket med et lag af et materiale, som skal bindes kemisk til sealeren. I dette tilfælde er produktvalget bundet af, at sealer og point kan reagere sammen. Dette vil være aktuelt, når man benytter de nye biokeramiske sealere eller ved resinbaserede sealere. Der har været lanceret alternativer til guttaperka. Mest aktuelt er Resilon (Epiphany/RealSeal), et resinbaseret kernemateriale. Det blev markedsført som et bedre kernemateriale end guttaperka. Det bruges ikke meget i dag, sandsynligvis på grund af at materialet kan blive udsat for kemisk eller biologisk nedbrydning (43,44).
Sealere
Det er sealernes egenskaber, som hyppigst bliver vurderet i forhold til rodfyldningens funktion. Fordi der er mange kemiske og biologiske egenskaber ved sealerne, som kan have betydning, er det let at bruge sådanne enkeltegenskaber i markedsføringen af diverse produkter. Ofte er der imidlertid langtfra en målbar egenskab i laboratoriet til dokumenteret effekt i klinikken. Der er også en fare for, at gode resultater for én egenskab skygger for manglende kvaliteter på andre områder.
Siden introduktionen i 1954 har epoxybaserede sealere som AH 26 og AH Plus udviklet sig til at blive et referencemateriale for sealere. Disse er godt dokumenterede fra laboratorietests, dyreforsøg og kliniske studier. De har gradvis erstattet zinkoxid-eugenolbaserede sealere i denne rolle, og før det havde man i Skandinavien sealere med kloroform som reference. Foruden epoxy og zinkoxid-eugenol har sealere baseret på silikone og calciumhydroxid efterhånden fået solid laboratoriemæssig og klinisk dokumentation, helt op til niveauet randomiserede kliniske studier. Der har været rapporteret om manglende fysisk stabilitet og integritet, som har dæmpet den oprindelige entusiasme for metakrylatbaserede rodfyldningsmaterialer. Hovedgrupperne af sealere er omtalt nedenfor, og en oversigt over de mest benyttede produkter og anvendelsesområder samlet i Tabel 1.
Materiale |
Undergruppe |
Eksempel på produkter |
Retrograd, perforation |
Rodfyldning |
Koronal tætning |
Pulpaoverkapning, amputation |
|---|---|---|---|---|---|---|
ZnO-eugenol |
Forstærket |
IRM, EBA |
x |
x |
||
Sealer |
ProcoSol, TubliSeal |
X |
||||
Resiner |
Epoxy |
AH26, AH plus |
x |
|||
metakrylat |
EndoRez, RealSeal |
x |
||||
komposit |
Retroplast; andre, flydende |
x |
||||
Glasionomer |
ActiV GP |
x |
||||
Ca(OH)2 |
Apexit, Sealapex; Dycal |
x |
||||
Silikone |
RoekoSeal, GuttaFlow |
x |
||||
Biokeram |
Ca-Si |
MTA, Biodentine |
x |
(x) |
x |
x |
Ca-Si-P |
Totalfill (Endosequence) |
x |
x |
x |
||
Ca-S |
Gips |
Cavit, Coltosol |
x |
|||
Guttaperka |
Beta |
Generisk (de fleste mærker) |
x |
|||
Alfa |
GuttaFusion, GuttaCore, Herofill |
x |
||||
plast-dækketglasionomer-dækketKeram-dækket |
EndoRezActiV GPTotalfill (Endosequence) |
xxxx |
||||
Resin-spidser |
Resilon |
x |
Zinkoxid-eugenolbaserede sealere: Sealere baseret på zinkoxid-eugenol har været på markedet i lang tid og har derfor god klinisk dokumentation. De forskellige mærker, som er på markedet, varierer med hensyn til type og mængde af tilsætningsstoffer ud over zinkoxid og eugenol. Zinkoxid-eugenolbaserede sealere har vist antibakteriel effekt ved direkte kontakttest (45). Den mængde eugenol, som afgives apikalt fra enrodede tænder in vitro, ser ud til at være lavere end den baktericide og cytotoksiske koncentration (46). Det har været rapporteret, at denne type sealer giver mere periapikal betændelse under heling sammenlignet med en calciumhydroxidbaseret sealer (47). Et klinisk opfølgningsstudie fandt ingen forskel i periapikal status, når en zinkoxid-eugenolbaseret sealer, en zinkoxid-eugenolbaseret med calciumhydroxid og en calciumhydroxidbaseret sealer blev sammenlignet efter fire år. I de tilfælde, hvor den calciumhydroxidbaserede sealer var benyttet, blev der rapporteret lidt bedre periapikal status efter to år sammenlignet med de zinkoxid-eugenolholdige sealere (48).
Resinbaserede sealere: Resiner er defineret som en blanding af monomerer og/eller makromolekyler med andre komponenter/substanser, som sammen danner et materiale med ønskede egenskaber. I denne gruppe finder vi bl.a. epoxy-baserede sealere som AH 26. Der var en vis bekymring for konsekvenserne ved frigivelse af formaldehyd under afbindingen af AH 26. Dette er næsten elimineret ved AH Plus (49,50). AH 26 og AH Plus er tokomponentsealer, som afbinder ved en polyadditionsreaktion. Den antibakterielle effekt af AH 26 og AH Plus er god initialt, men aftager hurtigt efter 24 timer (45).
Til gruppen af resinbaserede sealere hører også de metakrylatbaserede, som kom på markedet i midten af 1970'erne. De består hovedsagelig af en blanding af diverse metakrylatmonomerer, som polymeriserer ved afbinding. Andre tilsætningsstoffer giver ønskede materialeegenskaber. Adhæsion til dentinen er baseret på mikromekanisk retention. Andre sealere som MetaSeal og Real Seal SE har inkorporeret sure monomerer. Disse er tilsat for at ætse dentinen og fremme adhæsion (51). Dette modsvarer de selvætsende adhæsivsystemer, som benyttes ved tandfyldningsmaterialer. Disse sealere skal kunne danne kemisk binding til kernematerialet, så der dannes en såkaldt «monoblok». Forskellige strategier har været benyttet for binding mellem sealer og kernemateriale. Man har forsøgt at påføre metakrylatmonomerer på overfladen af guttaperka; men der er også udviklet særlige kernematerialer: Produktet Resilon har en kerne af polykaprolakton og dimetakrylatholdig resin, som kan binde sig kemisk til sealeren. Den rapporterede antimikrobielle effekt af metakrylatbaserede sealere varierer ved forskellige studier og produkter (45,52).
Calciumhydroxidbaserede sealere: Calciumhydroxidholdige sealere har været på markedet helt siden 1920'erne. Calciumhydroxid er tilsat primært for at stimulere periapikal vævsheling og for antibakteriel effekt. Den antibakterielle effekt tilskrives frigivelse af hydroxyl-ioner og dermed højt pH (53).
Calciumhydroxid er kendt for at stimulere hårdtvævsdannelse i kontakt med pulpalt og andet blødtvæv (54). Der er beskrevet mindre inflammation under heling periapikalt ved brug af calciumhydroxid sammenlignet med epoxy- og eugenolholdige sealere (47,48,55).
Silikonebaserede sealere: De mest kendte produkter med silikonebaserede sealere, RoekoSeal og Guttaflow, er baseret på polyvinylsiloksan. Guttaflow indeholder også små korn af guttaperka. Begge hærder via en additionspolymerisation. Den antimikrobielle effekt af de silikonebaserede sealere RoekoSeal og Guttaflow er meget lille eller helt fraværende. Guttaflow synes at give en tæt fyldning, da den ekspanderer lidt under afbinding (40)
Biokeramiske rodfyldningsmaterialer: Et keram er et uorganisk, ikke-metallisk materiale, som er sintret med varme og derefter nedkølet. Biokeramer er keramer, som antages at være biokompatible. Mineraltrioxid Aggregat (MTA) er et keram, som længe har været benyttet til retrograd fyldning efter rodspidsamputation. Siden introduktionen i 90'erne har det fået solid laboratoriemæssig og klinisk dokumentation, herunder randomiserede, kliniske studier. Anvendelsesområdet er udvidet til at omfatte pulpaoverkapning, reparation af perforationer, og apexificering og apexogenese.
Kemisk er MTA i udgangspunktet calciumsilikater, som reagerer med vand og stivner som almindelig bygningscement. Ligesom bygningscement er det stærkt basisk før afbinding, og den høje pH-værdi anses for gunstig for reaktionen med nærliggende væv. Højt pH giver også antibakteriel effekt; men denne effekt har været lav i in vitro-tests, især efter afbinding (56,57). MTA minder således om calciumhydroxid, som med de samme egenskaber har været et universalmiddel ved behandling af inficerede rodkanaler.
MTA indeholder flere kemiske forbindelser, som komplicerer anvendelsen, og det oprindelige materiale opfattes af mange som praktisk vanskeligt at håndtere og applicere (58 - 60). Indholdet af jern gør massen grå og kan medføre tydelig misfarvning af tænderne. På grund af en kornet og temmelig tør konsistens er materialet heller ikke egnet som sealer. Flere producenter har derfor foretaget ændringer og modifikationer af den oprindelige sammensætning for at forbedre brugervenligheden og udvide anvendelsesområdet.
Hvidt MTA indeholder ikke jern og medfører mindre eller ingen misfarvning af dentinen. Konsistensen er imidlertid ligesom den grå version. Biodentine® indeholder ikke aluminium og har fået en anden konsistens end MTA, hvilket mange ser som en forbedring (61,62). Anvendelsesområdet er i hovedsagen det samme.
En ny udvikling skete med tilsætning af calciumfosfatforbindelser. Det åbner for reaktioner med hårdtvæv, især dentin, med dannelse af hydroxylapatit. Det kan øge biokompatibiliteten samtidig med, at det kan give kemisk adhæsion til dentinen. Forbedringerne af konsistensen fortsætter løbende, og vi har nu fået materialer med sealerkonsistens og i pastaform, fx Endosequence®, nu markedsført som Totalfill®. Disse produkter kan afbinde ved hjælp af den naturlige fugtighed, som findes i rodkanaler og i eksponeret blødtvæv. Den antibakterielle effekt af Totalfill er knyttet til materialets evne til at give højt pH. Det høje pH har i in vitro-studier vist sig at kunne vedligeholdes over syv dage, hvilket medfører, at den antibakterielle effekt også vedvarer (45).
For at opnå binding til kernematerialet med Totalfill (Endosequence) skal det anvendes sammen med guttaperkapoints, som er overfladebehandlet med keramiske mikro- og nanopartikler, så der kan opstå en kemisk binding mellem guttaperka og sealer så vel som mellem sealer og dentin. Dermed opretholdes konceptet om en «monoblok» af fyldningsmasse kemisk forbundet med dentin, det samme koncept, som lå bag Resilon/RealSeal og Endo-REZ.
En sammenligning af egenskaber ved forskellige rodfyldningssealere
Silikone-, calciumhydroxid-, og zinkoxid-eugenolbaserede præparater er godt dokumenterede i laboratoriestudier, dyreforsøg og kliniske undersøgelser. Silikoner danner en intim, men ikke kemisk binding til dentin og guttaperka, og skrumper ikke ved afbinding. De er også bestandige i vandigt medium. Ca(OH)2- og ZnO-eugenolpræparater kan være følsomme for opløsning over tid (63,64). Alle tre typer har imidlertid stået sig godt i kliniske opfølgningsstudier (48,65,66).
De epoxybaserede sealere er hårde og seje, de opløses kun i ringe grad i vævsvæsker (64), og de binder godt til både dentin og guttaperka (67). Det er vist in vitro, at de epoxybaserede sealere AH 26 og AH Plus ekspanderer over tid (68). Epoxy er irriterende før og lige efter blanding (69); men denne virkning aftager, da materialet afbinder. Allergiske reaktioner er rapporteret, men forekommer sjældent. Kliniske studier med flere års opfølgning viser lige så gode kliniske resultater i form af fravær af apikal parodontitis som noget andet præparat (65).
Der er rapporteret bedre prognose ved brug af biokeram (MTA) ved pulpaoverkapning sammenlignet med calciumhydroxid (70,71). Her er årsagerne sandsynligvis biokompatibilitet kombineret med tæthed, bestandighed og antibakterielle egenskaber. Denne forskel kan imidlertid ikke overføres direkte til brugen af biokeramer som sealere. Tæthed, bestandighed og antibakterielle egenskaber kendetegner også mange andre i denne produktkategori. Afbundet epoxy og silikone tolereres også godt af blødtvæv. Gevinsten ved en mulig interaktion mellem biokeramer og vævet med produktion af hydroxylapatit efter rodfyldning af rodlukkede tænder er måske ikke stor, og vi har, naturligt nok, få eller ingen langtidsstudier over brugen af biokeramer som sealere.
Koronal forsegling
En rodfyldning afsluttes med en fyldning eller en krone. Det har længe været kendt, at rodbehandlingen vil kunne kompromitteres, hvis der er tekniske mangler ved restaureringen (72). Derfor lægges der vægt på, at der koronalt i kanalen og ind i pulpacavum bør foretages en ekstra forstærkning af rodfyldningen før topfyldningen for at hindre bakteriel penetration (73). Efter en periode med fokus på adhæsive materialer som en barriere mod sekundære problemer (væske-indsivning, infektion) foretrækker man nu at bruge klassiske, antibakterielle produkter som IRM. Adhæsive fyldninger kan være følsomme for fugtighed, og der er kort vej til rodhinden i tandhalsområdet. Dette kan forklare kliniske observationer af, at flydende kompositter lagt over rodfyldningen let løsnes ved præparering til fyldning/krone eller ved revisioner. Princippet om at sætte en prop i kanalåbningen ned til knogleniveau under topfyldningen er dokumenteret klinisk (74), mens materialevalget forbliver empirisk. IRM 2 - 4 mm ned i kanalmundingen synes at have bred støtte i fagmiljøet som en god procedure (Figur 1). De negative konsekvenser for hærdning af kompositte ovenover synes ikke at være af klinisk betydning.
Vurdering af dokumentationen for et materiale
Det vigtigste kriterium for et rodfyldningsmateriale er klinisk vellykkethed observeret over tid. Der kan gå lang tid, fra et materiale introduceres, til systematiske kliniske studier foreligger. Dette gør det vanskeligt at vurdere, hvorvidt man skal tage et nyt materiale i brug eller ej. Den første information, som foreligger, er oftest data fra laboratoriet og dyreforsøg, som sædvanligvis undersøger helt specifikke egenskaber ved materialet. Den type information anvendes hyppigt i reklameøjemed. Systematisk indhentning af data fra brug af materialet i patientbehandling målt op mod kriterier for klinisk succes er ikke nødvendige for at kunne sælge et materiale. Det kan derfor tage lang tid, før sådant datamateriale foreligger. Det er derfor nyttigt at kunne vurdere dokumentationen for et materiale ud fra, hvilken type undersøgelser der foreligger, og hvilket niveau på evidenspyramiden disse er gennemført på. En kortfattet oversigt præsenteres i Tabel 2.
Niveau på evidensstigen |
Slutmål for undersøgelsen |
Type af undersøgelse |
|---|---|---|
Aggregerede kliniske data |
Periapikal og pulpal sundhed/sygdom |
|
(primærmål) |
Meta-analyser |
|
Systematiske oversigter |
||
Kliniske studier |
Periapikal og pulpal sundhed/sygdom |
|
Randomiserede sammenligninger |
||
Kohorteundersøgelser |
||
Store kasus-serier |
||
Klinisk dokumentation |
Periapikal og pulpal sundhed/sygdom, «anvendelighed« |
Små kasus-serier |
Kasusrapporter |
||
Ikke-kliniske data |
Sekundærmål; surrogatmål |
|
Systematiske oversigter af dyreforsøg og laboratoriedata |
||
Vævsreaktioner, toksicitet, vævsregeneration |
Dyreforsøg |
|
Forsegling, adhæsion, penetration, flydeevne; teknisk/praktiske egenskaber |
Laboratoriestudier til bestemmelse af fysiske og kemiske egenskaber |
|
Antimikrobielle egenskaber, biostimulering |
Laboratoriestudier til bestemmelse af biologiske egenskaber in vivo og in vitro |
|
Konklusioner
Instrumentering kan gennemføres manuelt eller maskinelt. Maskinel instrumentering er let at lære og fører i de fleste tilfælde hurtigt til målet. Det forudsætter dog grundlæggende færdigheder i manuel instrumentering.
Guttaperkapoints vælges efter instrumentteknikken. Manuel instrumentering med 2 % stigning anvender tilsvarende guttaperka, nogle instrumenteringssystemer betjener sig af en jævn stigning med den fordel, at points kan anvendes uafhængigt af instrumenteringssystemet. Reciprokerende og nogle roterende systemer har varierende stigningsgrad på de sidste instrumenter; i så fald anvendes en guttaperka, som følger med instrumenteringssystemet.
Skyllemidler benyttes primært for at dræbe mikroorganismer og for at lette fjernelse af dentin og restvæv. Det er standardprocedure at benytte NaOCl primært under instrumentering og derefter EDTA.
Valget af sealer er uafhængigt af instrumenteringen, og det er stadig en god behandling at benytte en konventionel sealer kombineret med lateralkondensering af guttaperka. Sealere baseret på epoxy, silikone, calciumhydroxid og zinkoxid-eugenol er alle veldokumenterede. Biokeram-sealere er meget interessante, men der mangler foreløbig klinisk dokumentation og opfølgning. Plastbaserede sealere med plastkerne synes at være mindre bestandige mod nedbrydning.
English summary
Endodontic materials - irrigants, sealers, and obturating materials
The root canal filling concludes the classical triad in endodontic treatment: biomechanical instrumentation, disinfection and obturation. The purpose of the root canal filling is to prevent penetration of bacteria into the root canal and to prevent access of nutrients and growth of residual bacteria. The function of the root canal filling is to seal and obturate the root canal and kill remaining microbes. This is achieved most often with the use of a core material and a sealer. The core material acts as a piston to push the sealer out to fill the root canal system. In addition to achieve intimate contact with dentin, the sealer has contact with periapical soft tissue. Therefore, the sealers have to fulfill both technical and biological requirements. The endodontic treatment ends with a coronal seal to prevent coronal leakage of bacteria. A technically well-performed root canal filling, acceptable filling length and homogenous root filling, evaluated radiographically, with an adequate coronal restoration, is a reliable predictor for a successful outcome.
Valen H, Floer Johnsen G, Ørstavik D. Endodontiske materialer - skyllemidler, sealere og obturerende materialer. Nor Tannlegeforen Tid. 2017;127:248-56. doi:10.56373/2017-3-5
Litteratur
Byström A, Sundqvist G. Bacteriologic evaluation of the efficacy of mechanical root canal instrumentation in endodontic therapy. Scand J Dent Res. 1981; 89: 321 - 8.
Zehnder M. Root canal irrigants. J Endod. 2006; 32: 389 - 98.
De-Deus G, Belladonna FG, Silva EJ et al. Micro-CT Evaluation of Non-instrumented Canal Areas with Different Enlargements Performed by NiTi Systems. Braz Dent J. 2015; 26: 624 - 9.
McComb D, Smith DC. A preliminary scanning electron microscopic study of root canals after endodontic procedures. J Endod. 1975; 1: 238 - 42.
Mader CL, Baumgartner JC, Peters DD. Scanning electron microscopic investigation of the smeared layer on root canal walls. J Endod. 1984; 10: 477 - 83.
Cvek M, Nord CE, Hollender L. Antimicrobial effect of root canal debridement in teeth with immature root. A clinical and microbiologic study. Odontol Revy. 1976; 27: 1 - 10.
Byström A, Sundqvist G. The antibacterial action of sodium hypochlorite and EDTA in 60 cases of endodontic therapy. Int Endod J. 1985; 18: 35 - 40.
Siqueira JF, Jr., Rocas IN, Favieri A et al. Chemomechanical reduction of the bacterial population in the root canal after instrumentation and irrigation with 1 %, 2.5 %, and 5.25 % sodium hypochlorite. J Endod. 2000; 26: 331 - 4.
Clegg MS, Vertucci FJ, Walker C et al. The effect of exposure to irrigant solutions on apical dentin biofilms in vitro. J Endod. 2006; 32: 434 - 7.
Ma J, Wang Z, Shen Y et al. A new noninvasive model to study the effectiveness of dentin disinfection by using confocal laser scanning microscopy. J Endod. 2011; 37: 1380 - 5.
The SD. The solvent action of sodium hypochlorite on fixed and unfixed necrotic tissue. Oral Surg Oral Med Oral Pathol. 1979; 47: 558 - 61.
Radcliffe CE, Potouridou L, Qureshi R et al. Antimicrobial activity of varying concentrations of sodium hypochlorite on the endodontic microorganisms Actinomyces israelii, A. naeslundii, Candida albicans and Enterococcus faecalis. Int Endod J. 2004; 37: 438 - 46.
Sirtes G, Waltimo T, Schaetzle M et al. The effects of temperature on sodium hypochlorite short-term stability, pulp dissolution capacity, and antimicrobial efficacy. J Endod. 2005; 31: 669 - 71.
Abou-Rass M, Oglesby SW. The effects of temperature, concentration, and tissue type on the solvent ability of sodium hypochlorite. J Endod. 1981; 7: 376 - 7.
Marending M, Luder HU, Brunner TJ et al. Effect of sodium hypochlorite on human root dentine - mechanical, chemical and structural evaluation. Int Endod J. 2007; 40: 786 - 93.
Grigoratos D, Knowles J, Ng YL et al. Effect of exposing dentine to sodium hypochlorite and calcium hydroxide on its flexural strength and elastic modulus. Int Endod J. 2001; 34: 113 - 9.
Moorer WR, Wesselink PR. Factors promoting the tissue dissolving capability of sodium hypochlorite. Int Endod J. 1982; 15: 187 - 96.
Zhang W, Torabinejad M, Li Y. Evaluation of cytotoxicity of MTAD using the MTT-tetrazolium method. J Endod. 2003; 29: 654 - 7.
Pashley EL, Birdsong NL, Bowman K et al. Cytotoxic effects of NaOCl on vital tissue. J Endod. 1985; 11: 525 - 8.
Nygaard-Østby B. Chelation in root canal therapy: ethylenediaminetetraacetic acid for cleansing and widening of root canals. Odontol Tidskr. 1957; 65: 3 - 11.
Moon YM, Shon WJ, Baek SH et al. Effect of final irrigation regimen on sealer penetration in curved root canals. J Endod. 2010; 36: 732 - 6.
Kokkas AB, Boutsioukis A, Vassiliadis LP et al. The influence of the smear layer on dentinal tubule penetration depth by three different root canal sealers: an in vitro study. J Endod. 2004; 30: 100 - 2.
Yoshida T, Shibata T, Shinohara T et al. Clinical evaluation of the efficacy of EDTA solution as an endodontic irrigant. J Endod. 1995; 21: 592 - 3.
Goldberg F, Abramovich A. Analysis of the effect of EDTAC on the dentinal walls of the root canal. J Endod. 1977; 3: 101 - 5.
Hulsmann M, Heckendorff M, Lennon A. Chelating agents in root canal treatment: mode of action and indications for their use. Int Endod J. 2003; 36: 810 - 30.
Jeansonne MJ, White RR. A comparison of 2.0 % chlorhexidine gluconate and 5.25 % sodium hypochlorite as antimicrobial endodontic irrigants. J Endod. 1994; 20: 276 - 8.
Zamany A, Safavi K, Spångberg LS. The effect of chlorhexidine as an endodontic disinfectant. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2003; 96: 578 - 81.
Paiva SS, Siqueira JF, Jr., Rocas IN et al. Clinical antimicrobial efficacy of NiTi rotary instrumentation with NaOCl irrigation, final rinse with chlorhexidine and interappointment medication: a molecular study. Int Endod J. 2013; 46: 225 - 33.
Okino LA, Siqueira EL, Santos M et al. Dissolution of pulp tissue by aqueous solution of chlorhexidine digluconate and chlorhexidine digluconate gel. Int Endod J. 2004; 37: 38 - 41.
Fuss Z, Mizrahi A, Lin S et al. A laboratory study of the effect of calcium hydroxide mixed with iodine or electrophoretically activated copper on bacterial viability in dentinal tubules. Int Endod J. 2002; 35: 522 - 6.
Sirén EK, Haapasalo MP, Waltimo TM et al. In vitro antibacterial effect of calcium hydroxide combined with chlorhexidine or iodine potassium iodide on Enterococcus faecalis. Eur J Oral Sci. 2004; 112: 326 - 31.
Peciuliene V, Reynaud AH, Balciuniene I et al. Isolation of yeasts and enteric bacteria in root-filled teeth with chronic apical periodontitis. Int Endod J. 2001; 34: 429 - 34.
Kvist T, Molander A, Dahlen G et al. Microbiological evaluation of one- and two-visit endodontic treatment of teeth with apical periodontitis: a randomized, clinical trial. J Endod. 2004; 30: 572 - 6.
Ørstavik D, Haapasalo M. Disinfection by endodontic irrigants and dressings of experimentally infected dentinal tubules. Endod Dent Traumatol. 1990; 6: 142 - 9.
Ordinola-Zapata R, Bramante CM, Garcia RB et al. The antimicrobial effect of new and conventional endodontic irrigants on intra-orally infected dentin. Acta Odontol Scand. 2013; 71: 424 - 31.
Zehnder M, Schmidlin P, Sener B et al. Chelation in root canal therapy reconsidered. J Endod. 2005; 31: 817 - 20.
Marchesan MA, Pasternak Júnior B, Afonso MM et al. Chemical analysis of the flocculate formed by the association of sodium hypochlorite and chlorhexidine. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2007; 103: e103 - 5.
González-López S, Camejo-Aguilar D, Sanchez-Sanchez P et al. Effect of CHX on the decalcifying effect of 10 % citric acid, 20 % citric acid, or 17 % EDTA. J Endod. 2006; 32: 781 - 4.
Basrani BR, Manek S, Mathers D et al. Determination of 4-chloroaniline and its derivatives formed in the interaction of sodium hypochlorite and chlorhexidine by using gas chromatography. J Endod. 2010; 36: 312 - 4.
Hammad M, Qualtrough A, Silikas N. Extended setting shrinkage behavior of endodontic sealers. J Endod. 2008; 34: 90 - 3.
Kazemi RB, Safavi KE, Spångberg LS. Dimensional changes of endodontic sealers. Oral Surg Oral Med Oral Pathol. 1993; 76: 766 - 71.
Eldeniz AU, Ørstavik D. A laboratory assessment of coronal bacterial leakage in root canals filled with new and conventional sealers. Int Endod J. 2009; 42: 303 - 12.
Hiraishi N, Yau JY, Loushine RJ et al. Susceptibility of a polycaprolactone-based root canal-filling material to degradation. III. Turbidimetric evaluation of enzymatic hydrolysis. J Endod. 2007; 33: 952 - 6.
Whatley JD, Spolnik KJ, Vail MM et al. Susceptibility of methacrylate-based root canal filling to degradation by bacteria found in endodontic infections. Quintessence Int. 2014; 45: 647 - 52.
Zhang H, Shen Y, Ruse ND et al. Antibacterial activity of endodontic sealers by modified direct contact test against Enterococcus faecalis. J Endod. 2009; 35: 1051 - 5.
Hashieh IA, Pommel L, Camps J. Concentration of eugenol apically released from zinc oxide-eugenol-based sealers. J Endod. 1999; 25: 713 - 5.
Tanomaru Filho M, Leonardo MR, Silva LA et al. Effect of different root canal sealers on periapical repair of teeth with chronic periradicular periodontitis. Int Endod J. 1998; 31: 85 - 9.
Waltimo TM, Boiesen J, Eriksen HM et al. Clinical performance of 3 endodontic sealers. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2001; 92: 89 - 92.
Leonardo MR, Bezerra da Silva LA, Filho MT et al. Release of formaldehyde by 4 endodontic sealers. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1999; 88: 221 - 5.
Cohen BI, Pagnillo MK, Musikant BL et al. Formaldehyde evaluation from endodontic materials. Oral Health. 1998; 88: 37 - 9.
Kim YK, Grandini S, Ames JM et al. Critical review on methacrylate resin-based root canal sealers. J Endod. 2010; 36: 383 - 99.
Slutzky-Goldberg I, Slutzky H, Solomonov M et al. Antibacterial properties of four endodontic sealers. J Endod. 2008; 34: 735 - 8.
Byström A, Claesson R, Sundqvist G. The antibacterial effect of camphorated paramonochlorophenol, camphorated phenol and calcium hydroxide in the treatment of infected root canals. Endod Dent Traumatol. 1985; 1: 170 - 5.
Mitchell DF, Shankwalker GB. Osteogenic potential of calcium hydroxide and other materials in soft tissue and bone wounds. J Dent Res. 1958; 37: 1157 - 63.
Tagger M, Tagger E. Periapical reactions to calcium hydroxide-containing sealers and AH 26 in monkeys. Endod Dent Traumatol. 1989; 5: 139 - 46.
Torabinejad M, Hong CU, Pitt Ford TR et al. Antibacterial effects of some root end filling materials. J Endod. 1995; 21: 403 - 6.
Morgental RD, Vier-Pelisser FV, Oliveira SD et al. Antibacterial activity of two MTA-based root canal sealers. Int Endod J. 2011; 44: 1128 - 33.
Parirokh M, Torabinejad M. Mineral trioxide aggregate: a comprehensive literature review--Part III: Clinical applications, drawbacks, and mechanism of action. J Endod. 2010; 36: 400 - 13.
Ber BS, Hatton JF, Stewart GP. Chemical modification of proroot mta to improve handling characteristics and decrease setting time. J Endod. 2007; 33: 1231 - 4.
Lee ES. A new mineral trioxide aggregate root-end filling technique. J Endod. 2000; 26: 764 - 5.
Camilleri J, Sorrentino F, Damidot D. Investigation of the hydration and bioactivity of radiopacified tricalcium silicate cement, Biodentine and MTA Angelus. Dent Mater. 2013; 29: 580 - 93.
Rajasekharan S, Martens LC, Cauwels RG et al. Biodentine material characteristics and clinical applications: a review of the literature. Eur Arch Paediatr Dent. 2014; 15: 147 - 58.
McMichen FR, Pearson G, Rahbaran S et al. A comparative study of selected physical properties of five root-canal sealers. Int Endod J. 2003; 36: 629 - 35.
Schafer E, Zandbiglari T. Solubility of root-canal sealers in water and artificial saliva. Int Endod J. 2003; 36: 660 - 9.
Ørstavik D, Kerekes K, Eriksen HM. Clinical performance of three endodontic sealers. Endod Dent Traumatol. 1987; 3: 178 - 86.
Huumonen S, Lenander-Lumikari M, Sigurdsson A et al. Healing of apical periodontitis after endodontic treatment: a comparison between a silicone-based and a zinc oxide-eugenol-based sealer. Int Endod J. 2003; 36: 296 - 301.
Saleh IM, Ruyter IE, Haapasalo M et al. The effects of dentine pretreatment on the adhesion of root-canal sealers. Int Endod J. 2002; 35: 859 - 66.
Ørstavik D, Nordahl I, Tibballs JE. Dimensional change following setting of root canal sealer materials. Dental Materials. 2001; 17: 512 - 9.
Eldeniz AU, Mustafa K, Ørstavik D et al. Cytotoxicity of new resin-, calcium hydroxide- and silicone-based root canal sealers on fibroblasts derived from human gingiva and L929 cell lines. Int Endod J. 2007; 40: 329 - 37.
Hilton TJ, Ferracane JL, Mancl L et al. Comparison of CaOH with MTA for direct pulp capping: a PBRN randomized clinical trial. J Dent Res 2013; 92 (7 Supp): 16S-22S.
Mente J, Hufnagel S, Leo M et al. Treatment outcome of mineral trioxide aggregate or calcium hydroxide direct pulp capping: long-term results. J Endod. 2014; 40: 1746 - 51.
Gillen BM, Looney SW, Gu LS et al. Impact of the quality of coronal restoration versus the quality of root canal fillings on success of root canal treatment: a systematic review and meta-analysis. J Endod. 2011; 37: 895 - 902.
Beach CW, Calhoun JC, Bramwell JD et al. Clinical evaluation of bacterial leakage of endodontic temporary filling materials. J Endod. 1996; 22: 459 - 62.
Hommez GM, Coppens CR, De Moor RJ. Periapical health related to the quality of coronal restorations and root fillings. Int Endod J. 2002; 35: 680 - 9.
Adresse: Håkon Valen, Nordisk institutt for odontologiske materialer, NIOM, Sognsveien 70 A, 0855 Oslo. E-post: hvrukke@niom.no
Artikkelen har gjennomgått ekstern faglig vurdering.
Johnsen GF, Valen H, Ørstavik D. Endodontiske materialer - skyllemidler, sealere og obturerende materialer. Nor Tannlegeforen Tid. 2017; 127: 248-56.
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Valen H, Floer
Johnsen G, Ørstavik D. Endodontiske materialer - skyllemidler, sealere og obturerende
materialer. Nor Tannlegeforen Tid. 2017;127:248-56. doi:10.56373/2017-3-5