Komposittmaterialer - utlekking av monomer og cytotoksisitet
NIOM har på oppdrag fra Helsedirektoratet undersøkt fire komposittmaterialer: ett Own Brand Label (OBL)-materiale, to bulk-fill materialer og et mye benyttet universalmateriale. Det ble funnet ubetydelige forskjeller i utlekket monomer mellom produktene. I en cytotoksisitets-screening med ekstrakter fra produktene var det noe forskjell mellom materialene. Ytterligere molekylærbiologiske undersøkelser viste imidlertid ingen indikasjon på celleskade. Basert på disse undersøkelsene kan ingen av produktene bedømmes som mindre sikre enn de andre.
Det har i den senere tid blitt stilt spørsmål om dentale kompositter er trygge å bruke, spesielt de såkalte OBL-materialene. Det finnes begrenset informasjon om utlekking fra og cytotoksisitet av dentale kompositter som materialgruppe, selv om det er blitt publisert en rekke studier om enkeltkomponenter, særlig monomerer. Når det gjelder spesifikke produkter er det lite tilgjengelig informasjon.
Biokompatibiliteten til et materiale vil avhenge av sammensetningen til materialet og av hvilke forbindelser som lekker ut. Sammensetning og utlekking, sammen med cytotoksisitet for individuelle substanser og materialekstrakter, kan undersøkes i laboratoriet og gi grunnlag for vurdering av biologiske egenskaper. Det er imidlertid viktig å presisere at det er usikkerhet knyttet til overføring av konklusjoner fra laboratoriestudier til kliniske forhold. De homogene cellelinjemodellene som normalt benyttes i laboratoriestudier kan blant annet ha egenskaper som skiller seg fra celler i en levende organisme der det er et komplekst samspill mellom ulike celletyper.
Helsedirektoratet har bedt NIOM undersøke noen komposittmaterialer med hensyn til utlekking og toksisitet i cellekultur. NIOM har kvantitativt bestemt utlekking av monomerer fra komposittmaterialene og gjennomført ulike cytotoksisitets-undersøkelser med ekstrakter fra materialene. De undersøkte materialene var 4U (Nordenta, OBL-materiale), Filtek Bulk Fill Flowable (3M ESPE), Tetric EvoCeram Bulk Fill (Ivoclar Vivadent) og Filtek Z250 (3M ESPE). Filtek Z250 ble valgt som et referansemateriale fordi det er godt etablert og har vært i klinisk bruk i en årrekke.
Konklusjonen fra utlekkings-analysene er at de ulike materialene ikke viser noen vesentlig forskjell i total mengde utlekket monomer. Innledende screening viste et mulig cytotoksisk potensiale for to av materialene, men mer omfattende undersøkelser støttet ikke disse funnene. Samlet sett synes de undersøkte materialene å ha like biologiske egenskaper, basert på metodene som er benyttet her.
Metode og resultater
Prøvelegemer av komposittmaterialene ble herdet fra én side med herdelampe og herdetid som anbefalt av materialprodusenten. Overflaten til prøvelegemene ble slipt med slipepapir etter herding for å fjerne uherdet sjukt, og for å etterligne klinisk praksis, i henhold til beskrivelser i standard metode (ISO 7405, referanse 1). Ekstrakter ble laget på samme måte til cytotoksisitets- og lekkasjestudiene: til cytotoksisitets-undersøkelsene ble ekstraktene laget i celledyrkingsmedium (en vandig løsning); til lekkasje-analysene ble det benyttet rent vann som ekstraksjonsmiddel. Ekstraksjon ble gjort over 24 timer ved 37 °C under lett risting.
Sammensetningen til komposittmaterialer er sjelden oppgitt nøyaktig av produsent og ble derfor først undersøkt ved å identifisere monomerer i råmaterialene ved kromatografisk analyse. Kvantitativ lekkasje ble analysert for de to monomerene som det var mest av i hvert materiale. Resultater fra analysene er presentert i figur 1 som viser samlet lekkasje fra hvert materiale.
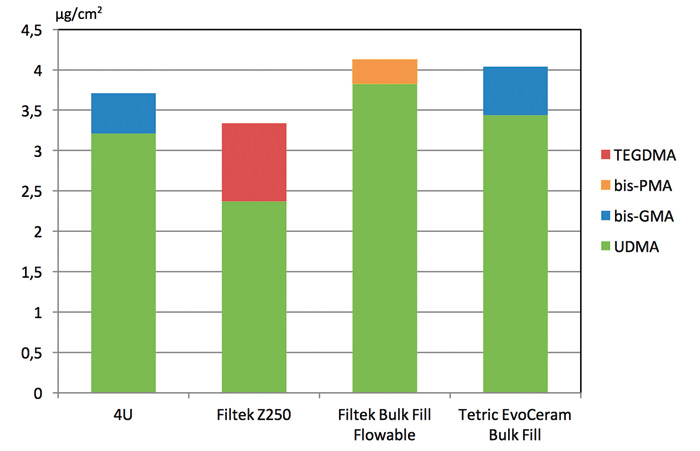
Figur 1. Konsentrasjon av kvantifiserte monomerer samlet for de ulike komposittene, angitt som mikrogram per kvadratcentimeter komposittoverflate. (bis-GMA: bisfenol A-glycidyl metakrylat; bis-PMA: propoksylert bisfenol A-glycidyl metakrylat; TEGDMA: trietylenglykol-dimetakrylat; UDMA: uretan-dimetakrylat).
Analysen viser ikke et fullstendig bilde av mulig utlekket monomer, men kun de to monomerene med størst mengde. Andre monomerer vil trolig også lekke ut, men i mindre mengder. Samlet sett er det ikke grunnlag til å si at noen av materialene har betydelig større eller annerledes lekkasje enn de andre materialene.
Evaluering av cytotoksisitet ble gjort i flere trinn for å underbygge og utfylle de innledende resultatene som kun kan ansees som screening av mulig cytotoksisitet. Først ble det gjennomført standardisert celleviabilitets-test (MTT metode) på muse-fibroblaster (L929 celler). Samme metode ble gjennomført på en mer sensitiv cellelinje (BEAS-2B, bronkiale epitelceller). For to av materialene som etter begge innledende undersøkelser viste lavest overlevelse, ble det i tillegg målt endringer i cellevekstmønster og celledød med flow cytometri. I tillegg ble det utført molekylærbiologiske undersøkelser.
Resultater fra MTT-undersøkelsene er gitt i tabell 1. I følge standarden (ISO 10993 - 5, referanse 2) skal en prøve tolkes å kunne ha et cytotoksisk potensiale hvis en analyse utført med MTT-test gir celleoverlevelse under 70 %. Det er viktig å presisere at resultatene fra slike laboratorietester ikke er direkte overførbare til menneske-eksponering, men er en indikasjon om mulig skadepotensial i menneske. Det kan derfor ikke utelukkes at et testet materiale som får celleoverlevelse større enn 70 % har et skadepotensial, eller at et testet materiale med celleoverlevelse mindre enn 70 % er trygt å bruke.
Materialer |
L929 celler |
BEAS-2B celler |
|---|---|---|
4U |
81,0 (3,9) |
95,3 (1,5) |
Filtek Bulk Fill Flowable |
50,8 (2,1) |
64,8 (7,4) |
Filtek Z250 |
66,8 (1,9) |
71,4 (4,9) |
Tetric EvoCeram Bulk Fill |
75,8 (4,8) |
93,2 (7,6) |
Ytterligere analyser ble utført på materialene som hadde mindre enn 70 % overlevelse for enten å bekrefte eller avkrefte tilstedeværelse av en toksisk respons. Dette ble gjort med flow cytometri av celler eksponert for ekstrakt fra Filtek Bulk Fill Flowable og Filtek Z250. Flow-histogram (figur 2) viser fordeling av celler i de forskjellige faser av cellevekstsyklus (G1, S og G2). Endret fordeling mellom disse fasene kan være tegn på vekstforstyrrelser i skadede celler. Undersøkelsene påviste ingen endring av vekstmønster eller økt celledød for de to undersøkte materialene sammenliknet med kontroll. Molekylærbiologiske undersøkelse viste ingen indikasjon på celleskade i form av økt oksidativt stress, DNA-skade eller protein-skade i BEAS-2B celler som ble eksponert for ekstrakter fra Filtek Z250 eller Filtek Bulk Fill Flowable.
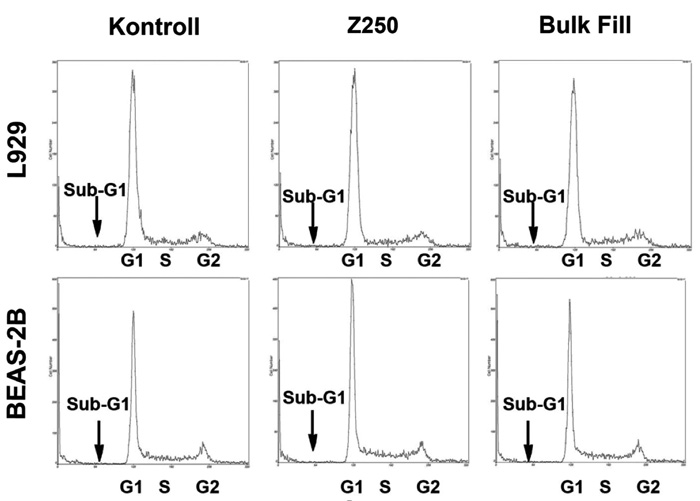
Figur 2. Eksempler på flow cytometriske analyser av ikke-eksponerte kontrollceller og celler eksponert for ekstrakt fra Filtek Z250 og Filtek Bulk Fill Flowable.
Les hele rapporten på NIOMs hjemmesider: www.niom.no\komposittmaterialer
Referanser
ISO 7405: 2008 Dentistry -- Evaluation of biocompatibility of medical devices used in dentistry
ISO 10993 - 5: 2009 Biological evaluation of medical devices -- Part 5: Tests for in vitro cytotoxicity
Adresse: Hilde B. M. Kopperud, NIOM. E-post: h.b.m.kopperud@niom.no