Måling av kortisol i saliva
Kortisol er et steroid og glukokortikoid som produseres i binyrebarken. Nivået av kortisol er høyest ca. en halv time etter oppvåkning og konsentrasjonen i saliva regnes som et godt mål for stressnivået. Nyere forskning har vist at metoder basert på immunoassays (IA) gir større usikkerhet for måling av konsentrasjonen av kortisol i saliva og at metoder basert på kombinert væskekromatografi og tandem massespektrometri (LC-MSMS) er å foretrekke. Ved forskningsprosjekter bør man derfor utelukkende benytte den sistnevnte metode til måling av konsentrasjonen av kortisol i saliva.
Hovedbudskap | |
|---|---|
· |
Kortisol øker ved stress og er en indikator for nivået av stress. |
· |
Kortisol kan måles i saliva og har blitt registrert ved studier av periodontal sykdom, odontofobi, orale smerter, temporomandibulære lidelser, burning mouth syndrome og oral lichen planus. |
· |
Odontologer som skal måle nivået av kortisol i saliva bør følge nyere anbefalinger fra spesialister i endokrinologi og klinisk biokjemi med hensyn til analysemetode. |
Det er velkjent at utskillelsen av kortisol øker ved stress. Nivået av kortisol i saliva blir hyppig benyttet som en indikator på stressnivået (1). Ved studier som omhandler periodontal sykdom, odontofobi, orale smerter, temporomandibulære lidelser, burning mouth syndrome og oral lichen planus har man benyttet konsentrasjonen av kortisol i saliva som et mål for stresspåvirkning (2 - 7). En forutsetning for dette må være at målemetoden for kortisol i saliva er pålitelig.
Hva er kortisol?
Kortisol er et steroid og glukokortikoid som produseres i binyrebarken.
Et steroid er et lipid karakterisert ved et karbonskjelett med fire sammenhengende ringer. De viktigste steroidene er kolesterol, steroidhormonene og deres forløpere og metabolitter. Kolesterol syntetiseres hovedsakelig i leveren. Substansen er en viktig byggesten for alle cellemembraner og er en forløper for kjønnshormoner, binyrebarkhormoner, gallesalter og vitamin D. Steroidhormoner er hormoner som dannes av steroider, og substansene er viktige i en rekke biologiske prosesser som regulerer atferd, immunitet, samt kroppens respons på stress og miljømessige endringer. Hos mennesket fører dysregulering, overproduksjon eller for lav produksjon av steroidhormoner til endokrine forstyrrelser. Hovedorganene for syntese av steroidhormoner hos mennesket er binyrene, testis, ovariene og placenta. Steroider syntetiseres fra kolesterol via en multi-step enzymatisk signalvei og inndeles etter hvilke reseptorer de binder til:
(A) mineralkortikoider, (B) kjønnshormoner (androgener, østrogener og progestagener) og (C) glukokortikoider.
A. Mineralkortikoider er en gruppe av hormoner som dannes i binyrebarken og som regulerer saltstoffskiftet, særlig natriumbalansen. Det mest potente naturlig forekommende mineralkortikoidet er aldosteron.
B. Kjønnshormoner er hormoner som regulerer de seksuelle funksjonene og utviklingen av de sekundære kjønnskjennetegn. Mannlige kjønnshormoner kalles androgene hormoner, mens de kvinnelige omfatter en lang rekke forskjellige former for østrogener og gestagener. Mannlige og kvinnelige kjønnshormoner produseres hos begge kjønn. Det viktigste mannlige kjønnshormonet er testosteron, som produseres i Leydigcellene i testiklene. Det kan også produseres i eggstokkene og i binyrebarken hos kvinner.
C. Glukokortikoider er en gruppe av kjemisk nært beslektete steroidhormoner som dannes i binyrebarken. Kortisol er det viktigste naturlig forekommende glukokortikoid (figur 1).
Figur 1. Kortisol.
Kortisol er også kjent som stresshormonet og har en rekke fysiologiske effekter i regulering av metabolisme, immunsystem, hjerte og vekst. Hormonet produseres i binyrebarken (cortex) i cellenes mitokondrier ved hjelp av de membranbundne P450 enzymene, samt enzymet hydroksysteroid dehydrogenase. Syntese og regulering av kortisol er nøye regulert av sentralnervesystemet, som er meget følsomt for negativ tilbakekobling både fra kortisol og syntetiske glukokortikoider. Utskillelsen av kortisol fra binyrene stimuleres av hypofysehormonet ACTH og er kraftigst i tidlige morgentimer. Kortisol diffunderer ut av cellene i binyrebarken og inn i blodbanen og bindes i blod til kortisolbindende globulin (CBG) (ca. 60 %) og albumin (ca. 30 %), mens 5 - 10 % sirkulerer ubundet (8). Det er den gjenværende ubundne, frie del av kortisol som er biologisk aktiv og kan binde seg til og aktivere glukokortikoidreseptorene i cellekjernen. Fordi steroider er fettløselige, diffunderer de relativt fritt fra blodet gjennom cellemembranen til cytoplasma i målcellene. Her modifiseres steroidhormonet i enkelte tilfeller før det binder spesifikke reseptorer. Når steroidet binder reseptoren, går to steroid-reseptorkomplekser sammen og danner en funksjonell DNA -bindende enhet som kan trenge inn i nukleus (cellekjernen). I kjernen binder steroid-ligand-komplekset spesifikke DNA-sekvenser og induserer transkripsjon av målgenene. Kortisol fører til transkripsjon av et stort antall gener (9,10). Ved transkripsjon avleses informasjonen i arvestoffet, og man får dannet mRNA som bindes til ribosomene. I ribosomene blir den genetiske koden omdannet til proteiner som ivaretar en rekke livsviktige oppgaver i kroppen. For høye kortisolnivåer gir Cushings syndrom, mens kortisolmangel er en potensielt livstruende tilstand (Addisons sykdom).
Hvilken betydning har kortisol for oral helse?
HPA-aksen (Hypothalamus, Pituitary gland and Adrenal glands) er et hovedsystem for stressregulering. Ved eksponering for stress-stimuli vil kroppen reagere med øket aktivitet av HPA-aksen. Dette manifesterer seg som øket sekresjon av kortisol. Både akutt og kronisk stress fører til aktivering av HPA-aksen, men immunsystemet reagerer forskjellig etter om stressreaksjonen er akutt eller langvarig. Ved den akutte stressreaksjonen øker immunsystemets aktivitet. Varer imidlertid belastningen av HPA-aksen over tid - flere uker, måneder og år, vil immunsystemet hemmes.
Hos barn med lav sosioøkonomisk status har det blitt påvist øket produksjon av kortisol (11). Ny forskning viser også en klar sammenheng mellom negative barndomserfaringer og tannhelse (12). Hos deprimerte voksne har HPA-aksen vist seg å være hyperaktiv (13). En kronisk HPA-akse hyperaktivitet og resulterende høy glukokortikoidfrigivelse har blitt assosiert med endret immunrespons og derav en øket mottagelighet for periodontitt gjennom påvirkning av de mekanismene som fører til lokal benresorpsjon (2,14). Hyperaktivitet i HPA-aksen har også blitt relatert til temporomandibulære lidelser (5), og hos pasienter med faciale smerter endres HPA-aktiviteten og medfører lavere sekresjon av kortisol (4). Pasienter med oral lichen planus har også fått påvist dysregulering av HPA-aksen, med påfølgende lavere sekresjon av morgenkortisol (7).
Innenfor det odontologiske fagfeltet finnes det således mange tilstander som kan bli påvirket av stress, gi endret respons av HPA-aksen og derved endring i utskillelse av kortisol.
Kortisol i saliva
Kortisol overføres fra blod til saliva ved diffusjon gjennom de acinære cellene i spyttkjertlene. Ved endringer i den frie konsentrasjonen i blodet er konsentrasjonen i saliva i likevekt innen fem minutter. Konsentrasjonen i saliva er mindre enn en tidel av serumkonsentrasjonen. Den er uavhengig av mengde utskilt saliva og av forholdet mellom mucus og serøs væske i saliva. I saliva finnes kortisol hovedsakelig i fri form (85 %); resten er bundet til kortisolbindende globulin, som i saliva finnes i en konsentrasjon på omtrent 1/1000 av konsentrasjonen i blodet. Fritt og ubundet kortisol kan krysse cellemembranen i duktære celler og acini celler i spyttkjertlene, slik at kortisol kan påvises i saliva. Kortisol i saliva er et ultra-filtrat av plasmakortisol og reflekterer nivået av biologisk aktivt ikke-bundet kortisol i serum. Det har en døgnvariasjon tilsvarende serumkortisol, med høyeste nivå om morgenen og det laveste ved midnatt. Intracellulært i parotisvev kan kortisol omdannes til det inaktive molekylet kortison ved hjelp av enzymet 1 1b-hydroxysteroid dehydrogenase type 2 (1 1b-HSD2) (figur 2). Dette enzymet finnes også i nyrevev, kolon og placenta (15).
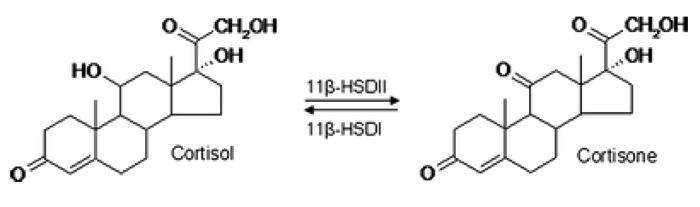
Figur 2. I parotis omdanner enzymet 1 1b-HSDII kortisol til kortison og enzymet 1 1b-HSDI kortison til kortisol.
Konsentrasjonen av kortisol i saliva anses som en markør for stressindusert HPA-akse stimulering (1) og vil bestemmes både av den mengde fritt kortisol som er til stede i serum, og av den metabolisme som skjer i parotisvev av kortisol ved hjelp av enzymet 1 1b-HSD2.
Målemetoder for kortisol i saliva
Prøver av saliva representerer en ikke-invasiv og kostnadseffektiv metode, og det også er mulig for pasienten å ta prøven selv. Hittil har den mest vanlige metode for å måle konsentrasjonen av kortisol i saliva vært ved bruk av immunoassays (IA). Metoden baserer seg på at analyttene binder seg til antistoffer. Antistoffene er laget med relativt høy spesifisitet for de molekylene som skal påvises, men stoffer med lik struktur kan allikevel binde seg til antistoffet og derved gi feil.
Kvantitative målinger av steroidhormoner representerer en betydelig analytisk utfordring (16). Årsaken til dette er at substansene er til stede i svært små mengder (dvs. pico til nanomolar området). Det er også vanskelig å skille endel steroider fra hverandre på grunn av den strukturelle likheten. Det er derfor nødvendig med både sensitive (dvs. evnen til å påvise lave konsentrasjoner) og spesifikke (dvs. evnen til å påvise og skille ut den søkte substans) analytiske metoder for å bestemme konsentrasjonen av steroidhormoner i komplekse biologiske matriser (for eksempel serum, urin og saliva). Introduksjon av masse-spektrometri har forbedret spesifisiteten og sensitiviteten ved måling av steroidhormoner. Masse-spektrometri er en metode som identifiserer mengde og type av kjemiske bestanddeler i en prøve ved å måle forskjellen av mengden ioner. Metoden betraktes i dag som gullstandard-metoden ved analyse av steroidhormoner. I en «Editorial» fra Handelsman DJ og Wartofksy L i tidsskriftet Journal of Endocrinology and Metabolism i oktober 2013 siteres «It is timely to recognize that for high-impact clinical research, the steroid immunoassay era is gradually to close, and for direct immunoassays it is effectively over» (17).
Miller og medarbeidere (18) har sammenlignet målemetodene IA med tandem masse-spektrometri for måling av kortisol i saliva. Konklusjonen er at analysemetoden «Liquid Chromatography and tandem Mass Spectrometry» (LC-MSMS) er å foretrekke og at IA-metodene innbyrdes ikke er sammenlignbare, med mindre man bruker den samme IA-metode (dvs. fra samme produsent). Ved IA-metoder vil man kunne få kryss-reaktivitet av kortison (dvs. påvisning av en inaktiv substans) (18). Konsentrasjonen av kortison i saliva er i gjennomsnitt 280 % av kortisol (19). Ved LC-MSMS metoder kan man i motsetning til ved IA-metoder skille mellom substansene kortisol og kortison (20) og man vil derfor få et mer pålitelig mål for konsentrasjonen av kortisol i saliva. Fordelene ved å bruke LC-MSMS til måling av kortisol i saliva ved endringer i HPA-aksen påpekes både av spesialister i klinisk biokjemi og av spesialister i endokrinologi (21).
English summary
Lygre H.
Quantification of cortisol in saliva
684-7.
Cortisol is a steroid and glucocorticoid produced in the cortex of the adrenal glands. The concentration of cortisol is on its highest amount about thirty minutes after morning awakening and the concentration in saliva correlates intimately to the level of stress. By comparing the method of liquid chromatography coupled to tandem mass spectrometry (LC-MSMS) seems to be superior to the very often applied immuno-assay methods. In research projects the LC-MSMS method should be mandatory when quantifying cortisol in saliva.
Referanser
Hellhammer DH, Wüst S, Kudielka BM. Salivary cortisol as a biomarker in stress research. Psychoneuroendocrinology 2009; 34: 163 - 71.
Breivik T, Gundersen Y, Gjermo P, Opstad PK. Chronic treatment with the glucocorticoid receptor antagonist RU486 inhibits diabetes-induced enhancement of experimental periodontitis. J Periodont Res 2014; 49: 36 - 44.
Yfanti K, Kitraki E, Emmanouil D, Pandis N, Papaqiannoulis L. Psychometric and bihormonal indices of dental anxiety in children. A prospective cohort study. Stress 2014; 17: 296 - 304.
Galli U, Gaab J, Ettlin DA, Ruggia F, Ehlert U, Palla S. Enhanced negative feedback sensitivity of the hypothalamus-pituitary-adrenal axis in chronic myogenous facial pain. Eur J Pain 2009; 13: 600 - 5.
Auvenshine RC. Temporomandibular disorders: associated features. Dent Clin North Am 2007; 51: 105 - 27.
de Souza FT, Kummer A, Silva ML, Amaral TM, Abdo EN, Abreu MH, Silva TA, Texeira AL. The association of openness personality trait with stress-related salivary biomarkers in burning mouth syndrome. Neuroimmunomodulation 2015; 22: 250 - 5.
Pippi R, Patini R, Ghiciuc CM, Sandu RB, Pasquali V, Scaccianoce S, Dima-Cozma LC, Patacchioli FR. Diurnal trajectories of salivary cortisol, salivary a-amylase and psychological profiles in oral lichen planus patients. J Biol Regul Homeost Agents 2014; 28: 147 - 54.
Haug E. Spyttprøver til kortisolmåling. Tidsskr Nor Lægeforen 2007; 127: 718.
Reddy TE, Pauli F, Sprouse RO, et al. Genomic determination of the glucocorticoid response reveals unexpected mechanisms of gene regulation. Genome Res 2009; 19: 2163 - 71.
Taniguchi-Yanai K, Koike Y, Hasegawa T, et al. Identification and characterization of glucocorticoid receptor-binding sites in the human genome. J Recept Signal Transduct Res 2010; 30: 88 - 105.
Chen E, Cohen S, Miller GE. How low socioeconomic status affects 2-year hormonal trajectories in children. Psycol Sci 2010; 21: 31 - 7.
Bright MA, Alford SM, Hinojosa MS, Knapp C, Fernandez-Baca DE. Adverse childhood experiences and dental health in children and adolescents. Community Dent Oral Epidemiol 2014; 42: 1 - 7.
Pariante CM, Lightman SL. The HPA axis in major depression: classical theories and new developments. Trends Neurosci 2008; 31: 464 - 8.
Dolic M, Bailer J, Staehle HJ, Eickholz P. Psychosocial factors as risk indicators of periodontitis. J Clin Periodontol 2005; 32: 1134 - 40.
Smith RE, Maguire JA, Stein-Oakley AN, Sasano H, Takahashi K, Fukushima K, Krozowski ZS. Localization of beta-hydrosteroid dehydrogenase type II in human epithelial tissue. J Clin Endocrinol Metab 1996; 81: 3244 - 8.
Methlie P. New corticosteroid assays in adrenal insufficiency and obesity. Thesis. UoB. 2014.
Handelsman DJ, Wartofsky L. Requirement for mass spectrometry sex steroid assays in the Journal of Clinical Endocrinology and Metabolism. J Clin Endocrinol Metab 2013; 98: 3971 - 3.
Miller R, Plessow F, Rauh M, Gröschl M, Kirschbaum C. Comparison of salivary cortisol as measured by different immunoassays and tandem mass spectrometry. Psychoneuroendocrinology 2013; 38: 50 - 7.
Perogamvros I, Owen LJ, Nerwell-Price J, Ray DW, Trainer PJ, Keevil BG. Simultaneous measurements of cortisol and cortisone in human saliva using liquid chromatography-tandem mass spectrometry: Application in basal and stimulated conditions. J Chromatogr B 2009; 877: 3771 - 5.
Jones RL, Owen LJ, Adaway JE, Keevil BG. Simultaneous analysis of cortisol and cortisone in saliva using XLC-MS/MS for fully automated online solid phase extraction. J Chromatogr B 2012; 881 - 882: 42 - 8.
Monaghan PJ, Keevil BG, Trainer PJ. The use of mass spectrometry to improve the diagnosis and the management of the PHA axis. Rev Endocr Metab Disord 2013; 14: 143 - 57.
professor, dr.odont., spesialist i periodonti. Institutt for klinisk odontologi, Det medisinsk-odontologiske fakultet, Universitetet i Bergen og Tannhelsetjenestens kompetansesenter, Vest/Rogaland, Stavanger
Adresse: Henning Lygre, Institutt for klinisk odontologi, Universitetet i Bergen, Årstadvei 19, 5009 Bergen. E-post: henning.lygre@uib.no
Artikkelen har gjennomgått ekstern faglig vurdering.
Lygre H. Måling av kortisol i saliva. Nor Tannlegeforen Tid. 2016; 126: 684-7.