Rask og effektiv sårtilheling i munnhulen: En rolle for signalmolekyler i saliva?
Sårtilheling er en kompleks prosess som består av en sekvens av sammenhengende hendelser. I munnhulen heles et sår raskt og stort sett uten arrdannelse, sammenliknet med sår i huden. Én av grunnene til dette er tilstedeværelse av saliva som inneholder stoffer som fremmer tilhelingen. Vi har undersøkt noen av virkningene av signalmolekylene nerve-vekstfaktor (nerve growth factor, NGF) og trekløver faktor 3 (trefoil family 3, TFF3) som blir frigjort i saliva. Sammen med andre studier tyder våre funn på at disse stoffene kan påvirke forskjellige faser i sårtilhelingen i munnhulen og at de dermed kan være lovende kandidater for å fremme tilheling av akutte og kroniske sår, både i munnhulen og i hud.
Hovedbudskap | |
|---|---|
· |
Sår i munnhulen heles raskt og stort sett uten arrdannelse. Vi har vist at nerve-vekstfaktor (NGF) peptider fremmer epitelial celledeling og migrasjon. |
· |
NGF peptider forekommer i saliva mens reseptorene ligger gjemt inni dypere epitellag. Dermed kan NGF fungere som overvåkningspeptid: ved sår kan NGF komme i kontakt med reseptor og kan aktivere cellene. |
· |
«Trekløver faktor 3» (TFF3) er et annet peptid i saliva som fremmer epitelial migrasjon. Selv om reseptor er ukjent er det mulig at det også kan ha en rolle som overvåkningspeptid. |
Sårtilheling er en flertrinns prosess med overlappende faser (faktaboks 1): hemostase, restitusjon, celleoverlevelse, inflammasjon, proliferasjon og kontraksjon/vevsremodellering. Et sår i munnhulen heles raskt og uten arrdannelse, til forskjell fra et sår i huden som etterlater seg et arr etter tilhelingen. Arrene i hud kan i sjeldne tilfeller bli hypertrofiske (innenfor opprinnelig sårgrense) eller keloide (utover opprinnelig sårgrense). En grunn til at sår i munnhulen heles raskere enn i hud er nærvær av saliva som inneholder aktive komponenter som bakteriehemmende stoffer, vekstfaktorer og faktorer som fremmer cellulær vandringshastighet. Dette fører til at pasienter med xerostomi kan vise forsinket sårtilheling (1). Dette er i tråd med museforsøk der man fjernet spyttkjertlene hos mus som så viste forsinket sårtilheling (2). Undersøkelser fra 1980-tallet, der man transplanterte hud til munnhulen (3), viser dog også at type celler (orale keratinocytter versus hud-keratinocytter) spiller en rolle. Det er senere vist at celler i orale og dermale vev har forskjellige iboende tilhelingsegenskaper (4). I denne artikkelen belyses hvordan vekstfaktorene NGF og TFF3 som forefinnes i saliva, kan påvirke forskjellige faser i sårtilhelingen i munnhulen.
Nerve-vekstfaktor og «trekløver faktor 3»
Nerve-vekstfaktor (NGF; nerve growth factor) er et polypeptid som tilhører neurotrofin faktorfamilien. Rita Levi-Montalcini og Stanley Cohen ved Washington University i St Louis oppdaget NGF i 1950-årene og beskrev virkningen på nerveceller. I 1986 fikk de Nobels pris for dette. Den biologiske aktiviteten av NGF er formidlet ved binding til 2 typer reseptorer på målcellen: TrkA (tropomyosin receptor kinase A) og p75NTR (neurotrophin reseptor med molvekt på 75 kiloDalton) (5). Mens TrkA har en viktig rolle ved nervecellers overlevelse og vekst, aktiverer p75NTR signalkaskader som fører til programmert celledød (apoptose) og veksthemning hos nerveceller. p75NTR kan også virke som co-reseptor som øker binding av NGF til TrkA (5). NGF har også en funksjon utenom nerveceller, bl.a. i keratinocytter fra hud. NGF er syntetisert som propeptidet proNGF. Både NGF og proNGF er aktive som homodimerer. NGF bindes med høy affinitet til TrkA reseptor og med lav affinitet til p75NTR reseptor (5).
Peptider av trekløverfaktor (TFF) familien deler en felles trekløverdomene, en struktur som består av 42 - 43 aminosyrer i en struktur med 3 løkker (6). TFFs utskilles sammen med muciner på slimhinneoverflater (6). Trekløverfaktor familie 3 (TFF3; trefoil family 3) i saliva ble oppdaget i 1999 (7). Cysteiner i peptidsekvensen danner disulfidbindinger, og deres plassering danner strukturen i trekløverdomenene. Funksjonene til TFFs ble først beskrevet av Podolsky og medarbeidere i 1994 som viste at TFF2 og TFF3 øker migrasjon av tarmcellene in vitro (8). Om TFF3 har en spesifikk reseptor er ukjent. En nyere undersøkelse viser at den kan interagere med toll-like reseptor 2 (TLR2), som ellers er kjent som en reseptor som binder stoffer av mikrobiell opprinnelse (9).
Kilder til NGF og TFF3 i saliva, og forekomsten av NGF-reseptorer i munnhulen
Tabell 1 gir en oversikt over hvilke celler som produserer NGF, NGF-reseptorer og TFF3 i munnhulen. Vi og andre har vist at NGF finnes i human saliva (10 - 12) og NGF-konsentrasjonen i saliva ligger antakelig mellom 1 - 10 ng/ml (10, 11). Vi har imidlertid vist at hovedmengden av NGF i human saliva ikke er modent NGF, men forskjellige former av proNGF (12). Vi fant videre at hovedproduksjonen av proNGF i humane spyttkjertler skjer i alle utførselsgangene (interkalerte, stripete, og samlerør) og ikke endestykkene (acini) (figur 1). Dette gjelder alle typer spyttkjertler hos mennesket (gl. parotis, gl. submandibularis, gl. sublingualis og de små spyttkjertlene spredt i munnhulen) (12).
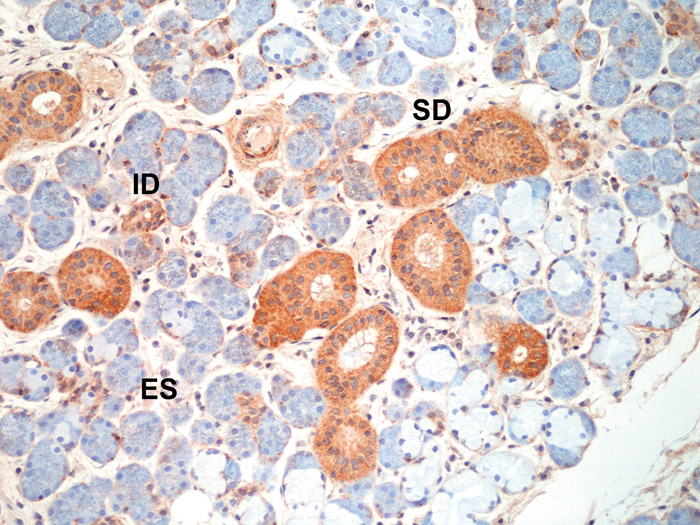
Figur 1. Produksjon av proNGF i gl. submandibularis. Brunfargen viser proNGF i interkalerte (ID) og stripete (SD) utførselsganger. Det er lite produksjon i endestykkene (ES). Kontrastfarging med hematoksylin. Foto: Institutt for oral biologi, Universitetet i Oslo.
Celletype |
Produksjon av NGF/proNGF |
NGF reseptor |
TFF3 |
|---|---|---|---|
Spyttkjertel acini |
mukøse ++serøse |
||
Spyttkjertelganger |
+ |
+ |
|
Orale keratinocytter |
+ |
+ |
+ |
Endotelceller |
+ |
+ |
- |
Fibroblaster |
+ |
+ |
- |
Vevsleukocytter |
+ |
+ |
- |
Infiltrerende leukocytter |
+ |
+ |
- |
Plateepitelet i munnhulen produserer også NGF (Figur 2). Immunfarging av biopsier fra frisk oral mukosa viser proNGF i alle lag, mens NGF-farging bare forekommer i de granulære og de øvre spinosum-lagene (13). Vi observerte at leukocytter og fibroblaster fra frisk og betent oral mukosa også produserer både proNGF og NGF (13, 14). ProNGF kan av flere enzymer bli kløyvd til NGF.
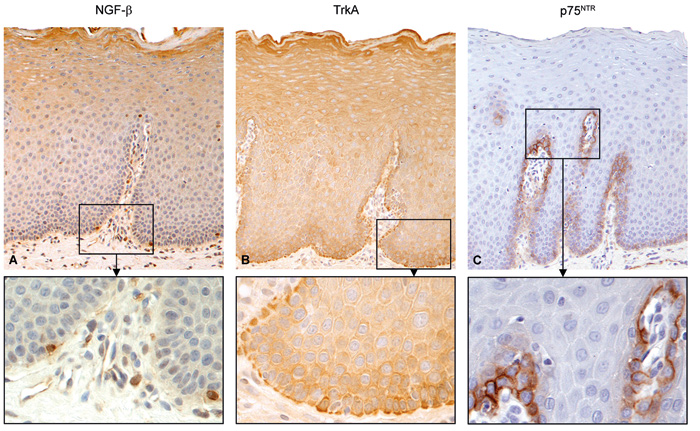
Figur 2. Uttrykk av NGF (A) og NGF-reseptorene TrkA (B) og p75NTR (C) i oral mukosa. Brunfargen angir uttrykket, blåfargen er hematoksylin kontrastfarging. Fra ref. 13, gjengitt med tillatelse av John Wiley & Sons, Inc.
NGF reseptorer finnes i de fleste bløtvev i munnhulen (13). TrkA uttrykkes primært i de basale og parabasale epitellagene, men også i de spinosale og granulære cellelagene. p75NTR finnes dog bare i de basale cellelagene (figur 2). I spyttkjertlene hos mennesket er TrkA sterkt uttrykt i alle utførselsgangene i alle typer spyttkjertler, mens p75NTR hovedsakelig finnes i de store utførselsgangene (12).
TFF3 blir også produsert i oralt epitel og spyttkjertler (15). Vi påviste TFF3 i kulturer av normale orale keratinocytter. I vevet blir TFF3 uttrykt i basallagene av det orale epitelet (figur 3A). I spyttkjertler viste immunhistokjemisk farging at TFF3 uttrykket var sterkest i mukøse acini av submandibulære og små spyttkjertlene. Serøse acini i de samme kjertlene viste svak farging (figur 3B og C). Dobbelfarging viste at TFF3 var sterkt uttrykt i mukøse, MUC5B-positive acini og i et begrenset granulært mønster i noen serøse, MUC7-positive demi-lunes og acini. I parotiskjertelen viste mange serøse svak positiv farging (15).
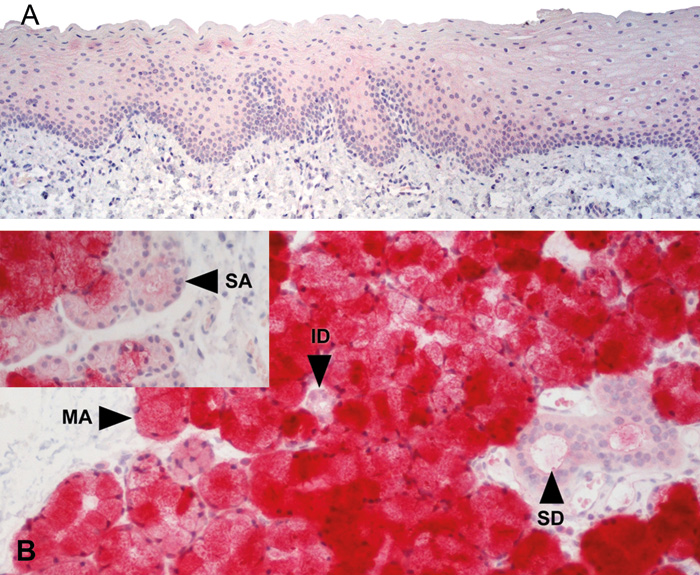
Figur 3. TFF3 uttrykk i oral mukosa (A) og små spyttkjertler (B). Rosa og rød farge angir forekomst av TFF3. ID, interkalære utførselsganger; MA, mukøse acini; SA, serøse acini; SD, stripete utførsels-ganger. Fra ref. 15. Gjengitt med tillatelse av John Wiley & Sons, Inc.
Rollen som NGF og TFF3 kan spille i de forskjellige faser ved sårtilheling av plateepitel i munnhulen
Trinnene i sårtilheling er beskrevet i faktaboks 1. Tabell 2 gir en sammenfatning over virkningene NGF kan ha ved sårtilheling i munnhulen og som beskrives nærmere nedenfor.
Trinn i sårtilhelingen |
Effekt |
|---|---|
Restitusjon |
Cellevandring, etablering av den epiteliale barrierefunksjon |
Celleoverlevelse |
Oppregulering av anti-apoptotiske proteiner |
Cellevekst |
Vekst av keratinocytter, endotelceller og fibroblaster |
Inflammasjon |
Uttrykk av adhesjonsmolekyler på endotelceller, frigjøring av inflammatoriske molekyler (interleukiner) fra basofile leukocytter og mastceller, kjemotaksi av nøytrofile leukocytter, dannelse av blodårer I granulasjonsvev. |
Vevstilheling |
Økt produksjon av matriks metalloproteinaser, differensiering av fibroblaster til myofibroblaster, fibroblast kontraksjon, apoptose av myofibroblaster |
Med hensyn til sårtilheling i munnhulen kan TFF3 og de forskjellige former av NGF agere som «overvåkningspeptider» (faktaboks 2). I tillegg kan plasmin, som dannes på grunn av blødning i såret, spalte proNGF produsert lokalt av keratinocyttene til aktivt NGF. I sårkanten vil NGF bindes til TrkA de basale keratinocyttene og fremme gjenoppretting av vevsstrukturen, som beskrevet nedenfor.
Epitelial restitusjon
Regenerering gjennom proliferasjon og differensiering er for treg til å beskytte slimhinnen effektivt mot infeksjon og væsketap. Hvis basalmembranen ikke er skadet skjer en hurtig re-epitelialisering gjennom migrasjon av nabocellene i det sårede område. Denne viktige tidlige reparasjonsprosessen begynner i løpet av minutter og er blitt kalt epitelial restitusjon (16). Restitusjon er en flertrinnsprosess som omfatter (i) reduksjon av celle-celle kontakt og endring i celleform mot en vandrende celletype, (ii) migrasjon, (iii) repolarisering og dannelse av «tight junctions» (morfologisk restitusjon) og (iv) etablering av ny barrierefunksjon (16).
Vi har vist at både NGF og TFF3 øker migrasjon av orale epitelceller (13, 17). NGF fremmer cellulær spredning, prosessen av å løsne celler fra sine naboer: NGF oppregulerer uttrykk av matriksmetalloproteinase-9 (MMP-9, type IV kollagenase) som kløyver viktige intercellulære koblinger (adherens junctions, desmosomer og tight junctions) (18), og dermed kan løsne epitelceller i sårkanten slik at de kan migrere. NGF øker motilitet av en rekke celletyper, deriblant humane dermale keratinocytter (19), fibroblaster (20) og endotelceller (21). I en in vitro-sårmodell har vi vist at både NGF og TFF3 også har denne motogene virkningen på orale keratinocytter (13, 17). Etter migrasjon må epitelcellene reetablere intercellulære «tight junctions». NGF kan oppregulere E-cadherin og zona occludens-1 protein uttrykk (22), noe som indikerer at NGF kan delta i reetablering av mukosal epitelbarrierefunksjon. Både NGF og TFF3 kan derfor bidra til den raske epiteliale restitusjonen i munnhulen.
I saliva finnes det ellers enda flere signalstoffer som kan fremme migrasjon av epitelceller, bl.a. epithelial growth factor (EGF), transforming growth factor-? (TGF-b) og histatiner (23). Flere av disse signalstoffer vil forsterke hverandre (16).
Epitelial celleoverlevelse
Effektiv reparasjon ved cellemigrasjon kan bare finne sted hvis enkeltcellene ikke dør i løpet av denne prosessen. Munnhulen har et fortrinn overfor hud fordi det er et fuktig miljø som vil forebygge dehydrering av cellene som kan øke celledød. Flere av de luminale overvåkningspeptidene kan dog i tillegg hemme apoptose av epitelceller. TFF3 er anti-apoptotisk gjennom EGFR aktivering (24). I hudkeratinocytter virker NGF også som en overlevelsesfaktor, muligens gjennom det anti-apoptotiske protein Bcl-2 (25). Vi har vist at orale epitelceller også har kapasitet til å opp-regulere anti-apoptotiske proteiner som IAP og FLIPL (26), men det har ikke blitt etablert en forbindelse med NGF eller TFF3 uttrykk og anti-apoptotiske proteiner. NGF undertrykker også endotelial celledød (27), slik at nødvendig nydannelse av blodkar ikke undermineres.
Cellevekst
Etter restitusjon er cellevekst av ulike celletyper, så som keratinocytter, endotelceller og fibroblaster, essensielle for sårtilheling. NGF stimulerer vekst av humane hudkeratinocytter (19), og dette har vi også vist for humane orale keratinocytter (13). NGF stimulerer også vekst av fibroblaster, men her produserer cellene selv nok NGF slik at ytterligere tilskudd ikke ser ut til videre å stimulere veksten (20). Dette er i overenstemmelse med observasjonen at NGF er en vekstfaktor for fibroblaster isolert fra periodontalligament (28). NGF er også vekstfremmende for endotelceller (29). Dette har ikke blitt undersøkt i celler fra munnhulen, men det er sannsynlig at NGF også her spiller en rolle ved nydannelse av blodårer ved sår i munnen.
Når det gjelder TFF3 fant vi ikke at det har effekt på proliferasjon av orale keratinocytter (17).
Inflammasjon
En annen tidlig og viktig hendelse ved epitelial sårheling er etableringen og reguleringen av aktiviteten av betennelse. Betennelse er et svar fra immunsystemet som respons på infeksjon eller vevsskade. Inflammasjonen har som mål (i) å aktivere lokale celler og enzymer for å varsle om skaden, (ii) å rekruttere hvite blodceller fra blodbanen, (iii) å gi plass til leukocyttene fra blodbanen (bindevevsresorpsjon) og (iv) å dirigere cellene i riktig retning (kjemotaksi). Betennelse beskytter verten mot infeksjon, men det har også den funksjon å resorbere og fjerne skadede celler og vevskomponenter.
Leukocytter som mastceller, eosinofiler, makrofager og lymfocytter kan produsere NGF. Mastceller, eosinofiler, basofiler, nøytrofiler, makrofager og lymfocytter kan uttrykke NGF-reseptorer, og dermed være mål for regulering av NGF (30). Pro-inflammatoriske cytokiner som IL-1b og TNF-a, som frigjøres av flere celletyper etter vevskade, fremmer NGF-syntese (30). NGF støtter opp under den inflammatoriske prosessen på flere måter. Det øker ekspresjonen av adhesjonsmolekyler som ICAM-1 på endotelceller, og letter derved rekruttering av leukocytter fra blodstrømmen og inn i det skadede vevet (29). NGF induserer frigjøring av inflammatoriske molekyler fra basofiler og mastceller, viktige celler med kapasitet til å oppdage vevsskade, og det er kjemotaktisk for og forbedrer superoksydproduksjon av nøytrofiler for å drepe bakterier (30). I oral mukosa har vi observert betennelsesceller i epitel og bindevev som uttrykker både NGF og dets reseptorer, både under friske og betente forhold (13, 14). Derfor er det sannsynlig at de ovenfor nevnte effektene av NGF også opptrer i sår i munnhulen. Det er imidlertid ikke klare bevis på at NGF har en kausal rolle i inflammatoriske prosesser: NGF produksjon kan også være et epifenomen som oppstår ved inflammatoriske reaksjoner.
Selv om inflammasjon er en nødvendighet for immunforsvaret og sårtilhelingen, viser nyere funn at sider ved inflammasjonen dog også kan forsinke tilhelingsprosessen og øke muligheten for arrdannelse (31). Føtal hud leger uten arr til slutten av tredje trimester og dette settes i forbindelse med at det utvikles lite betennelse i denne perioden. Flere studier indikerer at inflammasjon i munnhulen er mildere og mer kortvarig enn i huden, og at dette kan være en grunn til at sårtilhelingen er raskere i oral mukosa enn i hud (4). I en sammenligning mellom munnhulen og huden viser kunstig påførte sår lavere antall nøytrofiler, makrofager, mastceller og T-celler i inflammatoriske infiltrater i oral mukosa (32, 33). Også cytokinproduksjon (IL-6 og keratinocytt-derivert kjemokin) er lavere i orale enn i dermale sår (32). Saliva inneholder også flere komponenter med protease-hemmende virkning, som cystatiner (cysteine protease inhibitor) og sekretorisk leukocytt protease inhibitor (SLPI) som hemmer bl a trypsin, nøytrofil elastase og cathepsin G. Disse kan hemme utvikling av inflammasjon og vevsnedbrytning. Sammenfattet kan man si at en bedre kontrollert inflammasjonsfase kan bidra til raskere sårtilheling i munnhulen.
Vevsremodellering
Som det endelige trinn i sårtilhelingen foregår syntese og organisering av kollagen med remodellering. Fibroblaster spiller her en sentral rolle. Fibroblastene syntetiserer forskjellige typer kollagen, proteoglykaner, fibronektin and MMPer (matriks metalloproteaser). NGF øker produksjonen av MMP-9 (18). Ved sårtilheling vil forskjellige faktorer, deriblant NGF og TGF-b1, føre til differensiering av fibroblaster til proto-myofibroblaster og deretter til myo¬fibroblaster (34). Myofibroblastene er essensielle i reparasjonsprosessen, da de kontrollerer organisering av de ulike komponentene i den ekstracellulære matriksen, vevskontraksjon og sårtilheling (34). Fibroblaster og myofibroblaster har begge TrkA og p75NTR reseptorer på overflaten, men i ulik grad: fibroblaster har mange TrkA reseptorer mens p75NTR reseptorer finnes stort sett bare på myofibroblaster (20). På fibroblaster induserer NGF differensieringen til myofibroblaster og stimulerer fibroblast kontraksjon (20). For arrfri tilheling er det dog helt nødvendig at myofibroblastene tilbakedannes. p75NTR aktivering av myofibroblaster ved NGF fører til celledød og er en vei til eliminering av disse cellene slik at fullstendig sårtilheling kan finne sted (20). Regulering av fibroblaster og myofibroblaster ved NGF under oral sårtilheling er foreløpig ikke undersøkt.
Iboende egenskaper i henholdsvis hud og munnhulen spiller dog også en rolle ved arrdannelse. Det er for eksempel forskjell mellom fibroblaster fra hud og fra munnhulen. Transplanterer man hud fra ryggen på en mus inn i munnhulen og vice versa, blir utviklingen den at hud fra ryggen transplantert til munnen danner arr og at det orale vevet transplantert på ryggen ikke danner arr. En forklaring kan ligge i forskjellig forekomst av 2 typer fibroblaster, noen som uttrykker proteinet «Engrailed1» og noen som ikke gjør det (35). Den siste typen er ikke i stand til å produsere kollagen, en forutsetning for arrdannelse. På embryonalstadiet er det få slike celler og ikke arrdannelse. Under embryogenesen dannes det flere og flere Engrailed1 positive celler, og ved fødselen er det så mange positive celler i hud at arrdannelse er mulig. Hvorvidt det er flere «ikke-arrdannende» fibroblaster i munnhulen enn i hud kunne være interessant å undersøke.
Terapeutisk bruk av NGF og TFF3 ved kroniske tilstander. Anvendelse i munnhulen?
Allerede i 1979 ble det vist at fjerning av de submandibulære spyttkjertlene hos mus forsinket kontraksjonen hos eksperimentelle sår (2). Når man hos slike mus laget sår og appliserte NGF lokalt, økte hastigheten på sårtilhelingen hos dyrene (36). Dette viste klart at NGF bedrer sårtilhelingen. Senere ble det funnet tilsvarende resultater hos mennesket. Kroniske sår som ved kronisk korneal neurotropisme, kroniske hudsår og glaukom lar seg vanskelig helbrede ved konvensjonell behandling, men når pasienter ble behandlet med lokal applikasjon av NGF fra mus oppnådde man meget gode resultater (37, 38) (figur 4). Det ble ikke observert bivirkninger av behandlingen hos pasientene (37).
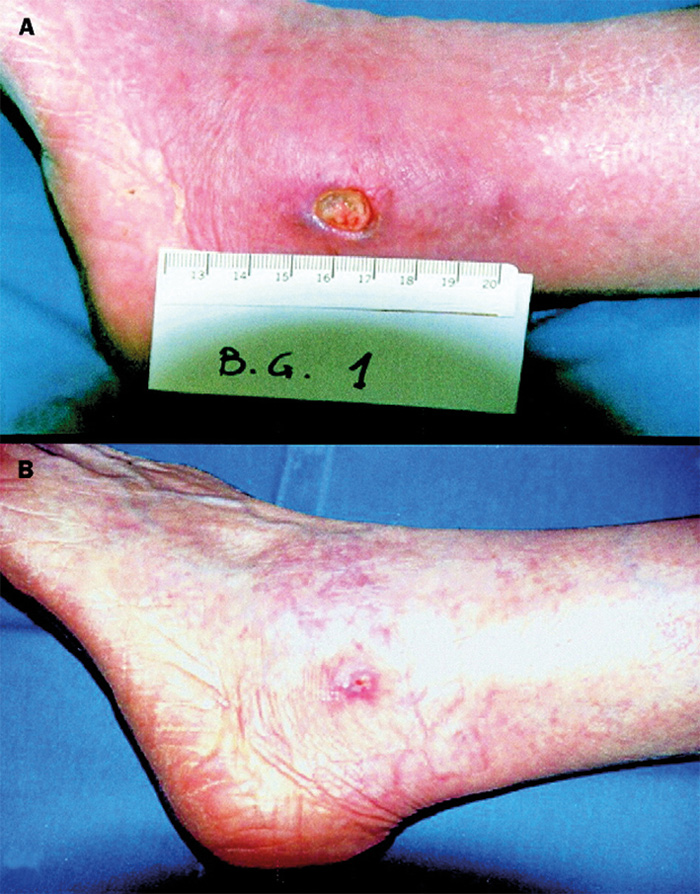
Figur 4: Kronisk sår hos en pasient med rheumatoid artritt. (A) Før behandling. (B) Etter lokal behandling med NGF for 8 uker viste såret nesten fullstendig tilheling. Fra ref. 38, gjengitt med tillatelse av Elsevier BV.
Også TFF3 er utprøvd ved skader og sykdommer. Undersøkelser på mus og kanin der man anbrakte sår på øyet til forsøksdyrene viste en gunstig effekt ved applikasjon av TFF3 (39). Også på pasienter med tørre øyne ser TFF3 ut til å kunne ha en gunstig virkning (40). Oral mukositt er en alvorlig følge av cancerbehandling ved radioterapi og kjemoterapi (41). Cytokiner og vekstfaktorer er prøvd ut ved behandling av oral mukositt hos cancerpasienter og behandling med keratinocytt vekstfaktor (Palifermin) viste gode resultater (41). TFF3 ble utprøvd på en pasientgruppe med oral mukositt, forårsaket av kjemoterapeutisk behandling for kolorektal cancer (42). Resultatene viste at TFF3 administrert med spray i munnhulen kraftig nedsatte symptomene av oral mukositt. Fordelen var mest tydelig i sårbare perioden mellom 7 og 14 dager etter oppstart av kjemoterapi, som falt sammen med den pro-apoptotiske epiteliale fasen i utvikling av oral mukositt. Behandling med NGF ble ikke utprøvd, men burde være av interesse.
Tilbakevendende orale after og aftøs stomatitt (RAS) er vanlige lidelser som kan redusere pasientens livskvalitet, føre til mye smerter og interferere med tygging og taleevne (43). Mildere tilfeller er behandlet med smertestillende midler, kortikosteroider og antimikrobielle preparater. Tilleggs¬behandling inkluderer lokal applikasjon av andre immunomodulatorer med antiinflammatorisk effekt som calcineurin hemmere, retinoider og tetracyclin. Det har vært en øket interesse for talidomid for bruk ved alvorlige, kroniske RAS (43). Det ville være interessant å utprøve NGF og TFF3 ved slike tilstander.
Bisfosfonat er et vanlig medikament for behandling av osteoporose. Pasienter som bruker dette medikamentet kan ha redusert sårtilheling etter en oral kirurgi med osteonekrose i kjeven som en fryktet komplikasjon (44). Lokal behandling med NGF eller TFF3 skulle kunne bli utprøvd også her.
Konklusjon
Flere faktorer i saliva bidrar til sårtilheling i munnhulen. NGF og TFF3 har forsøksvis blitt anvendt for å fremme sårtilheling på hud og slimhinner og har potensialet, sammen med andre aktive komponenter, til etter hvert å finne en plass i behandling av akutte og kroniske sår i munnhulen.
Takk
Vi takker medarbeiderne til originalartiklene for deres vitenskapelige bidrag: Katsuhiko Hayashi, Trond Storesund, Pernille Næsse, Kristin Kolltveit, Olav Schreurs, Andreas Karatsaidis, Edward Messelt, Harald Osmundsen, Cuong Khuu, Camilla Husvik, Dionisio Martin-Zanca, Asbjørn Røed, Magne Bryne, Tore Bjørnland og Masashi Sugisaki.
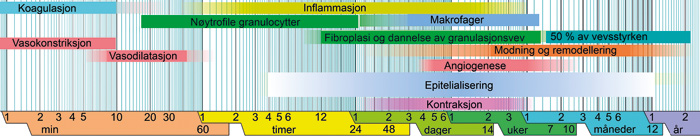
Faktaboks 1
Faser i normal sårtilheling
Sårtilheling er karakterisert ved flere, delvis overlappende, trinn (figur): hemostase, inflammasjon, migrasjon og proliferasjon, og remodellering.
Den umiddelbare responsen til dannelse av et sår er vasokonstriksjon av blodkarene i området. Dette nedsetter blødningen. Blodplater blir så aktiverte og danner en blodplateplugg, og koagulasjonskaskaden settes i gang med dannelse av et fibrinnettverk som resultat.
Selve sårtilhelingen starter med inflammasjonsfasen. Vasodilatasjon og øket vaskulær permeabilitet fører til at plasmaliknende væske kan sive ut i sårområdet og at leukocytter, især nøytrofile granulocytter, lettere kan trenge inn i vevet. Den primære oppgaven i den tidlige fasen av inflammasjonen er å fjerne bakterier, men også å skille ut faktorer som stimulerer deling og migrering av epitelceller og fibroblaster. En gruppe signalstoffer som betegnes som kjemokiner (f.eks. IL-8) blir frigjort i sårområdet. Celler som har kjemokinreseptor reagerer med å vandre i retningen der kjemokinene blir utskilt. Raskt (en time) etter sårdannelse ser man nøytrofile granulocytter i sårområdet. Disse har som oppgave å fjerne mikrober fra såret. I en senere fase vil antall makrofager i vevet øke. Disse cellene har oppgaver med å fjerne nekrotisk celleavfall og medvirke til at området blir befolket av celler som skal delta i regenerasjon av vevet, som fibroblaster og endotelceller.
Nokså tidlig etter sårdannelse vil flere typer celler, deriblant epitelceller (keratinocytter), endotelceller og fibroblaster begynne å vandre inn i sårområdet. Regenerering gjennom proliferasjon og differensiering er for treg til å beskytte slimhinnen effektivt mot infeksjon og væsketap. Hvis basalmembranen ikke er skadet, skjer en hurtig re-epitelialisering gjennom migrasjon av nabocellene i det sårede området. Keratinocytter i sårkanten vil løsne og begynne å migrere over såroverflaten og prøve å dekke over såret. Cellene løsner «i bakkant», fester seg i forkant og haler seg innpå sårområdet. Denne prosessen kalles epitelial restitusjon og er en fase som forutgår celledeling. Effektiv reparasjon ved cellemigrasjon kan oppnås bare hvis cellene ikke dør i løpet av denne prosessen: cellene trenger å være beskyttet mot apoptose (programmert celledød hvor et selvmordsprogram aktiveres på gennivå) og det skjer ved at det dannes anti-apoptotiske faktorer i cellene. Etter hvert vil keratinocyttene begynne å dele seg og differensiere til et nytt plateepitel. Nye kapillærer dannes og det løse vevet utvikles til granulasjonsvev. Etter 1 - 2 dager migrerer fibroblaster inn i sårområdet, deler seg og begynner å produsere nye intercellulære matriksproteiner. Etter dannelse av ny kollagenmatriks vil myofibroblaster som har festepunkter til ekstracellulære kollagenfibre, kontrahere vevet.
Siste fase i sårtilhelingen er remodellering. Kollagennettverket blir bygget om og celler som ikke lenger er nødvendige fjernes ved apoptose (programmert celledød). Det er spesielt viktig at myofibroblaster tilbakedannes: fordi myofibroblaster er meget aktive i syntese av ekstracellulær matriks fører vedvarende nærvær av disse cellene til overdreven arrdannelse og svekkelse av vevet.
(Modifisert etter Häggström M. «Medical gallery of Mikael Häggström 2014». Wikiversity Journal of Medicine)
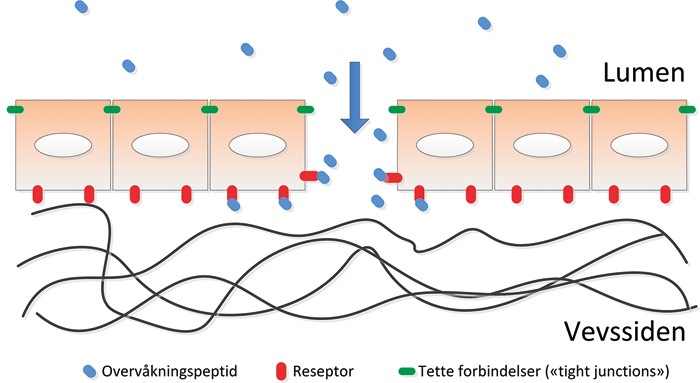
Faktaboks 2
Overvåkningspeptider
Prinsippet om luminale «overvåkningspeptider» er basert på at epiteliale celler under normale forhold har tette forbindelser (tight junctions) som danner en barriere som skiller stoffer i lumen (f eks i spytt) fra deres reseptorer som ligger utilgjengelige. Ved et sår vil så overvåkningspeptidene i munnhulen få adgang til reseptorene som vanligvis ligger skjult i det underliggende vevet, og aktivere cellene. Dette er tidligere vist i tykktarmen hvor reseptorene til epidermal vekstfaktor (EGF) bare sitter på den basolaterale siden av epitelcellene (45). Ved et sår kan vekstfaktorer i tarmlumen få tilgang til reseptorer, og delta i sårtilheling. Tilsvarende kan tenkes ved sår i munnhulen der NGF og proNGF i saliva vil få tilgang til sine reseptorer på keratinocytter som under normale forhold ikke er tilgjengelige. Det samme kan tenkes for TFF3, men der er reseptoren foreløpig ukjent.
English summary
Schenck K, Helgeland, K.
Rapid and scar-free wound healing in the oral cavity: a role of signaling molecules in saliva?
212-219
Wound healing is a complex process consisting of a sequence of consecutive events. In the oral cavity, wounds heal quickly and mostly without scarring, unlike in the skin. One reason for this is the presence of saliva which contains substances that promote healing. We have examined some of the effects of the signaling molecules nerve growth factor (NGF) and trefoil family 3 (TFF3) which are released in saliva. Along with other studies, our findings indicate that these signaling molecules affect different phases of oral wound healing and that they therefore may be promising candidates for promoting healing of acute and chronic wounds, both in the oral cavity and the skin.
professor, dr.odont., Institutt for oral biologi, Det odontologiske fakultet, Universitetet i Oslo
professor emeritus, dr.phil., Institutt for oral biologi, Det odontologiske fakultet, Universitetet i Oslo
Referanser
Epstein JB, Scully C. The role of saliva in oral health and the causes and effects of xerostomia. J Can Dent Assoc. 1992; 58: 217 - 21.
Hutson JM, Niall M, Evans D, Fowler R. Effect of salivary glands on wound contraction in mice. Nature. 1979; 279: 793 - 5.
Reilly JS, Behringer WH, Trocki I. Intraoral keloid: complication of forehead flap. Otolaryngol Head Neck Surg. 1980; 88: 139 - 41.
Glim JE, van Egmond M, Niessen FB, Everts V, Beelen RH. Detrimental dermal wound healing: what can we learn from the oral mucosa? Wound Repair Regen. 2013; 21: 648 - 60.
Dechant G. Molecular interactions between neurotrophin receptors. Cell Tissue Res. 2001; 305: 229 - 238.
Thim L, May FE. Structure of mammalian trefoil factors and functional insights. Cell Mol Life Sci. 2005; 62: 2956 - 73.
Jagla W, Wiede A, Hinz M, Dietzmann K, Gulicher D, Gerlach KL, Hoffmann W. Secretion of TFF-peptides by human salivary glands. Cell Tissue Res. 1999; 298: 161 - 6.
Dignass A, Lynch-Devaney K, Kindon H, Thim L, Podolsky DK. Trefoil peptides promote epithelial migration through a transforming growth factor beta-independent pathway. J Clin Invest. 1994; 94: 376 - 83.
Lin N, Xu LF, Sun M. The protective effect of trefoil factor 3 on the intestinal tight junction barrier is mediated by toll-like receptor 2 via a PI3K/Akt dependent mechanism. Biochem Biophys Res Commun. 2013; 440: 143 - 9.
Ruhl S, Hamberger S, Betz R, Sukkar T, Schmalz G, Seymour RA, Hiller KA, Thomason JM. Salivary proteins and cytokines in drug-induced gingival overgrowth. J Dent Res. 2004; 83: 322 - 6.
Nam JW, Chung JW, Kho HS, Chung SC, Kim YK. Nerve growth factor concentration in human saliva. Oral Dis. 2007; 13: 187 - 92.
Naesse EP, Schreurs O, Messelt E, Hayashi K, Schenck K. Distribution of nerve growth factor, pro-nerve growth factor, and their receptors in human salivary glands. Eur J Oral Sci. 2013; 121: 13 - 20.
Hayashi K, Storesund T, Schreurs O, Khuu C, Husvik C, Karatsaidis A, Helgeland K, Martin-Zanca D, Schenck K. Nerve growth factor beta/pro-nerve growth factor and their receptors in normal human oral mucosa. Eur J Oral Sci. 2007; 115: 344 - 54.
Hayashi K, Karatsaidis A, Schreurs O, Bjørnland T, Sugisaki M, Schenck K. NGF and its receptors TrkA and p75NTR in the epithelium of oral lichen. J Oral Pathol Med. 2008; 37: 241 - 8.
Storesund T, Schreurs O, Messelt EB, Kolltveit KM, Schenck K. Trefoil factor family 3 expression in the oral cavity. Eur J Oral Sci. 2009; 117: 636 - 43.
Hoffmann W. Trefoil factors TFF (trefoil factor family) peptide-triggered signals promoting mucosal restitution. Cell Mol Life Sci. 2005; 62: 2932 - 8.
Storesund T, Hayashi K, Kolltveit KM, Bryne M, Schenck K. Salivary trefoil factor 3 enhances migration of oral keratinocytes. Eur J Oral Sci. 2008; 116: 135 - 40.
Blanco-Mezquita T, Martinez-Garcia C, Proença R, Zieske JD, Bonini S, Lambiase A, Merayo-Lloves J. Nerve growth factor promotes corneal epithelial migration by enhancing expression of matrix metalloprotease-9. Invest Ophthalmol Vis Sci. 2013; 54: 3880 - 90.
Pincelli C, Sevignani C, Manfredini R, Grande A, Fantini F, Bracci-Laudiero L, Aloe L, Ferrari S, Cossarizza A, Giannetti A. Expression and function of nerve growth factor and nerve growth factor receptor on cultured keratinocytes. J Invest Dermatol. 1994; 103: 13 - 8.
Palazzo E, Marconi A, Truzzi F, Dallaglio K, Petrachi T, Humbert P, Schnebert S, Perrier E, Dumas M, Pincelli C. Role of neurotrophins on dermal fibroblast survival and differentiation. J Cell Physiol. 2012; 227: 1017 - 25.
Rahbek UL, Dissing S, Thomassen C, Hansen AJ, Tritsaris K. Nerve growth factor activates aorta endothelial cells causing PI3K/Akt- and ERK-dependent migration. Pflugers Arch. 2005; 450: 355 - 61.
Tan L, Hatzirodos N, Wormald PJ. Effect of nerve growth factor and keratinocyte growth factor on wound healing of the sinus mucosa. Wound Repair Regen. 2008; 16: 108 - 16.
Brand HS, Ligtenberg AJ, Veerman EC. Saliva and wound healing. Monogr Oral Sci. 2014; 24: 52 - 60.
Taupin DR, Kinoshita K, Podolsky DK. Intestinal trefoil factor confers colonic epithelial resistance to apoptosis. Proc Natl Acad Sci U S A. 2000; 97: 799 - 804.
Pincelli C, Haake AR, Benassi L, Grassilli E, Magnoni C, Ottani D, Polakowska R, Franceschi C, Giannetti A. Autocrine nerve growth factor protects human keratinocytes from apoptosis through its high affinity receptor (TRK): a role for BCL-2. J Invest Dermatol. 1997; 109: 757 - 64.
Karatsaidis A, Hayashi K, Schreurs O, Helgeland K, Schenck K. Survival signalling in keratinocytes of erythematous oral lichen planus. J Oral Pathol Med. 2007; 36: 215 - 22.
Graiani G, Emanueli C, Desortes E, Van Linthout S, Pinna A, Figueroa CD, Manni L, Madeddu P. Nerve growth factor promotes reparative angiogenesis and inhibits endothelial apoptosis in cutaneous wounds of Type 1 diabetic mice. Diabetologia. 2004; 47: 1047 - 54.
Kurihara H, Shinohara H, Yoshino H, Takeda K, Shiba H. Neurotrophins in cultured cells from periodontal tissues. J Periodontol. 2003; 74: 76 - 84.
Raychaudhuri SK, Raychaudhuri SP, Weltman H, Farber EM. Effect of nerve growth factor on endothelial cell biology: proliferation and adherence molecule expression on human dermal microvascular endothelial cells. Arch Dermatol Res. 2001; 293: 291 - 5.
Bonini S, Rasi G, Bracci-Laudiero ML, Procoli A, Aloe L. Nerve growth factor: neurotrophin or cytokine? Int Arch Allergy Immunol. 2003; 131: 80 - 4.
Eming SA, Krieg T, Davidson JM. Inflammation in wound repair: molecular and cellular mechanisms. J Invest Dermatol. 2007; 127: 514 - 25.
Szpaderska AM, Zuckerman JD, DiPietro LA. Differential injury responses in oral mucosal and cutaneous wounds. J Dent Res. 2003; 82: 621 - 6.
Mak K, Manji A, Gallant-Behm C, Wiebe C, Hart DA, Larjava H, Häkkinen L. Scarless healing of oral mucosa is characterized by faster resolution of inflammation and control of myofibroblast action compared to skin wounds in the red Duroc pig model. J Dermatol Sci. 2009; 56: 168 - 80.
Desmoulière A, Chaponnier C, Gabbiani G. Tissue repair, contraction, and the myofibroblast. Wound Repair Regen. 2005; 13: 7 - 12.
Rinkevich Y, Walmsley GG, Hu MS, Maan ZN, Newman AM, Drukker M, Januszyk M, Krampitz GW, Gurtner GC, Lorenz HP, Weissman IL, Longaker MT. Skin fibrosis. Identification and isolation of a dermal lineage with intrinsic fibrogenic potential. Science. 2015; 348: aaa2151.
Li AK, Koroly MJ, Schattenkerk ME, Malt RA, Young M. Nerve growth factor: acceleration of the rate of wound healing in mice. Proc Natl Acad Sci U S A. 1980; 77: 4379 - 81.
Manni L, Rocco ML, Bianchi P, Soligo M, Guaragna M, Barbaro SP, Aloe L. Nerve growth factor: basic studies and possible therapeutic applications. Growth Factors. 2013; 31: 115 - 22.
Tuveri M, Generini S, Matucci-Cerinic M, Aloe L. NGF, a useful tool in the treatment of chronic vasculitic ulcers in rheumatoid arthritis. Lancet. 2000; 356: 1739 - 40.
Schulze U, Sel S, Paulsen FP. Trefoil factor family peptide 3 at the ocular surface. A promising therapeutic candidate for patients with dry eye syndrome? Dev Ophthalmol. 2010; 45: 1 - 11.
Schulze U, Hampel U, Sel S, Contreras-Ruiz L, Schicht M, Dieckow J, Diebold Y, Paulsen F. Trefoil factor family peptide 3 (TFF3) is upregulated under experimental conditions similar to dry eye disease and supports corneal wound healing effects in vitro. Invest Ophthalmol Vis Sci. 2014; 55: 3037 - 42.
Raber-Durlacher JE, von Bültzingslöwen I, Logan RM, Bowen J, Al-Azri AR, Everaus H, Gerber E, Gomez JG, Pettersson BG, Soga Y, Spijkervet FK, Tissing WJ, Epstein JB, Elad S, Lalla RV; Mucositis Study Group of the Multinational Association of Supportive Care in Cancer/International Society of Oral Oncology (MASCC/ISOO). Systematic review of cytokines and growth factors for the management of oral mucositis in cancer patients. Support Care Cancer. 2013; 21: 343 - 55.
Peterson DE, Barker NP, Akhmadullina LI, Rodionova I, Sherman NZ, Davidenko IS, Rakovskaya GN, Gotovkin EA, Shinkarev SA, Kopp MV, Kulikov EP, Moiseyenko VM, Gertner JM, Firsov I, Tuleneva T, Yarosh A, Woon CW. Phase II, randomized, double-blind, placebo-controlled study of recombinant human intestinal trefoil factor oral spray for prevention of oral mucositis in patients with colorectal cancer who are receiving fluorouracil-based chemotherapy. J Clin Oncol. 2009; 27: 4333 - 8.
Liang MW, Neoh CY. Oral aphthosis: management gaps and recent advances. Ann Acad Med Singapore. 2012; 41: 463 - 70.
Marx RE. Pamidronate (Aredia) and zoledronate (Zometa) induced avascular necrosis of the jaws: a growing epidemic. J Oral Maxillofac Surg. 2003; 61: 1115 - 7.
Playford RJ, Wright NA. Why is epidermal growth factor present in the gut lumen? Gut. 1996; 38: 303 - 5.
Adresse: Karl Schenck, Institutt for oral biologi, Postboks 1052 Blindern, N-0316 Oslo. E-post: karl.schenck@odont.uio.no
Artikkelen har gjennomgått ekstern faglig vurdering.
Schenck K, Helgeland K. Rask og effektiv sårtilheling i munnhulen: en rolle for signalmolekyler i saliva? Nor Tannlegeforen Tid. 2016; 126: 212-219