Dentale restaureringsmaterialer: Biologiske egenskaber og deres kliniske konsekvenser
Tandrestaureringsmaterialer indeholder en mængde forskellige stoffer med ulige biologiske egenskaber. I mundhulen udsættes materialerne for både mekaniske, kemiske, mikrobielle og enzymatiske påvirkninger, og substanser kan frigives fra materialerne. Frigivne substanser kan medføre biologiske effekter i mundslimhinden, eller de kan absorberes og distribueres systemisk og give generelle reaktioner. I artiklen diskuteres biologiske mekanismer, som kan have betydning for frigivelse af stoffer fra polymerbaserede tandrestaureringsmaterialer, samt de biologiske konsekvenser på celleniveau. Endvidere diskuteres mekanismer for mulige kliniske konsekvenser af eksponering for frigivne stoffer med fokus på overfølsomhed, allergi og toksicitet.
Patienter med reaktioner, som antages at være relaterede til tandmaterialer, bør gennemgå en systematisk udredning. Allergisk kontaktmucositis kan fx forekomme hos patienter med allergi overfor guld, som samtidig har restaureringer, der indeholder guld. Ved kontaktallergiske læsioner i mundslimhinden, fx lichenoid kontaktlæsion, er det indiceret at udskifte det materiale, som patienten reagerer på.
Artiklen giver kliniske råd om, hvordan risikoen for bivirkningsreaktioner kan minimeres, samt om, hvordan reaktioner mod tandrestaureringsmaterialer rapporteres.
Hovedpunkter | |
|---|---|
· |
Inden for tandplejen anvendes mange forskellige typer af materialer, som kan frigive substanser og i sjældne tilfælde forårsage uønskede biologiske reaktioner. |
· |
Reaktionerne kan være lokale i mundslimhinden eller generelle og forårsagede af overfølsomhedsreaktioner, allergiske reaktioner og eventuelt toksiske effekter. |
· |
Allergisk kontaktmucositis kan opstå hos patienter med allergi mod substanser som frigives, fx guld fra guldlegeringer og kviksølv fra amalgamfyldninger. |
· |
Ved kontaktallergisk læsion i mundslimhinden (lichenoid kontaktlæsion), er det indiceret at udskifte det materiale, som er årsag til reaktionen. |
· |
Alle alvorlige reaktioner, som fx har forårsaget eller kunne have forårsaget alvorlig svækkelse af helbredet, skal rapporteres til de ansvarlige myndigheder. Det er vigtigt, at alle typer af reaktioner rapporteres til fabrikanten eller importøren samt om muligt også gennem producentuafhængige rapporteringssystemer. |
Tandrestaureringsmaterialer er blandt de mest anvendte kunstige materialer hos mennesker. De spænder fra materialer for forebyggelse til materialer, som anvendes til omfattende restaureringer af tænder. De fleste i befolkningen bliver på et tidspunkt eksponeret for dentale materialer i en eller anden form.
Der er et meget stort, men ukendt antal produkter fra forskellige producenter på det europæiske marked. Alle tandrestaureringsmaterialer er klassificeret som medicinsk-teknisk udstyr i henhold til det aktuelle europæiske direktiv (MDD 93/42/EEC) og bliver CE-mærket i henhold hertil. CE-mærkningen indebærer, at direktivets grundlæggende krav opfyldes. Disse krav er generelle, fx at materialerne er egnede til formålet, og at de ikke har skadevirkninger. Dette er procedurer, som ligger i hænderne på producenterne, kontrolleret af såkaldte tekniske kontrolorganer, dvs. firmaer som er akkrediteret til dette. Selv om CE-mærkning ikke sikrer detaljeret odontologisk kvalitet, er det vigtigt, at mærkningen indebærer en ansvarliggørelse af producenterne med hensyn til uønskede hændelser og kvalitetsproblemer med materialerne.
Holdbarhed og årsager til revision af restaureringer afhænger af mange faktorer: biologiske og tekniske egenskaber, og ikke mindst operatør- og patientfaktorer. Tandfyldningsmaterialer degraderes i mundhulen i varierende grad. Substanserne, som frigives, kan forårsage biologiske virkninger, som efterfølgende kan give uønskede kliniske reaktioner, fx ved toksiske mekanismer, overfølsomhedsreaktioner og allergi (figur 1).
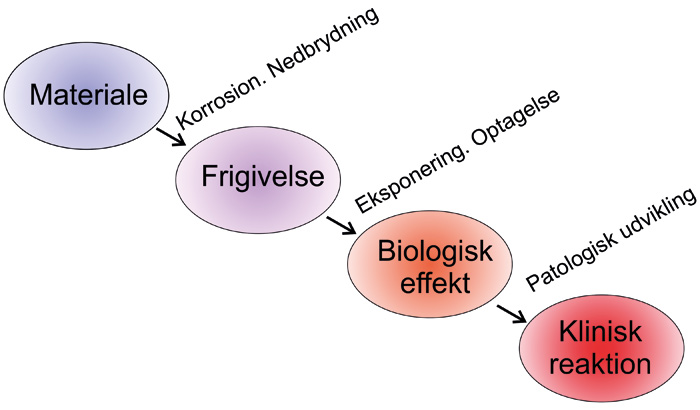
Figur 1. Bivirkningssekvens: Fra tilstedeværelse af et materiale til mulig uønsket klinisk reaktion.
Denne artikel handler om biologiske egenskaber ved tandrestaureringsmaterialer og deres eventuelle kliniske betydning, baseret på information fra laboratorieforsøg (in vitro-studier) og observerede kliniske reaktioner. Potentielle bivirkningsreaktioner ved tandrestaureringsmaterialer diskuteres med hensyn til stoffer, som kan antages at være primære risikofaktorer for materialereaktioner ved brug af det pågældende materiale. Dette er et ræsonnement, som i princippet kan omfatte alle kunstige biomaterialer, som anvendes på mennesker.
Frigørelse af substanser fra materialer
Dentale restaureringsmaterialer er udsat for store mekaniske, kemiske, mikrobielle og enzymatiske påvirkninger under klinisk brug.
Korrosion af metaller og keramer
Metaller og legeringer anvendes mest til kroner og broer samt til aftagelige protetiske konstruktioner. Metaller kan være ædle som de klassiske guldlegeringer eller uædle, hvoraf kobolt-krom-legeringer nok er de mest anvendte i dag (se egen artikel herom i dette tema). Alle metalliske legeringer afgiver metaller til omgivelserne, enten i ionisk form eller som partikler (1 - 3). Dette gælder også metalliske ortodontiske materialer og metaller, som anvendes i forbindelse med implantatbehandling. Også keramiske materialer afgiver substanser, men mængden bedømmes at være lav (3,4).
Frigivelse af substanser fra polymere materialer
Mekanismerne ved frigivelse af substanser fra polymere materialer er komplekse. Det kan ske gennem nedbrydning (degradering) af materialet eller via diffusion og frigivelse af ikke-polymeriserede monomerer eller andre stoffer. Umiddelbart efter at en ny plastfyldning er lagt, kan monomerer fra materialerne påvises i saliva; men allerede efter en uge er niveauerne ikke detekterbare (5).
Enzymatisk nedbrydning: I saliva findes der en række enzymer, som bl. a. bidrager ved fordøjelse og antibakterielt forsvar. Salivære esteraser har også evnen til at spalte esterbindinger i polymerbaserede materialer. In vitro-studier har vist, at human saliva har enzymaktivitet, som kan nedbryde esterbindinger i bisfenol A glycidyl-metakrylat (BisGMA; figur 2) og trietylenglykol-dimetakrylat (TEGDMA), altså monomerer som benyttes i binding og kompositter, og at human saliva forøger degradering og frigivelse af degraderingsprodukter fra kompositter (6).
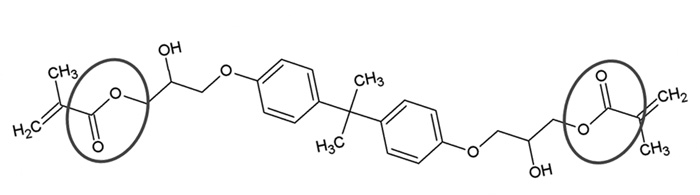
Figur 2. Strukturen på bisfenol A glycidyl-metakrylat (Bis-GMA): Bis-GMA er eksempel på en dimetakrylatmonomer, som benyttes i kompositter og bonding. Cirklerne angiver esterbindinger, og hvor disse kan degraderes ved tilstedeværelse af esterase (enzym) og vand. Esterbindingen vil også være eksponeret i polymeriseret tilstand.
Mikrobiel nedbrydning og biodegradering: Udover enzymer og vand i saliva vil materialer, som benyttes oralt, være eksponeret for mikroorganismer. Det orale mikrobiom består af mange forskellige bakterielle arter (7), som kan kolonisere restaureringsmaterialer og danne biofilm.
Der er rapporteret dannelse af tykkere biofilm på kompositter og keramer sammenlignet med glasionomer in situ (8), og biofilm på komposit angives at have højere vitalitet sammenlignet med biofilm på amalgamfyldninger (9). Der er også beskrevet forøget mængde af Streptococcus mutans ved fyldninger af komposit sammenlignet med amalgam og glasionomer (10) samt forøget proportion af cariesassocierede bakterier ved kompositrestaurerede flader sammenlignet med ikke-restaureret dentin og emalje (11).
In vitro-studier har vist, at biofilm på komposit kan øge degradering og overfladeruhed (12,13). Enzymer med esteraseaktivitet produceret af S. mutans har i denne sammenhæng vist sig at øge degradering af binding og komposit (14). In vitro-studier indikerer også, at biodegradering kan øge bakteriel mikrolækage i interfasen mellem dentin og materiale (15). Nedbrydningsprodukter fra dentale monomerer har vist sig at kunne påvirke bl. a. bakteriel vækst og gen-ekspression (13,16,17). Det er også rapporteret, at eluater fra og monomerer benyttet i komposit forøger produktionen af vanduopløseligt glukan, et ekstracellulært polysakkarid, der er knyttet til bakteriens cariesfremmende egenskaber, hos Streptococcus sobrinus (18).
Materialet, man benytter ved en restaurering, kan således efter alt at dømme påvirke dental biofilm ved afgivelse af monomerer og nedbrydningsprodukter fra kompositter og antibakterielle produkter som kviksølv og kobber fra amalgam (19,20) og fluor og aluminium fra glasionomerbaserede materialer (21).
Der har været indikationer på, at restaureringsmaterialet synes at påvirke sammensætningen af den mikrobielle flora ved sekundærcaries, da der har været påvist forøget antal mikroorganismer og større mikrobiel mangfoldighed fra sekundærcaries under kompositfyldninger sammenlignet med amalgam (22). En nyere undersøgelse rapporterede derimod ingen signifikant forskel i sammensætningen af den mikrobielle flora fra sekundærcaries, hvor der var benyttet komposit hhv. amalgam (23).
Basale mekanismer for biologiske reaktioner
Interaktion med cellulære molekyler
Metakrylatmonomererne HEMA og TEGDMA, som ofte benyttes i kompositter, binding og for sidstnævntes vedkommende også i resinmodificeret glasionomer, er blandt de mest undersøgte i cellekultursystemer. Det er påvist, at monomererne binder til glutation (GSH) i celler relativt hurtigt (minutter til timer) efter eksponering (24,25). En sådan reaktion er generelt detoksificerende og giver lavere reaktivitet af fremmedstoffet og øget vandopløselighed (letter udskillelsen fra kroppen) (26). Ved højere eksponeringskoncentrationer vil underskud af GSH i eksponerede celler imidlertid kunne forstyrre cellernes redoxbalance. Endvidere antager man, at monomerernes cysteinreaktivitet ikke er specifik for GSH, men også sker i proteiner. Strukturelle forandringer af kroppens proteiner som følge af en sådan protein-monomer-kompleksdannelse kan være en forklaring på stoffernes allergiske potentiale. Cystein og modifikationer af cystein i proteiner er vigtige for mange proteiners funktion. Binding af monomer til cystein kan derfor også have andre effekter på levende celler, end vi til dato kender.
Det har været antydet, at metakrylater kan interagere med andre cellulære molekyler end proteiner og GSH som fx lipider og DNA (27,28). Det er påvist, at celler aktiverer DNA-skaderesponsmekanismer ved eksponering for både HEMA og TEGDMA (29,30). I de fleste forsøg er der imidlertid benyttet koncentrationer, som er relativt høje sammenlignet med dem, som måles klinisk. Ved brug af klinisk mere relevante koncentrationer foreligger der ikke undersøgelser, som giver et sikkert grundlag for at sige, at metakrylaterne er gentoksiske.
Partikler. Nanopartikler
Hvordan nedbrydningsprodukter fra materialerne påvirker levende celler, er sparsomt undersøgt. Dette gælder både de nævnte polymer- og monomernedbrydningsprodukter og fyldpartikler, som frigives ved slitage, pudsning og udskiftning af komposit. Partiklerne, som benyttes i materialerne, er af forskellig størrelse, og de mindste er nanopartikler (fra 1 til 100 nanometer). Fra partikelforskning generelt ser man, at nanopartikler kan give andre biologiske effekter end større partikler med samme kemiske sammensætning. Dette kan bl. a. forklares ved, at enkelte barrierer, som fx cellemembraner, er mindre effektive over for mindre partikler. Kortlægningen af eksponering for partikler, der frigives fra tandbehandlingsmaterialer, er mangelfuld, både med hensyn til mængde og karakterisering. En sådan kortlægning er vigtig for at afdække et eventuelt bivirkningspotentiale.
Studier, som har undersøgt toksiciteten af tandrestaureringsmaterialer, er stort set udført i cellelinjer, som ikke kan forventes at være en sufficient model for en kompleks multicellulær organisme. Undersøgte stoffer kan fremstå som enten mere eller mindre skadelige i cellekulturer sammenlignet med celler i kroppen. Resultaterne må derfor tolkes med forsigtighed med henblik på kliniske konsekvenser. Trods forskelle er in vitro-modeller et vigtigt værktøj til at afdække mulige molekylære interaktioner i celler, og de kan således give et godt udgangspunkt for en risikovurdering.
Faktaramme
Rapportering av uønskede hendelser - Norge
I Norge gjelder lignende regelverk for medisinsk utstyr som i Danmark. Hendelser som har ført til eller kunne ha ført til død, eller alvorlig forverring av en pasients, brukers eller annen persons helsetilstand og som har eller kan ha sammenheng med bruk av medisinsk utstyr skal rapporteres til Helsedirektoratet (https://helsedirektoratet.no/medisinsk-utstyr/meld-korrigerende-tiltak-feil-og-uonsket-hendelse-med-medisinsk-utstyr#meldeskjema-for-virksomhet-som-bruker-medisinsk-utstyr). Produsent skal også informeres.
Mindre alvorlige hendelser bør meldes til produsenten av materialet, enten direkte eller via dennes representant.
Biologiske bivirkninger skal også rapporteres til Bivirkningsgruppen for odontologiske biomaterialer (www.bivirkningsgruppen.no).
Legemiddelbivirkninger meldes til Relis (https://relis.no).
Det er pliktig å melde bivirkninger ved kosmetiske produkter (for eksempel blekemidler) brukt i tannlegevirksomhet til Folkehelseinstituttet (https://www.fhi.no/ml/kosmetikk/slik-melder-du-inn-bivirkninger-ved/)
Kliniske biologiske reaktioner
Dentalmaterialer er i høj grad biokompatible, og uønskede reaktioner (bivirkninger) på dentalmaterialer, som anvendes i henhold til brugsanvisningen, er sjældne; men der kan dog ske svigt i rutiner, fx spild af bindingsmateriale på gingiva. Dette øger risikoen for en uønsket reaktion. Disse tilfælde kan i teorien betragtes som afvigelser; men det er ikke praktisk muligt at skelne mellem uønskede reaktioner, som er sket på grund af, at brugsanvisningen ikke er blevet fulgt, og tilfælde hvor materialet er blevet anvendt ifølge anvisningen. Derfor omfattes alle uønskede reaktioner på dentalmaterialer hos patienter af begrebet «bivirkning».
Større epidemiologiske undersøgelser om forekomst af bivirkninger ved dentalmaterialer savnes. Det anslås dog, at uønskede reaktioner mod alle typer af dentalmaterialer forekommer ved ca. 0,1 % af alle behandlinger (31).
Kliniske manifestationer
Bivirkninger fra dentalmaterialer kan klinisk manifestere sig som fx orale lichenoide kontaktlæsioner, stomatitis/mucositis, sårdannelser, ødem og rubor (figur 3 - 4). Symptomer kan være fx smerte og stikken. Andre tegn og symptomer kan være urticaria og dermatitis. Samtidig kan det antages, at en relativt stor andel af bivirkningerne efter tandbehandling heler relativt hurtigt og dermed aldrig bliver observeret af den behandlende tandlæge. Patienter kan også være bekymrede for risikoen for bivirkninger fra et bestemt materiale, og dermed kan uønskede reaktioner af subjektiv natur medieres. Sådanne mekanismer tager vi ikke op i denne oversigt.
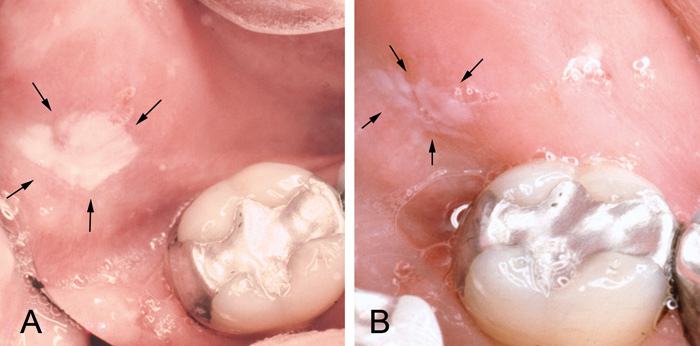
Figur 3. Lichenoid kontaktreaktion ved en bukkal amalgamfyldning: Før udskiftning (A) og tre uger efter udskifting til glasionomercement (B). Reaktionen var knap synlig efter ca. to måneder.
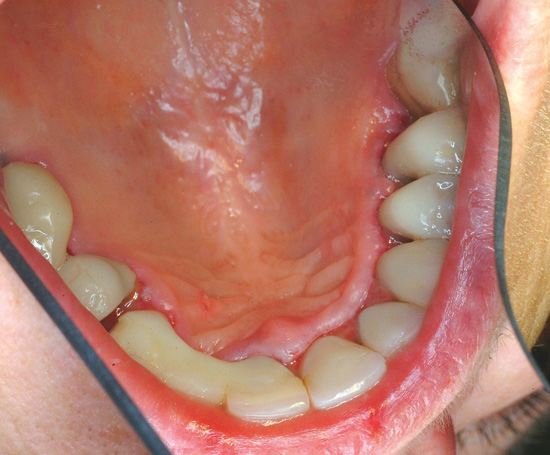
Figur 4. Reaktion efter behandling med plastbaseret cement: Sår i den marginale gingiva efter behandling med plastbaseret cement. Patienten var allergisk mod monomererne EGDMA og 2-HEMA. En samtidig toksisk reaktion mod akrylater kan ikke udelukkes.
Der er en række omstændigheder, som skal være opfyldt, før en klinisk reaktion mod et dentalmateriale kan opstå. Materialet skal frigive en eller flere substanser, som kan optages i mundslimhinde, mave-tarm eller lunger, og distribueres til celler, hvor substansen giver en biologisk effekt. Ved tilstrækkeligt høj dosis kan en klinisk effekt observeres (figur 1). Den kliniske effekt kan være forårsaget af toksiske mekanismer eller overfølsomhedsreaktioner/allergi.
Toksiske og allergiske mekanismer
Eksponering for toksiske stoffer giver - afhængigt af dosis - toksiske effekter. I princippet kan alle stoffer være toksiske, det er kun et spørgsmål om dosis («sola dosis facit venenum»; Paracelsus, 1493 - 1541). Den toksiske effekt kan medieres af, at stoffet bindes til vigtige kemiske grupper i fx proteiner og på den måde påvirker funktionen af enzymer, membraner, transportmekanismer og strukturelle proteiner. Stoffer kan også generere frie radikaler eller påvirke DNA og derigennem være mutagene.
Et centralt begreb inden for toksikologien er sammenhængen mellem dosis og respons. Generelt gælder, at ved højere doser vil flere personer i en eksponeret gruppe fremvise en vis effekt. Ved eksperimentelle studier er det normalt, at man forsøger at bestemme, hvilket dosisniveau som er det højeste, der kan administreres, uden at det giver observerbare skadelige effekter (NOAEL; No Observed Adverse Effect Level).
Eksponeringer kan være akutte (dvs. mindre end 14 dage) eller kroniske (mere end et år) (32), og effekter kan være reversible eller irreversible. Det er vanskeligere at påvise sundhedsskadelige virkninger ved kronisk eksponering end ved akutte eksponeringer. Risikoen for, at en toksisk effekt skal opstå efter kronisk eksponering, anses for at være proportionel med den kumulative dosis.
Eksponeringsmåden har stor betydning for, hvilke effekter der kan forventes efter eksponering for en toksisk substans. Eksponering kan ske på flere måder, og absorptionen kan variere betydeligt alt efter, om den sker via hud eller slimhinder, efter synkning eller efter inhalation. Desuden kan individuelle faktorer (fx alder, køn, prædisponerende faktorer og genetisk polymorfi) have betydning for effekten af et toksisk stof efter optagelse i kroppen. En generel regel for minimering af risikoen for toksiske effekter fra dentalmaterialer er at holde eksponeringen for skadelige stoffer så lav som muligt og tage særligt hensyn til sårbare grupper (fx gravide, børn, allergikere, individer med gentagen eksponering). Ved valg af materiale er det relevant at spørge sig selv, om der findes andre alternative materialer, og man bør følge substitutionsprincippet, dvs. at materialer med relativt høj risiko for bivirkninger erstattes med materialer med mindre risiko.
Overfølsomhedsreaktioner og allergi: Individer, som er overfølsomme for et stof, får reproducerbare «tegn og symptomer» ved eksponering for doser, som tolereres af raske individer uden denne overfølsomhed. Overfølsomhedsreaktioner, som medieres via immunologiske mekanismer, kaldes allergiske reaktioner, og disse kan være antistofmedierede (fx via IgE eller IgG) eller cellemedierede (33). Overfølsomhedsreaktioner, hvor immunologiske mekanismer ikke kan påvises, kaldes «ikke-allergisk overfølsomhed». Inflammation, som skyldes allergisk (eller ikke-allergisk) overfølsomhed, kan resultere i forøget følsomhed - hyperreaktivitet - hvorved inflammationen kan forværres af infektioner, irritanter, fysisk anstrengelse etc. (33).
Anafylaksi: Anafylaksi er en alvorlig og potentielt livstruende, systemisk overfølsomhedsreaktion, som kan karakteriseres ved bl. a. blodtryksfald, kløende udslæt, angioødem og åndedrætsbesvær. Ved anafylaksi frigives inflammatoriske mediatorer (fx histamin) og cytokiner fra mastceller og basofile granulocytter. Ved en allergisk anafylaksi er personen altid tidligere blevet eksponeret for stoffet. Reaktionen medieres af en immunologisk mekanisme, fx via IgE-, IgG- eller immunkomplekser. Et eksempel på dette er fødevareanafylaksi udløst af jordnødder, som er en IgE-medieret allergisk anafylaksi. Når en anafylaktisk reaktion opstår på grund af ikke-immunologiske forhold, kaldes den «ikke-allergisk anafylaksi» (33). Anafylaktiske reaktioner mod dentalmaterialer er beskrevet i litteraturen. Fx kan formaldehyd, som frigives fra rodfyldningsmaterialer, forårsage alvorlige anafylaktiske reaktioner (34).
Urticaria: Ved urticaria («nældefeber») frigives histamin fra mastceller gennem immunologiske eller ikke-immunologiske mekanismer. De ikke-immunologiske mekanismer kan være fysiske, fx berøring, tryk, friktion og vand. Urticaria er beskrevet i forbindelse med behandling med fissurforsegling (35) og i forbindelse med rodbehandling med materialer, som indeholder formaldehyd (34).
Kontaktdermatitis: Dermatitis er lokal inflammation i huden. Hvis tilstanden skyldes immunologiske mekanismer, kaldes den allergisk kontaktdermatitis. Denne kan forårsages af fx nikkel, krom, kviksølv, kolofonium (harpikssyre) og andre kemikalier med lav molekylvægt (såkaldte haptener). I de tilfælde, hvor kontaktdermatitis ikke skyldes nogen immunologisk mekanisme, anvendes begrebet «ikke-allergisk kontaktdermatitis» (eller «irritativ kontaktdermatitis») (33). Tilsvarende begreber bør anvendes om inflammation i mucosa (mucositis, allergisk kontaktmucositis, ikke-allergisk kontaktmucositis/irritativ kontaktmucositis).
I Tabel 1 angives eksempler på materialekategorier, kritisk substans (frigivet substans, som kan antages at udgøre den primære risiko for bivirkning fra materialetypen), eksponeringsmåde, mekanismer og eksempler på kliniske manifestationer for potentielle bivirkningsreaktioner, som kan tænkes at opstå i forbindelse med tandbehandling. I tabellen henvises generelt til kasusrapporter med beskrivelser af reaktioner, hvor årsagen sandsynligvis har været det mistænkte materiale. Vurderingen af sammenhæng mellem eksponering og reaktion baserer sig på en sandsynlighedsvurdering tilsvarende den, der anlægges ved bivirkninger af lægemidler (36). Problemstillinger, som kan være aktuelle, er bl. a. (i), er reaktionen beskrevet tidligere? (ii) er der et tidsmæssigt sammenfald? (iii) mindskes symptomerne eller forsvinder reaktionen, hvis eksponeringen ophører? (iv) kan reaktionen være bivirkning fra noget andet, fx lægemidler? (v) har patienten fået en lignende reaktion ved tidligere eksponering. Af naturlige årsager er det sjældent, man kan teste, om reaktionen kommer igen ved fornyet eksponering for det mistænkte tandrestaureringsmateriale.
Materiale |
Kritisk substans* |
Eksponering |
Mekanismer |
Eksempler på kliniske manifestationer |
Referencer |
|---|---|---|---|---|---|
Polymerbaserede materialer (inklusive bondingmaterialer og fissurforseglingsmaterialer, cementeringsmaterialer) |
Metakrylater(monomerer) |
Lokal (intraoral)Inhalation |
Overfølsomhed/ allergi |
Intraoral kontaktlæsion |
(35,48) |
Temporære cementer med eugenol |
Eugenol |
Lokal (intraoral) |
Overfølsomhed/ allergi |
Intraoral kontaktlæsion |
(49,50) |
Temporære cementer med kolofonium (harpikssyre) |
Kolofonium |
Lokal (intraoral)Systemisk |
Overfølsomhed/ allergi |
Intraoral kontaktlæsion |
(51) |
Aftryksmaterialer (polyæter) |
«Base paste component» |
Lokal (intraoral) |
Overfølsomhed/ allergi |
Intraoral kontaktlæsion |
(52) |
Kobolt-krom-legeringer |
Kobolt |
Lokal (intraoral) |
Overfølsomhed/ allergi |
Palmoplantar postulose (PPP) |
(53) |
Guld- og palladiumlegeringer |
GuldPalladium |
Lokal (intraoral) |
Overfølsomhed/ allergi |
Oral lichenoid læsion |
(54)(55)(46) |
Amalgam |
Kviksølv |
Lokal (intraoral) |
Overfølsomhed/ allergiToksicitet |
Oral lichenoid læsion |
(56)(57,58)(59,60) |
* Frigivet substans, som kan antages at udgøre primær risiko for bivirkning
Hvad gør man, hvis patienten reagerer mod et materiale?
Som kliniker vil man fra tid til anden opleve, at patienten rapporterer om reaktioner, efter at en tand er blevet restaureret med et kunstigt materiale (37). Det kan være lokale reaktioner relateret topografisk til den aktuelle restaurering eller mere generelle reaktioner fjernt fra restaureringen (figur 5). Man kan også skelne mellem den objektive og identificerbare reaktion på den ene side og den subjektive og lidt mere diagnostisk vanskelige reaktion på den anden side. Det første, tandlægen må vurdere i sådanne tilfælde, er, om dentalmaterialet er den mest sandsynlige årsag til reaktionen. Er reaktionen sammenfaldende i tid med restaureringsproceduren? Har patienten oplevet lignende reaktioner før? Har patienten kendte allergier, som kan relateres til fyldningsmaterialet? Kan nogle af indholdsstofferne i materialet krydsreagere med kendte allergener? Det er velkendt, at patienter med allergi mod palladium sædvanligvis også reagerer mod nikkel. Årsagen hertil er sandsynligvis en krydsreaktion (38). Kan læsionen relateres til andre årsager, som fx traumatisk læsion, pulpitissmerter eller andre former for hud- og slimhindelidelser?
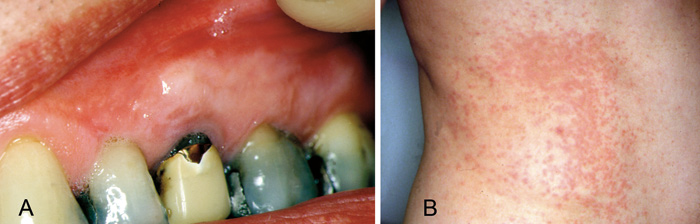
Figur 5. Lichenoid kontaktallergisk reaktion hos patient med guldallergi: Intraoral lichenoid kontaktreaktion ved en guldkrone, som var fremstillet fem år tidligere (A). Patienten havde også reaktioner ved hoftepartiet (B). Fem måneder efter at kronen var blevet fjernet, var reaktionen helt forsvundet. Reaktionen blev af dermatolog tolket som systemisk kontaktdermatitis (fjernreaktion) i forbindelse med guldallergi (Tilpasset efter (46), med tilladelse fra forlaget).
Endvidere bør det vurderes, om det er nødvendigt at fjerne den restaurering, som antages at være årsag til symptomerne. Hvis der ses en kontaktlæsion, som er opstået postoperativt, og som topografisk kan bringes i kontakt med restaureringen, er dette en indikation for udskiftning af restaureringen til et alternativt materiale (39). Er reaktionerne mere generelle og fjerntliggende, kan diagnostikken være mere udfordrende. Eventuelle almensygdomme bør udelukkes som årsag, før en udskiftning påbegyndes. I sådanne tilfælde bør der samarbejdes med læge eller hudspecialist omkring den videre diagnostik (40).
Forebyggelse af reaktioner: Materialehåndtering
Ved kendte allergier eller på forhånd rapporterede reaktioner over for en eller flere bestanddele i et restaureringsmateriale er det et godt forsigtighedsprincip at undgå videre anvendelse af dette materiale på den pågældende patient.
Ved eventuel fjernelse/udboring af restaureringer vil der blive frigivet meget borestøv. Dette kan både penetrere nærliggende slimhinder og inhaleres af patienten, og operatøren kan også blive eksponeret. Tiltag, som kan modvirke dette, er anvendelse af kraftig vandspray på det roterende instrument samt brug af vakuumsug (40). Også brug af kofferdam kan minimere eksponeringen ved udboring af restaureringsmaterialet (41) (figur 6).
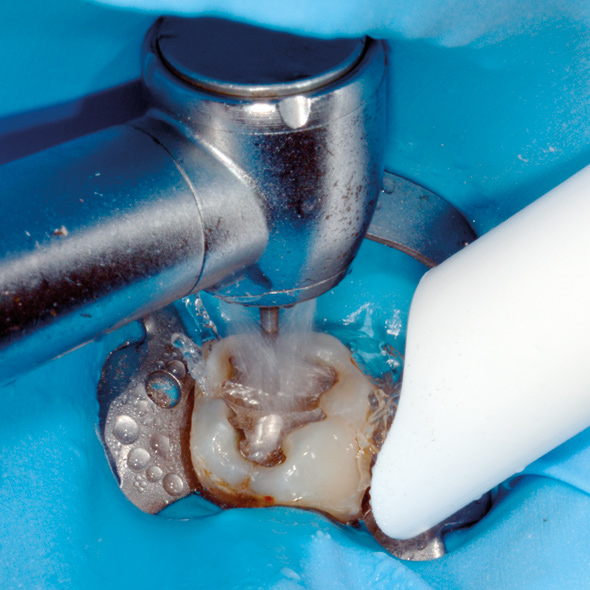
Figur 6. Kofferdambeskyttelse: Fjernelse af amalgamfyldning med højhastighedsbor, vakuumsug og kofferdambeskyttelse.
Ved fremstilling af polymerbaserede fyldningsmaterialer frarådes enhver kontakt mellem hud- og slimhindeoverflader og uhærdet materiale. For at minimere risikoen for patienten i denne sammenhæng er brug af kofferdam et godt hjælpemiddel. Kofferdamdugen vil ud over fugtighedskontrol også holde slimhinden/tungen borte fra operationsområdet. Latexfri kofferdamdug bør foretrækkes for at undgå reaktioner hos patienter med latexallergi.
Endvidere vil en ufuldstændig hærdning kunne føre til lækage af upolymeriserede monomerer og dermed danne grobund for materialerelaterede reaktioner (42). En tilstrækkelig hærdning af materialet er derfor vigtig, samtidig med at de respektive lag med komposit ikke bliver for tykke. For konventionelle lyshærdende kompositter er den anbefalede hærdedybde ca. 2 mm, mens den for såkaldte bulk-fill-kompositter er 4 - 5 mm. Al hærdning i større dybde er usikker med hensyn til omsætningsgrad. Effekten af hærdelampen reduceres betragteligt med afstanden fra lyskilden, og dette effekttab må kompenseres med tid (43). Det er vigtigt med tilstrækkelig hærdetid, mindst det som producenten anbefaler; men man skal være opmærksom på risiko for temperaturstigning ved brug af højeffektlamper (44).
Viden om materialerne
Når en patient får en materialerelateret reaktion, vil det ofte være nødvendigt at finde ud af, hvilke stoffer dette restaureringsmateriale består af. Med den gældende lovgivning (materialerne klassificeres som medicinsk-teknisk udstyr) er dette ingen enkel sag, fordi producenterne formelt set ikke behøver angive alle relevante substanser i produktdatablade, og disse datablade kan desuden være unøjagtige (45). Det mest naturlige er at kontakte producenten for oplysninger. Det vil variere, hvordan forskellige producenter vil forholde sig hertil; men det kendetegner seriøse producenter, at de er behjælpelige med svar på specifikke spørgsmål om sammensætning.
Rapportering
I henhold til grundlaget for CE-mærkning har producenterne pligt til at modtage rapporter om uønskede hændelser og bivirkninger. Dette er desværre ikke alment tilgængelig information; men under alle omstændigheder bør man rapportere i højere grad, end man gør i dag. Ved alvorlige hændelser, som potentielt er trusler mod liv og helbred, skal der også rapporteres til sundhedsmyndighederne. I Danmark er det Lægemiddelstyrelsen, som skal modtage sådanne rapporter (https://laegemiddelstyrelsen.dk/da/udstyr/lovgivning-og-vejledning/sundhedsstyrelsens-vejledninger/vejledning-til-sundhedspersonale-og-brugere-om-indberetning-af-haendelser-med-medicinsk-udstyr). Det er værd at bemærke, at de, som fremstiller medicinsk udstyr «efter mål» (tandteknikere, tandlæger med egne produktionssystemer, fx fræseudstyr) er at betragte som producenter (https://laegemiddelstyrelsen.dk/da/udstyr/lovgivning-og-vejledning/sundhedsstyrelsens-vejledninger/vejledning-til-fabrikanter-af-medicinsk-udstyr-efter-maal).
Norge har siden 1993 haft et dedikeret og producentuafhængigt nationalt rapporteringssystem for biologiske reaktioner på dentale materialer, som modtager rapporter fra sundhedspersonel vedrørende observerede og mistænkte bivirkninger ved dentale materialer. De fleste rapporterede reaktioner har ikke kunnet verificeres ved fx allergitest, fjernelse af materialet og reeksponering etc. , og det er tilstrækkeligt, at der er fremkommet en mistanke om, at det pågældende materiale var årsag til reaktionen. De longitudinelle data vises i figur 7. Data for perioden 1993 - 2015 viser, at andelen af rapporter om amalgam er mindsket betydeligt siden 1993, medens andelen af rapporter om metaller og legeringer er steget fra ca. 10 % i 1993 til ca. 35 % i 2015. Denne stigning kan muligvis relateres til forbedret diagnostik samt den nye viden om guldallergi, som er fremkommet i denne tidsperiode. Andelen af rapporter relateret til plastfyldningsmaterialer og cement var ca. 30 % i 2015, og denne andel er ikke steget på trods af, at anvendelsen af disse materialetyper er steget i løbet af observationsperioden.
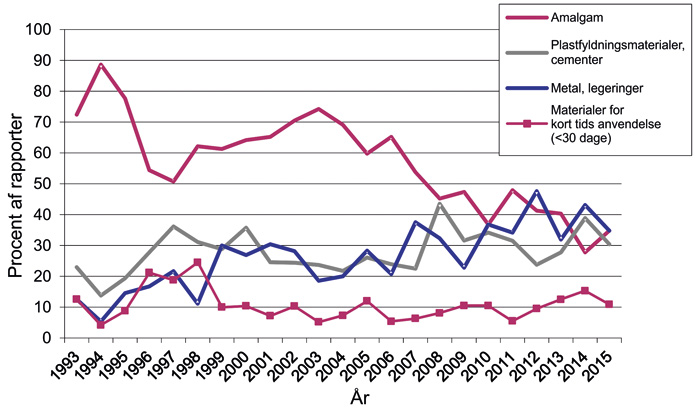
Figur 7. Bivirkningsrapporter 1993 til 2015: Andelen (i procent) af rapporteringer for de forskellige typer angivne materialer. Fra Bivirkningsgruppens årsrapport 2015 (47).
Konklusion
Inden for tandplejen anvendes mange forskellige typer af materialer, som kan frigive substanser og forårsage uønskede biologiske reaktioner. Alle alvorlige reaktioner skal rapporteres til de ansvarlige myndigheder. Det er vigtigt, at alle typer af reaktioner rapporteres till producenten eller dennes repræsentant, samt om muligt også gennem producentuafhængige rapporteringssystemer.
English summary
Dental restorative materials: Biological properties and their clinical implications
Dental restorative materials contain a large number of substances with different biological properties. In the oral cavity restorations are exposed to mechanical, chemical, microbial, and enzymatic influence, and consequently some of the substances can be released. Released substances can potentially cause biological effects in the oral mucosa, or be absorbed and distributed systemically and cause general reactions. In the present article biological mechanisms which may have importance for the release of substances from polymer based restorative materials, and the biological implications on the cellular level, are discussed. In addition, different mechanisms for clinical implications of the exposure to the released substances are discussed with a focus on hypersensitivity, allergy and toxicity.
Patients with reactions allegedly related to dental materials should be examined systematically. Allergic contact mucositis may appear in patients with allergy to gold and simultaneous exposure to dental gold alloys. Patients with contact allergic lesions in the oral mucosa (e. g. lichenoid contact lesions) should have the material causing the reaction replaced. Clinical advice regarding how the risk for adverse reactions to dental materials can be minimized is provided as well as recommendations regarding reporting of adverse reactions to dental materials.
Björkman L, Roar Gjerdet N, Tore Samuelsen J, Valen H, Lægreid T. Dentale restaureringsmaterialer: Biologiske egenskaber og deres kliniske konsekvenser. Nor Tannlegeforen Tid. 2016;126:872-80. doi:10.56373/2016-11-8
Litteratur
Wataha JC, Nelson SK, Lockwood PE. Elemental release from dental casting alloys into biological media with and without protein. Dent Mater. 2001; 17: 409 - 14.
Geurtsen W. Biocompatibility of dental casting alloys. Crit Rev Oral Biol Med. 2002; 13: 71 - 84.
Richardson GM, James KJ, Peters RE et al. Assessment of exposures and potential risks to the US adult population from the leaching of elements from gold and ceramic dental restorations. J Expo Sci Environ Epidemiol. 2016; 26: 309 - 14.
Anusavice KJ. Degradability of dental ceramics. Adv Dent Res. 1992; 6: 82 - 9.
Michelsen VB, Kopperud HB, Lygre GB et al. Detection and quantification of monomers in unstimulated whole saliva after treatment with resin-based composite fillings in vivo. Eur J Oral Sci. 2012; 120: 89 - 95.
Jaffer F, Finer Y, Santerre JP. Interactions between resin monomers and commercial composite resins with human saliva derived esterases. Biomaterials. 2002; 23: 1707 - 19.
Dewhirst FE, Chen T, Izard J et al. The human oral microbiome. J Bacteriol. 2010; 192: 5002 - 17.
de Fucio SB, Puppin-Rontani RM, de Carvalho FG et al. Analyses of biofilms accumulated on dental restorative materials. Am J Dent. 2009; 22: 131 - 6.
Auschill TM, Arweiler NB, Brecx M et al. The effect of dental restorative materials on dental biofilm. Eur J Oral Sci. 2002; 110: 48 - 53.
Svanberg M, Mjör IA, Ørstavik D. Mutans streptococci in plaque from margins of amalgam, composite, and glass-ionomer restorations. J Dent Res. 1990; 69: 861 - 4.
Thomas RZ, van der Mei HC, van der Veen MH et al. Bacterial composition and red fluorescence of plaque in relation to primary and secondary caries next to composite: an in situ study. Oral Microbiol Immunol 2008. ; 23: 7 - 13.
Beyth N, Bahir R, Matalon S et al. Streptococcus mutans biofilm changes surface-topography of resin composites. Dent Mater. 2008; 24: 732 - 6.
Gregson KS, Shih H, Gregory RL. The impact of three strains of oral bacteria on the surface and mechanical properties of a dental resin material. Clin Oral Investig. 2012; 16: 1095 - 103.
Bourbia M, Ma D, Cvitkovitch DG et al. Cariogenic bacteria degrade dental resin composites and adhesives. J Dent Res. 2013; 92: 989 - 94.
Kermanshahi S, Santerre JP, Cvitkovitch DG et al. Biodegradation of resin-dentin interfaces increases bacterial microleakage. J Dent Res. 2010; 89: 996 - 1001.
Khalichi P, Cvitkovitch DG, Santerre JP. Effect of composite resin biodegradation products on oral streptococcal growth. Biomaterials. 2004; 25: 5467 - 72.
Khalichi P, Singh J, Cvitkovitch DG et al. The influence of triethylene glycol derived from dental composite resins on the regulation of Streptococcus mutans gene expression. Biomaterials. 2009; 30: 452 - 9.
Kawai K, Tsuchitani Y. Effects of resin composite components on glucosyltransferase of cariogenic bacterium. J Biomed Mater Res. 2000; 51: 123 - 7.
Ørstavik D. Antibacterial properties of and element release from some dental amalgams. Acta Odontol Scand. 1985; 43: 231 - 9.
Morrier JJ, Suchett-Kaye G, Nguyen D et al. Antimicrobial activity of amalgams, alloys and their elements and phases. Dent Mater. 1998; 14: 150 - 7.
Hayacibara MF, Rosa OP, Koo H et al. Effects of fluoride and aluminum from ionomeric materials on S. mutans biofilm. J Dent Res. 2003; 82: 267 - 71.
Splieth C, Bernhardt O, Heinrich A et al. Anaerobic microflora under Class I and Class II composite and amalgam restorations. Quintessence Int. 2003; 34: 497 - 503.
Mo SS, Bao W, Lai GY et al. The microfloral analysis of secondary caries biofilm around Class I and Class II composite and amalgam fillings. BMC Infect Dis. 2010; 10: 241.
Stanislawski L, Lefeuvre M, Bourd K et al. TEGDMA-induced toxicity in human fibroblasts is associated with early and drastic glutathione depletion with subsequent production of oxygen reactive species. J Biomed Mater Res A. 2003; 66: 476 - 82.
Schweikl H, Hiller KA, Eckhardt A et al. Differential gene expression involved in oxidative stress response caused by triethylene glycol dimethacrylate. Biomaterials. 2008; 29: 1377 - 87.
Parkinson A, Ogilvie BW. Biotransformation of Xenobiotics In: Casarett LJ, Doull J, Klaassen CD, eds. Casarett and Doull's toxicology: The basic science of poisons. 7th ed. New York: McGraw-Hill, 2008; 161 - 304.
Caughman GB, Schuster GS, Rueggeberg FA. Cell lipid alterations resulting from prolonged exposure to dimethylaminoethylmethacrylate. Clin Oral Investig. 1999; 3: 181 - 7.
Schweikl H, Schmalz G. Triethylene glycol dimethacrylate induces large deletions in the hprt gene of V79 cells. Mutat Res. 1999; 438: 71 - 8.
Samuelsen JT, Holme JA, Becher R et al. HEMA reduces cell proliferation and induces apoptosis in vitro. Dent Mater. 2008; 24: 134 - 40.
Eckhardt A, Gerstmayr N, Hiller KA et al. TEGDMA-induced oxidative DNA damage and activation of ATM and MAP kinases. Biomaterials. 2009; 30: 2006 - 14.
Kallus T, Mjör IA. Incidence of adverse effects of dental materials. Scand J Dent Res. 1991; 99: 236 - 40.
ATSDR. Glossary of Terms: Agency for Toxic Substances and Disease Registry. (Set 2016 september). Tilgængelig fra: URL: http://www.atsdr. cdc. gov/glossary. html
Johansson SG, Cardell LO, Foucard T et al. Reviderad, global nomenklatur för allergi. Entydiga termer skapar klarhet och undanröjer missförstånd. Läkartidningen. 2006; 103: 379 - 83.
Braun JJ, Zana H, Purohit A et al. Anaphylactic reactions to formaldehyde in root canal sealant after endodontic treatment: four cases of anaphylactic shock and three of generalized urticaria. Allergy. 2003; 58: 1210 - 5.
Hallström U. Adverse reaction to a fissure sealant: report of case. ASDC J Dent Child. 1993; 60: 143 - 6.
Beermann B, Persson I. Läkemedelsbiverkningar. (Set 2016 september). Tilgængelig fra: URL: http://www.lakemedelsboken. se/kapitel/lakemedelsanvandning/lakemedelsbiverkningar. html#x3_117.
Lygre GB, Gjerdet NR, Grönningsæter AG et al. Reporting on adverse reactions to dental materials - intraoral observations at a clinical follow-up. Community Dent Oral Epidemiol. 2003; 31: 200 - 6.
Hindsen M, Spiren A, Bruze M. Cross-reactivity between nickel and palladium demonstrated by systemic administration of nickel. Contact Dermatitis. 2005; 53: 2 - 8.
Håheim LL, Dalen K, Eide R et al. Helseeffekt av å skifte ut amalgamfyllinger ved mistanke om plager eller helseskader fra amalgam. Oslo: Nasjonalt kunnskapssenter for helsetjenesten, 2006; Rapport fra Kunnskapssenteret nr. 10 - 2006.
HELSEDIREKTORATET. Retningslinjer for utredning og behandling ved mistanke om bivirkninger fra odontologiske biomaterialer (IS-1481). Oslo: Helsedirektoratet, 2008.
Berglund A, Molin M. Mercury levels in plasma and urine after removal of all amalgam restorations: the effect of using rubber dams. Dent Mater. 1997; 13: 297 - 304.
Fan PL, Meyer DM. FDI report on adverse reactions to resin-based materials. Int Dent J 2007; 57: 9 - 12.
NIOM. Retningslinjer for lysherding i odontologi. Nor Tannlegeforen Tid. 2014; 124: 910.
Price RB, Ferracane JL, Shortall AC. Light-Curing Units: A Review of What We Need to Know. J Dent Res. 2015; 94: 1179 - 86.
Kanerva L, Henriks-Eckerman ML, Jolanki R et al. Plastics/acrylics: material safety data sheets need to be improved. Clin Dermatol. 1997; 15: 533 - 46.
Vamnes JS, Morken T, Helland S et al. Dental gold alloys and contact hypersensitivity. Contact Dermatitis. 2000; 42: 128 - 33.
UNI HELSE. Årsrapport 2015: Bivirkningsgruppen for odontologiske biomaterialer, Bergen: Uni Research, 2016 (Set 2016 september). Tilgængelig fra: URL: http://uni.no/media/manual_upload/bivirkningsgruppen_arsr_2015. pdf
Moore MM, Burke FJ, Felix DH. Allergy to a common component of resin-bonding systems: a case report. Dent Update 2000; 27: 432 - 4.
Barkin ME, Boyd JP, Cohen S. Acute allergic reaction to eugenol. Oral Surg Oral Med Oral Pathol. 1984; 57: 441 - 2.
Sarrami N, Pemberton MN, Thornhill MH et al. Adverse reactions associated with the use of eugenol in dentistry. Br Dent J. 2002; 193: 257 - 9.
Bruze M. Systemically induced contact dermatitis from dental rosin. Scand J Dent Res. 1994; 102: 376 - 8.
Mittermuller P, Szeimies RM, Landthaler M et al. A rare allergy to a polyether dental impression material. Clin Oral Investig. 2012; 16: 1111 - 6.
Song H, Yin W, Ma Q. Allergic palmoplantar pustulosis caused by cobalt in cast dental crowns: a case report. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2011; 111: e8 - 10.
Tvinnereim HM, Lundekvam BF, Morken T et al. Allergic contact reactions to dental gold. Contact Dermatitis. 2003; 48: 288 - 9.
Garau V, Masala MG, Cortis MC et al. Contact stomatitis due to palladium in dental alloys: a clinical report. J Prosthet Dent. 2005; 93: 318 - 20.
Issa Y, Brunton PA, Glenny AM et al. Healing of oral lichenoid lesions after replacing amalgam restorations: a systematic review. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2004; 98: 553 - 65.
McGivern B, Pemberton M, Theaker ED et al. Delayed and immediate hypersensitivity reactions associated with the use of amalgam. Br Dent J. 2000; 188: 73 - 6.
Kal BI, Evcin O, Dundar N et al. An unusual case of immediate hypersensitivity reaction associated with an amalgam restoration. Br Dent J. 2008; 205: 547 - 50.
Weidenhammer W, Bornschein S, Zilker T et al. Predictors of treatment outcomes after removal of amalgam fillings: associations between subjective symptoms, psychometric variables and mercury levels. Community Dent Oral Epidemiol. 2010; 38: 180 - 9.
Langworth S, Strömberg R. A case of high mercury exposure from dental amalgam. Eur J Oral Sci. 1996; 104: 320 - 1.
Korrespondance: Lars Björkman, Bivirkningsgruppen for odontologiske biomaterialer, Postboks 7810, 5020 Bergen. E-post: Lars. Bjorkman@uni. no
Artikkelen har gjennomgått ekstern faglig vurdering.
Björkman L, Gjerdet NR, Samuelsen JT, Valen H, Lægreid T. Dentale restaureringsmaterialer: Biologiske egenskaber og deres kliniske konsekvenser. Nor Tannlegeforen Tid. 2016; 126: 872-80.
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Björkman L, Roar
Gjerdet N, Tore
Samuelsen J, Valen H, Lægreid T. Dentale restaureringsmaterialer: Biologiske egenskaber og
deres kliniske konsekvenser. Nor Tannlegeforen Tid. 2016;126:872-80. doi:10.56373/2016-11-8