Tilleggseffekten av fotodynamisk terapi ved ikke-kirurgisk periodontal behandling
Fotodynamisk terapi (PDT) som et tillegg ved ikke-kirurgisk periodontal behandling har fått et økende oppmerksomhet de siste årene. Resultatene i publiserte studier er imidlertid ikke entydig positive.
Målet med denne litteraturgjennomgangen var å evaluere tilleggseffekten av fotodynamisk terapi ved ikke-kirurgisk periodontal behandling. Det ble utført et søk i litteraturdatabasene PubMED, EMBASE og OVID Medline. Søket resulterte i totalt 37 artikler. Fem studier oppfylte inklusjonskriteriene. De kliniske parametere som ble evaluert var blødning ved sondering (BoP), klinisk festenivå (CAL) og lommedybder (PPD). Antall prosjektdeltagere varierte mellom 16 og 33 og oppfølgingstid på studiene var fra 6 til 12 måneder. Pasientene i kontrollgruppene ble behandlet med scaling og rotplanering (SRP), og testgruppen fikk scaling og rotplanering og tilleggsbehandling med PDT (SRP + PDT).
Alle de inkluderte studiene fant statistisk signifikant endring i en eller flere kliniske parametere fra utgangspunktet (baseline) til 6 måneders-kontrollen. To studier rapporterte ingen signifikante forskjeller mellom test- og kontrollgruppen. En studie med 12 måneders varighet fant statistisk signifikante forskjeller i favør testgruppen for alle kliniske parametere evaluert, både etter 6 og 12 måneder. De øvrige to studiene fant statistisk signifikante forskjeller i favør av testgruppen for BoP og CAL.
I et korttidsperspektiv (inntil 12 måneder) finnes det liten dokumentasjon på positiv tilleggseffekt ved bruk av PDT i periodontal behandling. Det er behov for flere studier med lang oppfølgingstid og god studiedesign.
Den viktigste strategien i årsaksrettet periodontal behandling er å redusere, eller om mulig eliminere, den bakterielle infeksjonen. Instruksjon i munnhygiene etterfulgt av ikke-kirurgisk eller kirurgisk periodontal behandling er den mest dokumenterte terapien (1 - 3). Likevel klarer man ikke alltid å redusere infeksjonen tilstrekkelig til å oppnå periodontal helse. Man har derfor lenge vært på jakt etter andre metoder for ytterligere å redusere infeksjonen. Systemisk antibiotika som tillegg til mekanisk behandling, har blitt brukt (4, 5), men antibiotikaterapi er omdiskutert. Andre måter å redusere/eliminere infeksjonen på uten fare for resistensutvikling bør derfor utforskes.
Som alternativ til systemisk antibiotika er forskjellige, lokalt appliserbare antimikrobielle og antiseptiske midler blitt undersøkt (6 - 8). Hensikten er å målrette og begrense bruken av antibiotika til de lommene der progresjon av periodontal sykdom fortsetter etter tradisjonell mekanisk behandling. Hypotesen er at ved lokal deponering vil det antimikrobielle virkestoffet gi en lokal virkning samtidig som den spesielt fremstilte bæreren for antibiotikumet («carrier») kan gi en depoteffekt nede i lommen. En viktig fordel er at ved lokalt appliserbare antibiotika kan man bruke så høye konsentrasjoner at virkningen blir meget sterk på de fleste mikroorganismer, samtidig som virkningen på vertsorganismen for øvrig blir minimal. Forskjellige typer antibiotika har vært forsøkt, for eksempel tetracyklin fibertråder, klorheksidin «chip», minocycline gel, metronidazol gel og doksysyklin polymerer (6 - 8). Greenstein & Polson (9) rapporterte i en oversiktsartikkel at effekten i lommereduksjon varierte fra -0,3 mm (minocyclin gel) til + 0,7 mm (tetracyklin fiber). De konkluderte med at det finnes svært få langtidsstudier (5 år eller lengre), at tilleggseffekten var moderat og at det var usikkert om bruk av disse midlene førte til at det ble mindre behov for periodontal kirurgi.
Fotodynamisk terapi (PDT) ble oppdaget rundt år 1900, da den tyske medisinstudenten Raab (10) observerte at levende Paramecium caudatum som ble farget med akridin og undersøkt i lysmikroskop, gradvis mistet evnen til å bevege og dele seg. Raabs mentor kalte dette for en fotodynamisk effekt. PDT er dermed en relativt gammel oppdagelse, selv om den ikke har vært systematisk undersøkt og dokumentert før de siste 20 - 30 år. PDT er avhengig av applikasjon av en fotosensitiser (FS) på ønsket virkested. Effekten har vært mest undersøkt og brukt innen kreftbehandling, hvor man bruker spesifikke FS som utfører ønsket virkning på maligne celler (11). Innenfor periodontal behandling er det den antimikrobielle effekten som har vært mest utforsket (12 - 14).
I periodontal behandling er fenotiaziner (metylen-blå og toluidin-blå) de mest benyttede FS. Disse stoffene er naturlig kationiske (positivt ladede) og binder derfor både til gram-negative (Gr-) og gram-positive (Gr+) bakterier. Man forsøker å utnytte forskjellene i cellemembranen mellom bakterier og eukaryote celler, fordi bakterienes cellemembran har en høyere andel negativt ladede grupper og mangler positivt ladede lipider og kolesterol som man finner i cellemembranen til eukaryote celler.
I følge Jori og medarbeidere (15) er de antatt viktigste fordelene ved antimikrobiell fotodynamisk terapi:
- Bredt virkningsspektrum; metoden påvirker bakterier, sopp og protozoer
- Effekt også på antibiotikaresistente bakterier
- Det er mulig å utvikle PDT-protokoller som kan gi en omfattende reduksjon i antallet patogene bakterier. Dette hevdes å kunne utføres med veldig liten skade på vertscellene
- Man har ikke funnet utvikling av foto-resistente bakterier selv etter mange behandlinger
- Dokumentert liten mutagen risiko
- Tilgjengeligheten av spesifikke FS gjør at man spesifikt kan applisere FS i de infiserte områdene
- Flere forskjellige lyskilder for å aktivere FS er tilgjengelig
Både lasere og «vanlig lys» har omtrent samme effekt når de blir brukt som lyskilde ved aktivering av FS. Det vesentlige ved lyskilden er at lyset har nok energi til å aktivere FS. Forskjellen på PDT og laser i periodontal behandling er at man i PDT bruker et lys, diodelaser (809 - 980 nm) eller «vanlig lys» med en bølgelengde som er tilpasset for aktivering av FS (600 - 800nm). Andre typer lasere brukt i periodontal behandling er Nd: Yag og Er: Yag, og disse har arbeidsområdet sitt ved andre bølgelengder enn PDT. Nd: Yag laser (1064 nm) er en bløtvevslaser som hevdes å gi en reduksjon av antallet bakterier i lommen, og bløtvevskyrettasje. Er: Yag laser (2940 nm) er en hardvevslaser som i tillegg til å redusere antallet bakterier i lommen, også er vist å kunne fjerne tannstein. PDT har kun en antimikrobiell effekt (16).
Det finnes i dag tre kommersielle PDT-produkter; HELBO-systemet (HELBOs Photodynamic Systems GmbH), Periowave-systemet (Periowave, Ondine Biopharma, Vancouver, Canada) og Fotosan-systemet (Fotosan, CMS Dental, København, Danmark).
Systemene er relativt like i praktisk bruk; først appliseres FS i de lommene hvor man ønsker å bruke PDT, for deretter å lysaktivere FS ved hjelp av en egnet lyskilde (figur 1). Ved aktivering av FS frigjøres det cytotoksiske radikaler som påfører bakteriene skader og fører til celledød (15). FS er vanligvis tilgjengelig som en tyntflytende gel som appliseres i lommen, og lyskildene leveres med tynne spisser som gjør at man kan få distribuert lyset helt ned til lommens bunn. Periowave- og HELBO- systemene bruker diodelaser, mens Fotosan-systemet bruker en LED-lampe. Forsøket med å utvikle alternativer til antibiotika til bruk ved infeksjoner er et satsingsområde. Et av de mer interessante områdene er PDT.
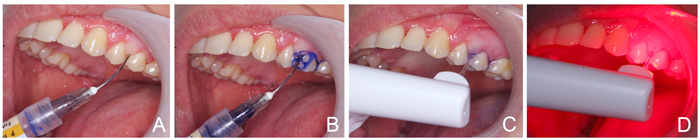
Figur 1. Klinisk bruk av Fotosansystemet: Fotosensitiser i sprøyte med butt spiss føres ned til lommens bunn (A); Appliserering av fotosensitiser fra lommens bunn til man har fylt hele lommen (B); Spissen på LED-lampen føres ned til lommens bunn (C); LED-lampen aktiverer fotosensitiser (D).
Målet med denne litteraturgjennomgangen var å kritisk gjennomgå litteraturen på området med tanke på å evaluere tilleggseffekten av fotodynamisk terapi ved ikke-kirurgisk periodontal behandling.
Materiale og metode
PubMED søk ble utført på følgende måte: Først søk uten datobegrensning på følgende MeSH-termer (MeSH: Medical Subject Headings) og søkeord. «Photochemotherapy» AND «Dental Scaling» [All Fields] AND «humans» [MeSH Terms], «Photodynamic therapy» AND «Dental Scaling» [All Fields] AND «humans» [MeSH Terms], (antimicrobial photodynamic therapy) AND (dental scaling) AND «periodontal diseases», Filters: «Humans», «Subgingival Curettage» [Mesh] AND «Photochemotherapy» [MeSH] and «photoactivated disinfection chronic periodontitis.» Kun søkestrategien i Pub MED er beskrevet, da søk i Ovid MEDLINE, EMBASE og Cochrane ikke ga noen andre treff enn PubMED.
Disse søkekriteriene resulterte i 37 artikler (figur 2).
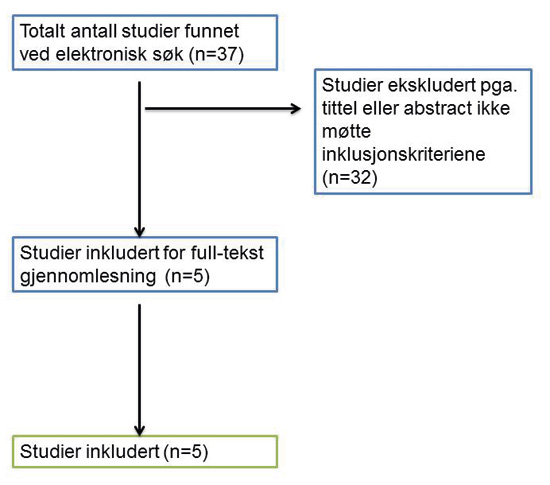
Figur 2. Resultat av litteratursøking.
Inklusjonskriteriene var:
- Varighet ≥ 6 mnd.
- Kliniske studier
- Kronisk periodontitt
- Publisert i årene 2008 - 2013
- Engelsk språk
- Fagfelle vurderte publikasjoner
- Systemisk friske pasienter
- Scaling og rotplanering (SRP) utført
- Blindet undersøker
Eksklusjonskriteriene var:
- Kasuistikker
- Bruk av antibiotika < 3 måneder før studiestart og/eller under studien
- Kort varighet (< 6 måneder)
- Dyrestudier
- Ikke engelsk språk
Fem studier gjensto til fulltekst gjennomlesing.
Kontrollgruppen i studiene fikk SRP behandling, mens testgruppen fikk i tillegg PDT behandling (SRP + PDT).
Følgende parametere ble evaluert: Klinisk festenivå (CAL), lommedybder (PPD), blødning ved sondering til lommens bunn (BoP)
Tabell 1 viser oversikt over lyskilder og fotosensitiser med virketid som ble benyttet i de inkluderte studiene. PDT ble gjennomført kun en gang i alle studiene (17 - 21).
Inkluderte studier |
Lyskilde/virketid |
Fotosensitizer (FS)/ virketid |
|---|---|---|
Christodoulides et al. (2008) |
Diodelaser, 670 nm, 75mW i 1 min |
Fenotiazin klorid i 3 min. |
Berakdar et al. (2012) |
Diodelaser, 670 nm, 150 mW i 1 min |
0,005 % Metylen blå * |
Theodoro et al. (2012) |
GaAIAs LLLT laser, 660 nm, 30 mW i 2,5 min |
Toluidin blå i 1 min. |
Dilsiz et al. (2013) |
Aluminium-gallium-arsenid (diode) laser, 808nm,100mW i 1 min |
1 % Metylen blå i 3 min. |
Alwaeli et al. (2013) |
Diodelaser 660nm, 100mW i 1 min |
Fenotiazin klorid i 3 min. |
* Virketiden til FS fremgår ikke i studien
Ekskluderte studier: (12 - 14, 22 - 50).
Resultater
Kun fem studier oppfylte inklusjonskriteriene. Den viktigste årsak til eksklusjon var for kort oppfølgingstid (< 6 mnd). Antall deltagere i de inkluderte studiene varierte fra 16 - 33, og fire studier hadde oppfølgingstid på 6 måneder (18 - 21), mens en studie rapporterte resultater både etter 6 og 12 måneder (17). Studiene var split-mouth (17, 18), parallell design (19), og split-mouth design (20, 21), men hvor kun enkelttenner ble undersøkt.
Alle de inkluderte studiene fant statistisk signifikante forskjeller i en eller flere kliniske parametere fra baseline til 6 måneder (tabell 2). Av de fem inkluderte studiene rapporterte to studier statistisk signifikante forskjeller i BoP i favør av testgruppen etter 6 måneder (17, 19), to studier rapporterte tilsvarende for PPD (17, 18), og en studie for CAL (17) (tabell 2). To studier rapporterte ingen signifikante forskjeller mellom test og kontrollgruppe (20, 21), og en studie (17) beskrev statistisk signifikante forskjeller i favør av testgruppen for alle kliniske parametere evaluert, både ved 6 og 12 måneder (tabell 2).
Forfattere (år), antall deltakere |
CAL |
PPD |
BoP (%) |
|||||
|---|---|---|---|---|---|---|---|---|
SRP+PDT |
SRP |
SRP+PDT |
SRP |
SRP+PDT |
SRP |
|||
Christodoulides et al. (2008) N=24 |
baseline |
4,1±0,5 |
4,5±1,0 |
3,7±0,5 |
3,6±0,6 |
54±16 |
59±21 |
|
6 mnd. |
3,4±0,6 |
4,0±1,0 |
2,8±0,4 |
2,9±0,3 |
10±5 |
20±4 |
||
forskjell |
0,7±0,3 b |
0,5±0,5 b |
0,7±0,3 b |
0,7±0,7 b |
44 a,b |
39 b |
||
Berakdar et al. (2012) N=22 |
baseline |
8,1±1,3 |
7,2±1,2 |
6,4±0,8 |
5,9±0,8 |
100 |
100 |
|
6 mnd. |
x |
x |
3,5 |
3,5 |
13,6 |
22,7 |
||
forskjell |
2,90,8a |
2,40,6 |
86,4b |
77,3b |
||||
Theodoro et al. (2012) N=33 |
baseline |
6,52±2,11 |
6,23±1,25 |
5,75±1,44 |
5,81±1,0 |
93,9 |
97 |
|
6 mnd. |
4,96±2,07 |
4,25±1,73 |
3,42±1,15 |
3,1±0,83 |
45,5 |
27,3 |
||
forskjell |
1,56 b |
1,98 b |
2,33 b |
2,71 b |
48,4 b |
69,7 b |
||
Dilsiz et al. (2013)N=24 |
baseline |
7,67±0,56 |
7,50±0,72 |
5,88±0,74 |
5,83±0,76 |
88±0,34 |
92±0,28 |
|
6 mnd. |
6,13±0,99 |
6,04±1,00 |
4,33±0,48 |
4,42±0,88 |
38±0,49 |
46±0,51 |
||
forskjell |
1,54±1,10 b |
1,50±0,88 b |
1,54±0,59 b |
1,42±0,88 b |
50 b |
46 b |
||
Alwaeli et al. (2013)N=16 |
baseline |
9,22 |
9,0 |
6,16 |
6,38 |
98,6 |
98,4 |
|
6 mnd. |
7,62 |
8,87 |
4,4 |
5,84 |
19,2 |
63,5 |
||
Forskjell |
1,6 a,b |
0,13 |
1,77 a,b |
0,54 b |
79,4 a,b |
34,9 b |
||
12 mnd. |
7,74 |
8,87 |
4,66 |
5,78 |
34,2 |
85,7 |
||
forskjell fra baseline |
1,48 a,b |
0,13 |
1,51 a,b |
0,6 b |
64,4 a,b |
12,7 b |
||
a. Statistisk signifikant forskjell mellom gruppene (p<0,001 - 0,05)
b. Statistisk signifikant forskjell fra baseline. (p<0,001 - 0,05)
x. Oppgitt i graf, men eksakte verdier fremkommer ikke
Diskusjon
Alle de inkluderte studiene viste en statistisk signifikant forbedring fra utgangspunktet (baseline) for en eller flere av de kliniske parameterne, hvilket kan sies å være ytterligere dokumentasjon på effekten av SRP ved periodontal behandling. Flere studier fant statistisk signifikant tilleggseffekt av PDT (17 - 19). I alle de inkluderte studiene var utgangspunktet definert som før hygieneinstruksjon og fjerning av supragingival tannstein.
Blant de inkluderte studiene var det store forskjeller i studiedesign. Kun én studie behandlet og analyserte samtlige tenner i munnen (19). De resterende studiene (17, 18, 20, 21) behandlet og analyserte få tenner i hver enkelt pasient, og kun en av disse rapporterte resultater etter 12 måneder (17).
Forskjellene i kliniske parametere mellom test og kontrollgruppene i de inkluderte studiene var liten, og i 4 av studiene trolig ikke klinisk relevant (18 - 21). En studie skilte seg ut med å rapportere over 1 mm forskjell i favør testgruppen, ved både 6 og 12 måneder (17). Tilsvarende forskjeller i favør av testgruppen ble rapportert i en nylig publisert studie med 6 måneders varighet (51).
En studie hadde tre studiearmer hvor de i en av gruppene benyttet kalium-titanyl-fosfat (KTP)-laser som et tillegg til SRP (20). Dette er en type laser hvor laserstrålen fra en Nd: YAG laser (1064 nm) dirigeres gjennom KTP krystallen for å skape en stråle i det synlige grønne delen av spektret (532nm). Signifikant bedre resultater ble rapportert for CAL og PPD i denne lasergruppen enn for de andre gruppene (SRP alene og SRP + PDT). Dette samsvarer med funnene i en liknende studie (52), hvor Nd: Yag laser ble benyttet. Imidlertid er det studier som ikke har funnet noen tilleggseffekt ved bruk av Nd: Yag laser (53, 54). Entydig positive resultater er heller ikke rapportert ved Er: Yag laser. Andre har undersøkt effekten av Er: Yag laser alene, Er: Yag+ SRP og SRP alene (55). De fant ingen statistisk signifikante forskjeller for kliniske parametre mellom gruppene, men fant statistisk signifikante forskjeller fra baseline for alle grupper. Effekten av gjentatte behandlinger med Er: Yag laser mot gjentatte behandlinger med SRP i periodontal behandling er også blitt undersøkt (56). Det ble ikke funnet noen statistisk signifikante forskjeller mellom gruppene.
Effekten av kun FS som tillegg til SRP har også vært undersøkt. En av de inkluderte studiene hadde en tredje studiearm hvor kun SRP + FS (toluidin blå) uten laserlys ble benyttet (21). De kliniske resultatene i denne gruppen skilte seg ikke statistisk signifikant fra verken SRP gruppen eller SRP + PDT gruppen. Dette funnet støttes opp av en in vitro-studie (57), hvor FS måtte lysaktiveres for å få effekt. Dersom scaling og rotplanering er utført umiddelbart før bruk av PDT, kan blod og gingivalvæske gjøre det vanskelig å få FS til feste seg til bakteriene i biofilmen. Effekten av lysaktiveringen kan i tillegg påvirkes av at blod kan absorbere lyset. I enkelte in vitro forsøk fikk FS virke i 5 minutter før lysaktivering (58, 59). Dette avviker fra hvordan FS ble brukt i de inkluderte studiene her, hvor det ble brukt 1 - 3 minutters skylling og kontinuerlig applikasjon i lommen med FS.
I en behandlingssituasjon vil tilleggsbehandling med PDT innebære økt tidsbruk. Minimum tid man skal lysaktivere FS per tann i de systemene som er inkludert i denne litteraturgjennomgangen er 1 minutt. De fleste systemene inkludert her lot FS virke i 3 minutter per tann, hvilket gir en total behandlingstid per tann på 4 minutter. FS kan appliseres på flere tenner samtidig, men bare tiden det tar å lysaktivere lommene på en pasient med 20 tenner, blir ca. 20 minutter.
Det er få holdepunkter for at tilleggseffekten av PDT ved SRP er vesentlig bedre enn mekanisk behandling alene. Imidlertid, med en stadig økende mikrobiell resistensutvikling mot antibiotika (60), og de følgene dette har for både enkeltindivid og miljø, er det viktig og samfunnsøkonomisk riktig å utvikle andre behandlingsformer som kan erstatte antibiotika. I dette bildet passer PDT fortsatt inn, da man har hatt lovende resultater in vitro. Alle FS brukt i de inkluderte studiene tilhører den samme gruppen (fenotiaziner), uten at man per i dag har oppnådd overbevisende resultater ved bruk av denne. Fremtidige studier bør kanskje undersøke om andre typer FS og andre typer lyskilder kan gi bedre og mer forutsigbar effekt.
I et korttidsperspektiv (inntil 12 måneder) finnes det liten dokumentasjon på positiv tilleggseffekt ved bruk av PDT i periodontal behandling. Det er behov for flere studier med lang oppfølgingstid og god studiedesign.
Takk
Takk til Ellen Bruzell ved NIOM for bistand og gode innspill i arbeidet med denne artikkelen.
English summary
The adjunctive effect of photodynamic therapy in non-surgical periodontal treatment
Photodynamic therapy as an adjunct to scaling and root planing in the treatment of periodontal disease has gained increased attention in the recent years. The aim of this literature review was to evaluate the clinical effect of photodynamic therapy as an adjunct to non-surgical periodontal treatment. A PubMED search resulted in 37 articles, published in the years 2008 - 2013. Five articles were included according to the inclusion criteria. The number of participants in the included studies varied from 16 to 33, and the effect of PDT was evaluated after 6 and 12 months. The control groups received scaling and root planing (SRP) and the test groups received scaling and root planing with adjunctive use of photodynamic therapy (SRP + PDT). The following parameters were evaluated: bleeding on probing (BoP), pocket probing depth (PPD) and clinical attachment level (CAL).
All included studies reported statistically significant reduction in one or more clinical parameters from baseline to 6 months. Two studies reported no significant differences between test and control groups, while one study reported statistically significant better results for the test group for all clinical parameters evaluated, both after 6 and 12 months.
Conclusion: There is little, although some, documentation on a positive adjunctive effect of PDT, but more long term documentation in larger study populations are warranted.
Lutnæs OB, Wohlfahrt JC, Aass AM, Koldsland OC. Tilleggseffekten av fotodynamisk terapi ved ikke-kirurgisk periodontal behandling. Nor Tannlegeforen Tid. 2015;125:692-7. doi:10.56373/2015-8-9
Referanser
Isidor F, Karring T. Long-term effect of surgical and non-surgical periodontal treatment. A 5-year clinical study. J Periodontal Res. 1986; 21: 462 - 72.
Kaldahl WB, Kalkwarf KL, Patil KD, Molvar MP, Dyer JK. Long-term evaluation of periodontal therapy: I. Response to 4 therapeutic modalities. J Periodontol. 1996; 67: 93 - 102.
Lindhe J, Nyman S. The effect of plaque control and surgical pocket elimination on the establishment and maintenance of periodontal health. A longitudinal study of periodontal therapy in cases of advanced disease. J Clin Periodontol. 1975; 2: 67 - 79.
Zandbergen D, Slot DE, Cobb CM, Van der Weijden FA. The clinical effect of scaling and root planing and the concomitant administration of systemic amoxicillin and metronidazole: a systematic review. J Periodontol. 2013; 84: 332 - 51.
Heitz-Mayfield LJ. Systemic antibiotics in periodontal therapy. Aust Dent J. 2009; 54: 96 - 101.
Kinane DF, Radvar M. A six-month comparison of three periodontal local antimicrobial therapies in persistent periodontal pockets. J Periodontol. 1999; 70: 1 - 7.
Wennstrom JL, Newman HN, MacNeill SR, Killoy WJ, Griffiths GS, Gillam DG, et al. Utilisation of locally delivered doxycycline in non-surgical treatment of chronic periodontitis. A comparative multi-centre trial of 2 treatment approaches. J Clin Periodontol. 2001; 28: 753 - 61.
Michalowicz BS, Pihlstrom BL, Drisko CL, Cobb CM, Killoy WJ, Caton JG, et al. Evaluation of periodontal treatments using controlled-release tetracycline fibers: maintenance response. J Periodontol. 1995; 66: 708 - 15.
Greenstein G, Polson A. The role of local drug delivery in the management of periodontal diseases: a comprehensive review. J Periodontol. 1998; 69(5): 507 - 20.
Raab O. Über die Wirkung fluoreszierende Stoffe auf Infusorien. Zeit Biol. 1900: 524 - 46.
Agostinis P, Berg K, Cengel KA, Foster TH, Girotti AW, Gollnick SO, et al. Photodynamic therapy of cancer: an update. CA Cancer J Clin. 2011; 61: 250 - 81.
Campos GN, Pimentel SP, Ribeiro FV, Casarin RC, Cirano FR, Saraceni CH, et al. The adjunctive effect of photodynamic therapy for residual pockets in single-rooted teeth: a randomized controlled clinical trial. Lasers Med Sci. 2013; 28: 317 - 24.
Chondros P, Nikolidakis D, Christodoulides N, Rossler R, Gutknecht N, Sculean A. Photodynamic therapy as adjunct to non-surgical periodontal treatment in patients on periodontal maintenance: a randomized controlled clinical trial. Lasers Med Sci. 2009; 24: 681 - 8.
Braun A, Dehn C, Krause F, Jepsen S. Short-term clinical effects of adjunctive antimicrobial photodynamic therapy in periodontal treatment: a randomized clinical trial. J Clin Periodontol. 2008; 35(: 877 - 84.
Jori G, Fabris C, Soncin M, Ferro S, Coppellotti O, Dei D, et al. Photodynamic therapy in the treatment of microbial infections: basic principles and perspective applications. Lasers Surg Med. 2006; 38: 468 - 81.
Cobb CM, Low SB, Coluzzi DJ. Lasers and the treatment of chronic periodontitis. Dent Clin North Am. 2010; 54: 35 - 53.
Alwaeli HA, Al-Khateeb SN, Al-Sadi A. Long-term clinical effect of adjunctive antimicrobial photodynamic therapy in periodontal treatment: a randomized clinical trial. Lasers Med Sci. 2013; 15: 15.
Berakdar M, Callaway A, Eddin MF, Ross A, Willershausen B. Comparison between scaling-root-planing (SRP) and SRP/photodynamic therapy: six-month study. Head Face Med. 2012; 8: 8 - 12.
Christodoulides N, Nikolidakis D, Chondros P, Becker J, Schwarz F, Rossler R, et al. Photodynamic therapy as an adjunct to non-surgical periodontal treatment: a randomized, controlled clinical trial. J Periodontol. 2008; 79: 1638 - 44.
Dilsiz A, Canakci V, Aydin T. Clinical effects of potassium-titanyl-phosphate laser and photodynamic therapy on outcomes of treatment of chronic periodontitis: a randomized controlled clinical trial. J Periodontol. 2013; 84: 278 - 86.
Theodoro LH, Silva SP, Pires JR, Soares GH, Pontes AE, Zuza EP, et al. Clinical and microbiological effects of photodynamic therapy associated with nonsurgical periodontal treatment. A 6-month follow-up. Lasers Med Sci. 2012; 27: 687 - 93.
Al-Zahrani MS, Bamshmous SO, Alhassani AA, Al-Sherbini MM. Short-term effects of photodynamic therapy on periodontal status and glycemic control of patients with diabetes. J Periodontol. 2009; 80: 1568 - 73.
Arweiler NB, Pietruska M, Skurska A, Dolinska E, Pietruski JK, Blas M, et al. Nonsurgical treatment of aggressive periodontitis with photodynamic therapy or systemic antibiotics. Three-month results of a randomized, prospective, controlled clinical study. Schweiz Monatsschr Zahnmed. 2013; 123: 532 - 44.
Bassir SH, Moslemi N, Jamali R, Mashmouly S, Fekrazad R, Chiniforush N, et al. Photoactivated disinfection using light-emitting diode as an adjunct in the management of chronic periodontitis: a pilot double-blind split-mouth randomized clinical trial. J Clin Periodontol. 2013; 40: 65 - 72.
Javed F, Qadri T, Ahmed HB, Al-Hezaimi K, Corbet FE, Romanos GE. Is photodynamic therapy with adjunctive non-surgical periodontal therapy effective in the treatment of periodontal disease under immunocompromised conditions? J Coll Physicians Surg Pak. 2013; 23: 731 - 6.
Luchesi VH, Pimentel SP, Kolbe MF, Ribeiro FV, Casarin RC, Nociti FH, Jr., et al. Photodynamic therapy in the treatment of class II furcation: a randomized controlled clinical trial. J Clin Periodontol. 2013; 40: 781 - 8.
Thierbach R, Eger T. Clinical outcome of a nonsurgical and surgical treatment protocol in different types of peri-implantitis: a case series. Quintessence Int. 2013; 44: 137 - 48.
Souza SL, Andrade PF, Silva JS, Tristao FS, Rocha FA, Palioto DB, et al. Effects of antimicrobial photodynamic therapy on transforming growth factor-beta1 levels in the gingival crevicular fluid. Photomed Laser Surg. 2013; 31: 65 - 71.
Balata ML, Andrade LP, Santos DB, Cavalcanti AN, Tunes Uda R, Ribeiro Edel P, et al. Photodynamic therapy associated with full-mouth ultrasonic debridement in the treatment of severe chronic periodontitis: a randomized-controlled clinical trial. J Appl Oral Sci. 2013; 21: 208 - 14.
Bombeccari GP, Guzzi G, Gualini F, Gualini S, Santoro F, Spadari F. Photodynamic therapy to treat periimplantitis. Implant Dent. 2013; 22: 631 - 8.
Giannelli M, Formigli L, Lorenzini L, Bani D. Combined photoablative and photodynamic diode laser therapy as an adjunct to non-surgical periodontal treatment: a randomized split-mouth clinical trial. J Clin Periodontol. 2012; 39: 962 - 70.
Noro Filho GA, Casarin RC, Casati MZ, Giovani EM. PDT in non-surgical treatment of periodontitis in HIV patients: a split-mouth, randomized clinical trial. Lasers Surg Med. 2012; 44: 296 - 302.
Giannopoulou C, Cappuyns I, Cancela J, Cionca N, Mombelli A. Effect of photodynamic therapy, diode laser, and deep scaling on cytokine and acute-phase protein levels in gingival crevicular fluid of residual periodontal pockets. J Periodontol. 2012; 83: 1018 - 27.
Cappuyns I, Cionca N, Wick P, Giannopoulou C, Mombelli A. Treatment of residual pockets with photodynamic therapy, diode laser, or deep scaling. A randomized, split-mouth controlled clinical trial. Lasers Med Sci. 2012; 27: 979 - 86.
Novaes AB, Jr., Schwartz-Filho HO, de Oliveira RR, Feres M, Sato S, Figueiredo LC. Antimicrobial photodynamic therapy in the non-surgical treatment of aggressive periodontitis: microbiological profile. Lasers Med Sci. 2012; 27: 389 - 95.
Sgolastra F, Gatto R, Petrucci A, Monaco A. Effectiveness of systemic amoxicillin/metronidazole as adjunctive therapy to scaling and root planing in the treatment of chronic periodontitis: a systematic review and meta-analysis. J Periodontol. 2012; 83: 1257 - 69.
Bories C, Struillou X, Badran Z, Soueidan A. [Peri-implantitis: tools and techniques for disinfecting the implant surface]. Schweiz Monatsschr Zahnmed. 2011; 121: 341 - 55.
Mettraux G, Husler J. [Implementation of transgingival antibacterial photodynamic therapy (PDT) supplementary to scaling and root planing. A controlled clinical proof-of-principle study]. Schweiz Monatsschr Zahnmed. 2011; 121: 53 - 67.
Ge L, Shu R, Li Y, Li C, Luo L, Song Z, et al. Adjunctive effect of photodynamic therapy to scaling and root planing in the treatment of chronic periodontitis. Photomed Laser Surg. 2011; 29: 33 - 7.
Lui J, Corbet EF, Jin L. Combined photodynamic and low-level laser therapies as an adjunct to nonsurgical treatment of chronic periodontitis. J Periodontal Res. 2011; 46: 89 - 96.
Matthews DC. Seeing the Light--the truth about soft tissue lasers and nonsurgical periodontal therapy. J Can Dent Assoc. 2010; 76: a30
Sigusch BW, Engelbrecht M, Volpel A, Holletschke A, Pfister W, Schutze J. Full-mouth antimicrobial photodynamic therapy in Fusobacterium nucleatum-infected periodontitis patients. J Periodontol. 2010; 81: 975 - 81.
Romanos GE, Brink B. Photodynamic therapy in periodontal therapy: microbiological observations from a private practice. Gen Dent. 2010; 58: e68 - 73.
Pinheiro SL, Donega JM, Seabra LM, Adabo MD, Lopes T, do Carmo TH, et al. Capacity of photodynamic therapy for microbial reduction in periodontal pockets. Lasers Med Sci. 2010; 25: 87 - 91.
Polansky R, Haas M, Heschl A, Wimmer G. Clinical effectiveness of photodynamic therapy in the treatment of periodontitis. J Clin Periodontol. 2009; 36: 575 - 80.
Benhamou V. Photodisinfection: the future of periodontal therapy. Dent Today. 2009; 28: 108 - 9.
de Oliveira RR, Schwartz-Filho HO, Novaes AB, Garlet GP, de Souza RF, Taba M, et al. Antimicrobial photodynamic therapy in the non-surgical treatment of aggressive periodontitis: cytokine profile in gingival crevicular fluid, preliminary results. J Periodontol. 2009; 80: 98 - 105.
Andrade PF, Garlet GP, Silva JS, Fernandes PG, Milanezi C, Novaes AB, Jr., et al. Adjunct effect of the antimicrobial photodynamic therapy to an association of non-surgical and surgical periodontal treatment in modulation of gene expression: a human study. J Photochem Photobiol B. 2013; 126: 119 - 25.
Esposito M, Grusovin MG, De Angelis N, Camurati A, Campailla M, Felice P. The adjunctive use of light-activated disinfection (LAD) with FotoSan is ineffective in the treatment of peri-implantitis: 1-year results from a multicentre pragmatic randomised controlled trial. Eur J Oral Implantol. 2013; 6: 109 - 19.
Lulic M, Leiggener Gorog I, Salvi GE, Ramseier CA, Mattheos N, Lang NP. One-year outcomes of repeated adjunctive photodynamic therapy during periodontal maintenance: a proof-of-principle randomized-controlled clinical trial. J Clin Periodontol. 2009; 36: 661 - 6.
Betsy J, Prasanth CS, Baiju KV, Prasanthila J, Subhash N. Efficacy of antimicrobial photodynamic therapy in the management of chronic periodontitis: a randomized controlled clinical trial. J Clin Periodontol. 2014; 41: 573 - 81.
Qadri T, Javed F, Poddani P, Tuner J, Gustafsson A. Long-term effects of a single application of a water-cooled pulsed Nd: YAG laser in supplement to scaling and root planing in patients with periodontal inflammation. Lasers Med Sci. 2011; 26: 763 - 6.
Eltas A, Orbak R. Clinical effects of Nd: YAG laser applications during nonsurgical periodontal treatment in smoking and nonsmoking patients with chronic periodontitis. Photomed Laser Surg. 2012; 30: 360 - 6.
Slot DE, Timmerman MF, Versteeg PA, van der Velden U, van der Weijden FA. Adjunctive clinical effect of a water-cooled Nd: YAG laser in a periodontal maintenance care programme: a randomized controlled trial. J Clin Periodontol. 2012; 39: 1159 - 65.
Lopes BM, Theodoro LH, Melo RF, Thompson GM, Marcantonio RA. Clinical and microbiologic follow-up evaluations after non-surgical periodontal treatment with erbium: YAG laser and scaling and root planing. J Periodontol. 2010; 81: 682 - 91.
Krohn-Dale I, Boe OE, Enersen M, Leknes KN. Er: YAG laser in the treatment of periodontal sites with recurring chronic inflammation: a 12-month randomized, controlled clinical trial. J Clin Periodontol. 2012; 39: 745 - 52.
Sarkar S, Wilson M. Lethal photosensitization of bacteria in subgingival plaque from patients with chronic periodontitis. J Periodontal Res. 1993; 28: 204 - 10.
Bhatti M, MacRobert A, Meghji S, Henderson B, Wilson M. A study of the uptake of toluidine blue O by Porphyromonas gingivalis and the mechanism of lethal photosensitization. Photochem Photobiol. 1998; 68: 370 - 6.
Valduga G, Breda B, Giacometti GM, Jori G, Reddi E. Photosensitization of wild and mutant strains of Escherichia coli by meso-tetra (N-methyl-4-pyridyl)porphine. Biochem Biophys Res Commun. 1999; 256: 84 - 8.
WHO. The evolving threat of antimicrobial resistance: Options for action. WHO Press, World Health Organization. 2012. http: //www.who.int/patientsafety/implementation/amr/publication/en/
Adresse: Odd Carsten Koldsland; Postboks 1109 Blindern, 0317 Oslo. E-post: oddcko@odont.uio.no
Artikkelen har gjennomgått ekstern faglig vurdering.
Lutnæs OB, Wohlfahrt JC, Aass AM, Koldsland OC. Tilleggseffekten av fotodynamisk terapi ved ikke-kirurgisk periodontal behandling. Nor Tannlegeforen Tid. 2015; 125: 692-7.
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Lutnæs OB, Wohlfahrt JC, Aass AM, Koldsland OC. Tilleggseffekten av fotodynamisk terapi ved ikke-kirurgisk
periodontal behandling. Nor Tannlegeforen Tid. 2015;125:692-7. doi:10.56373/2015-8-9