Ytre membranvesikler - offensive bakterielle våpen eller gode samaritaner?
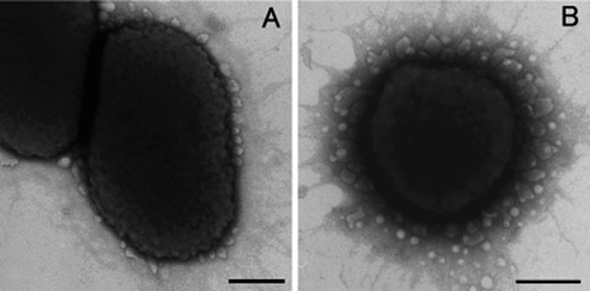
OMVs observert gjennom transmisjon electronmikroskop ved den ytre cellemembranen til P. gingivalis. A: OMVs fra stamme ATCC 32777T (type I fimA stamme). B: OMVs ved den ytre membran til stamme TDC 60 (type II fimA stamme). Linjal = 200 nm.
Gram-negative bakterier snører av små runde blemmer eller vesikler fra sin ytre cellemembran kalt ytre membranvesikler (OMVs) (Fig. 1). Vesikkelproduksjonen varierer med vekstfase og næringstilgang. OMVs varierer i størrelse fra 20 til 300 nm. På grunn av størelsen er de blitt betegnet som nanovesikler. Eksempler på mikrober som produserer disse vesiklene er bakterier som forbindes med periodontitt, herunder Porphyromonas gingivalis. Også ikke-patogene arter kan produsere vesikler. Først trodde man blemmene var artefakter når man oppdaget dem i mikroskopet. Rapporter om deres eksistens ble lenge fulgt av vantro. I dag vet vi at disse vesiklene er viktige i bakterienes liv, og at de har en rekke funksjoner (1). La oss kort se på noen av dem.
OMVs virker som et sekresjonssystem i bakterier og transporterer blant annet lipider, membranproteiner og signalmolekyler. I motsetning til andre bakterielle sekresjonssystemer er lasten beskyttet av vesiklenes membran, og den kan avleveres i ønskede seter via reseptorer. Dette er viktig når OMVs skal utrydde konkurrerende bakterier som antibiotika ikke kan nå. Mange bakterier bruker OMVs til å skille ut virulensfaktorer, herunder giftstoffer. Det ser vi for eksempel hos den periodontopatogene bakterien Aggregatibacter actinomycetemcomitans. OMVs kan også transportere antibiotika over i andre bakterieceller, selv til arter som er forskjellig fra dem. De kan videre inneholde beta-laktamaser som er enzymer som beskytter dem selv og andre bakterier mot antibiotika. I tarmen kan de forsyne normalfloraen med næringsstoffer, altså opptre til vertens fordel (gode samaritaner). Vi vet ennå ikke om dette også skjer i munnhulen, men det er ikke utenkelig. Gjennom sin last av enzymer, toksiner, kommunikasjonssignaler og antigener kan OMVs stimulere både det medfødte og det ervervede immunsystem.
OMVs har ulike måter å virke som «lokkeduer» på. Hos Moraxella catarrhalis (halsbakterie) kan de lede antistoffresponsen vekk fra seg selv ved at de får verten til å produsere antistoffer som ikke virker på dem. De kan også virke som «lokkeduer» for bakteriofager og peptidantibiotika ved å transportere disse molekylene bort fra morcellen. OMVs kan formidle «cross-kingdom» dialog, dvs. kommunikasjon mellom human vert og bakterier. Dette skjer i tarmen via et inositolfosfat signaleringsenzym (1). OMVs er også viktige for kommunikasjon mellom bakterier. Denne kan skje over lange avstander.
En annen viktig funksjon hos OMVs er deres virkning på lokal økologi. De fremmer både cellulær aggregering, autoaggregering og koaggregering mellom en rekke forskjellige bakterier. Ved sin transport av toksiner, herunder lipopolysakkarid (endotoksin) til periodontale lommer kan de skade lommeepitelet. De kan også bringe bakterier som ikke kan bevege seg til periodontale lommer ved at de formidler koaggregering med bevegelige bakterier. De bevegelige bakteriene transporterer da de ubevegelige bakteriene til lommen («piggy back»). Dette bidrar til å gjøre mikrofloraen i lommen mer variert.
I tarmen kan OMVs ha en «sosial» funksjon ved at de bringer oligosakkarider, monosakkarider og aminosyrer til andre bakterier, f. eks. til bakterier innen slekten Bacteroides. Herved begunstiger de bakterier som ikke kan bryte ned polysakkarider.
OMVs er blitt betegnet som «virulence bullets» eller «bacterial bombs». Dette beror på at de kan bl. a. inneholde antimikrobielle stoff som dreper andre bakteriearter. De kan også inneholde toksiner som dreper lymfocytter og myelocytter. Spesielt viktig her er JP2-stammen hos A. actinomycetemcomitans. Toksiner og virulensfaktorer kan avleveres direkte til målcellene uten degradering og fortynning på veien.
Hos P. gingivalis-OMVs blir de viktigste virulensfaktorene, gingipainer (2), sortert ut før lasten avleveres til målcellen. Sannsynligvis spiller O-antigenet i lipopolysakkarid en viktig rolle i denne sorteringen. OMVs kan feste seg til både bakterier og vertens celler. De kan også invadere vertsceller og bryte ned cellens proteiner. Dette skader viktige cellefunksjoner i vertscellen (1).
OMVs ser ut til å være velegnet til vaksiner. Deres rike innhold av virulensfaktorer synes å gjøre dem spesielt interessante som periodontittvaksine. Til nå har de med hell vært benyttet som vaksine mot meningitt. Et nytt felt av spesiell interesse er nye bakterie- og virusinfeksjoner der OMVs kan manipuleres slik at de inneholder proteiner som kan brukes som «lokkefugler» og vaksiner.
Konklusjonen er at OMVs virker både som offensive bakterielle våpen og gode samaritaner.
Referanser
Olsen I, Amano A. Outer membrane vesicles - offensive weapons or good Samaritans? J Oral Microbiol 2015, 7: 27468 - http://dx.doi.org/10.3402/jom.v7.27468.
Olsen I, Potempa J. Strategies for the inhibition of gingipains for the potential treatment of periodontitis and associated systemic diseases. J Oral Microbiol 2014, 6: 24800 - http://dx.doi.org/10.3402/jom.v6.24800.
Adresser: Ingar Olsen, Institutt for Oral Biologi, Det Odontologiske Fakultet, Universitetet i Oslo, PB 1052 Blindern, 0316 Oslo, og Atsuo Amano, Department of Preventive Dentistry, Osaka University Graduate School of Dentistry, 1 - 8 Yamadaoka, Suita-Osaka 565 - 0871, Japan.
E-post: ingar.olsen@odont.uio.no