Legemiddelindusert gingival overvekst (LIGO)
Legemidler kan forårsake overvekst av gingiva - betegnet som legemiddelindusert gingival overvekst, på norsk forkortet til LIGO. Tilstanden er et resultat av legemidlenes hemmende effekt på gingivale fibroblasters intracellulære kalsiummetabolisme, samt en forsterkning av den inflammatoriske vevsreaksjon på biofilm. Dette fører til dannelse av fibrotisk vev med klinisk observerbar overvekst i gingiva. LIGO er vanligst forekommende hos brukere av kalsineurin-hemmere, hydantoin-derivater og kalsiumantagonister. De sistnevnte legemidlene foreskrives hyppig til eldre pasienter ved hypertensjon og stabil angina pectoris. Forekomst, patologi og klinikk, herunder behandling diskuteres. God plakkontroll og systematisk behandling av foreliggende periodontal sykdom, inklusive kirurgi, kan redusere LIGO. Seponering av det LIGO-induserende legemiddelet, samt erstatning med et annet legemiddel, bør alltid tas opp til vurdering ved denne bivirkningen. Pasientens lege må informeres og alltid medvirke ved seponering og erstatning av aktuelle legemidler.
Kunnskapsgrunnlag
Artikkelen er basert på søk i PubMed (søk i februar og mars 2013) med søkeordene «Drug-Induced Gingival Overgrowth» (DIGO), «Drug-Induced Gingival Hyperplasia», «Drug-Induced Gingival Enlargement», «Drug-Associated Gingival Enlargement», samt søk i Reseptregisteret ved bruk av anatomisk terapeutisk kjemisk legemiddelregister (ATC-klassifikasjonssystemet) (1).
I norsk faglitteratur har betegnelsen gingival hyperplasi blitt brukt om legemiddel-indusert gingival overvekst. Uttrykket gir ingen informasjon om årsaken til overveksten, samt at ordet hyperplasi betyr økning i antall celler. Ved LIGO sees imidlertid også en sterk økning av mengden ekstracellulært kollagen. Det foreslåes derfor å erstatte uttrykket gingival hyperplasi i norsk faglitteratur med betegnelsen legemiddel-indusert gingival overvekst og forkortet til LIGO.
Bakgrunn
Legemiddel-indusert gingival overvekst (LIGO) (figur 1 og 2) settes først og fremst i sammenheng med bruk av kalsiumantagonister (C08), hydantoin-derivater (N03A B) og kalsinevrinhemmere (L04A D) (tabell I), men har også blitt rapportert ved bruk av andre immunsuppresiver, samt antibiotika og antikonseptiva (1). Kalsiumantagonister, kalsinevrinhemmere og hydantoinderivater har forskjellige kliniske indikasjoner. Kalsiumantagonister virker ved at de bindes seg til kalsiumkananaler(L-type) og hindrer derved at kalsiumioner beveger seg inn i hjertemuskelceller og glatte muskelceller i perifere kar. Dette vil da utvide koronare arterier og perifere arterioler, men ikke vener. Kalsinevrinhemmeren ciklosporin hemmer produksjon og frisetting av lymfokiner, mens takrolimus hemmer kalsinevrin og fører til kalsiumavhengig inhibering av T-cellesignaloverføring. Hydantoinderivatene fenytoin og fosfenytoin modulerer nervecellenes spenningsavhengige natrium- og kalsiumkanaler.
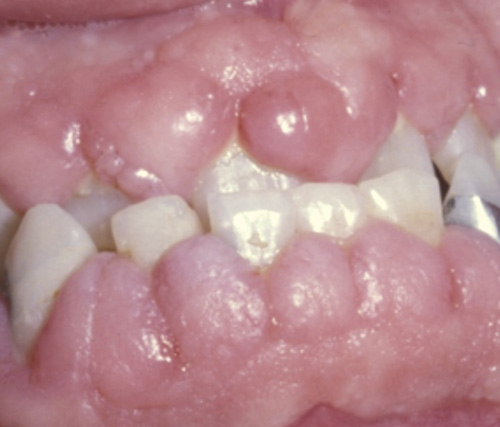
Figur 1. 11 år gammel gutt med epilepsi, som hadde stått på Epinat®(fenytoin) i fire år. Bildet er utlånt av avdelingstannlege Ivar Hoff, IKO, Det medisinskodontologiske fakultet, UiB.
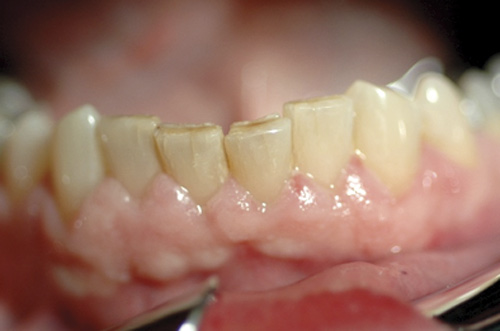
Figur 2. 58 år gammel mann, som har stått på Adalat®(nifedipin) i 2 måneder. Bildet er utlånt av professor Knut N. Leknes,IKO, Det medisinskodontologiske fakultet, UiB.
Kalsiumantagonister (C08) |
Adalat® (nifedipin), filmdrasjerte tabletter, Bayer Schering Pharma AG |
Adalat Oros® (nifedipin), depottabletter, Bayer Schering Pharma AG |
Amlodipin®(amlodipin), tabletter, Actavis Norway AS |
Amlodipin®(amlodipin), tabletter, Orifarm Generics AS |
Amlodipin®(amlodipin), tabletter, BMM Pharma AB |
Amlodipin®(amlodipin), tabletter, Sandoz AS |
CARDIZEM RETARD®(diltiazem), depottabletter, Pfizer AS |
Cardizem Uno®(diltiazem), depottabletter, Pfizer AS |
Felodipin®(felodipin), depottabletter, Sandoz AS |
Felodipin®(felodipin), depottabletter, ratiopharm AS |
Felodipin®(felodipin), depottabletter, Sandoz AS |
Isoptin Retard®(verapamil), depottabletter, ABBOTT Norge AS |
Lerkanidipin®(lerkanidipin), filmdrasjerte tabletter, Actavis Norway AS |
Lomir®(isradipin), tabletter, Novartis Norge (2) |
Lomir sro®(isradipin), depotkapsel, Novartis Norge (2) |
Norvasc®(amlodipin), tabletter, Pfizer AS |
Norvasc®(amlodipin), tabletter, 2care4 |
Plendil®(felodipin), depottabletter, AstraZeneca |
Verakard®(verapamil), filmdrasjert tablett, Nycomed Pharma AS |
Zanidip®(lerkanidipin), filmdrasjerte tabletter, Meda AS |
Hydantoinderivater (N03A B) |
Epinat®(fenytoin), tabletter, Takeda Nycomed |
Fenytoin®(fenytoin), tabletter, NAF «Apotek» |
Kalsinevrin-hemmere (L04A D) |
Sandimmun Neoral®(ciklosporin), kapsler, Farlic |
Sandimmun Neoral®(ciklosporin), kapsler, Farmagon |
Sandimmun Neoral®(ciklosporin), kapsler, Novartis |
Adport®(takrolimus), kapsler, Sandoz |
Advagraf®(takrolimus), kapsler, Astellas |
Modigraf®(takrolimus), granulat til mikstur, Astellas |
Prograf®(takrolimus), kapsler, Astellas |
Prograf®(takrolimus), kapsler, Farmagon |
Prograf®(takrolimus), kapsler, Orifarm |
Tacni®(takrolimus), kapsler, Teva |
De tre nevnte legemiddelgruppene har som felles egenskap en virkningsmekanisme som influerer på omsetning av kalsium i celler. Kalsium hører til de sekundære budbringere i cellene hvor de binder seg til og aktiverer ulike proteiner som har betydning for intracellulære signalveier.
LIGO ble først rapportert etter bruk av hydantoinderivater (2), senere ciklosporin (3) og takrolimus (4). For kalsiumantagonister kom den første rapporten om LIGO som resultat av nifedipinbruk i 1984 (5). Amlodipin ble rapportert å kunne forårsake LIGO i 1993 (6).
LIGO kan interferere både med oral estetikk og funksjon, samt øke morbiditeten både ved karies og periodontal sykdom (figur 1 og 2).
Forekomst
Tall fra det franske bivirkningsregisteret (Organisation de la pharmacovigilance nationale) viser at i perioden fra 1984 til 2010 ble det meldt totalt 401 831 bivirkninger av legemidler og av disse utgjorde LIGO 147 (0,04 %). Av disse ble 13,6 % definert som alvorlige, hvorav 65 % krevde hospitalisering. Basert på tallene fra det franske bivirkningsregisteret forekom 70 % av LIGO-tilfellene i aldersgruppen 30 - 69 år, de fleste i aldersgruppen 50 - 59 år (23 %) (7).
Tall fra Integrated Primary Care Information (IPI)-databasen i Nederland viser 103 (0,5 %) LIGO-rapporter blant 20 636 kalsiumantagonistbrukere med medianalder ca. 60 år. Det må understrekes at de anvendte søkeordene i den sistnevnte databasen kun dekket LIGO med symptomer (8). Det er også viktig å påpeke at bivirkningsmeldingene både fra IPI og det franske bivirkningsregisteret er sendt inn av leger og ikke tannleger. Følgelig er det ikke-standardiserte diagnoser som legges til grunn for de presenterte funn av forekomst. Man må derfor kunne anta at den hittil anvendte utilstrekkelige diagnostikk for registrering av LIGO som bivirkning av legemidler underestimerer forekomsten. Forfatteren er ikke kjent med at det foreligger tall for forekomst av LIGO i Norge, eller Skandinavia for øvrig.
Også i ny litteratur fremkommer påstand om at det er større forekomst av LIGO hos menn (9), i dette tilfellet med henvisning til Sooriyamoorthy et al. (10). Referansen fra 1990 viser til analyser av gingiva fra tre pasienter og er således ikke pålitelig. I de to ovenfor omtalte databasefunnene refererer det franske bivirkningsregisteret til overvekt av menn (58,5 %)(7), mens IPI-databasen i Nederland finner overvekt av kvinner (58,3 %) (8). Den kjønnsmessige fordelingen synes av foreliggende grunn å være uavklart.
I andre publikasjoner som vurderer forekomsten av LIGO varierer dette innenfor legemiddelgruppene kalsiumantagonister, antiepileptika og immunsuppresiver og sees oftest ved fenytoin, nifedipin og ciklosporin. Blant ikke-institusjonaliserte fenytoin-brukere har forekomsten av LIGO blitt rapportert å være ca.40 % (11). Kalsiumantagonisten nifedipin er funnet å variere i forekomst mellom 6 % og 85 % (12, 13). Tilsvarende spredning i forekomst finnes også for ciklosporin (14). Ifølge Bondon-Guitton et al. (7) synes LIGO å debutere mellom 0 og 9 måneder etter oppstart av immunsupprimerende legemidler. For kalsiumantagonister kan LIGO debutere i de tre første måneder like så vel som etter ett års bruk av legemidlene. LIGO ved antiepileptika synes å debutere etter mer enn ett års bruk av denne type legemidler (7). LIGO forekommer ved monoterapi, men også ved polyfarmasi (15), eksempelvis ved å kombinere ciklosporin og kalsiumantagonister, som begge kan forårsake LIGO (14).
Patologi
Til tross for at kalsiumantagonister, kalsinevrinhemmere og hydantoinderivater har forskjellige virkningsmekanismer og kliniske indikasjoner, trigger de cellulære mekanismer som fører til endret kalsiummetabolisme og økt vevsdannelse, dominert av fibrose (dvs. økt bindevevsmengde i et vev eller organ).
Histologisk manifesterer LIGO seg som akkumulering av ekstracellulær kollagen matriks, samt varierende grad av inflammasjon og fortykkelse av epitelet. Inflammasjonen i vevet er mer uttalt ved ciklosporinindusert LIGO (16), enn ved LIGO forårsaket av kalsiumantagonister og hydantoinderivater.
I frisk gingiva er syntese og nedbrytning av kollagen balansert for å opprettholde homeostasen i vevet. Gingivale fibroblaster syntetiserer kollagen. Nedbrytning av kollagen skjer både ekstracellulært og intracellulært. Fibrose oppstår når balansen mellom syntese og nedbrytning av vev endres. Vevstyping fra transplanterte pasienter har vist at «human leucocyte antigen» (HLA) B37-positive personer har signifikant større sannsynlighet for å utvikle alvorlig LIGO ved samtidig bruk av ciklosporin (17). Lin SJ og medarbeidere (18) har i tillegg vist at overekspresjon av androgene reseptorer hos gingivale fibroblaster stimulert av nifedipin kan være en av mekanismene som gir økt kollagenproduksjon. En annen interessant observasjon er at gingivale fibroblaster er utstyrt med L-type kalsiumkanaler(19). Kanalene har avgjørende betydning for virkningsmekanismen for kalsiumantagonister i hjertemuskelceller, samt glatte muskelceller i perifere kar, men det betyr også at kalsiumantagonister kan virke direkte på gingivale celler ved å hindre opptak av kalsium i fibroblastene.
Inhibisjon av kollagen fagocytose og nedbrytning er en annen mulig mekanisme for økt fibrose ved LIGO (19, 20, 21).
Også mastceller er rapportert å ha betydning for utvikling av fibrose. Ved LIGO skjer degranulering av mastceller med frigjøring av substanser som direkte vil kunne påvirke fibroblastenes evne til proliferasjon og syntese av kollagen, samt indirekte ved å øke inflammasjonsgraden i vevet (23).
Hvilken betydning vil biofilmindusert inflammasjon i vevet ha på LIGO?
Det er ingen tvil om at inflammasjon vil øke graden av fibrose i gingiva. Makrofager i inflammert vev vil frigi TGF-beta som stimulerer proliferasjon og aktivering av fibroblaster. Kim et al. (24) har nylig vist at periostin, et protein med betydning for matriksregulering og fibrose, blir oppregulert av nifedipin i gingivale fibroblaster gjennom «transforming growth factor-b» (TGF-b). Også tumor nekrose faktor-a (TNF-a) konverterende enzym (TACE) utrykkes i makrofager, plasma celler og epitel celler hos LIGO-pasienter med periodontal sykdom (25).
Kan det tenkes at ernæringsmessige forhold spiller inn?
Folsyre er betegnelsen på den syntetiske formen for folat, et vannløselig B-vitamin (B9). Folsyre finnes ikke naturlig i kroppen, men omgjøres til dihydrofolat av cellene i tarmveggen. En felles egenskap som både hydantoinderivater, kalsiumantagonister og kalsineurin-hemmere deler er påvirkning av kalsiummetabolismen, med et redusert opptak av kalsium som resultat. Dette fører til redusert opptak av folsyre i cellene, som vil kunne begrense produksjonen av kollagenase (26), enzymet som bryter ned kollagen. Arya og medarbeidere (27) rapporterer om statistisk signifikant lavere forekomst av LIGO hos hydantoinbrukere etter tilførsel av 0,5 mg folsyre per dag.
Makroskopisk karakteriseres LIGO av fortykkelse av gingiva. Sanz (28) beskriver at overveksten kan være lokalisert eller generell, samt forekomme både marginalt, i papillene eller diffust (figur 1 og 2). McGaw og medarbeidere (29) publiserte i 1987 kriterier for klinisk diagnostisering og klassifisering av LIGO (Grade 0, 1, 2 and 3).
Klinikk
Figur 1 viser et makroskopisk utseende som er karakteristisk for LIGO ved bruk av hydantoinderivater. Pasienten har varierende gingival overvekst av Grad 2 og 3 (29) (Grad 2 - Moderat gingival overvekst, <1/3 av tannkronens lengde; Grad 3 - Markert gingival overvekst, >1/3 av tannkronens lengde). Pasienten i figur 2, derimot, vil diagnostiseres som å ha overvekst av Grad 1 - uskarp gingivalrand (29). Overveksten kan meget enkelt oversees og/eller diagnostiseres som en inflammasjonsbetinget overvekst uten at bruk av legemidler tas med i vurderingen. I dette tilfellet viser imidlertid bildet at pasienten har meget god munnhygiene og at overveksten av gingiva utelukkende skyldes legemiddelet, som i dette tilfellet er en kalsiumantagonist (nifedipin).
Hvor sannsynlig er det at du som tannlege vil se slike pasienter?
Alle allmenpraktiserende tannleger i Norge vil komme i kontakt med pasienter som bruker kalsiumantagonister forskrevet mot hypertensjon. På verdensbasis har én av tre personer høyt blodtrykk. I Norge får personer over 50 år jevnt stigende forskrivning av kalsiumantagonister med alderen. I aldersgruppen 70 - 79 år forskrives det til 1/5 av befolkningen og i gruppen 80 - 89 år noe i underkant av 1/4. Tallene fra Reseptregisteret 2011 viser at vel 50 % av reseptforskrivninger av kalsiumantagonister gjelder amlodipin (1). I senere tid er det rapportert flere kasuistikker med betydelig utvikling av LIGO etter bruk av amlodipin (30, 31, 15, 32).
Hos geriatriske pasienter representerer LIGO en utfordring fordi disse pasientene i like stor grad som andre ikke kan ta ansvar for sin egen munnhygiene. Kvantitative og kvalitative endringer i gingival biofilm, samt øket gingival inflammasjon vil da i større grad kunne forverre en eksisterende periodontal sykdom hos disse pasientene.
Alle pasienter med LIGO vil ha nytte av at det i behandlingen blir fokusert på plakkontroll (33). For pasienter med diagnostisert periodontal sykdom må denne behandles systematisk. Periodontal behandling vil redusere graden av LIGO(34). Ved vurdering av eventuelle kirurgisk inngrep må man ta med i betraktningen at dette ikke vil være en etiologisk basert terapi, i motsetning til den effekt som man vil få ved seponering av legemiddelet. I en ny oversiktsartikkel anbefaler Livada og Shiloah (9) seponering av kalsiumantagonister og oppstart av andre antihypertensiver som det beste behandlingsalternativ ved LIGO indusert ved kalsiumantagonister. Imidlertid må spørsmål angående både seponering av aktuelle legemidler og forskrivning av nye legemidler alltid tas opp med pasientens lege. Pasientens lege må informeres om at det ved forslag om seponering av kalsiumantagonister så må disse ikke erstattes av andre typer kalsiumantagonister. Legen må forskrive andre legemidler i hovedgruppen av antihypertensiver, eksempelvis en ACE-hemmer eller angiotensin II reseptor antagonist. Årsaken til dette er at LIGO regnes som en gruppeeffekt av kalsiumantagonister (9,35). Seponering av legemidler og oppstart av andre antihypertensiva må alltid foretas av pasientens lege.
Organtransplanterte pasienter ses langt sjeldnere enn pasienter med hypertensjon, men er økende i Norge dvs. ca. 300 nyretransplantasjoner per år i Norge. Systemisk behandling med takrolimus brukes stort sett kun ved organtransplantasjon, mens ciklosporin i tillegg brukes ved stamcelletransplantasjon og en del autoimmune sykdommer, slik som noen hudvaskulitter, Behcets sykdom og pyoderma gangrenosum.
For immunsuppresiver er valg av takrolimus som alternativ til ciklosporin ved LIGO diskutabelt. De to legemidlene har forskjellig bivirkningsprofil, men den molekylære mekanisme som er ansvarlig for de toksiske effekter av legemidlene er imidlertid i stor grad ukjent (36). Flere rapporter har påvist lavere LIGO-forekomst ved takrolimus, sammenlignet med ciklosporin. Penninga og medarbeidere (36) finner i en metaanalyse basert på ti studier med 952 hjerte-transplanterte pasienter at den relative risiko for å få LIGO var statistisk signifikant mindre ved takrolimus, sammenlignet med mikroemulsjonsbasert ciklosporin (RR 0,07; 95 % CI 0,01 - 0,37, p=0,002). Den nevnte metaanalysen finner også at takrolimus er bedre enn ciklosporin i forhold til hypertensjon, hyperlipidemi og hirsutisme. En studie av Paixão og medarbeidere (37) finner at forekomsten av LIGO ved ciklosporin og takrolimus synes å være lik, men at LIGO ved takrolimus oppstår senere og er mindre alvorlig enn ved ciklosporin. Det må bemerkes at antallet i den sistnevnte studien er lavt (takrolimus-gruppen n=24 og ciclosporin-gruppen n=25), samt at observasjonstiden er kort (180 dager).
I gruppen av immunsuppresiver finnes legemidler som ikke induserer LIGO, betegnet som mTOR-hemmere (dvs. «mammalian target of rapamycin»). Sirolimus og everolimus er eksempler her og tilhører makrolidene. Disse virker antifibrotisk. Hvorvidt man kan erstatte ciklosporin eller takrolimus med mTOR-hemmere må eventuelt avgjøres av pasientens lege.
Azitromycin (Azitromax®) er et makrolid-antibiotikum i samme gruppe som erytromycin, samt de foran nevnte sirolimus og everolimus, som har vist seg å ha god effekt ved behandling av periodontal sykdom(38). En annen interessant klinisk virkning av azitromycin ble rapportert i 1995 (39) og viste at legemiddelet har den egenskap at det kan reversere LIGO indusert ved ciklosporin. Dette har senere blitt bekreftet av Wirnsberger i 1998 (40) og Tokgoz i 2004 (41).
I løpet av de siste tjue år har det blitt introdusert flere nye legemidler for behandling av epilepsi. Hydantoinderivater er et av flere legemidler som virker enzym-induserende på cytokrom-P 450 systemet. Dette kan bidra til utvikling av uheldig co-morbiditet hos brukerne av legemiddelet. Hydantoinderivater er av den grunn ikke et selvfølgelig førstevalg ved diagnostisert epilepsi i dag(42), spesielt ikke ved epilepsi hos eldre (43). Til tross for det har det vist seg at hydantoinderivater er det foretrukne forskrevne legemiddel ved epilesi hos eldre i Norge(43).
For alle typer LIGO er det god terapi, i samarbeid med pasientens lege, å seponere det involverte legemiddel og erstatte det med et annet. Hvis dette er mulig, vil man da foreta en etiologisk basert terapi som medfører at den gingivale overveksten forsvinner, om enn over tid. Tatt i betraktning pasientens medisinske diagnose(r) er det sannsynligvis enklest å endre legemiddelbruken når pasienten har fått forskrivning av kalsiumantagonister, men det finnes alternative legemidler både ved forskrivning av hydantoinderivater og kalsinevrinhemmere. Vurdering av dette må alltid foretas av lege. Den odontologiske vurdering av pasienten vil omfatte plakkontroll og behov for periodontal behandling, inklusiv vurdering av periodontal kirurgi. Kirurgisk behandling vil gi rask reduksjon av LIGO, men vil alltid være influert av residivtendens hvis pasienten fortsetter med det LIGO-induserende legemiddelet. En systematisk gjennomført periodontal behandling med depurasjon og plakkontroll vil redusere LIGO ved at den biofilminfluerte inflammasjon blir mindre, men den forsvinner ikke (figur 2). Også bruk av azitromycin vil gi en anti-inflammatorisk effekt med redusert fibrose, men det vitenskapelige rasjonale for forskrivning av azitromycin er foreløpig for svakt til at dette kan anbefales som supplerende terapi.
English summary
Drug-induced gingival overgrowth (DIGO) - incidence, pathology and clinical aspects
Drugs may induce gingival overgrowth - described as drug-induced gingival overgrowth (DIGO). DIGO results from an intracellular restrained effect on calcium metabolism of gingival fibroblasts, combined with an increased inflammatory tissue reaction from dental biofilm. This results in formation of fibrotic tissue giving clinically detectable gingival enlargement. DIGO is most common in patients using phenytoin, calcineurin-inhibitors, and calcium-channel blockers. The latter group of drugs is often prescribed in elderly patients with hypertension or angina. Incidence, pathology, and clinical aspects, including treatment modalities are discussed. Meticulous dental hygiene and treatment of diagnosed periodontal disease may reduce DIGO. Periodontal surgery may be assessed. Drug cessation and substitution to other classes of drugs should always be considered, however, by routine in cooperation with the physician.
Lygre H. Legemiddelindusert gingival overvekst (LIGO). Nor Tannlegeforen Tid. 2014;124:370-75. doi:10.56373/2014-5-10
Hovedbudskap | |
|---|---|
· |
Forekomsten av legemiddel-indusert gingival overvekst (LIGO) synes å være høyere hos brukere av kalsineurin-hemmere og hydantoin-derivater, sammenlignet med kalsiumantagonistbrukere. Hos eldre (> 65 år) er forekomsten av epilepsi større enn hos barn og unge, og fenytoin er fremdeles ett av de mest forskrevne antiepileptika i denne aldersgruppen. Forskrivning av kalsiumantagonister hos personer over 60 år i Norge er svært hyppig, spesielt i aldersgruppen 80 - 89 år. |
· |
Helsepersonell må være oppmerksomme på at LIGO forekommer hyppig hos eldre pasienter. Tannhelsepersonell kan med sin kompetanse og sine tiltak bidra, i dialog med pasientens lege, til å minimalisere effekten av denne orale bivirkningen av legemidler. |
Referanser
www.reseptregisteret.no (18.01.2013).
Kimball O. The treatment of epilepsy with sodium diphenyl hydantoinate. J Am Med Assoc. 1939; 112: 1244 - 1245.
Starzl TE, Klintmalm GB, Porter KA, Iwantsuki S, Schroter GP. Liver transplantation with use of cyclosporine and prednisone. N Engl J Med. 1981; 395: 266 - 269.
Adams CK, Famili P. A study of the effects of the drug FK-506 on gingival tissue. Transplant Proc. 1991; 23: 3193 - 3194.
Lederman D, Lumerman H, Reuben S, Freedman PD. Gingival hyperplasia associated with nifedipine therapy. Oral Surg. 1984; 57: 620 - 622.
Ellis JS, Seymour RA, Thomason JM, Monkman SC, Idle JR. Gingival sequestration of amlodipine and amlodipine-induced gingival overgrowth (letter). Lancet. 1993; 341: 1102 - 1103.
Bondon-Guitton E, Bagheri H, Montastruc JL. Drug-induced gingival overgrowth: a study in the French Pharmacovigilance Database. J Clin Periodontol. 2012,39: 513 - 518.
Kaur G, Verhamme KMC, Dieleman JP, Vanrolleghem A, van Soest EM, Stricker BHCh, et al. Association between calcium channel blockers and gingival hyperplasia. J Clin Periodontol. 2010; 37: 625 - 30.
Livada R, Shiloah J. Calcium channel blocker-induced gingival enlargement. J Hum Hypertens. 2014; 28: 10 - 14.
Sooriyamoorthy M, Gower DB, Eley BM. Androgen metabolism in gingival hyperplasia induced by nifedipin and cyclosporine. J Periodont Res. 1990; 25: 25 - 30.
Casetta I, Granieri E, Desidera M, Monetti V, Tola M, Paolino E, et al. Phenytoin-induced gingival overgrowth: a community-based cross-sectional study in Ferrara, Italy. Neur epidemiol. 1997; 16: 296 - 303.
Barak S, Engelberg IS, Hiss J. Gingival hyperplasia caused by nifedipine. Histopathologic findings. J Periodontol. 1987; 58: 639 - 642.
Ellis JS, Seymour RA, Steel JG, Robertson P, Butler TJ, Thomason JM. Prevalence of gingival overgrowth induced by calcium channels blockers: a community-based study. J Periodontol. 1999; 70: 63 - 67.
López-Pintor RM, Hernández G, de Arriba L, Morales JM, Jimenéz C, de Andrés A. Amlodipin and nifedipin used with cyclosporin induce different effects on gingival enlargement. Transplantation Proceedings 2009; 41: 2351 - 2353.
Chang CW, Yang CJ, Lai YL. Phenytoin- and amlodipine-induced gingival overgrowth. J Dent Sci. 2012; 7: 85 - 88.
Nakib N, Ashrafi SS. Drug-induced gingival overgrowth. Dis Mon. 2011,57: 225 - 230.
Cebeci I, Kantarci A, Firatli E et al. Evaluation of the frequency of HLA determinants in patients with gingival overgrowth induced by cyclosporin A. J Clin Periodontol. 1996; 23: 737 - 742.
Lin SJ, Lu HK, Lee HW, Chen YC, Li CL, Wang LF. Nitric oxide inhibits androgen reseptor-mediated collagen production in human gingival fibroblasts. J Periodont Res. 2012; 47.701 - 710.
Jeng JH, Lan WH, Wang JS, Chan CP, Ho YS, Lee PH, et al. Signaling mechanism of thrombin-induced gingival fibroblast-populated collagen gel contraction. Br J Pharmacol. 2006; 147: 188 - 198.
McGulloch CAG, Knowles GC. Deficiencies in collagen phagocytosis by human fibroblasts in vitro - a mechanism for fibrosis. J Cell Physiol. 1993; 155: 461 - 471.
Kataoka M, Shimizu Y, Kunikiyo K, Asahara Y, Yamashita K, Ninomiya M, et al. Cyclosporin A decreases the degradation of type I collagen in rat gingival overgrowth. J Cell Physiol. 2000; 182: 351 - 358.
Kataoka M, Shimizu Y, Kunikiyo K, Asahara Y, Azuma H, Sawa T. Nifedipine induces gingival overgrowth in rats through a reduction in collagen phagocytosis by gingival fibroblasts. J Periodontol. 2001; 72: 1078 - 1083.
Subramani T, Rathnavelu V, Yeap SK, Alitheen NB. Influence of mast cells in drug-induced gingival overgrowth. Mediators of Inflammation volume 2013, article ID255172, 8 pages.
Kim SS, Jackson-Boeters L, Darling MR, Rieder MJ, Hamilton DW. Nifedipin induces periostin expression in gingival fibroblasts through TGF-beta. J Dent Res. 2013,92: 1022 - 1028.
Tomita T, Kubota T, Nakasone N, Morozumi T, Abe D, Maruyama S, et al. gene and protein localization of tumour necrosis factor (TNF)-a converting enzyme in gingival tissues from periodontitis patients with drug-induced gingival overgrowth. Arch Oral Biol. 2013; 58: 1014 - 1020.
Corrêa JD, Queiroz-Junior CM, Costa JE, Teixereira AL, Silva TA. Phenytoin-induced gingival overgrowth: A review of the molecular, immune and inflammatory features. ISRN Dent Volume 2011: doi: 10.5402/2011/497850.
Arya R, Gulati S, Kabra M, Sahu JK, Kalra V. Folic acid supplementation prevents phenytoin-induced gingival overgrowth in children. Neurology. 2011,76: 1338 - 1343.
Sanz M. Current use of calcium canal blockers (CCBs) are associated with an increased risk of gingival hyperplasia. J Evid Base Dent Pract. 2011,11: 118 - 119
McGaw T, Lam S, Coates J. Cyclosporin-induced gingival overgrowth : Correlation with dental plaque scores, gingivitis scores, and cyclosporine levels in serum and saliva. Oral Surg Oral med oral Pathol 1987; 64: 293 - 297.
Sharma S, Sharma A. Amlodipine-induced gingival enlargement - a clinical report. Compend Contin Educ Dent. 2012; 33: 78 - 82
Agnihotri R, Bhat GS, Bhat KM. Amlodipine-induced gingival overgrowth: Considerations in a geriatric patient. Geriatr Gerontol Int. 2010; 11: 365 - 368.
Sucu M, Yuce M, Davutoglu V. Amlodipine-induced massive gingival hypertrophy. Can Fam Physician. 2011; 57: 436 - 437.
Ciancio SG. Medications: A Risk Factor for Periodontal Disease Diagnosis and Treatment. J Periodontol. 2005; 76: 2061 - 2065.
Mavrogiannis M Ellis JS, Thomason JM, Seymour RA. The management of drug induced gingival overgrowth. J Clin Periodontol. 2006; 33: 434 - 439.
Kalsiumantagonister og gingival overvekst. RELIS Vest. Rapport datert 09.12.2013.
Penninga L, Møller CH, Gustafsson F, Steinbrüchel DA, Gluud C. Tacrolimus versus cyclosporin as primary immunosuppression after heart transplantations: systemic review with meta-analyses and trial sequential analyses of randomized trials. Eur J Clin Pharmacol. 2010; 66: 1177 - 1187.
Paixão CG, Sekigutchi RT, Saraiva L, Pannuti CM, Silva Jr HT, Medina-Pestana JO, et al. Gingival overgrowth among patients mediated with cyclosporine A and tacrolimus undergoing renal transplantation: a prospective study. J Periodontol. 2011,82: 251 - 258.
Hirsch R, Deng H, Laohachai MN. Azitromycin in periodontal treatment: more than an antibiotic. J Periodont Res. 2012; 47.137 - 148.
Wahlstrom E, Zamora JU, Teichman S. Improvement in cyclosporine-associated gingival hyperplasia with azithromycin therapy. N Engl J Med. 1995; 332: 753 - 754.
Wirnsberger GH, Pfragner R, Maurice A, Zach R, Bogiatzis A, Holzer H. Effect of antibiotic treatment with azithromycin on cyclosporine A-induced gingival hyperplasia among renal transplant recipients. Transpalant Proc. 1998; 30: 2117 - 2119.
Tokgoz B, Sari HI, Yildiz O, et al. Effects of azitromycin on cyclosporin-induced gingival hyperplasia in renal transplant patients. Transplant Proc. 2004; 36: 2699 - 2702.
Brodie MJ, Mintzer S, Pack AM, Gidal BE, Vecht CJ, Schmidt D. Enzyme induction with antiepileptic drugs: cause for concern? Epilepsia. 2013; 54: 11 - 27.
Nakken KO, Sætre E, Markhus R, Lossius MI. Epilepsi hos eldre. Tidsskrift Nor Legeforen. 2013; 133: 528 - 531.
Adresse: Henning Lygre, Farmakologi - farmasi, Klinisk institutt 2, Universitetet i Bergen, Jonas Lies veg 87, 5021 Bergen. henning.lygre@k2.uib.no
Artikkelen har gjennomgått ekstern faglig vurdering.
Lygre H. Legemiddelindusert gingival overvekst (LIGO) - forekomst, patologi og klinikk. Nor Tannlegeforen Tid. 2014; 124: 370-75:
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Lygre H. Legemiddelindusert gingival overvekst (LIGO). Nor Tannlegeforen Tid. 2014;124:370-75. doi:10.56373/2014-5-10