Biofilmdannelse på orale proteser
De mikrobiologiske forholdene i munnhulen, og dermed pasientens orale helse, blir påvirket av orale protesers utforming og materialer. Det er mange faktorer som styrer sammensetningen av munnhulefloraen og dannelsen av biofilm. Denne artikkelen tar for seg de momentene tannleger må ta hensyn til ved framstilling av faste og avtakbare protetiske konstruksjoner, slik at biofilmdannelsen blir så liten og så gunstig som mulig for pasienten. I tillegg beskrives mekanismene bak biofilmdannelse og patologisk utvikling av mikrofloraen.
All protetisk behandling innebærer at vi i større eller mindre grad endrer de mekaniske og kjemiske forhold i munnen. Dermed endres de mikrobiologiske forholdene rundt de orale strukturene som er berørt av restaureringen. Ved innsetting av fremmed materiale i munnhulen kan vi skape nye nisjer for mikroflora, eller endre forholdene for biofilmen som legger seg på alle overflater i munnhulen. Dersom disse endringene medfører økning i antallet ugunstige mikroorganismer, vil dette øke det generelle infeksjonstrykket for pasienten. Dette kan på sikt medføre skadevirkinger fra mikrofloraen, som for eksempel sekundærkaries i en kronekant, soppinfeksjon under en helprotese eller progresjon av periodontal sykdom på resttannsettet rundt en partialprotese, dersom pasienten er disponert for dette. Velformede protetiske erstatninger kan imidlertid også skape bedre forhold rundt et svekket resttannsett med store, gamle fyllinger, aktiv karies og progredierende periodontitt. Alle protetiske restaureringer må derfor utformes på en slik måte at de gir minst mulig negative endringer i pasientens orale miljø. På denne måten kan restaureringene gjøre nytte, heller enn skade.
Biofilm i orale miljøer
I munnhulen hos alle mennesker lever hundrevis av ulike arter mikroorganismer, både bakterier, virus og sopp (1). Over 700 ulike bakteriearter er til nå identifisert i det orale miljøet og det finnes opp mot en million mikroorganismer per kubikkmillimeter saliva (2). Disse lever i komplekse samfunn med hverandre og er ofte organisert i tynne lag av mikroorganismer - biofilm - festet på overflaten av munnhulens ulike bestanddeler. Ett eksempel er plakk på tannoverflater (3,4). Biofilmen bygges opp på en ren, fuktig flate dekket av salivaproteiner som bakterier kan feste seg til ved hjelp av mikroskopiske utstikkere eller overflatemolekyler i celleveggene (figur 1). Bakteriene fester seg til hverandre og kommuniserer med hverandre med signalmolekyler (3). De skiller også ut proteiner, polysakkarider og andre substanser fra cellen. Dette blandes med substanser fra saliva og danner en ekstracellulær matriks som holder hele samfunnet sammen.
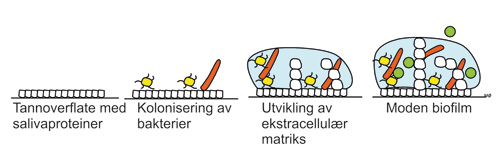
Figur 1. Utvikling av biofilm på rene tannoverflater.
Mikroorganismer i et slikt miljø vil opptre ulikt fra tilsvarende mikroorganismer fritt i saliva. Den omsluttende matriksen gjør det mulig for mikroorganismene i en biofilm å beskytte seg selv og hverandre. Mikroorganismene vil også være tett bundet til hverandre og kleber seg til alle fuktige overflater der de ikke umiddelbart fjernes mekanisk. Hos friske mennesker er dette en gunstig ordning, fordi biofilmen beskytter mot inntrengning av fremmede mikroorganismer fra mat og andre smittekilder og på den måten holder den orale mikrofloraen i balanse. Dette kompliseres betraktelig dersom balansen endres og begynner å favorisere sykdomsfremkallende mikroorganismer. Biofilmen beskytter også mikroorganismene mot stoffer med antibakteriell, antiviral og antifungal effekt (5). Mikroorganismene som befinner seg fritt i saliva vil dø lettere, mens organismene i biofilmen vil være mindre påvirket av medikamentene.
Biofilmens tykkelse, struktur og sammensetning påvirkes av en rekke faktorer, som for eksempel pH, næringstilgang, oksygen, avfallsprodukter og overflaten den ligger på (4,6 - 11). Biofilmens mikrobiologiske sammensetning er dermed ulik på forskjellige steder i munnhulen. Approksimalrommene vil ha helt andre forhold enn kinnslimhinner og dermed favorisere andre mikroorganismer i biofilmdannelsen. Dersom biofilmen får stå i fred og ro i dagevis, vil den også utvikle seg annerledes enn om den fjernes daglig ved tannbørsting og så må bygges opp på nytt fra grunnen (4). Bakterier i en biofilm tilpasser seg miljøet i matriksen og regulerer hvilke gener som er aktive etter dette. Dette er bakgrunnen for at daglig fjerning av plakk, altså biofilm, er gunstig for å redusere antall bakterier med sykdomsfremkallende effekter. Biofilmdannelse er også et stort problem for ulike medisinske biomaterialer som settes inn i fuktige miljøer som blodbanen, urinveissystemet eller mage-tarmtraktus (12). Fordelen med biofilmen i munnhulen er at den er lettere å komme til og rengjøre enn for eksempel venekatetere eller stemmebåndsproteser, som må opereres ut igjen når biofilmdannelsen gir inflammasjon og infeksjon.
Mikroorganismer i oral biofilm
Hovedparten av mikroorganismene i oral biofilm er bakterier, men hos de fleste voksne mennesker er det også sopparter og virus, som kan ha betydning for utvikling av sykdom, til stede (1,2). Mikrofloraen utvikles gradvis hos barn etter hvert som tennene vokser frem og nye nisjer skapes. Både vennligsinnede bakterier uten kjente sykdomsfremkallende egenskaper og mikrober med kjent patogen effekt etableres i en dynamisk prosess, der balansen beveger seg fra gunstig til ugunstig og tilbake igjen avhengig av hvordan forholdene i munnhulen utvikler seg (2). Sykdom utvikles først når de patogene mikroorganismene kommer opp i en viss prosentandel. Candida albicans og andre sopparter vil som regel alltid være tilstede i det orale miljøet, men hos friske individer med stabile forhold i munnhulen vil antallet holdes lavt fordi forholdene favoriserer andre typer mikroorganismer, særlig bakterier uten kjent patogen effekt.
Personer med få eller ingen tenner vil ha en annen mikroflora enn personer med fullt tannsett (7). Flere faktorer bidrar til at tenner uten restaureringer har en annen sammensetning i biofilmen enn tenner med restaureringer (13 - 17). Restaureringene vil gi kanter og spalter som kan komplisere den mekaniske fjerningen av biofilmen ved vanlig munnhygiene (figur 2) (15, 17). Slike kanter og spalter danner gjerne et litt annet kjemisk miljø enn glatte flater, og vil dermed favorisere andre mikrober. Ru eller ujevne overflater gir også mye raskere oppvekst av biofilm enn glatte flater (13). Det er derfor vesentlig at alle typer restaureringer har så god kanttilslutning som mulig og er glattpolerte. Dersom kronekanten ligger langt fra gingivalranden, vil den ha mindre påvirkning på gingival og periodontal helse enn om den ligger nær eller under gingivalranden.
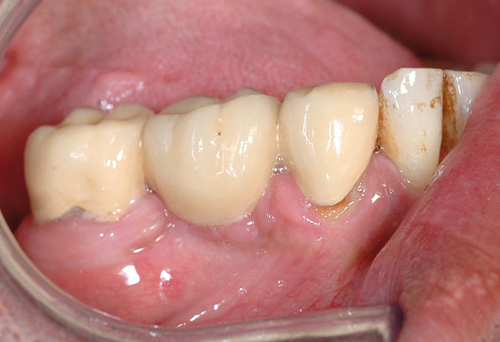
Figur 2. Karies i kronekant bukkalt på tann 44 samt irritasjonshyperplasi av gingiva under bindeleddet på en bro med plakkretinerende utforming. Foto: M. Øilo.
Avtakbare restaureringer som helproteser, partialproteser og kjeveortopediske plater, vil i tillegg skape nye store flater for biofilmdannelse i munnhulen slik at den totale overflaten med biofilm øker betydelig (6,16,18 - 20). Dermed øker det totale antallet mikroorganismer som blir værende i munnhulen over tid. De økologiske forholdene i munnhulen påvirkes også, noe som medfører at balansen mellom de ulike mikroorganismene i biofilmen endres. Dette vil påvirke slimhinnen, som er i direkte kontakt med restaureringen, men også de tennene som eventuelt er igjen i munnhulen. De tennene som er i direkte kontakt med protesene, vil få den største belastningen, i og med at de får et, helt annen økologisk habitat i sitt umiddelbare nærmiljø, men også tenner i motsatt kjeve vil påvirkes av at balansen i det orale miljøet endres.
Tykkere plakk vil redusere pH-nivå, oksygentilførsel og næringstilgang inne i selve biofilmen (figur 3) (4,6,11,21). Eventuelle matrester i plakket gir rikelig tilgang på næring og dermed økning i antallet mikrober som kan overleve i biofilmen. Dette favoriserer vekst av bakterier som assosieres med kariesutvikling supragingivalt (Streptococcus mutans, Actinomyces spp., Veillonella spp. og Lactobacillus spp.) og utvikling av gingivitt og periodontitt subgingivalt (Porphyromonas gingivalis, Treponema denticola, Tannerella forsythia m. fl.). Andre forhold kan spille inn ved fremvekst av andre patogene mikrober. Virus i munnhulefloraen kan bli liggende latent i verten etter en primærinfeksjon og reaktiveres når verten har en periode med redusert immunforsvar. Ett eksempel er Herpes simplex, som ligger latent i gangliene og som kan bryte ut ved forkjølelse, UV-lys eller andre former for stress (1). Sopparter som C. albicans og andre typer Candida kan blomstre opp ved plutselige endringer i de kjemiske og fysiske forholdene i munnhulen. Store overflater som med ett ikke lenger får tilgang på oksygen, som området under en ny helprotese, vil plutselig gi bedre forhold for anaerobe mikroorganismer, mens andre organismer som er avhengige av oksygentilførsel (aerobe) vil dø ut eller reduseres (6,21 - 25). Candida får dermed gunstigere forhold og kan øke i antall, noe som kan starte en inflammasjonsprosess i munnslimhinnen (protesestomatitt). Det er imidlertid flere forhold, som saliva flow, traumer og plakkmengde, som påvirker den patologiske utviklingen. Materialene som restaureringen består av kan også påvirke sammensetningen i biofilmen.
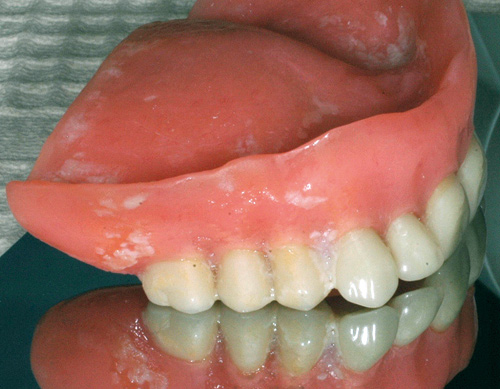
Figur 3. Protese full av plakk etter mangelfullt hygieneregime. Foto: M. Øilo.
Orale infeksjoner
Oppvekst av patogene mikroorganismer kan gi infeksjoner i orale vev dersom vertens immunforsvar ikke klarer å bekjempe disse. De vanligste infeksjoner som følge av biofilmdannelse er pulpitt ved ubehandlet karies, gingivitt og periodontitt (4). Karies er definert som demineralisering av tennenes hardvev. Demineralisering i seg selv er ikke en infeksjon, men en følgetilstand av økt syreproduksjon fra nærliggende bakterier. Dette oppstår når mikrobene i supragingival biofilm i nær relasjon til tennenes hardvev prosesserer karbohydrater fra matrester og danner syre (4). Miljøet i biofilmen blir dermed surt (pH<5) og hardevevet løses opp. Gingivitt oppstår når et tilstrekkelig antall mikrober blir liggende i en subgingival biofilm over tid hvor tilgangen på oksygen reduseres i takt med tykkelsen på biofilmen. Dette favoriserer fremvekst av patogene, anaerobe mikroorganismer. Vevet vil da respondere på disse med en inflammasjonsprosess for å bekjempe de patogene mikrobene. Denne vevresponsen kan da føre til periodontitt som er klassifisert som tap av kollagene fibre som binder tannen til beinet og resorpsjon av bein (4). I forbindelse med avtakbare proteser er også protesestomatitt et betydelig problem.
Dette er i tillegg svært vanskelig å behandle uten å få residiv (21,22,25,26). C. albicans og andre Candida-typer vil alltid være til stede i munnhulen. Så lenge pasienten ikke kan endre på de lokale forholdene i vesentlig grad, er rekolonisering etter endt medisinering vanskelig å unngå. De viktigste forebyggende tiltak mot alle disse infeksjonene er hyppig biofilmfjerning. Tannlegen må legge forholdene til rette for at pasienten kan holde både proteser og slimhinner så rene og plakkfrie som mulig. Oppbevaring av protesene tørt om natten vil redusere tilveksten av Candida ettersom disse er avhengige av fuktighet for å overleve. Reduksjon av bakterier på proteseoverflaten med bakteriehemmende stoffer som klorheksidin eller lignende kan trolig hemme tilveksten av Candida også. Bakterieadhesjon på proteseoverflaten øker muligheten for etablering av Candida i en biofilm, og det øker sannsynligheten for sykdomsutvikling (23). Samtidig er det viktig at slimhinnen er fri for gnagsår, hyperplasier og andre plakkretinerende defekter, samt at proteseoverflaten er glatt og lett å rengjøre. Pasientens generelle helse- og ernæringsstatus vil også kunne påvirke kroppens immunforsvar mot soppinfeksjoner (1,3,6).
Tenner er helt spesielle organer siden de penetrerer slimhinnen og har én del festet på innsiden av kroppen og én del som står blottlagt i munnhulen (27). Den delen av tannen som står i munnhulen blir kontinuerlig utsatt for kolonisering av mikroorganismer. Tannkjøttslommen som omkranser tannhalsen har en beskyttende effekt ved at den dento-epiteliale forbindelsen danner en barriere som hindrer bakterier i å trenge ned i slimhinne og ben rundt tannen. Gingivaleksudatet som dannes i lommen skyller inntrengende mikroorganismer ut av lommen og holder slimhinnen frisk så lenge biofilmen ikke innholder for mange patogene mikrober. Eksudatet innholder i tillegg beskyttelsesstoffer som dreper, hemmer eller påvirker mikroorganismene og gjør plakket mindre patogent. Dersom biofilm som inneholder høy grad av patogene mikrober som P. gingivalis, T. denticola, T. forsythia m. fl. blir liggende langs tannkjøttsranden over lengre tid, vil dette kunne føre til en inflammasjonsprosess i slimhinnen og etter hvert til en infeksjon av gingiva (figur 4). Gingivitten vil medføre en hevelse i gingiva og økt blødningstendens. Dette kompliserer den nødvendige hygienen og reduserer kroppens evne til å forsvare seg mot invasjon av mikrober. Mikroorganismene vil da kunne etablere seg i periodontallommen og danne et nytt miljø der. Dette vil gi gunstige vekstvilkår for anaerobe bakterier og økt sykdomsutvikling. Dersom dette får utvikle seg over tid kan infeksjonen utvikles og spres til det alveolære benet, periodontitt. Infeksjon nær det alveolære benet vil kunne indusere resorpsjon av ben og dermed tap av feste for tennene i relasjon til dette. Det periodontale støtteapparatets respons på patogene mikrober er avhengig av en rekke faktorer i tillegg til personens mulighet for å holde mikrofloraen i munnhulen sunn (1,3,6).
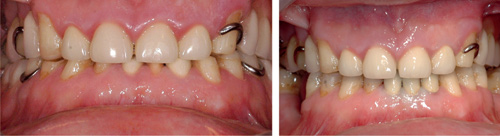
Figur 4. Gingivitt rundt overskuddssement liggende langs kronekantene på fire kroner i front (venstre). Samme pasient etter at overskuddssement i kronekanten var fjernet (høyre). Foto: M. Øilo.
Systemiske interaksjoner
Infeksjoner i munnhulen vil kunne påvirke pasientens generelle helse på mange måter. I første omgang er det ugunstig for pasienten å ha større inflammasjonsprosesser i det hele tatt, fordi dette innebærer at immunforsvaret konstant må jobbe for å holde infeksjonen i sjakk. Dette er spesielt ugunstig for personer som har andre systemiske sykdommer som også krever et immunforsvar i full beredskap, for eksempel pasienter med leddgikt, immunsvekkende sykdommer eller kreft. Økt tilvekst av mikrober i munnhulen gir også økt sannsynlighet for at disse mikrobene kan forårsake infeksjoner andre steder i kroppen. Mikrober kan passere fra munnslimhinnen og over i blodbanen og spres til hele kroppen (3,4,21,28). Dette er spesielt ugunstig for personer med kunstige hjerteklaffer og immunsvekkede pasienter som er mer utsatt for livstruende infeksjoner. Patogene mikrober kan også løsne fra biofilmen i munnhulen og innåndes til lungene. Det blir ofte påvist orale bakterier i lungene hos eldre pasienter som er døde av lungebetennelse (21,28). C. albicans fra munnhulen kan spres til svelget og føre til systemisk soppinfeksjon i hele mage-tarmtraktus, noe som er svært ubehagelig og vanskelig å bekjempe ettersom infeksjonen residiverer raskt etter medikamentell behandling (figur 5) (24,29).
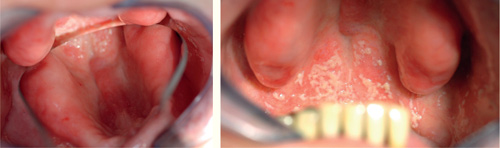
Figur 5. Pasient med protesestomatitt under en gammel helprotese med spredning til svelget. Foto: M. Øilo.
Personer med dårlig generell helse vil ofte også få dårligere oral helse på grunn av svekket immunforsvar og endret fysikalsk/kjemisk balanse i kroppen, som for eksempel munntørrhet, reduserte jernlagre, endring i stoffskifte og redusert væske- eller næringsopptak (30,31). De vil da være mer utsatt for fremvekst av både patogene og andre mikrober i de orale biofilmer og være dårligere i stand til å bekjempe den påfølgende inflammasjonsprosessen. Pasienter som benytter mange medikamenter er ofte munntørre og får dermed lettere tykk biofilm, fordi manglende saliva i munnen reduserer den naturlige vaskeprosessen (32). Biofilm hos munntørre vil også lettere ha lav pH over lengre tid, fordi bufferingen fra saliva ikke strekker til.
Materialrelaterte interaksjoner
De ulike materialene som orale proteser består av, kan påvirke biofilmdannelsen i stor grad (10). Keramiske materialer har svært glatt overflate som er lett å rengjøre, og de er dermed gunstig med tanke på å redusere biofilmdannelsen på selve protesen. Tilsvarende kan metaller poleres opp til høyglansede flater med liten plakkretinerende evne. Likevel vil det være enkelte legeringer som har høyere adhesjonsrate for bakterier enn andre. Trolig tiltrekkes bakterier av metaller med en elektrisk ladning (10). Det kan også tenkes at enkelte mikrober kan bli påvirket av substanser som lekker ut fra metallene, eksempelvis kvikksølv fra amalgam, som virker bakteriestatisk. Dessuten vil det alltid være plakkretinerende områder mellom restaurering og tann som kan øke biofilmdannelsen langs kantene av restaureringen (33,34).
Implantater har gjerne en glatt og blank overflate på områder som er blottlagt i munnhulen, men de består ofte av flere komponenter med små spalter mellom seg. Dette kan gi grobunn for mikroorganismer og dermed forårsake periimplantitt eller manglende osseointegrering (29,35). Implantatene har en betydelig ruere overflate der de skal omsluttes av ben. Redusert benfeste som følge av periimplantitt vil blottlegge den rue overflaten, som vil ha en betydelig høyere adhesjon for orale mikroorganismer og dessuten være mye vanskeligere å rengjøre (figur 6). Dersom en biofilm med ugunstige mikroorganismer får etablere seg på en slik overflate vil den være nærmest umulig å stoppe. Implantatenes direkte kontakt med benvev vil også bety at infeksjoner rundt implantatet lettere kan bli overført direkte i blodbanen (27). Det er ingen bindevevshinne som kan fungere som barriere, slik som det er rundt tenner. Tilgjengelige studier på periimplantitt kan ikke fullt ut forklare hva som er forskjellen eller likheten mellom periimplantitt og periodontitt, men det er mye som tyder på at pasienter som har eller har hatt alvorlig periodontitt også er mer utsatt for periimplantitt (36). Mikrofloraen rundt et implantat med sunt og friskt støtteapparat tilsvarer mikrofloraen rundt tenner med frisk gingiva (37). Mikrofloraen ved periimplantitt er tilsvarende som periodontitt, men ofte med større innslag av sopp og tilstedeværelse av flere bakteriearter enn det som vanligvis observeres ved periodontitt (37). Dette skyldes trolig at metallet og overflaten på implantatet påvirker biofilmen som dannes der. Det er ennå usikkert om dette vil påvirke behandlingen av periimplantitt.
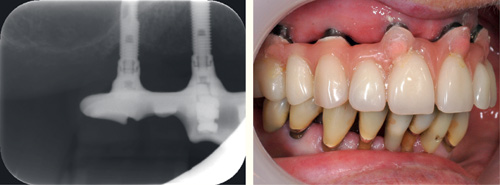
Figur 6. Implantat i regio 16 med blottlagte skrueriller med ru overflate som følge av tidligere periimplantitt. Foto: M. Øilo.
Polymere materialer som kompositt, glassionomer og akrylmaterialer har en overflate som inneholder mer porer og defekter enn metaller og keramer (figur 7). Disse vil fylles med fuktighet og vil kunne fungere nærmest som et spesialtilpasset dyrkningskammer for enkelte mikrober (6,8,24,38,39). Dette fremmer biofilmdannelse og kompliserer fjerningen av biofilmen etterpå. I tillegg vil de orale bakteriene i biofilmen danne syrer som ødelegger og ruer opp overflaten (9,10). Candida har spesielt lett for å kolonisere på akryl og er svært vanskelig å fjerne fra overflaten når den først har satt seg fast. Akryl i protesebasis er hard og stiv og gir ofte store plager for pasientene i form av såre og ømme slimhinner. Dette kan føre til behov for justeringer som ruer opp proteseoverflaten ytterligere, eller behov for fôringer av protesene med andre materialer. De fôringsmaterialene vi har i dag er enten kaldpolymerisert akryl, myke akrylmaterialer som innholder plasticider, eller polyvinylsiloksaner. Alle fôringsmaterialene inneholder enda flere porer og defekter enn varmpolymerisert protesebasis og gir dermed betydelig økt fare for candidafremvekst (38,40,41).
Spesielt er de myke materialene svært utsatt for dette. Pasientene vil ofte foretrekke disse materialene på grunn av økt komfort. Immunsupprimerte pasienter er spesielt utsatt ettersom de ofte har problemer med konvensjonelle proteser. Pasienten må opplyses nøye om risikoen for soppinfeksjon og den merbelastning det kan føre til. Studier har vist at alle myke fôringsmaterialer har betydelig økt risiko for soppinfeksjoner allerede etter tre til seks måneder og pasienten må derfor belage seg på å skifte disse ut regelmessig for å minimere risikoen for systemisk spredning (42). Nylonproteser (f.eks. Valplast) er nå etablert som et alternativt protesebasismateriale, spesielt for partialproteser (43). Disse har trolig noe lavere tendens til biofilmdannelse enn akrylbaserte materialer og polyvinylsiloksaner på grunn av glattere overflate og færre porer, men til gjengjeld har de alltid en mer plakkretinerende design, slik at resttannsettet er mer utsatt for uheldig mikrobetilvekst.
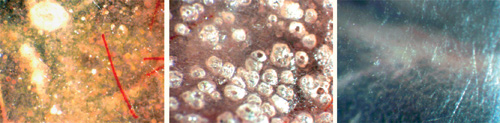
Figur 7: Eksempel på ulike polymeroverflater, A) Polert akryl, B) Upolert kaldpolymerisert akryl, C) Polert nylon. Forskjellene i antall porer og ujevnheter vil påvirke biofilmdannelsen. Foto: M. Øilo.
Konklusjon
Alle orale proteser påvirker det orale miljøet. Endringer i forholdene i munnhulen kan gi nye habitater og økologiske forhold som kan gi en endret biofilm. Ugunstige materialer eller protesedesign kan gi fremvekst av patogene mikrober og føre til infeksjoner hos pasienten. Det er viktig at potensielle skadevirkninger vurderes nøye før protetisk behandling igangsettes, slik at det er klart at protesene vil gjøre nytte, heller enn skade. Pasienten må få instrukser om hvordan de kan fjerne biofilmen og holde infeksjonsrisikoen på et minimum.
Takk
Forfatterne ønsker å takke professor Knut N. Leknes for innspill og kommentarer til teksten.
English summary
Biofilm formation on dental prostheses
The design and material of dental prostheses will affect the microbiological environment of the oral cavity and thereby the patient''s oral health. There are many factors that influence the composition of the oral micro flora and the development of oral biofilms. The mechanisms behind biofilm formation and pathological development of oral micro flora are complex and depend on mechanical, chemical and host-related variables. In order to minimize the biofilm formation and to avoid an increase of pathological microbes, dentists must consider these factors when producing both fixed and removable dental prostheses.
Øilo M, Bakken V. Biofilmdannelse på orale proteser. Nor Tannlegeforen Tid. 2012;122:346-51. doi:10.56373/2012-5-10
Hovedbudskap | |
|---|---|
· |
Utformingen av dentale proteser påvirker den orale mikrofloraen |
· |
Uheldig design kan gi fremvekst av patogene mikroorganismer og forårsake infeksjon |
· |
Enkelte materialer kan gi grobunn for spesielle mikroorganismer |
· |
Faste og avtakbare proteser må utformes slik at de i minst mulig grad bidrar til økt biofilmdannelse |
Referanser
Lamont RJ. Oral microbiology and immunology. Washington, ASM Press, 2006.
Aas JA, Paster BJ, Stokes LN, Olsen I, Dewhirst FE. Defining the normal bacterial flora of the oral cavity. J Clin Microbiol. 2005; 43: 5721 - 2.
Avila M, Ojcius DM, Yilmaz O. The oral microbiota: Living with a permanent guest. DNA Cell Biol. 2009; 28: 405 - 11.
Filoche S, Wong L, Sissons CH. Oral biofilms: Emerging concepts in microbial ecology. J Dent Res. 2010; 89: 8 - 18.
Marsh PD. Plaque as a biofilm: Pharmacological principles of drug delivery and action in the sub- and supragingival environment. Oral Dis. 2003; 9 Suppl 1: 16 - 22.
von Fraunhofer JA, Loewy ZG. Factors involved in microbial colonization of oral prostheses. Gen Dent. 2009; 57: 136 - 43.
Sachdeo A, Haffajee AD, Socransky SS. Biofilms in the edentulous oral cavity. J Prosthodont. 2008; 17: 348 - 56.
Paranhos Hde F, da Silva CH, Venezian GC, Macedo LD, de Souza RF. Distribution of biofilm on internal and external surfaces of upper complete dentures: The effect of hygiene instruction. Gerodontology. 2007; 24: 162 - 8.
Morgan TD, Wilson M. The effects of surface roughness and type of denture acrylic on biofilm formation by streptococcus oralis in a constant depth film fermentor. J Appl Microbiol. 2001; 91: 47 - 53.
Busscher HJ, Rinastiti M, Siswomihardjo W, van der Mei HC. Biofilm formation on dental restorative and implant materials. J Dent Res. 89: 657 - 65.
Palmer RJ, Jr.. Supragingival and subgingival plaque: Paradigm of biofilms. Compend Contin Educ Dent. 31: 104 - 106.
Francolini I, Donelli G. Prevention and control of biofilm-based medical-device-related infections. FEMS Immunology & Medical Microbiology. 59: 227 - 238.
Adamczyk E, Spiechowicz E. Plaque accumulation on crowns made of various materials. Int J Prosthodont. 1990; 3: 285 - 91.
Chan C, Weber H. Plaque retention on teeth restored with full-ceramic crowns: A comparative study. J Prosthet Dent. 1986; 56: 666 - 71.
Jameson LM, Malone WF. Crown contours and gingival response. J Prosthet Dent. 1982; 47: 620 - 4.
Addy M, Bates JF. Plaque accumulation following the wearing of different types of removable partial dentures. J Oral Rehabil. 1979; 6: 111 - 7.
Parkinson CF. Excessive crown contours facilitate endemic plaque niches. J Prosthet Dent. 1976; 35: 424 - 9.
Zlataric DK, Celebic A, Valentic-Peruzovic M. The effect of removable partial dentures on periodontal health of abutment and non-abutment teeth. J Periodontol. 2002; 73: 137 - 44.
Radford DR, Challacombe SJ, Walter JD. Denture plaque and adherence of candida albicans to denture-base materials in vivo and in vitro. Critical Reviews in Oral Biology & Medicine. 1999; 10: 99 - 116.
McHenry KR, Johansson OE, Christersson LA. The effect of removable partial denture framework design on gingival inflammation: A clinical model. J Prosthet Dent. 1992; 68: 799 - 803.
Coulthwaite L, Verran J. Potential pathogenic aspects of denture plaque. Br J Biomed Sci. 2007; 64: 180 - 9.
Pereira-Cenci T, Del Bel Cury AA, Crielaard W, Ten Cate JM. Development of candida-associated denture stomatitis: New insights. J Appl Oral Sci. 2008; 16: 86 - 94.
Campos MS, Marchini L, Bernardes LA, Paulino LC, Nobrega FG. Biofilm microbial communities of denture stomatitis. Oral Microbiol Immunol. 2008; 23: 419 - 24.
Seneviratne CJ, Jin L, Samaranayake LP. Biofilm lifestyle of candida: A mini review. Oral Dis. 2008; 14: 582 - 90.
Ramage G, Tomsett K, Wickes BL, Lopez-Ribot JL, Redding SW. Denture stomatitis: A role for candida biofilms. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2004; 98: 53 - 9.
Redding S, Bhatt B, Rawls HR, Siegel G, Scott K, Lopez-Ribot J. Inhibition of candida albicans biofilm formation on denture material. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2009; 107: 669 - 72.
Leknes KN. The influence of anatomic and iatrogenic root surface characteristics on bacterial colonization and periodontal destruction: A review. J Periodontol. 1997; 68: 507 - 16.
Sumi Y, Kagami H, Ohtsuka Y, Kakinoki Y, Haruguchi Y, Miyamoto H. High correlation between the bacterial species in denture plaque and pharyngeal microflora. Gerodontology. 2003; 20: 84 - 7.
Ramage G, Martinez JP, Lopez-Ribot JL. Candida biofilms on implanted biomaterials: A clinically significant problem. FEMS Yeast Res. 2006; 6: 979 - 86.
Marsh PD, Martin MV. Oral microbiology, ed 5th. Edinburgh, Elsevier, 2009.
Marsh PD, Percival RS, Challacombe SJ. The influence of denture-wearing and age on the oral microflora. J Dent Res. 1992; 71: 1374 - 81.
Chiappelli F, Bauer J, Spackman S, Prolo P, Edgerton M, Armenian C, Dickmeyer J, Harper S. Dental needs of the elderly in the 21st century. Gen Dent. 2002; 50: 358 - 63.
Gotfredsen K, Carlsson GE, Jokstad A, Arvidson Fyrberg K, Berge M, Bergendal B, Bergendal T, Ellingsen JE, Gunne J, Hofgren M, Holm B, Isidor F, Karlsson S, Klemetti E, Lang NP, Lindh T, Midtbo M, Molin M, Narhi T, Nilner K, Owall B, Pjetursson B, Saxegaard E, Schou S, Stokholm R, Thilander B, Tomasi C, Wennerberg A. Implants and/or teeth: Consensus statements and recommendations. J Oral Rehabil. 2008; 35 Suppl 1: 2 - 8.
Felton DA, Kanoy BE, Bayne SC, Wirthman GP. Effect of in vivo crown margin discrepancies on periodontal health. J Prosthet Dent. 1991; 65: 357 - 364.
Subramani K, Jung RE, Molenberg A, Hammerle CH. Biofilm on dental implants: A review of the literature. Int J Oral Maxillofac Implants. 2009; 24: 616 - 626.
Ong CT, Ivanovski S, Needleman IG, Retzepi M, Moles DR, Tonetti MS, Donos N. Systematic review of implant outcomes in treated periodontitis subjects. J Clin Periodontol. 2008; 35: 438 - 62.
Heitz-Mayfield LJ, Lang NP. Comparative biology of chronic and aggressive periodontitis vs. Peri-implantitis. Periodontol. 2000; 53: 167 - 81.
Boscato N, Radavelli A, Faccio D, Loguercio AD. Biofilm formation of candida albicans on the surface of a soft denture-lining material. Gerodontology. 2009; 26: 210 - 3.
Rocha EP, Luvizuto ER, Sabotto SF. Biofilm formation and caries incidence with removable partial dentures. Dent Today. 2008; 27: 60, 62 - 3.
Nikawa H, Jin C, Makihira S, Egusa H, Hamada T, Kumagai H. Biofilm formation of candida albicans on the surfaces of deteriorated soft denture lining materials caused by denture cleansers in vitro. J Oral Rehabil. 2003; 30: 243 - 50.
Pereira-Cenci T, da Silva WJ, Cenci MS, Cury AA. Temporal changes of denture plaque microbiologic composition evaluated in situ. Int J Prosthodont. 23: 239 - 42.
Mutluay MM, Oguz S, Fløystrand F, Saxegaard E, Dogan A, Bek B, Ruyter IE. A prospective study on the clinical performance of polysiloxane soft liners: One-year results. Dent Mater J. 2008; 27: 440 - 7.
Øilo M, Gjengedal H, Strand GV. Nylonproteser. Nor Tannlegefor Tid. 2008; 118: 900 - 3.
Adresse: Marit Øilo, IKO, MOF, Årstadveien 17, postboks 7800, 5020 Bergen. E-post: marit.oilo@iko.uib.no
Artikkelen har gjennomgått ekstern faglig vurdering.
Marit Øilo og Vidar Bakken. Biofilmdannelse på orale proteser. Nor Tannlegeforen Tid. 2012; 122: 346-51.
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Øilo M, Bakken V. Biofilmdannelse på orale proteser. Nor Tannlegeforen Tid. 2012;122:346-51. doi:10.56373/2012-5-10