Sammenhængen mellem marginal parodontitis og hjerte-kar-sygdom
professor, sektionsleder, specialtandlæge, ph.d., dr.odont., odont.dr. (h.c.), Afdelingerne for Parodontologi, Tandlægeskolerne, De Sundhedsvidenskabelige Fakulteter, Københavns og Aarhus Universiteter
professor, sektionsleder, specialisttandläkare, ph.d., odont.dr., Afdelingen for Parodontologi og Dentale Implantater, Odontologiska Institutionen, Karolinska Institutet, Stockholms Universitet
overlæge, klinisk lektor, speciallæge, Kardiologisk Afdeling Y, Bispebjerg Hospital, og Det Sundhedsfaglige Fakultet, Københavns Universitet.
Iskæmisk hjertesygdom skyldes forkalkningsprocesser i koronararterierne, idet der dannes ateromatøse plakker, der kan være stabile eller ustabile. Udviklingen af sygdommen ved ustabile plakker kan stimuleres af inflammation, og ved denne tilstand kan trombocytter og leukocytter trænge ind gennem karvæggen og medføre trombedannelse med okklusion af karret. Herved opstår et infarkt i hjertemuskulaturen. Inflammationen formidles af inflammationsmediatorer, der kan syntetiseres på stedet eller andre steder i organismen. Derved kan ''spill-over'' af inflammationsmediatorer fra parodontiet tænkes at spille en rolle for forløbet af iskæmisk hjertesygdom. Desuden kan parodontale patogener ved bakteriæmi tænkes at blive overført til de ateromatøse plakker og derved iværksætte inflammation i koronarkarrene. Da parodontal inflammation kan påvirke lipidmetabolismen, er der også herved mulighed for, at marginal parodontitis kan influere forløbet af iskæmisk hjertesygdom.
I gennem en årrække har en betydelig del af den parodontologiske forskning været rettet mod de mulige sammenhænge med en række sygdomme, herunder hjerte-kar-sygdom (HKS). Da der tidligere i de nordiske tandlægeblade har været omtale af denne sammenhæng (1), vil der i denne artikel i kort form blive fokuseret på de nyere resultater inden for dette tema.
Baggrunden for en mulig sammenhæng mellem hjerte-kar-sygdom og marignal parodontitis er erkendelsen af, at iskæmisk hjertesygdom (IHS), der skyldes forkalkningsprocesser i koronararterierne, er en lidelse, hvis udvikling har en betydelig inflammatorisk komponent. Ved IHS forekommer forkalkningsprocesser i de ateromatøse plakker, og sygdommens udvikling beror på, om disse plakker er stabile eller ustabile. Ved ustabil plak kan der ske ruptur af plakkens kappe (figur 1), og især trombocytter og leukocytter kan trænge ind gennem karvæggen under dannelse af en okkluderende trombe, hvorved en del af hjertemuskulaturen bliver iskæmisk. Der dannes derved et infarkt. Den ustabile plak er karakteriseret ved forstørrelse af lipidkernen og udtynding af kappen med dysfunktion i endotelcellerne, der spiller en central rolle i sygdomsudviklingen. De processer, der kan føre til ustabil plak, kan stimuleres af inflammation. Denne inflammation kan tænkes formidlet af inflammationsmediatorer, cytokiner, der syntetiseres på stedet eller føres dertil efter syntese ved inflammationsprocesser andre steder i organismen. Inflammation i parodontiet kan derved tænkes at bidrage til destabilisering af den ateromatøse plak ved påvirkning af endotelcellerne og ved frisætning af cytokiner fra inflammationsprocessen i de parodontale væv til blodbanen. Desuden kan bakteriæmi som følge af inflammation i parodontiet (3) indebære, at orale bakterier binder sig til de ateromatøse plakker, hvor de kan medføre inflammation. Andre muligheder for påvirkning af patogenesen ved IHS er ændring af lipidmetabolismen som følge af parodontal inflammation.
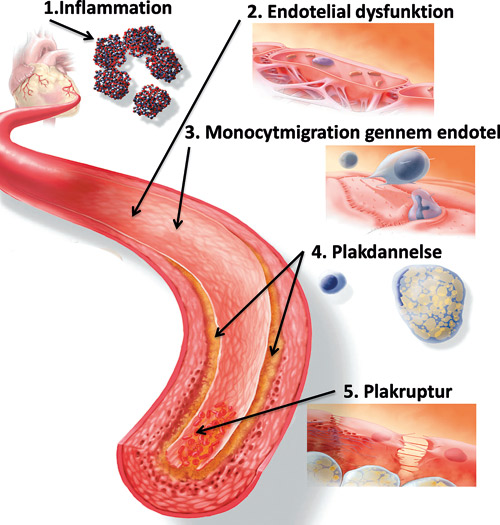
Figur 1: Udvikling af ateromatose: Skematisk fremstilling af inflammatoriske faktorer og udvikling af ateromatose. 1. Aktiveret inflammation i karvæggen, her symboliseret ved øget C-reaktivt protein (CRP), medfører 2. endotelial dysfunktion, som 3. aktiverer monocytadhæsion og -migration gennem det skadede endotel, som igen 4. fører til omdannelse af monocytterne til skumceller og dermed lipidophobning i karvæggen. 5. Dette kan medføre sprængning af kapselmaterialet mellem det cirkulerende blod og karvævet og hermed starte trombocytaggregation og trombedannelse (ikke vist). Modificeret efter (2).
Påvirkning af endotelcellerne
En af de mest overraskende undersøgelser i denne sammenhæng blev publiceret af Tonetti og medarbejdere i 2007 (4). Undersøgelsen viste, at parodontalbehandling medførte forbedring af den endotelcelle-styrede kardilatation. Seks måneder efter parodontalbehandling blev endotelfunktionen, målt som flow-medieret kardilatation i armarterien, signifikant forbedret. Studiet viste imidlertid også, at parodontalbehandlingen førte til en tydelig aktivering af inflammationsmediatorer og forringet endotelfunktion 24 timer efter indgrebet. Den kliniske betydning af disse fund er endnu uklar. Undersøgelsen tydede således på, at marginal parodontitis medførte endotelial dysfunktion, der, som nævnt ovenfor, er en vigtig komponent ved IHS. I fortsættelse heraf har Ghorbani og medarbejdere netop vist, at endotelcellestyret karkontraktion i koronarkar fra rotter bliver mere følsom for karkontraherende substans efter inkubering med lipopolysakkarid (LPS) fra Porphyromonas gingivalis (5). Hypotesen kunne således være, at LPS, der frigøres til blodbanen fra parodontal infektion, kan medføre forøget karkontraktion i koronarkar, hvilket er til ugunst i forbindelse med IHS.
Bakteriæmi
Ved blodige indgreb i mundhulen opstår bakteriæmi, men også dagligdags procedurer, som tandbørstning, brug af tandtråd og tygning kan medføre bakteriæmi. Omfang og hyppighed af bakteriæmi afhænger af de nævnte procedurer, men også inflammationstilstande i parodontiet spiller en afgørende rolle. Således optræder bakteriæmi hyppigst ved parodontitis, mens sunde parodontale forhold beskytter mod bakteriæmi (3). Parodontalbehandling er dermed et vigtigt led i forebyggelse af bakteriæmi med orale bakterier. Som led i afklaringen af bakteriæmiers betydning for IHS er det i flere undersøgelser søgt belyst, om orale bakterier slog sig ned i ateromatøse plakker, hvor de kan medføre inflammation med udvikling af ustabil plak (figur 2). Ingen undersøgelser har imidlertid kunnet påvise levende orale bakterier i ateromatøse plakker, men flere undersøgelser har vist spor af orale bakterier i disse plakker. Således er der isoleret DNA fra de vigtigste periopatogener, Porphyromonas gingivalis (P.g.), Prevotella intermedia, Aggregatibacter actinomycetemcomitans, Treponema denticola og Tannerella forsythia og fra andre orale bakterier (6,7). Disse fund indebærer imidlertid ikke, at de pågældende bakterier har inficeret de ateromatøse plakker, men fragmenter af bakterierne kan være bragt dertil fra mundhule eller blodbanen, for eksempel via fagocytter.
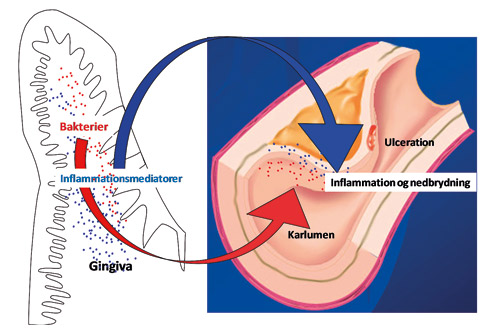
Figur 2: Parodontitis og iskæmisk hjertesygdom: Parodontitis kan via bakteriæmi og via frigivelse af cytokiner fra parodontiet tænkes at påvirke udviklingen af iskæmisk hjertesygdom. Bakteriæmi med infektion eller cytokinmedieret inflammation i ateromatøse plakker i koronarkarrene er således en mulig faktor i svækkelsen af kappen over ateromet, hvorved plakruptur kan opstå (jf. pkt. 5 i figur 1).
Interessen for de orale bakteriers betydning er steget, idet eksponering for periopatogener, herunder P.g. enten intravenøst eller via oral gavage har medført forstærket udvikling af ateromatøse plakker i eksperimentelle modeller bl.a. i Apo-E deficiente mus, en transgen mus med tilbøjelighed til at udvikle åreforkalkning (8).
Frisætning af cytokiner til blodbanen
En række cytokiner menes at have betydning for patogenesen ved IHS. Det drejer sig primært om Interleukin (IL)-1, Tumor Necrosis Factor (TNF)-? og IL-6, idet disse inflammationsmediatorer kan potensere inflammation. Da de alle produceres ved inflammation i parodontiet, og derfra kan overføres til blodbanen, er der mulighed for påvirkning af væv uden for mundhulen (figur 2). En yderligere mulighed for en sådan påvirkning er cytokinproduktion som følge af bakteriæmi. Således viste Forner og medarbejdere (2006), at et resultat af bakteriæmi efter orale procedurer (tandrensning, tandbørstning og tygning) var signifikant stigning i IL-6-mængden i blodbanen (9). En signifikant sammenhæng mellem parodontitis og høje niveauer af andre inflammationsmarkører som C-reaktivt protein (CRP) og fibrinogen kan desuden være af betydning for sammenhængen mellem parodontitis og IHS, således som det er vist af Buhlin og medarbejdere i 2009 (10). I det såkaldte PAVE studie kunne man ikke identificere nogen sikker effekt af mekanisk parodontal infektionsbehandling på inflammationsmarkøren højfølsomt C-reaktivt protein. Mange af kontrolpatienterne i dette studie fik dog også parodontalbehandling. Dette gør resultatet svært at vurdere og viser, at der findes mange tilbageværende spørgsmål at besvare i store velkontrollerede kliniske undersøgelser (11).
Ændring af lipidmetabolismen
Det er velkendt, at lipidmetabolismen spiller en rolle for udvikling af IHS. Høje kolesterolværdier og uheldig fordeling af mættede og umættede fedtsyrer i blodbanen er således prædisponerende for IHS. I den forbindelse er det interessant, at parodontitis, formentlig som følge af forøget IL-1 og TNF-?, kan medføre metabolisk dysregulering af serum-lipid-metabolismen. Det er således i flere undersøgelser vist, at parodontitispatienter har forhøjede total kolesterol, LDL- og triglyceridniveauer kombineret med sænket HDL-niveau (12,13). Det afgørende er imidlertid, at behandling af parodontitis kan ændre lipidmetabolismen i gunstig retning. Et studie fra Stockholm-gruppen viste således, at HDL-koncentrationen var signifikant forøget og LDL-koncentrationen formindsket et år efter parodontalbehandling (14).
Konklusion
Talrige undersøgelser tyder på, at den kroniske inflammation ved marginal parodontitis kan have konsekvenser for almenhelsen. Det er fortsat ikke helt klart, hvorledes de patogenetiske sammenhænge fungerer, men i kraft af intensiv forskning foreligger en konstant voksende forståelse for de muligt involverede mekanismer. Det er oplagt, at fælles baggrundsfaktorer for sygdommene parodontitis og iskæmisk hjertesygdom også kan tænkes at være en del af baggrunden for de konstaterede epidemiologiske sammenhænge, om end der i de fleste nyere undersøgelser er korrigeret for sådanne forhold (15). Der kan dog være tale om hidtil ukendte fælles forhold, herunder genetisk polymorfi (16), som en del af forklaringen. I en nyligt publiceret undersøgelse (17) forstærkes dog mistanken om en kausal sammenhæng mellem HKS og marginal parodontitis. I undersøgelsen blev 884 hjerteinfarktpatienter fulgt i tre år. I perioden fik 154 en hjerte-kar-hændelse (død, infarkt, stroke eller koronararterieintervention). Hos ikkerygere [ikke-røkere] var parodontitis en tydelig risikofaktor for recidiv.
English summary
Holmstrup P, Klinge B, Sigurd B.
Connection between periodontitis and coronary heart disease
38-41
Coronary heart disease is due to formation of atheromatous plaques in the walls of the coronary arteries. These plaques may be stable or unstable, the latter condition being associated with risk of disease progression. The conversion from stable to unstable plaque is stimulated by inflammation. Unstable plaque may be associated with migration of thrombocytes and leukocytes through the vessel wall resulting in thrombus formation and occlusion of the vessel whereby an infarct of the heart musculature occurs. Inflammation is brought about by inflammatory mediators, cytokines, which may be synthesized in the area or in other parts of the body. Thereby spill-over of cytokines from the periodontium may play a part in the course of coronary heart disease. Also, bacteremia associated with periodontal disease may result in transferral of periopathogens to the atheromatous plaques where the bacteria may provoke inflammation in the coronary arteries. Also periodontal inflammation seems to influence lipid metabolism, from which we may conclude that periodontal disease may initiate or influence the development of coronary heart disease.
Hovedpunkt | |
|---|---|
· |
Der er øget mistanke om en kausal sammenhæng mellem hjerte-kar-sygdomme og marginal parodontitis. |
· |
Det er vigtigt, at tandlæger i praksis kender til de mulige følgevirkninger af parodontal inflammation, så de kan diskutere disse med patienterne. |
Referencer
Klinge B, Holmstrup P. Parodontit och allmänsjukdomar. Tandlægebladet. 2004; 108: 116 - 25. (Parallelpublikationer: Tandläkartidningen. 2004; 96: 26 - 35 og Nor Tannlegeforen Tid. 2004; 114: 72 - 9).
Verma S, Szmitko PE, Ridker PM. C-reactive protein comes of age. Nat Clin Pract Cardiovasc. 2005; 2: 29 - 36.
Forner L, Larsen T, Kilian M et al. Incidence of bacteremia after chewing, tooth brushing and scaling in individuals with periodontal inflammation. J Clin Periodontol. 2006; 33: 401 - 7.
Tonetti MS, D''Aiuto F, Nibali L et al. Treatment of periodontitis and endothelial function. N Engl J Med. 2007; 356: 911 - 20.
Ghorbani B, Holmstrup P, Edvinsson L et al. LPS from Porphyromonas gingivalis increases the sensitivity of contractile response mediated by endothelin-B (ET(B)) receptors in cultured endothelium-intact rat coronary arteries. Vasc Pharmacol. 2010; 53: 250 - 7.
Fiehn N-E, Larsen T, Christiansen N et al. Identification of periodontal pathogens in atherosclerotic vessels. J Periodontol. 2005; 76: 731 - 6.
Christiansen N, Bruvo M, Larsen T et al. Oral Biofilm Bacteria in Atherosclerotic Vessels. PLoS ONE. Submitted.
Lalla E, Lamster IB, Hofmann MA et al. Oral infection with a periodontal pathogen accelerates early atherosclerosis in apolipoprotein E-null mice. Arterioscler Thromb Vasc Biol. 2003; 23: 1405 - 11.
Forner L, Nielsen CH, Bendtzen K et al. Increased plasma levels of IL-6 in bacteremic periodontitis patients after scaling. J Clin Periodontol. 2006; 33: 724 - 9.
Buhlin K, Hultin M, Norderyd O et al. Risk factors for atherosclerosis in cases with severe periodontitis. J Clin Periodontol. 2009; 36: 541 - 9.
Offenbacher S, Beck JD, Moss K et al. Results from the periodontitis and vascular events (PAVE) study: a pilot multicentered, randomized, controlled trial to study effects of periodontal therapy in a secondary prevention model of cardiovascular disease. J Periodontol. 2009; 80: 190 - 201.
Buhlin K, Gustafsson A, Pockley AG et al. Risk factors for cardiovascular disease in patients with periodontitis. Eur Heart J. 2003; 24: 2099 - 107.
Lösche W, Karapetow F, Pohl A et al. Plasma lipid and blood glucose levels in patients with destructive periodontal disease. J Clin Periodontol. 2000; 27: 537 - 41.
Buhlin K, Hultin M, Norderyd O et al. Periodontal treatment influences risk markers for atherosclerosis in patients with severe periodontitis. Atherosclerosis. 2009; 206: 518 - 22.
Geismar K, Stoltze K, Sigurd B et al. Periodontal disease and coronary heart disease. J Periodontol. 2006; 77: 1547 - 54.
Geismar K, Enevold C, Sørensen LK et al. Involvement of interleukin-1 genotypes in the association of coronary heart disease with periodontitis. J Periodontol. 2008; 79: 2322 - 30.
Dorn JM, Genco RJ, Grossi SG et al. Periodontal disease and recurrent cardiovascular events in survivors of myocardial infarction (MI): the Western New York Acute MI Study. J Periodontol. 2010; 81: 502 - 11.
Adresse: Palle Holmstrup, Fagområdet Parodontologi, Odontologisk Institut, Nørre Allé 20, 2200 København N. E-post: pah@sund.ku.dk
Artikkelen har gjennomgått ekstern faglig vurdering.