Om fluoriders virkningsmekanismer
Kalsiumfluorid (CaF2) som dannes i store mengder i demineraliseringer på tennene ved regulær bruk av fluortannpasta, er mer stabil enn tidligere antatt og finnes fortsatt på behandlete tannoverflater etter flere uker. Når plaquebakterier danner syrer som demineraliserer tannoverflaten, løses fosfationer først og kalsiumioner eksponeres. Fluorioner i væskefasen binder seg til kalsiumet og danner stabil CaF2 på tannflaten som stopper videre demineralisering på stedet. I motsetning til teorien om at det er dannelse av fluorapatitt som forklarer den kariesforebyggende effekten av fluorider, er det nå foreslått at dette hovedsakelig skyldes lokal dannelse av CaF2 på tannoverflaten og i initiale lesjoner.
Tradisjonelle kariesprofylaktiske metoder (inkludert fluortannpasta) kan ikke stoppe tannerosjoner. Det er imidlertid vist at metallfluorider (f.eks. tinnfluorid SnF2 og titan-tetrafluorid TiF4) har en slik effekt. De er kjente kompleksdannere, og i løsning dannes det metalhydroxider, fluorioner frigis og pH faller. Frie protoner blir fanget av fluorioner, og hydrogenfluorid-molekyler (HF) bidrar til at det dannes et beskyttende lag av CaF2 på tannoverflaten. Fortynnet løsning av HF er vist å være effektiv mot videre erosjoner ved at store mengder stabil CaF2 dannes på tannoverflaten ved lav pH.
Kariesfrekvensen har vært meget høy i Norge. Dette skyldtes et tradisjonelt høyt sukkerforbruk. Det er velkjent at den sterkt reduserte kariesfrekvens i befolkningen i løpet av de siste 40 år, skyldes den omfattende bruk av fluorider i form av fluortannpasta (1 - 3). Tilsetting av fluorider til tannpasta ble prøvd allerede i 1930-årene, men resultatene var meget skuffende. Grunnen var at tannpasta den gang inneholdt kalsiumkarbonat (kritt) som slipemiddel, og kalsium har meget høy affinitet for fluorid. Dette inaktiverte fluoridet gjorde at denne tannpastaen var uten effekt mot karies. Langt senere ble monofluorofosfat (MFP) brukt som fluoridkilde i tannpasta fordi det var virksomt til tross for innehold av slipemiddel med kalsium. Bruken av MFP er basert på forskningen til den svenske professoren Yngve Ericsson (4). Senere ble silika brukt som slipemiddel i tannpasta. Dette gjorde det mulig å anvende NaF som fluoridkilde, og gjorde fluortannpasta billigere å fremstille.
Det var tannpasta med MFP som ble introdusert i Norge i 1971, i regi av den internasjonale tannpastaindustrien. Det var ingen store forventninger knyttet til dette hos forskerne, da det var enighet om at den kariesforebyggende effekten av fluorid var knyttet til bruken av systemisk fluorid (Figur 1). Fluortabletter ble anbefalt for barn fra før tannfrembruddet, og bruken av slike tabletter var forutsatt å fortsette, i hvert fall frem til voksen alder. Dette var en krevende form for kariesprofylakse, som bare ble gjennomført av den mest ressurssterke del av befolkningen.
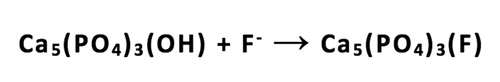
Figur 1. Hydroksylapatitt samt fluorid (anvendt enten lokalt eller systemisk) gir fluorapatitt som er mer resistent mot syre enn hydroksylapatitt. Dette var den opprinnelige hypotesen for fluoridets kariesprofylaktiske effekt som er sterkt svekket ved nyere forskningsresultater.
Vannfluoridering ble ansett å være den ideelle kariesprofylaktiske metode, og denne var innført i USA allerede kort tid etter andre verdenskrig. Siden erfaringene var gode, ble det i de påfølgende år innført vannfluoridering i flere av de store statene i USA. Det ble rapportert om god effekt, og ingen ulemper (5). Helsemyndighetene i Norge ville gjerne innføre vannfluoridering, i alle fall i de største byene, da kariesfrekvensen var ekstremt høy, og en stor del av den voksne befolkning hadde tannproteser. Det var imidlertid stor motstand, til dels meget usaklig kritikk mot vannfluoridering, som ble ansett for å være en statsautorisert tvangsmedisinering. Alternative former for kariesprofylakse, så som kampanjer for forbedret munnhygiene eller bruk av sorbitol og xylitol for å redusere sukkerforbruket, hadde ingen målbar effekt i befolkningen. Politikerne satset derfor heller på en sterk økning av antallet tannleger, og på innføring av Den offentlige tannhelsetjenesten, med offentlige tannklinikker over hele landet, etter mønster av Folktandvården i Sverige.
Etter innføring av fluortannpasta i 1971 ble tannhelsen på få år sterkt forbedret over hele landet og effekten økt over tid (2). Det er sannsynligvis et viktig aspekt ved tannpasta at tannbørstingen og slipemidlene i tannpastaen fjerner tannbelegget, slik at fluoridet kan virke direkte på den eksponerte emaljen. Dette er i motsetning til fluoridskylling, som ikke fjerner tannbelegg. Effekten av fluortannpasta var stor på frembrutte tenner hos barn og ungdom, og den hadde også en god effekt hos voksne pasienter. Dette viste meget klart at denne effekten var lokal, og ikke systemisk. I tillegg til den effektive kliniske kariesreduksjonen, er bruk av fluortannpasta interessant fordi metoden er frivillig og individuell. Dertil påfører metoden ikke myndighetene nye utgifter.
Etter en viss tvil i begynnelsen bruker nå hele befolkningen fluortannpasta, og karies er ikke lenger et stort samfunnsproblem i Norge (2) til tross for at noen stor forandring i kosthold neppe har funnet sted. Det er viktig at alle tannleger og tannpleiere forstår grunnen til denne gunstige situasjon.
Hvordan virker fluorid lokalt på tannflaten?
Kliniske erfaringer viser at fluorid har liten effekt på etablerte, større kaviteter, særlig på approksimalflater. Små approksimale karieslesjoner kan derimot stanses ved at det anvendes tanntråd påført litt fluortannpasta i en periode, eller med assistanse fra en tannpleier eller tannlege. Effekten av fluorid er aller best på begynnende karieslesjoner, spesielt på glattflater der emaljen ikke er gjennombrutt. En permanent bruk av fluortannpasta fra barnealder vil derfor i mange tilfeller hindre at karies utvikles i det hele tatt (3).
En bedre innsikt når det gjelder fluoridets virkningsmekanisme, ble oppnådd ved hjelp av noen enkle eksperimenter med haitenner. Haiemalje består av nesten 100 % fluorapatitt og er usedvanlig hard og robust. Den karieshemmende effekten av fluorider var etter tidens oppfatning knyttet til en systemisk effekt ved dannelse av fluorapatitt, og haitenner skulle derfor være absolutt kariesresistente. Eksperimentet ble gjennomført ved at små biter av haitenner og humane tenner ble festet in situ på tennene til en gruppe forsøkspersoner, på en slik måte at disse ble dekket av tannbelegg. Etter en standardisert forsøksperiode ble alle tannbitene samlet fra forsøkspersonene og analysert. Forsøket ble utført i Oslo, mens analysene ble foretatt av et uavhengig laboratorium (6). Det ble påvist uten tvil at haitenner hadde fått demineraliseringer som følge av karieseksponeringen i forsøket. Denne observasjon støttes av flere andre forskere (7, 8). Dette viser at selv ikke massiv fluorapatitt er resistent mot karies og støtter tanken om at lokale fluorbehandlinger, som for eksempel med fluortannpasta, er av største viktighet. Selv ved systemisk bruk av fluorid dannes ikke noe som minner om haiemalje. Dette svekket altså den rådende teori som postulerte at dannelse av fluorapatitt var den eneste kjente mekanisme som forklarte den kariesreduserende effekt av både lokal og endogen fluoridbehandling (9).
En annen fluoridforbindelse som dannes under lokalbehandling av tenner med fluorid, er kalsiumfluorid (CaF2) eller rettere sagt et kalsiumfluoridlignende materiale. Denne forbindelsen hadde fått liten oppmerksomhet fra forskerne, da det ble hevdet at CaF2 er ustabilt i munnhulen, og derfor ikke kunne forventes å spille en rolle i fluoridets virkningsmekanisme (9). Det var derfor et mål i en periode, ved formulering av kommersielle fluoridprodukter, at disse, om mulig, ikke skulle danne kalsiumfluorid. Hypotesen om at kalsiumfluorid var ustabilt i munnhulen og derfor ikke kunne spille noen rolle i kariesprofylaksen, var formulert av en kjent amerikansk kjemiker, og var alminnelig akseptert selv om den kun var basert på teoretiske betraktninger. Senere ble det utarbeidet en metode som gjorde det enkelt å avgjøre om kalsiumfluorid fantes på en tannflate. Kalsiumfluorid er løselig i basiske løsninger (1N kaliumhydroksid, KOH) i løpet av 24 timer, i motsetning til fluorapatitt, som er uløselig i KOH (10).
Omfattende studier som ble utført av Øgaard og medarbeidere (11 - 16), viste at kalsiumfluorid faktisk er tungt løselig og meget stabilt i munnhulen. Dette var i skarp motsetning til den rådende hypotese, som beskrevet ovenfor. Cruz og medarbeidere (17 - 19) viste at fluortannpasta og andre former for lokalbehandling med fluorid forårsaket dannelse av kalsiumfluorid på de behandlede tenner.
Det neste logiske skritt i denne forskningen var å vurdere om kalsiumfluorid i seg selv kunne spille en rolle i fluoridets virkningsmekanisme.
Om kalsiumfluoridets rolle i kariesprofylaksen
Under demineralisering av emalje ved lav pH, forvandles fosfatgruppene i hydroksylapatitten til mono- eller di-hydrogenfosfat. Slike fosfatgrupper er løselige og gjør at emalje (hydroksylapatitt) begynner å gå i oppløsning ved at fosfatgruppene tapes, noe som utgjør den første fase i oppløsningen av hydroksylapatitt i syre (20). Dette representerer også første fase av kariesprosessen. Hvis fluoridioner er til stede i denne fase av prosessen, vil disse reagere med høy affinitet for kalsiumionene som blir eksponert på emaljeoverflaten etter tapet av fosfatgruppene. Dermed dannes det kalsiumfluorid på tannoverflaten som erstatning for det opprinnelige kalsiumfosfat i emaljeoverflaten. Denne forseglingen med kalsiumfluorid hindrer videre demineralisering (figur 2). Det kalsiumfluorid som er dannet som en del av den nye overflaten, dannes ved pH 5,5 - 4,5, og vil således være stabilt ved mulige fremtidige kariesangrep på dette pH-nivå.
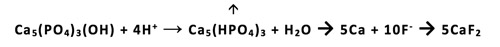
Figur 2. I emalje og (hydroksylapatite) som utsettes for bakteriell syre under et kariesangrep, vil fosfatet som er en del av emaljeoverflaten, transformeres til mono-hydrogenfosfat som er løselig, og forsvinner fra tannmineralet. Hydroksylgruppen i hydroksylapatitten vil reagere med hydrogen som således går over til vann (se figur). Det kalsium som bandt det forsvunnede fosfat er eksponert på emaljeoverflaten og reagerer med fluorid, som har en høy affinitet for kalcium. Dermed dannes et kalsiumfluorid som er en del av tannoverflaten, som forsegler tannoverflaten og forhindrer videre dekalsinasjon. 5CaF2 i figuren refererer seg til denne kalsiumfluorid. Denne effekten lokalt på tannoverflaten representerer en nyere hypotese enn den illustrert i Figur 1.
Denne modellen var utarbeidet ved eksperimenter (21 - 24) som tyder på at dannelsen av kalsiumfluorid, etter tapet av fosfat som beskrevet ovenfor, har en sentral rolle i den lokale kariesprofylaksen, bruken av fluortannpasta inkludert. Likeledes er denne lokale effekten av dominerende betydning i all praktisk kariesprofylakse. En karieshemmende effekt via en systemisk mekanisme ville vært meget tidkrevende, som diskutert ovenfor. Både effekten av vannfluoridering og fluortabletter vil kunne gi en lokal effekt i tillegg.
Det kan være relevant å minne om at mens CaF2 inneholder 50 % fluorid, er det tilsvarende innholdet i fluorapatitt 0, 2 %. Dette vil reflekteres i tettheten av fluorid i overflaten av tenner som er lokalbehandlet. Den er langt høyere enn den tilsvarende tetthet av fluorid i overflaten av systemisk behandlede tenner. Fluorapatittdannelse er en svært langsom prosess i laboratoriet, og selv i vannfluorideringsområder er neppe mer enn 10 % av hydroksylionene i apatitten byttet ut med fluoridioner (25). Da selv massiv fluorapatitt ikke er resistent mot karies, representerer derfor ikke systemisk fluoridbehandling en kostnadseffektiv metode for kariesforebyggelse.
Hvordan noen fluorider kan inhibere tannerosjoner ved meget lave pH-nivåer
Det er velkjent at tannerosjoner på grunn av høyt konsum av sur frukt, fruktsafter, mineralvann, eller ved at endogen saltsyre som kan finnes i munnhulen ved fordøyelsesproblemer, utgjør et økende klinisk problem. Tradisjonell kariesprofylakse med fluorid, som beskrevet ovenfor, har ingen forebyggende effekt på utvikling av tannerosjoner. Det er imidlertid kjent at metallfluoridene tinn(II)-fluorid (SnF2) og titan-tetrafluorid (TiF4) har en slik effekt (26 - 29). Det er nylig vist at også en sterkt fortynnet flussyre (0,1 % vandig løsning av HF, med et naturlig pH på 3), har denne effekten (30 - 32). Metallene i metallfluoridene er kompleksdannere og har sterk affinitet for hydroksylgrupper når disse metallene eksponeres for vann. Når metallfluoridene løses i vann, vil følgelig pH synke raskt på grunn av det oppståtte overskudd av protoner ved dannelse av Sn(OH)2 og Ti(OH)4. I et surt miljø vil derfor fluoridionene, som ble fortrengt fra metallionet av hydroksylinoner, danne HF molekyler sammen med de tallrike protoner som finnes i den sure væskefasen. Dette HF vil danne CaF2 på de erosjonstruede tannflater. Protonene vil gi hydrogenering av fosfatgruppene på tannflatene hvoretter fluoridet vil danne CaF2 på tannflatene som angitt i figur 2. Forskjellen er at CaF2 i dette tilfelle dannes ved pH 2 - 3, og derved også er stabilt ved dette pH nivå, og derfor inhiberer erosjoner. Det er ikke kjent om metalhydroksidene også virker beskyttende. Titan-tetrafluorid kan gi et pH ned mot pH 2, og vil gi sterkere erosjonsinhibering.
Det kan synes som om fluorid ved lav pH alene kan forklare effekten av både metallfluoridene og sterkt fortynnet flussyre. Det viser seg imidlertid at en vandig løsning av natriumfluorid ved lav pH ikke har effekt mot tannerosjoner. Grunnen til at en surgjort, vandig løsning av NaF ikke vil hemme utvikling av tannerosjoner, er sannsynligvis at det i denne løsning dannes mindre HF, fordi fluorid har høyere affinitet for Na+ enn for H+, grunnet forskjeller i elektronegativitet mellom disse kationene. Hvis surgjøringen av NaF foretas med en sterk syre (f.eks. HCl) vil denne dissosiere og kunne demineralisere emaljen som skulle beskyttes. Hvis surgjøringen foretas med en svak syre (f.eks. sitronsyre) vil denne kunne løse kalsium fra tannflaten ved sitronsyrens kelatoreffekt. Dette er i motsetning til sterkt fortynnet flussyre (HF), som er en udissosiert svak syre der F- ikke har noen kelatoreffekt (Figur 3). Den fortynnede flussyren (0,1 % vandig løsning av HF med et naturlig pH på 3) vil kunne være et nyttig kariesprofylaktikum for pasienter med høy kariesaktivitet (3, 33).
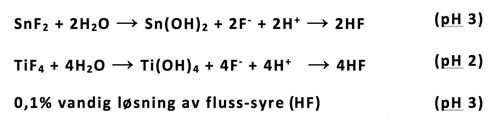
Figur 3. Disse formlene illustrerer hvordan tinnfluorid (SnF2) og titan-tetrafluorid (TiF4), danner H+ og F- og HF fremkommer. HF reagerer med emaljen som angitt i Figur 2, og danner CaF2, som beskytter tannoverflaten mot erosjon. Se den elektronmikroskopiske illustrasjon (Figur 4).

Figur 4. Skanning elektronmikroskopi (SEM) bilde av emalje som er behandlet med titan-tetrafluorid (som beskytter tannoverflaten mot erosjon). De grå strukturene er kalsiumfluorid, og de hvite strukturene er metallisk titan.
Både karies og tannerosjoner skyldes i første omgang tap av fosfat fra emaljen, og begge disse prosesser kan derfor stoppes på dette nivået ved tilførsel av fluorid som gir dannelse av kalsiumfluorid, som forsegler overflatene mot videre oppløsning, (se figur 2). Dette viser at kalsiumfluorid kan dannes ved pH-nivåer fra 5,5 ned til 2, og derfor først går i løsning ved de samme pH-nivåer der det ble dannet, noe som er en spesiell egenskap som gjør denne fluoridforbindelse nyttig ved profylakse mot både karies og tannerosjoner.
English summary
On the mechanism of action of fluoride
When dental enamel is exposed to bacterial acids, the phosphate on the tooth mineral surface is transferred to soluble mono- or di-hydrogen phosphates, which are then lost from the surface. The calcium ions that were bound to the phosphate groups are then free to react with fluoride ions and form a special form of calcium fluoride (CaF2). As the calcium ions which bind to the fluoride are still a part of the solid enamel, this process seals exposed calcium sites, thereby stopping further dissolution of enamel. Research indicates that fluorapatite in the tooth surface is less important than previously thought, whereas the fluoride provided locally to the tooth surfaces in the form of regular use of toothpaste has been shown to be extremely effective due to the mechanism outlined above. More recent studies indicate that dental erosion can also be inhibited by fluoride. Treatment of enamel and dentine with acidic fluorides such as SnF2 and TiF4, or dilute aqueous solution of hydrogen fluoride (HF), with pHs of 2 - 3 reduce the effects of acid challenge. The mechanism is probably similar to that described above, whereby undissociated HF reacts with tooth surfaces and leads to the formation of a more acid-resistant CaF2.
Hovedbudskap | |
|---|---|
· |
Den forbedrede tannhelse i Norge i løpet av de siste 40 år skyldes omfattende bruk av fluortannpasta i befolkningen |
· |
Da effekten av fluortannpasta er stor både hos barn og voksne, må effekten være lokal og ikke systemisk. Dannelse av kalsiumfluorid på tannoverflaten ved bruk av tannpasta er hovedforklaringen |
· |
Effekten av fluorider er størst på begynnende, knapt synlige karieslesjoner, noe som gjør at barn som bruker fluortannpasta fra småbarnsalder ofte ikke utvikler karies |
· |
Bruk av fluortannpasta representerer således den beste, kjente metode for masseprofylakse mot karies |
· |
Konvensjonelle metoder for kariesprofylakse (inkludert fluortannpasta) har ingen effekt mot dentale erosjoner, mens behandling med sure metallfluorider, slik som tinnfluorid og titanfluorid, virker lovende |
Referanser
1. Øgaard B, Rölla G, Cruz R. Fluoride dentifrices - a possible cariostatic mechanism. In: Embery G, Rölla G (eds). Clinical and biological aspects of dentifrices. Oxford University press, Oxford, UK, 1992, pp. 305 - 12.
2. Rölla G, Øgaard B. Reduction in caries incidence in Norway from 1970 to 1984 and some considerations concerning the reasons for this phenomenon. In Frank RM and O''Hickey S (eds): Strategy for dental caries prevention in European countries according to their laws and regulations. IRL Press Ltd, Oxford, England 1987, pp 223 - 229.
3. Marthaler TM. Changes in dental caries 1953 - 2003. Caries Res. 2004: 38; 173 - 181.
4. Alkali metal monofluorophosphate and calcium carbonate dentifrice. United States Patent number 3,119,443, 1964. Patenteier: Sten Yngve Ericsson.
5. Arnold FA Jr, Likins RC, Russell AL, Scott DB. Fifteenth year of Grand Rapids fluoridation study. J Am Dent Assoc. 1962; 65: 780 - 785.
6. Øgaard B, Rölla G, Ruben J, Dijkman T, Arends J. Microradiographic study of demineralization of shark enamel in a human caries model. Scand J Dent Res. 1988; 96: 209 - 11.
7. Larsen MJ, von der Fehr FR, Birkeland JM. Effect of fluoride on the saturation of an acetate buffer with respect to hydroxyapatite. Arch Oral Biol. 1976; 21: 723 - 8.
8. Fejerskov O. Changing paradigms in concepts on dental caries: consequences for oral health care. Caries Res. 2004; 38: 182 - 91.
9. McCann HG. The solubility of fluorapatite and its relationship to that of calcium fluoride. Arch Oral Biol. 1968; 13: 987 - 1001.
10. Caslavska V, Moreno EC, Brudevold F. Determination of the calcium fluoride formed from in vitro exposure of human enamel to fluoride solutions. Arch Oral Biol. 1975; 20: 333 - 9.
11. Øgaard B, Rölla G, Ruben J, Arends J. Relative cariostatic effects of KOH-soluble and KOH-insoluble fluoride in situ. J Dent Res. 1990; 69: 1505 - 7.
12. Øgaard B. Effects of fluoride on caries development and progression in vivo. J Dent Res. 1990; 69: 813 - 9; 820 - 3.
13. Rölla G, Øgaard B, Cruz R. Topical application of fluorides on teeth. New concepts of mechanisms of interaction. J Clin Periodontol. 1993; 20: 105 - 8.
14. Rölla G. On the role of calcium fluoride in the cariostatic mechanism of fluoride. Acta Odontol Scand. 1988; 46; 341 - 345.
15. Rölla G, Saxegaard E. Critical evaluation of the composition and use of topical fluorides, with emphasis on the role of calcium fluoride in caries inhibition. J Dent Res. 1990; 69: 780 - 5.
16. Øgaard B, Duschner H, Ruben J, Arends J. Microradiography and confocal laser scanning microscopy applied to enamel lesions formed in vivo with and without fluoride varnish treatment. Eur J Oral Sci. 1996; 104: 378 - 83.
17. Cruz R, Rölla G, Øgaard B. Formation of fluoride on enamel in vitro after exposure to fluoridated mouthrinses. Acta Odontol Scand. 1991; 49: 329 - 34.
18. Cruz R, Øgaard B, Rölla G. Acquisition of alkali-soluble fluoride by enamel through treatment with NaF-containing toothpastes in vitro. Scand J Dent Res. 1992; 100: 81 - 7.
19. Cruz R, Øgaard B, Rölla G. Uptake of KOH-soluble and KOH-insoluble fluoride in sound human enamel after topical application of a fluoride varnish (Duraphat) or a neutral 2 % NaF solution in vitro. Scand J Dent Res. 1992; 100: 154 - 8.
20. Duschner H, Uchtmann H. Degradation of surface enamel and formation of precipitates after topical applications of sodium fluoride solutions in vitro. Acta Odontol Scand. 1988; 46: 365 - 74.
21. Lagerlöf F, Saxegaard E, Barkvoll P, Rölla G. Effects of inorganic orthophosphate and pyrophosphate on dissolution of calcium fluoride in water. J Dent Res. 1988; 67: 447 - 9.
22. Saxegaard E. Alkali solubility of calcium fluoride pre-exposed to inorganic orthophosphate at pH 6.8. Acta Odontol Scand. 1988; 46: 361 - 3.
23. Saxegaard E, Rölla G. Fluoride acquisition on and in human enamel during topical application in vitro. Scand J Dent Res. 1988; 96: 523 - 35.
24. Saxegaard E, Rölla G. Kinetics of acquisition and loss of calcium fluoride by enamel in vivo. Caries Res. 1989; 23: 406 - 11.
25. Fejerskov O, Thylstrup A, Larsen MJ. Rational use of fluorides in caries prevention. A concept based on possible cariostatic mechanisms. Acta Odontol Scand. 1981; 39: 241 - 9.
26. Büyükyilmaz T, Øgaard B, Rölla G. The resistance of titanium tetrafluoride-treated human enamel to strong hydrochloric acid. Eur J Oral Sci. 1997; 105: 473 - 7.
27. Büyükyilmaz T, Øgaard B, Duschner H, Ruben J, Arends J. The caries-preventive effect of titanium tetrafluoride on root surfaces in situ as evaluated by microradiography and confocal laser scanning microscopy. Adv Dent Res. 1997; 11: 448 - 52.
28. Willumsen T, Øgaard B, Hansen BF, Rölla G. Effects from pretreatment of stannous fluoride versus sodium fluoride on enamel exposed to 0.1 M or 0.01 M hydrochloric acid. Acta Odontol Scand. 2004; 62: 278 - 81.
29. Hove LH, Holme B, Young A, Tveit AB. The protective effect of TiF4, SnF2 and NaF against erosion-like lesions in situ. Caries Res. 2008; 42: 68 - 72.
30. Young A, Thrane PS, Saxegaard E, Jonski G, Rölla G. Effect of stannous fluoride toothpaste on erosion-like lesions: an in vivo study. Eur J Oral Sci. 2006; 114: 180 - 3.
31. Hjortsjö C, Jonski G, Thrane PS, Saxegaard E, Young A. The effects of acidic fluoride solutions on early enamel erosion in vivo. Caries Res. 2009; 43: 126 - 31.
32. Hjortsjö C, Jonski G, Thrane PS, Saxegaard E, Young A. Effect of stannous fluoride and dilute hydrofluoric acid on early enamel erosion over time in vivo. Caries Res. 2009; 43: 449 - 54.
33. Øgaard B, Rölla G, Arends J, ten Cate JM. Orthodontic appliances and enamel demineralization. Part 2. Prevention and treatment of lesions. Am J Orthod Dentofac Orthop. 1988; 94: 123 - 8.
Adresse: Alix Young Vik, Institutt for klinisk odontologi, Avdeling for kariologi og gerodontologi, Postboks 1109 Blindern, 0317 Oslo. E-post: a.y.vik@odont.uio.no
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Rölla G, Vik AY, Øgaard B. Om fluoriders virkningsmekanismer. Nor Tannlegeforen Tid. 2011;121:366-70. doi:10.56373/2011-6-12