Periodontal sykdom og bioaktive lipider
Sykdommer som astma, reumatiske sykdommer, inflammatoriske tarmsykdommer og periodontal sykdom assosieres med inflammasjon. Inflammasjon er en kompleks prosess, som kan påvirkes terapeutisk. Ny forskning indikerer at daglig tilførsel av omega-3 fettsyrer og lav-dose acetylsalisylsyre (ASA), som anbefales ved hjerte-kar-sykdom, også kan styrke den periodontale helse. Inntak av omega-3 fettsyrer og lav-dose ASA gir lokal produksjon i vevet av bioaktive lipider som fremmer tilheling av inflammasjon og bringer vevet tilbake i likevekt (homeostase).
Inflammasjon er en kompleks og meget viktig prosess ved mange humane sykdommer, eksempelvis hjerte-kar-sykdom, astma, reumatiske sykdommer, inflammatoriske tarmsykdommer og periodontal sykdom. Utvikling av kreft, diabetes, Alzheimer og sykelig fedme assosieres også med dysregulering av inflammasjon. De nevnte sykdommene utgjør et alvorlig helseproblem i store deler av verden. Nyere forskning har avdekket at tilheling av den akutte fase ved inflammasjon er en høyst aktiv prosess og at lokalt produserte biologisk aktive lipider har en meget viktig funksjon med å bringe vevet tilbake til likevekt (dvs. homeostase) (figur 1). (1)
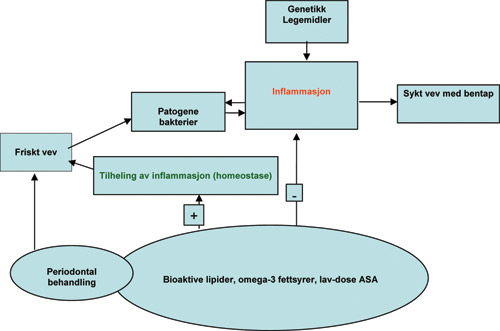
Figur 1. Forenklet skjema over faktorer som påvirker inflammasjon og tilheling ved periodontal sykdom.
Periodontal sykdom defineres som en inflammatorisk tilstand i oralt vev initiert av mikrobiell biofilm. Sykdommen fører til tap av tannens støttevev, eventuelt tap av tenner. Studier av sykdommens utvikling har vist at hovedårsaken til nedbrytning av periodontalt vev skyldes vertens respons på infeksjonen og ikke på det infeksiøse agens direkte (2). Med denne kunnskap som bakgrunn kan modulering av vertens vevsrespons bli et element ved behandling av periodontal sykdom (3). Målet med denne type terapi er å svekke de overstimulerte inflammatoriske prosesser, samt å stimulere tilheling og periodontal stabilitet, uten samtidig å hindre normale forsvarsmekanismer eller totalt å inhibere inflammasjonsprosessen. Omega-3 fettsyrer og acetylsalisylsyre (ASA) har egenskaper som kan nedregulere destruktive prosesser i humant vev, men samtidig oppregulere beskyttende og regenerative prosesser på inflammatorisk respons (4) (Figur 1). Disse effekter er knyttet til lokal syntese av lipider og deres biologiske virkning.
Omega-3 fettsyrer
Omega-3 fettsyrer er flerumettete fettsyrer, vanligvis referert til som essensielle fettsyrer, fordi de ikke syntetiseres av pattedyr og derfor må tilføres gjennom dietten. EPA (EicosaPentaenoic Acid) og DHA (DocosaHexaenoic Acid) er de omega-3 fettsyrene som ansees å være de mest biologisk aktive. Den naturlige kilde for tilførsel av EPA og DHA er fet fisk. Fiskeolje inneholder EPA og DHA i varierende mengder. Tran inneholder vitaminer i tillegg til EPA og DHA. Eksempelvis inneholder fem milliliter Møllers tran 0,6 g DHA og 0,4 g EPA. Denne mengde anbefaler Helsedirektoratet at man inntar daglig. Tilsvarende mengde DHA og EPA svarer til inntak av 40,8 g rå laks eller 31,8 g makrell i tomat per dag (5).
Inntak av omega-3 fettsyrer vil gi fordeling til omtrent alle celler i organismen. Et øket inntak av EPA og DHA hos mennesker og dyr vil gi et høyere innhold i vevet av disse substansene. Sammensetningen av fosfolipidmolekylene i cellemembraner, samt deres funksjon, vil da endres. Dette vil påvirke uttrykk av gener, samt syntese av signalstoffer og eikosanoider (6,7). Eikosanoider er lipidmolekyler og omfatter i utgangspunktet tre substansgrupper; prostaglandiner, tromboksaner og leukotriener. Fosfolipider i cellemembraner danner utgangspunkt for dannelse av eikosanoider. Eikosanoider har viktige funksjoner som start- og stoppsignaler ved tilheling av akutt inflammasjon (4). Substansene har også viktige fysiologiske funksjoner i lunger, blodkar, nervesystem, benvev og fordøyelsessystem. Omega-6 fettsyren arakidonsyre (AA) (figur. 2) danner utgangspunkt for syntese av prostaglandiner av 2-serien (D2, E2, F2 og I2) - i en tre trinns reaksjon som involverer enzymet cyclooxygenase (COX). Prostaglandin E2 (PGE2) frigjøres fra karvegger i små blodkar som respons på infeksjons- eller inflammasjonsstimuli og vil stimulere osteoblaster til å frigi faktorer fra osteoklaster som resulterer i benresorpsjon (8). Flere humane studier indikerer at PGE2 er involvert ved progresjon av periodontal sykdom. Substansen kan påvises i høyere konsentrasjoner både i gingiva og i gingivalvæske hos pasienter med periodontal sykdom, sammenlignet med friske personer (9).
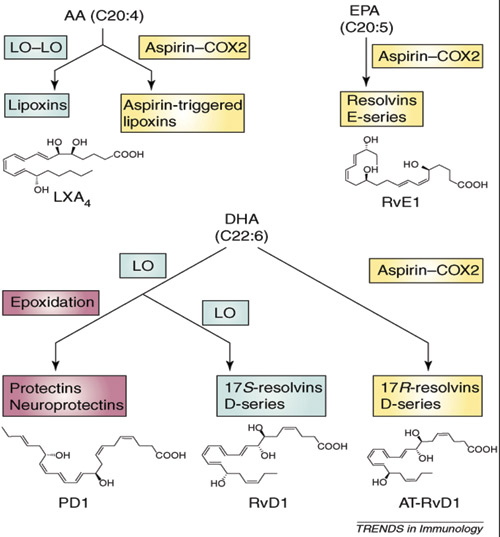
Figur 2. Syntese av lipoxiner, resolviner og protektiner. Figuren viser at AA, EPA og DHA er utgangspunkt for syntese av bioaktive lipider, samt at acetylsalisylsyre (aspirin) ved sin effekt på COX-2 også vil gi bioaktive lipder. LO=lipoxygenase. (Med tillatelse fra Elsevier Limited, License number 252002009943354).
Omega-3 fettsyrer og lokalt produserte bioaktive lipider
Hos friske personer og ved eksperimentelle dyremodeller har det blitt påvist at tilførsel av EPA og DHA kan øke syntesen av eikosanoider. DHA og EPA danner da prostaglandiner av 3-serien og ikke 2-serien. Prostaglandiner av 3-serien virker anti-inflammatorisk, i motsetning til de pro-inflammatoriske prostaglandiner av 2-serien som dannes fra AA. Økende innhold av omega-3 fettsyrene DHA/EPA i humant vev fører til konkurranse med omega-6 fettsyren AA og resulterer i høyere produksjon av anti-inflammatoriske prostaglandiner av 3-serien. DHA/EPA vil også være utgangspunkt for syntese av andre biologisk aktive lipider i humant vev. Nyere forskning har identifisert flere nye familier av bioaktive lipider - betegnet henholdsvis som resolviner, protektiner og neuroprotektiner (Figur 2), senere også maresiner. De nevnte substansene kan påvises i tilhelingsfasen ved akutt inflammasjon (10,11). De fleste nye bioaktive lipider er strukturelle varianter av 3-hydroxy fettsyrer. EPA og DHA i vev danner utgangspunkt for syntese av henholdsvis E-typen (RvE) og D-typen (RvD) av resolviner (Figur 2).
Bioaktive lipider er vist å ha positiv innflytelse på tilheling av akutt inflammasjon ved sykdommer som astma, artritt, retinopati og periodontal sykdom. I en eksperimentell dyremodell med utvikling av periodontal sykdom hos kanin er det påvist at RvE1 reduserer infiltrasjon av neutrofile celler, reduserer tap av ben og bindevev, samt regenererer bløtvev og ben (12,13) (Figur 2). RvE1 og RvD1 er også funnet å kunne svekke inflammatorisk utløst smerte hos mus via sentrale og perifere mekanismer (14). Ved hjelp av avansert massespektrometriske metoder utvides stadig kunnskapene om omsetning av omega-3 fettsyrer i forskjellige celletyper. I en nylig publikasjon påvises at DHA og DPA (DocosaPentaenoicAcid) i makrofager kan omdannes til elektrofile oxo-derivater (EFOX) med anti-inflammatoriske egenskaper (15). Forfatterne konkluderer med at dannelse av EFOX som signalstoffer kan medvirke til de positive kliniske helseeffekter man observerer ved tilførsel av omega-3 fettsyrer.
ASA og lokalt produserte bioaktive lipider
Salisylsyre finnes i piletrær (Salix alba). Den greske filosofen Hippokrates oppdaget den smertestillende effekten man fikk ved å tygge blad eller bark fra dette treet. ASA fremstilles ved acetylering av salisylsyre. Medikamentet ble syntetisert av tyske kjemikere fra salisylsyre og acetylklorid i 1859, senere med eddik anhydrid i stabil form. Bayer markedsførte Aspirin® som pulver fra 1899 og fra 1915 i tablettform. ASA er det eldste legemiddel i NSAIDs-gruppen.
Den kliniske effekten av ASA er avhengig av doseringen, hvilket enzym som involveres i reaksjonen, samt celletypen. Ved lavdose-ASA (75 - 160mg) vil effekten på blodplatene være mest markert. ASA inaktiverer cyclooxygenase (COX)-enzymene ved acetylering av det aktive enzymsetet. Dette vil redusere tromboxansyntesen i blodplatene, men også prostasyklinsyntesen i endotelceller kan påvirkes. COX-enzymene i endotelceller krever imidlertid høyere konsentrasjoner av ASA enn COX-enzymene i blodplater. Derfor vil lavdose-ASA gi selektiv effekt på tromboxansyntesen i blodplatene, uten at den gunstige effekten av prostasyklinproduksjonen fra endotelcellene oppheves. Dette er bakgrunnen for lavdose-ASA som tromboseprofylaktikum (16).
ASA har helt unike farmakologiske effekter på COX-2 enzymet sammenlignet med andre NSAIDs, som totalt vil blokkere enzymet. En total hemming av COX-2 vil føre til inhibisjon av tilhelingsprosessen ved inflammasjon. NSAIDs betegnes derfor også som tilhelingstoksiske legemidler (17). Den gunstige kliniske effekt av NSAIDs er at kardinaltegnene ved inflammasjon (bl.a. smerte og hevelse) svekkes. Total blokkering av COX-2 fører imidlertid til mindre produksjon av PGE2, som er en nødvendig substans for å gjenopprette homeostase (likevekt) av det inflammerte vev (18) (Figur 1). Den fordelaktige effekt av lav-dose ASA er at det fører til acetylering av COX-2 (Figur 2 - Aspirin-COX2). Ved denne prosessen dannes et nytt enzym - 15R LO (LO = lipoxygenase) som gir sluttproduktene «aspirin-triggered lipoxins», AT-RvE1 og AT-RvD1 (Figur 2). Dette er bioaktive lipider med noe lengre halveringstid enn native substanser. Substansen vil derfor gi forlenget stimuli til tilhelingsprosessene ved akutt inflammasjon. Statiner som er indisert ved høye kolesterolverdier, har også vist seg å stimulere dannelse av bioaktive lipider og kan derfor bidra til anti-inflammatorisk effekt (19) - også ved periodontal sykdom (20). Lav-dose ASA endrer også syntesen av lipoxiner ved å virke på enzymet COX-2 slik at det dannes aspirin-triggete lipoxiner (figur 2) (ATL-lipoxin A4).
Periodontal terapi, omega-3 fettsyrer og ASA
Omega-3 fettsyrer har både i kliniske og eksperimentelle forsøk vist å kunne svekke akutte og kroniske inflammasjoner i vev. Mange studier på dyr har undersøkt den terapeutiske effekten av omega-3 fettsyrer på periodontale forhold. Noen av disse studiene viser reduksjon i nivå av prostaglandin E2 (PGE2) ved tilførsel av omega-3 fettsyrer. PGE2 er en ofte brukt markør for graden av inflammasjon, samt nedbrytning av ben ved periodontal sykdom (21). I en nylig publisert epidemiologisk artikkel ble for første gang sammenhengen mellom inntak av omega-3 fettsyrene DHA og EPA og forekomst av periodontal sykdom hos eldre personer undersøkt (22). Studien viser en klar statistisk sammenheng mellom et lavt inntak av DHA og en høy forekomst av periodontal sykdom, mens et lavt inntak av EPA bare viste en tendens mot høyere forekomst av periodontal sykdom. Personer med lavt inntak av DHA hadde signifikant færre tenner enn gruppen med høyere inntak av DHA.
Sammenhengen mellom inntak av omega-3 fettsyrer og periodontitt har også nylig blitt undersøkt i USA. Naqvi og medarbeidere fant i en nasjonal undersøkelse av 9182 voksne over 20 år at et høyt inntak av DHA, men i noe mindre grad EPA, var assosiert med lavere forekomst av periodontitt (23). En ny klinisk studie har undersøkt effekten av å tilføre DHA og EPA, kombinert med lavdose ASA på periodontal sykdom (24). Tilstedeværelse av omega-3 fettsyrer og ASA i periodontalt vev vil kunne medvirke til å nedregulere destruktive prosesser og oppregulere beskyttende og regenerative prosesser ved syntese av eikosanoider og spesialiserte bioaktive lipid-mediatorer. I den nevnte kliniske studien ble pasientene delt i to grupper der kontrollgruppen fikk placebokapsler, samt standard ikke-kirurgisk behandling bestående av SRP (Scaling and Root Planning). Terapigruppen fikk i tillegg til SRP tilført 900 mg EPA og DHA, samt 81 mg ASA hver dag i 6 måneder. Både kliniske og biokjemiske parametre ble målt i begge grupper etter 3 og 6 måneder. Biomarkørene ble målt i saliva men ikke i blod. Biokjemisk analyse basert på saliva er viktig fordi man da kan studere lokalt produserte markører for periodontal sykdom. Nivået av RANKL og MMP-8, markører for henholdsvis benresorpsjon og inflammasjon, ble målt i saliva. Resultatene fra studien viser at konsentrasjonen av RANKL og MMP-8 i terapigruppen synker jevnt fra behandlingsstart mot 6 måneders kontroll.
I kontrollgruppen er nivået tilnærmet det samme etter 3 og 6 måneder som ved utgangpunktet. Ved måling etter 6 måneder er det statistisk signifikant forskjell (p<0.001 og p<0.01) mellom henholdsvis konsentrasjonen av både RANKL og MMP-8 i kontrollgruppen og terapigruppen. I de kliniske parametrene lommedybdemål og festenivå er det statistisk signifikant forskjell både etter 3 og 6 måneder mellom kontrollgruppen og terapigruppen, med redusert lommedybdemål og øket festenivå som resultat i terapigruppen. Til tross for at forfatterne konkluderer med at daglig tilførsel av DHA/EPA og ASA bør vurderes som en del av terapien ved periodontal sykdom, trenger vi mer forskning før vi endrer dagens behandlingsstrategi. Undersøkelsen indikerer imidlertid at daglig inntak av DHA og EPA, samt lavdose ASA, kan bedre resulatet av konvensjonell ikke-kirurgisk periodontal behandling.
Hjerte-kar-sykdom og periodontitt
Studien fra El-Sharkawy og medarbeidere er meget interessant av flere grunner. I de seneste førti år har behandling av periodontal sykdom endret seg svært lite. Dette er den første studien som bekrefter at intervensjon med DHA/EPA og lavdose ASA kan være aktuell tilleggsterapi ved ikke-kirurgisk behandling av periodontal sykdom. I nasjonale retningslinjer for primærforebygging av hjerte-kar-sykdom i Norge anbefales 75 mg ASA som standard daglig dose av Helsedirektoratet. Samtidig styrker nyere resultater fra medisinsk forskning grunnlaget for å vurdere bruk av DHA/EPA til forebygging av hjertesykdom (25). De Oliveira og medarbeidere har påvist sammenheng mellom dårlig munnhygiene og øket nivå av risikomarkører for hjerte-kar-sykdom (26). Dette styrker oppfatningen av at oral inflammasjon kan indusere økning i inflammasjon i andre deler av kroppen. Ingen har imidlertid hittil påvist en kausal sammenheng mellom hjerte-kar-sykdom og periodontal sykdom. Assosiasjonen som er påvist mellom disse sykdommene ved epidemiologiske undersøkelser, samt nyere annen forskning styrker kunnskapsgrunnlaget for at DHA/EPA kombinert med lav-dose ASA vil gi positiv helsegevinst ved samtidig forekomst av hjerte-karsykdom og periodontitt. En sannsynlig virkningsmekanisme for DHA/EPA og lavdose ASA er lokal dannelse av biologisk aktive lipid mediatorer (Figur 2).
English summary
Periodontal disease and bioactive lipids
No major changes have been introduced in periodontal disease therapy in the last forty years. Asthma, rheumatic disease, inflammatory bowel disease, and periodontal disease are associated with inflammation, which is a complex process. In many human diseases host modulation has been introduced as a part of therapy. Late clinical reports have demonstrated low-cost daily adjunctive therapy of omega-3 and low-dose aspirin in combination to strengthen the clinical outcome of non-surgical periodontal therapy. This adjunctive therapy is also recommended to prevent CVD. Recent research indicates the mode of mechanism of omega-3 fatty acids and low-dose aspirin to be the formation of bioactive compounds designated as specialized pro-resolution lipid mediators actively influencing the process of inflammation and promote tissue homeostasis.
Lygre H. Periodontal sykdom og bioaktive lipider. Nor Tannlegeforen Tid. 2011;121:832-6. doi:10.56373/2011-13-11
Hovedbudskap | |
|---|---|
· |
Periodontal sykdom er en folkesykdom der inflammasjon er en sentral prosess |
· |
Nyere forskning indikerer at biologisk aktive lipider dannes lokalt i periodontalt vev med utgangspunkt i DHA/EPA og ASA, og virker som signalstoffer for tilheling av inflammasjon |
· |
Ny forskning indikerer at daglig inntak av omega-3 fettsyrene DHA og EPA, samt lavdose ASA, kan bedre resultatet av konvensjonell ikke-kirurgisk periodontal behandling |
Referanser
1. Serhan CN. Novel lipid mediators and resolution mechanisms in acute inflammation. The American Journal of Pathology. 2010; 177: 1576 - 91.
2. Van Dyke TE, Serhan CN. Resolution of inflammation: a new paradigm for the pathogenesis of periodontal diseases. J Dent Res. 2003; 82: 82 - 90.
3. Bhatavadekar NB, Williams RC. New directions in host modulation in the management of periodontal disease. J Clin Periodontol. 2009; 36: 124 - 6.
4. Serhan CN, Chiang N, van Dyke TE. Resolving inflammation: dual anti-inflammatory and pro-resolution lipid mediators. Nat Rev Immunol. 2008; 8: 349 - 61.
5. DTU Fødevareinstituttet. Fødevaredatabanken. www.foodcomp.dk/fvdb_default.asp
6. Jump DB, Clarke SD. Regulation of gene expression by dietary fat. Annu Rev Nutr. 1999; 19: 63 - 90.
7. Duplus E, Glorian M, Forest C. Fatty acid regulation of gene transcription. J Biol Chem. 2000; 275: 30749 - 52.
8. Roberts FA, Houston LS, Lukehart SA, Mancl LA, Persson GR, Page RC. Periodontitis vaccine decreases local prostaglandin E2 levels in a primate model. Infect Immun. 2004; 72: 1166 - 8.
9. Ohm K, Albers HK, Lisboa BP. Measurements of eight prostaglandins in human gingival and periodontal disease using high pressure liquid chromatography and radioimmunity. J Periodontal Res. 1984; 19: 501 - 11.
10. Serhan CN, Hong S, Gronert K, Colgan SP, Devchand PR, Mirick G, Moussignac RL. Resolvins: a family of bioactive products of omega-3 fatty acid transformation circiuts initiated by aspirin treatment that counter proinflammatory signals. J Exp Med. 2002; 196: 1025 - 37.
11. Serhan CN, Clish CB. Aspirin triggered lipid mediators: nouvel inhibitions of leucocyte trafficing. Thorax 2000; 55 Suppl 2: 10-2.
12. Hasturk H, Katarci A, Ohira T, Arita M, Ebrahimi N, Chiang N, Petasis NA, Levy BD, Serhan CN, van Dyke TE. RvE1 protects from local inflammation and osteioclast-mediated bone destruction in periodontitis. FASEB J. 2006; 20: 401 - 3.
13. Hasturk H, Katarci A, Gouget-Surmenian E, Blackwood A, Andry C, Serhan CN, van Dyke TE. Resolvins regulated inflammation at the cellular and tissue level and restores tissue homeostasis in vivo. J Immunol. 200/; 179: 7021 - 9
14. Xu ZZ, Zhang L, Liu T, Park JY, Berta T, Yang R, Serhan CN, Ji RR.Resolvins RvE1 and RvD1 attenuate inflammatory pain via central and peripheral actions. Nat Med. 2010; 16: 592 - 7.
15. Groeger AL, Ciponilla A, Cole MP, Woodcock SR, Bonacci BA, Rudolph TK, Rudolph V, Freeman BA, Schopfer F. Cyclooxygenase-2 generates anti-inflammatory mediators from omega-3 fatty acids. Nat Chem Biol. 2010; 6: 433 - 41.
16. Dubois RN, Abramson SB, Crofford L, Gupta RA, Simon LS, van de Putte LBA, Lipsky PE. Cyclooxygenase in biology and disease. FASEB J. 1998; 12: 1063 - 73.
17. Van Dyke TE. Proresolving lipid mediators: potential for prevention and treatment of periodontitis. J Clin Periodontol. 2011; 38.119 - 25 .
18. Levy BD, Clish CB, Schmidt B, Gronert K, Serhan CN. Lipid mediator class switching during acute inflammation: signals in resolution. Nat Immunol. 2001; 2: 612 - 9.
19. Birnbaum Y, Ye Y, Freeberg SY, Nishi SP, Martinez JD, Huang MH, Urtesky BF, Prez-Polo JR. Augemntation of myocardial production of 15-epi-lipoxin-A4 by pioplitazone and atorvastatin in the rat. Circulation. 2006; 114: 929 - 35.
20. Fajardo ME, Rocha ML, Sánchez-Marin FJ, Espinosa-Chávez EJ. Effect of atorvastatin on chronic periodontitis: a randomized pilot study. J Clin Periodontol. 2010; 37: 1016 - 22.
21. Vardar S, Buduneli E, Baylas H, Berdeli AH, Atilla G. Individual and combined effects of selctive cyclooxygenase-2 inhibitor and omega-3 fatty acid on endotoxin-induced periodontitis in rats. J Periodontol. 2005; 76: 99 - 106.
22. Iwasaki M, Yoshihara A, Moynihan P, Watanabe R, Taylor GW, Miyazaki H. Longitudinal relationship between dietary o-3 fatty acids and periodontal disease. Nutrition. 2010; 26: 1105 - 9.
23. Naqvi AZ, Buettner C, Phillips RS, Davies RB, Mukamal KJ. N-3 fatty acids and periodontitis in US adults. J Am Diet Assoc. 2010; 110: 1669 - 75.
24. El-Sharkawy H, Aboelsaad N, Eliwa M, Darwesh M, Alshhat M, Kartarci A, Hasturk H, van Dyke TE. Adjunctive treatment of chronic periodontitis with daily dietary supplementation with omega-3 fatty acids and low-dose aspirin. J Periodont. 2010; 81: 1635 - 43.
25. Græsdal A. Bruk av omega-3 fettsyrer i forebygging av hjertesykdom. Tidsskrift Nor Legeforen. 2009; 129: 2109 - 12.
26. De Oliveira C, Watt R, Hamer M. Toothbrushing, inflammation and risk of cardiovascular disease: results from Scottish Health Survey. BMJ. 2010; 340: c2451.
Adresse: Seksjon for farmakologi, Institutt for indremedisin, UiB, Laboratoriebygget, 9. et., Haukeland Universitetssykehus, 5021 BERGEN
Artikkelen har gjennomgått ekstern faglig vurdering.
Lygre H. Periodontal sykdom og bioaktive lipider. Nor Tannlegeforen Tid. 2011; 121: 832-6.
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Lygre H. Periodontal sykdom og bioaktive lipider. Nor Tannlegeforen Tid. 2011;121:832-6. doi:10.56373/2011-13-11