Munnhulekreft, dentale biomaterialer og inflammasjon
Kan det tenkes at dentale biomaterialer eller inflammasjonsprosesser i relasjon til implantater eller tenner spiller en rolle ved utvikling av munnhulekreft? En liknende spørsmålsstilling finnes innen ortopedisk kirurgi, der man av og til ser mesenchymale tumorer, oftest sarkomer, i nær relasjon til leddproteser og ofte i kombinasjon med inflammatoriske prosesser.
Gjennomgang av kliniske rapporter innen odontologi viser bare ett publisert tilfelle av sarkom i relasjon til et implantat (titan), og det er ingen dokumentasjon for en sammenheng mellom munnhulekreft og dentale restaureringer. Det er imidlertid beskrevet flere kasus der gingivale plateepitelkarsinomer oppstår i umiddelbar nærhet av implantater eller periodontalt affiserte tenner. Slike kasus blir oftest satt i sammenheng med kjente årsaksfaktorer for oral kreft, men i enkelte tilfeller oppstår gingivale plateepitelkarsinomer der det bare foreligger periodontitt eller periimplantitt. Enkelte epidemiologiske undersøkelser indikerer også at kronisk periodontitt kan være en uavhengig risikofaktor ved orale kreftformer, men indikasjonene er usikre. Etter en samlet vurdering av kliniske rapporter og kasusbeskrivelser er det lite som tyder på at stoffer fra dentale biomaterialer har bidratt til utvikling av kreft, mens inflammasjonens rolle i form av periimplantitt eller periodontitt ikke helt kan avvises.
En mulig sammenheng mellom kreftrisiko og bestemte stoffer i miljø og i matvarer har lenge vært en gjenganger i media. I det siste har også betydningen av betennelse for kreftutvikling fått spalteplass (1). Det er derfor ikke unaturlig at pasienter spør hvordan man kan være sikker på at det ikke finnes noen sammenheng mellom tannmaterialer og kreft -eller mellom tannkjøttsbetennelser og kreft.
Det er velkjent at dentale biomaterialer avgir komponenter til oral slimhinne, gingivalt sulcusvev eller benvev. Det gir mulighet for toksiske eller immunologiske reaksjoner. Mutagene reaksjoner kan heller ikke utelukkes. Det siste åpner for å knytte tumorutvikling til slike materialer. En WHO-utredning fra 1999 (2), som omhandlet kreftrisiko ved kirurgiske implantater og andre fremmedstoffer, plasserte imidlertid dentale materialer i en samlegruppe der man ikke har kunnet påvise noen karsinogen aktivitet for mennesker (Gruppe 3, Tabell 1), men man har heller ikke direkte bevis for det motsatte, jfr. Gruppe 4. Bare polymere og metalliske implantater i tynne sjikt, implantater av nikkel eller kobolt og visse krom/kobolt/jern legeringer ble klassifisert som mulige karsinogener under Gruppe 2B.
Gruppe 1. Humant karsinogen. |
Gruppe 2. A. Sannsynligvis karsinogent. Begrenset bevis for karsinogenitet hos mennesker, men tilstrekkelig bevis hos dyr. |
Gruppe 2. B. Muligens karsinogent. Begrenset bevis for karsinogenitet hos mennesker og ikke tilstrekkelig bevis for karsinogenitet hos dyr. |
Gruppe 3. Ikke klassifiserbar med hensyn til karsinogenitet. Ikke tilstrekkelig bevis for karsinogenitet hos mennesker og ikke tilstrekkelig eller begrenset bevis hos dyr. |
Gruppe 4. Sannsynligvis ikke karsinogent for mennesker. |
På denne bakgrunn er det lite som tyder på at dentale biomaterialer representerer noen statistisk målbar risiko med hensyn til kreftutvikling. På den annen side opptrer det en sjelden gang gingival kreft i nær relasjon til dentale restaureringer eller implantater. I betraktning av at det finnes argumenter for at inflammasjon kan spille en rolle ved visse kreftformer kan periodontitt og periimplantitt være interessant i denne sammenheng (3,4).
Denne artikkelen tar sikte på å systematisere og diskutere kliniske rapporter som omhandler gingival kreft med nær relasjon til dentale restaureringer, spesielt implantater, og til periodontal inflammasjon. Diskusjonen baserer seg på tilsvarende problemstillinger innen ortopedisk implantologi, samt nyere synspunkter om inflammasjonens rolle ved utvikling av kreft.
Ortopediske implantater og kreft
En stor del av de ortopediske implantatene er metallbaserte leddproteser og frakturimplantater, altså eksponeringsformer som likner dentale implantater, men med mye større kontaktflate. Oftest er det tale om rusfritt stål eller krom-kobolt-proteser som blir sementert fast, men også en del titanbaserte proteser med eller uten sementfeste. Korrosjon og slitasje kan føre til lekkasje av metallioner. Hofteleddsproteser basert på metall mot metall, kan gi økning i konsentrasjonen av en rekke metallioner i vev og vevsvesker. Blod- serum- og urinverdien av mulige karsinogener som krom og kobolt kan komme opp i konsentrasjoner som tilsvarer grenseverdiene ved industriell eksponering (5). Andre slitasjekomponenter fra polyetylen og polymetylmetakrylatbasert bensement i leddprotesene, kan forårsake cellulære og humorale vevsreaksjoner, som så kan føre til osteolyse og løsning (6). I utgangspunktet er det derfor to teoretiske muligheter for kreftutvikling ved ortopediske implantater: en lokal reaksjon i fysisk nærhet til implantatet og en fjernreaksjon på helt andre lokalisasjoner.
Lokal kreft
Det norske leddproteseregisteret inneholder foreløpig ingen opplysninger om kreftutvikling i forbindelse med implantatbehandling (7). Opplysninger fra andre land tyder imidlertid på at neoplasmer relatert til kirurgiske implantater og fremmedlegemer som granatsplinter og kuler forekommer en sjelden gang (8). Det er tale om mesenchymale tumorer, de fleste sarkomer, med svært varierende latenstid. Enkelttilfeller av sarkom i relasjon til leddproteser har vært kjent lenge. En oversikt fra 1995 listet opp 20 kasus med sarkomer eller lymfomer i tidsperioden 1956 til 1990 i relasjon til leddproteser og fikseringsutstyr av metall (9). En noe nyere studie omfattet 12 kasus med sarkomer i umiddelbar nærhet til hofteproteser og fikseringsutstyr i femur (10). Forfatterne mente det var stor sannsynlighet for en sammenheng mellom sarkomene og metallimplantatene. De støttet seg også på opplysninger om andre tilfeller av sarkom i relasjon til hofte- og kneleddsproteser som til da var beskrevet i litteraturen. En annen analyse av krefttilfeller i relasjon til totalprotese i hofteledd viste at slike pasienter ofte hadde vært utsatt for flere komplikasjoner og inngrep (11).
Fjernreaksjoner
Etterundersøkelser av flere tusen finske pasienter med hofte- og kneproteser av metall-/polyetylentypen over en 15-årsperiode viste imidlertid ingen økning av kreft målt som standardisert insidens ratio (SIR), muligens med unntak av lymfomer og prostatakreft (12,13). I disse undersøkelsene ble det heller ikke påvist lokale sarkomer. Liknende etterundersøkelser på nordisk basis har heller ikke vist øket kreftinsidens for pasienter med totale hofteleddsproteser, for det meste metall på polyetylen (14). Tvert imot syntes det som enkelte krefttyper opptrådte sjeldnere hos de hofteopererte.
Gingivale karsinomer
Kreft kan oppstå hvor som helst i munnhulen. Den vanligste orale kreftformen er plateepitelkarsinomer lokalisert til den «hesteskoen» som utgjøres av munngulvet, de posteriolaterale deler av tungen og den retromolare regionen, men også gingiva, gane, og bukkal slimhinne er aktuelle lokalisasjoner. De gingivale karsinomene med tannkontakt kan likne vanlig gingivitt eller periodontitt (15). I et større biopsimateriale fra USA utgjorde kreft på gingiva eller kjevekam opp til 20 % av all oral kreft, og ble klassifisert som den tredje hyppigste lokalisasjonen etter munngulv og tunge. Nesten halvparten av disse tilfellene oppsto i nær kontakt med tenner og opptrådte hyppigst hos eldre menn (16). I en annen undersøkelse fra USA utgjorde gingivale plateepitelkarsinomer 27 % av all oral kreft, hyppigst i underkjeven (17).
I oversikter av denne art er det ikke spesifisert i hvilken utstrekning gingivale krefttilfeller hadde direkte kontakt til tannoverflate, restaureringer eller implantater. Rapportene fokuserer på pasientenes alders- og kjønnssammensetning og på ytre årsaksfaktorer som røyking, alkohol, beteltygging (i Østen) og premaligne tilstander som leukoplakier, erytroplakier og oral lichen planus. I enkelte tilfeller vises det også til såkalte verrukøse karsinomer, som er mer avgrenset og ikke har samme spredningsfare som plateepitelkarsinomene.
De mer detaljerte kasusbeskrivelser (18 - 23) oppsummert i Tabell 2, viser at gingivale plateepitelkarsinomer ofte opptrer i nær kontakt med fyllinger og kroner, som på Figur 1. I 4 av de 6 kasus som beskrives i tabellen, var den kliniske diagnosen relatert til periodontitt. Diagnostiske feilvurderinger av denne art fører ofte til at det ikke blir tatt biopsi i første omgang.
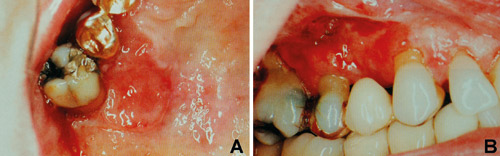
Figur 1. Gingivalt plateepitelkarsinom palatinalt (A) og bukkalt (B) i høyre overkjeve i nær relasjon til amalgamfylling og kronearbeide. (Gjengitt med tillatelse fra Quintessence International, referanse 23)
Forfatter (referanse) |
Beskrivelse |
|---|---|
Kirkham & al. (1985) (18) |
Kvinne, 37. Ingen kjente prekankrøse tilstander, ikke-røker. Liten, oppdrevet, smerteløs gingival lesjon med krateraktig struktur sentralt, bukkalt for 16. Klinisk diagnose: Abcess m/fistel. Antatt tannrelatert. Kirurgi m/full mukoperiostal flap. Karsinomdiagnose. Tilheling uten følger. Ingen metastaser. Atypisk. |
Craig & al. 1989 (19) |
Mann, 70. Ingen kjente prekankrøse tilstander, ikke-røker. Hygienist merket subgingival defekt på 31 og gingivalt erythem 31,32,33. Ikke bedring v/profylakse. Biopsi: Karsinomdiagnose. Ikke spredning til underliggende ben. |
Heller & al. 1991(20) |
Kvinne, 66. Røker, tidl. mastektomi, periodontal abcess på 36, skrå benlomme. Ingen påfallende restaureringer. Klinisk diagnose: periodontitt. Flapoperert 2 ganger, senere ekstraksjon, men persisterende smerte. Ny vevsvekst, biopsi, diagnose og omfattende kirurgi. Ingen metastaser. Plateepitelkarsinom antatt oppstått i sulcusepitel. |
Li & al. 2004 (21) |
Mann, 48, røker, beteltygger. Leukoplaki på tungen. Lyserødt, svampaktig vev bukkalt, smerteløst. Periodontitt m/horisontal bennedbrytning 36,37. Dårlig tilpasset krone 36, som ble ekstrahert og bløtvev fjernet. Karsinomdiagnose, kirurgi. |
Lee & al. 2007 (22) |
Kvinne, 46. Ingen kjente riskofaktorer. Rød, svullen gingiva bukkalt 21,22, som hadde MK-kroner. Antatt dentoalveolær abcess fra 21. Rotkanalterapi. Ingen bedring. Biopsi og karsinomdiagnose. Fem tenner m/kjeveben kirurgisk fjernet. |
Yoon & al. 2007 (23) |
Kvinne, 81. Ingen kjente risikofaktorer. Ømhet, smerte høyre maxilla, flatt, erytematøst gingivalvev palatinalt og bukkalt for 16. Mobilitet, furkasjon. Fyllinger og kroner på nærstående tenner. Klinisk diagnose: endodontal eller periodontal infeksjon. Ingen effekt av antibiotika. Biopsi, karsinomdiagnose og omfattende kirurgi. |
Metastaser på gingiva kan også forekomme, oftest fra lunge. I enkelte tilfeller oppdages metastasen før det foreligger mistanke om lungekreft (24). Over 60 % av metastasering til oralt bløtvev fra primærkreft i lunge, nyre eller bryst kan være lokalisert til gingiva (25).
Periodontal inflammasjon og oral kreft
I likhet med undersøkelse av fjernreaksjoner som følge av ortopediske implantater finnes det også undersøkelser som omhandler sammenhengen mellom periodontitt og oral kreft i sin alminnelighet. Man har indikasjoner på at kronisk periodontitt kan være en egen, uavhengig risikofaktor ved tungekreft og andre orale plateepitelkarsinomer, etter at det er justert for kjente risikofaktorer som alder, kjønn, røkning, alkohol etc. (26). En stort anlagt epidemiologisk studie med sikte på å undersøke sammenhengen mellom oral kreft og en del helseindikatorer, viste også en svak assosiasjon mellom periodontitt og oral plateepitelkarsinom. Studien var basert på intervjudata der periodontitt ble indikert med tanntap og selvopplevd mobilitet. Forfatterne påpeker selv fallgruvene ved en slik metode, men mener at deres data støtter teorien om den karsinogene effekten av en persisterende inflammasjon som periodontitt (27).
Peri-implantitter og karsinomer
Betennelser rundt dentale implantater med eller uten bentap er et vanlig funn. I verste fall kan slike periimplantitter føre til tap av implantatet ved lignende mekanismer som ved periodontitt (28). En sjelden gang forekommer det plateepitelkarsinomer i nær relasjon til slike implantater. Noen slike tilfeller er oppsummert i Tabell 3. Clapp og medarbeidere (29) beskrev 3 slike tilfeller i forbindelse med mandibulære implantater hos eldre pasienter, der ingen av de vanlige årsaksfaktorene ved oral kreft var til stede. Det var tale om ett implantat med hydroksyapatittoverflate og to av titan. Men i de fleste andre kasus finnes det opplysninger om premaligne tilstander og tidligere behandlet kreft (30 - 34).
Forfatter (referanse) |
Beskrivelse |
|---|---|
Clapp & al. 1996 (29) |
Kvinne, 65. Ingen kjente risikofaktorer. Utviklet plateepitelkarsinom rundt hydroksylapatittdekket titanimplantat i underkjeven. Lokal kirurgi 2 x med tre års mellomrom. Døde etter 6 mndr. |
Mann, 79. Ingen kjente risikofaktorer. Utviklet karsinom rundt titanimplantater i underkjeven etter fire år. Omfattende kirurgi og stråleterapi uten suksess. |
|
Kvinne, 90. Tidligere behandlet for plateepitelkarsinom på bukkalslimhinnen. Utviklet Karsinom rundt titanimplantater på urelatert sted. Omfattende kirurgi. |
|
Moxley & al. 1997 (30) |
Kvinne, 74. Tidligere verrukøst karsinom i underkjeven. Omfattende kirurgisk behandling, flere år. Nå plateepitelkarsinom rundt titanfikstur. Diskusjon om titanimplantatet hadde noe med saken å gjøre. |
Block & al. 2001 (31) |
Mann, 72. Tidligere røker. Tidligere behandlet for verrukøst karsinom i underkjevens molarregion. Kirurgi, senere titanimplantater i samme sted. Senere nytt karsinom i relasjon til implantatene, ny tilheling og nye implantater. Til slutt radikal kirurgi. |
El-Naaj & al. 2006 (32) |
Kvinne, 70. Tidligere thyroid- og mammakreft. Oppdrevet sår bukkalt for 6 gamle implantater i underkjeven. Total bennedbrytning. Diagnose: platepitelkarsinom. Omfattende kirurgi. |
Mann, 72. Røker. Lichen planus på kinnslimhinnen. Gamle protesebærende implantater i underkjevens front. Oppdrevet sår bukkalt for implantatene. Total bennedbrytning. Omfattende kirurgi og strålebehandling. |
|
Czerninski. & al. 2006 (33) |
Kvinne, 52. Røker. Lichen planus. Tre år gamle mandibulære titanimplantater i molarregionen. Stort bentap. Sår på alveolarkammen posteriort for implantatene. Biopsi: plateepitelkarsinom. Kirurgi. |
Mann, 80. Tidligere behandlet for oral plateepitelkarsinom og tykktarmkreft. Sår, oppdrevet masse rundt fem år gamle implantater i underkjevens front. Bare lokal kirurgi. Pasienten døde. |
|
Gallego & al. 2008 (34) |
Kvinne 81. Behandlet for oral lichen. Senere sår på kjevekammen i venstre mandibulære molarregion. Biopsi. Plateepitelkarsinom. Kirurgi, deretter to implantater i underkjevens front. Senere igjen sårt ved det ene implantatet, som viste seg å være nytt karsinom eller residiv. |
Det er pekt på at plateepitelkarsinomer i relasjon til implantater kan ha vokst ned i sulcus fra leukoplaki eller verrukøst karsinom i nærliggende slimhinne og at implantatene ikke nødvendigvis har noe med saken å gjøre (30,31). Også langvarig lichen planus kan ha ført til økt følsomhet overfor karsinogene faktorer og kan ha vært medvirkende ved av implantatrelatert karsinom (32).
En særegen problematikk i denne sammenhengen er karsinomer med lokalisasjon rundt implantater som er satt inn som rehabilitering etter kirurgisk behandling av nettopp oral kreft. I slike tilfelle blir det spørsmål om de osseointegrerte implantatene kan ha bidratt til ny primærtumor, eller om implantatene kanskje har vanskeliggjort kontrollene, slik at lokale residiver av karsinom er blitt tatt for å være benigne peri-implantitter (35).
Sarkom i relasjon til dentalt implantat
Samtlige av de refererte kasus gjelder plateepitelkarsinomer rundt implantater i underkjeven. I 2008 ble det imidlertid beskrevet et tilfelle av osteosarkom i relasjon til et titanimplantat til erstatning for tann 16 hos en 38 år gammel kvinne uten kjente risikofaktorer (36). Tannen var tapt etter mislykket endodonti og det ble satt inn et implantat (Replace Select, Nobel Biocare, Gøteborg, Sverige). Omtrent et år etterpå ble det konstatert sarkom lokalisert til bukkalsiden tett på implantatet. Computertomografi viste gjennombrudd til bløtvev bukkalt. Pasienten ble behandlet med cytostatika og gjennomgikk deretter omfattende kirurgisk behandling med etterfølgende innsetting av obturator. Sarkomer er ikke beskrevet i relasjon til dentale implantater tidligere, så dette er derved det eneste kjente tilfelle av kreft i relasjon til et dentalt implantat med et forløp som likner kreftutvikling i ved ortopediske benimplantater.
Diskusjon
Den foreliggende oversikten er begrenset til kliniske observasjoner på menneskemateriale. Samlet viser kasusrapporter fra ortopedisk kirurgi at mesenchymale tumorer, oftest sarkomer og ofte med dødelig utgang, kan opptre i nærheten av metallimplantater i ben, men i følge de rapporter som er sitert ovenfor, opptrer de uhyre sjelden i forhold til det store antall ortopediske implantater som er i funksjon. De enkelte kasusbeskrivelsene kan gi en mistanke om en kausal relasjon mellom implantatet og den maligne tumoren, men ofte er leddprotesen samtidig i ferd med å løsne som følge av inflammasjon, nekrose og dannelse av såkalte pseudotumorer, som er betegnelsen på en omfattende lymfocyttinfiltrasjon og nekrose, som kan ha sammenheng med slitasjekomponenter fra metall (37). Det er kjent at inflammatoriske tilstander noen ganger foreligger før maligne tilstander oppstår, mens det i andre tilfeller er slik at onkogen aktivitet induserer inflammasjon, som igjen medvirker ved kreftutviklingen (4).
Forenklet kan inflammasjonens dobbeltrolle beskrives slik: Inflammasjonen som følger infeksjon eller vevsskade mobiliserer immunsystemets forsvarsverk. Immuncellenes signalsubstanser stimulerer til øket blodforsyning og øket invasjon av celler som både kan nøytralisere fremmed substans og stimulere til ny cellevekst og tilheling. En viss type lymfocytter, som ikke er avhengig av antigenstimulering, kan peke ut og drepe både virusinfiserte og neoplastiske celler (38), mens den økede celleveksten stopper av seg selv ved apoptose når tilhelingen er fullført. På den måten er forsvarsmekanismene ved betennelse med på å begrense muterte celler med karsinogent potensiale.
På den andre siden kan kreftceller dra nytte av inflammasjonsprosessen. Dette er ingen ny tanke. Kreftutvikling i sammenheng med vedvarende inflammasjon som ved arr, liggesår, brannsår og lignende har vært postulert for lenge siden (39). Forholdet forklares ved at de samme inflammasjonsfremmende stoffene som immuncellenes produserer for reparasjon av vevsskade, vil kunne fungere som stimuli for formering av kreftceller (40 - 42). Det kan derfor være vanskelig å bedømme om en implantatrelatert malign tumor har sammenheng med avgitte komponenter fra implantatet eller med den inflammasjonen som foreligger.
Under alle omstendigheter er insidensen av implantatrelaterte tumorer så liten at de ikke gir seg utslag på kreftstatistikker. Store befolkningsundersøkelser gir ikke grunnlag for å mene at ortopediske implantater har noen målbar fjernvirkning med hensyn kreft (12 - 14). Man kan altså stå overfor en tumorutvikling som på en eller annen måte har relasjon til implantatet, men hvor potensielle årsakselementer som avgitte komponenter, fysisk konfigurasjon og inflammasjon er vanskelig å holde fra hverandre. Kliniske rapporter kan gi en pekepinn i om etiologien, men tillater ikke å fastslå eller å avkrefte en kausal relasjon. Det antas at ortopediske proteseregistre i fremtiden vil kunne kaste ytterligere lys over dette aspektet ved å inkludere detaljopplysninger om kreftutvikling i relasjon til leddimplantatene.
Den generelle verdien av informasjon som stammer fra ortopedisk kirurgi for odontologiske spørsmål beror først og fremst på den lærdom som ligger i studier av reaksjonen på kroppsfremmede materialer etter direkte eksponering på mennesker. Tallrike undersøkelser viser at resultater fra dyreforsøk ikke uten videre kan overføres til mennesker (3). Den spesielle verdien beror på at dentale implantater har en eksponeringsform som likner ortopediske implantater, riktignok med en beskjeden slitasjefaktor og en mindre overflate. Det er rimelig å anta at disse forhold bidrar til å minske en risiko som i utgangspunktet er ytterst liten. Det finnes da også bare ett publisert tilfelle av osteosarkom i relasjon til et dentalt implantat (36). Forfatterne presiserer at man vanskelig kan bekrefte eller avkrefte om dette sarkomet kan settes i kausal relasjon til det aktuelle titanimplantatet.
Disse forhold betyr imidlertid ikke at dentale implantater er «frikjent» med hensyn til kreftutvikling. I motsetning til ortopediske implantater har de dentale implantatene kontakt til epitelvev, noe som gir muligheter for utvikling av plateepitelkarsinomer med utspring i sulcusvev eller annet epitelvev i munnslimhinnen. Samtidig finnes det ofte inflammasjon i form av periimplantitt. I likhet med utvikling av sarkomer i nærheten av ortopediske implantater kan man derfor ikke se bort fra at inflammatoriske faktorer kan være av betydning. Et liknende resonnement gjelder ved gingivale plateepitelkarsinomer som opptrer i nær relasjon til periodontal inflammasjon.
I noen av de refererte kasus oppsto karsinom nær relasjon til dentale fyllinger eller kroner, f. eks. der amalgam- og gullrestaurering er i nærkontakt (23, Figur 1) men forfatterne reflekterer ikke nærmere over dette. Det finnes heller ingen opplysninger fra Bivirkningsgruppen for odontologiske biomaterialer som kopler gingival kreft til dentale restaureringer og, så vidt vites, heller ingen publiserte kasus hvor dette er et poeng.
De tilfellene av gingival kreft som er referert her, opptrer oftest hos pasienter som på forhånd har premaligne tilstander i munnhulen, eller som har andre, kjente risikofaktorer med hensyn til munnhulekreft. Samtidig har de gingivale plateepitelkarsinomene ofte en nær relasjon til inflammatoriske prosesser ved peri-implantitt eller periodontitt. Det er derfor ikke urimelig å anta at gingival inflammasjon og kreftutvikling kan bli gjenstand for øket interesse fra forskerhold i likhet med periodontitt og hjertekarsykdom.
English summary
Oral cancer, dental biomaterials, and inflammation
The present paper discusses the potential role of dental biomaterials and inflammatory processes in gingival carcinogenesis. Parallel questions are associated with orthopedic implants that sometimes initiate malignant mesenchymal tumors like sarcomas. Only one case of sarcoma has been described in relation to dental implants and no oral malignancy has been related to other dental restorations. On the other hand, several cases of squamous cell carcinomas in close contact with dental implants with peri-implantitis or teeth with periodontal inflammation have been reported. Most often the gingival carcinomas occur in patients with known risk factors or oral premalignancies. However, other cases exhibit no potential risk factor except periodontal or peri-implant inflammation. This observation may be of interest in view of the present discussion on the role of inflammation in carcinogenesis. Epidemiological research has indicated that periodontal inflammation may be an independent risk factor in oral cancer. In conclusion, no evidence indicates that dental biomaterials contribute to the development of gingival cancers, whereas the role of periodontal and implant inflammatory processes cannot be completely disregarded.
Jacobsen N. Munnhulekreft, dentale biomaterialer og inflammasjon. Nor Tannlegeforen Tid. 2011;121:636-41. doi:10.56373/2011-10-7
Hovedbudskap | |
|---|---|
· |
Kjente komplikasjoner ved ortopediske implantater er inflammatoriske prosesser og en sjelden gang også maligne, mesenchymale tumorer som sarkomer. |
· |
Det finnes bare ett publisert tilfelle av sarkom i relasjon til et dentalt implantat og ingen malignitet som kan settes i direkte relasjon til andre dentale restaureringer. |
· |
Det finnes imidlertid en del tilfeller av plateepitelkarsinom som oppstår nær implantater med periimplantitt og til periodontal inflammasjon. Det diskuteres hvorvidt slike inflammatoriske prosesser kan spille en rolle ved utvikling av gingival kreft. |
Referanser
1. Brøin, May Britt: Helse. Betennelse gir grobunn for kreft. Aftenposten 25. oktober 2010.
2. IARC monographs on the evaluation of carcinogenic risks to humans. Surgical Implants and Other Foreign Bodies. Volume 74. WHO International Agency for Research on Cancer. Lyon 1999.
3. Mantovani A. Allavera P, Sica A, Balkwill F. Cancer-related inflammation. Nature. 2008; 453: 463 - 44.
4. Tezal M, Sullivan MA, Hyland A, Marshall JR, Stoler D, Reid ME, Loree TR, Rigual NR, Merzianu NR, Hauck L, Lillis C, Wactawski-Wende J, Scannapieco FA. Chronic periodontitis and the incidence of head and neck squamous cell carcinoma. Cancer Epidemiol Biomarkers Prev. 2009; 18: 2406 - 12.
5. Sargeant A, Goswami T, Swank M. Ion concentrations from hip implants. J Surg Orthop Adv. 2006; 15: 113 - 4.
6. Witzleb W-C, Ziegler J, Krummenauer F, Neumeister V, Guenther K-P. Exposure to chromium, cobalt and molybdenum from metal-on-metal total hip replacement and hip resurfacing arthroplasty. Acta Orthop. 2006; 77: 697 - 705.
7. Dale H, Hallan G, Espehaug B, Havelin LI, Engesæter LB. A study on 97344 primary total hip replacements in the Norwegian Arthroplasty Register from 1987 to 2007. Acta Orthop. 2009: 80: 639 - 45.
8. Shoen FJ. Tumorigenesis and biomaterials. In Ratner, Hoffman, Schoen and Lemons (editors): Biomaterials Science. An introduction to materials in medicine. 2. edition 2004. Elsevier Academic Press, pp. 338 - 45.
9. Vahey JW, Simonian PT, Conrad EU. Carcinogenicity and metallic implants. Am J Orthop. 1995; 24: 319 - 24.
10. Keel SB, Jaffe KA, Petur Nielsen G, Rosenberg AE. Orthopedic implant-related sarcoma: a study of twelve cases. Mod Pathol. 2001; 14: 969 - 77.
11. Visuri T. Pulkkinen P, Paavolainen P. Malignant tumors at the site of total hip prosthesis. Analytic review of 46 cases. J Arthroplasty. 2006; 21: 311 - 23.
12. Paavolainen P, Pukkala E, Pulkkinen P, Visuri T. Cancer incidence in Finnish hip replacement patients from 1980 to 1995: a nationwide conhort study involving 31,651 patients. J Arthroplasty. 1999; 14: 272 - 80.
13. Paavolainen P. Pukkala E, Pulkkinen P, Visuri T. Cancer incidence after total knee arthroplasty: a nationwide Finnish cohort from 1980 - 1996 involving 9,444 patients. Acta Orthop Scand. 1999; 70: 609 - 17.
14. Visuri T, Pukkala E, Pukkanen P, Paavolainen P. Cancer incidence and causes of death among total hip replacement patients: a review based on Nordic cohorts with a special emphasis on metal-on-metal bearings. Proc Inst Mech Eng H. 2006; 220: 399 - 407.
15. McGaw WT, Pan JT. Cancer of the gingiva, buccal mucosa, and palate. J Can Dent Assoc. 1996; 62: 146 - 50.
16. Barasch A, Gofa A, Krutchkoff DJ, Eisenberg E. Squamous cell carcinoma of the gingiva. A case series analysis. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1995; 80: 183 - 7.
17. Makridis SD, Mellado JR, Freedman AL, Salkin LM, Stein LM. Leal K, Miller AS. Squamous cell carcinoma of gingiva and edentulous alveolar ridge: a clinicopathologic study. Int J Periodontics Restorative Dent. 1998; 18: 292 - 8.
18. Kirkham DB, Hoge HW, Sadeghi EM. Gingival cell carcinoma appearing as a benign lesion: report of a case. J Am Dent Assoc 1985; 111: 767 - 9.
19. Craig RM Jr, Vickers VA, Correll RW. Erythroplastic lesion on the mandibular marginal gingival. J Am Dent Assoc. 1989; 119: 543 - 4.
20. Heller AN, Klein A, Barocas A. Squamous cell carcinoma of the gingival presenting as an endoperiodontic lesion J Periodontol. 1991; 62: 573 - 5.
21. Li PY, Auyeung L, Huang SC, Squamous cell carcinoma of the mandibular gingival. Chang Gung Med J 2004; 27: 777 - 81.
22. Lee JJ, Cheng SJ, Lin SK, Chiang CP, Yu CH, Kok SH. Gingival squamous cell carcinoma mimicking a dentoalveloar abcess: report of a case. J Endod. 2007; 33: 177 - 80.
23. Yoon TYH, Bhattacharyya I, Katz J, Towle HJ, Islam MN. Squamous cell carcinoma of the gingiva presenting as a localized periodontal disease. Quintessence Int. 2007; 38: 97 - 102.
24. Tanaka M, Hiraki A, Ueoka H, Bessho A, Kiura K, Takigawa N, Kodani T & al. Gingival metastasis in lung cancers. Oncol Rep. 2002; 9: 571 - 4.
25. Seoane J, Van der Waal I, Van der Waal RI, Cameselle-Teijero J, Anton I, Alcazar-otero JJ, Varela-Centeles P, Diz P. Metastatic tumours to the oral cavity: a survival study with a special focus on gingival metastasis. J Clin Periodontol. 2009; 36: 488 - 92.
26. Tezal M, Sullivan MA, Reid ME, Marshall JR, Hyland A, Loree T, Lillis C, Hauck L, Wactawski-Wende J, Scannapieco FA. Chronic periodontitis and the risk of tongue cancer. Arch Otolanryngol Head Neck Surg. 2007; 133: 450 - 4.
27. Divaris K, Ohlhan AE, Smith J et al. Oral health and risk for head and neck squamous cell carcinoma. The Carolina Head and Neck Cancer study. Cancer Causes Control. 2010; 21 : 567 - 75.
28. Koldsland OC, Scheie AA, Aass. AM. Prevalence of implant loss and the influence of associated factors. J Periodontol. 2009; 80: 1069 - 75.
29. Clapp C, Wheeler JC, Martof AB, Levine PA. Oral squamous cell carcinoma in association with dental osseointegrate implants. An unusual occurrence. Arch Otolanryngol Head Neck Surg. 1996; 122: 1402 - 3.
30. Moxley JE, Stoelinga PJ, Blijdorp PA. Squamous cell carcinoma associated with a mandibular staple implants. J Oral Maxillofacial Surg. 1997; 55: 1020 - 2.
31. Block MS, Scheufler E. Squamous cell carcinoma appearing as peri-implant bone loss: a case report. J Oral Maxillofacial Surg. 2001; 59: 1349 - 52.
32. El-Naaj A, Trost O, Tagger-Green N, Trouilloud P, Robe N, Malka G, Peled M. Peri-implantitis or squamous cell carcinoma? Rev Stomatol Chir Maxillofac. 2007; 108: 458 - 60.
33. Czerninski R, Kaplan I, Almoznino G, Maly A, Regev E.. Oral squamous cell carcinoma around dental implants. Quintessence Int. 2008; 37: 707 - 11.
34. Gallego L, Junquera L, Baladron J, Villareal P. Oral squamous cell carcinoma assoiated with symphyseal dental implants. An unusual case report. J Am Dent Assoc. 2008; 139: 1061 - 5.
35. Shaw R, Sutton D, Brown J, Cawood J. Further malignancy in field change adjacent to osseointegrated implants. Int J Oral Maxillofac Surg. 2004; 33: 353 - 5.
36. McGuff HS, Heim-Hall J, Holsinger FC, Jones AA, O''Dell DS, Hafemeister AC. Maxillary osteosarcoma associated with a dental implant: report of a case and review of the literature regarding implant-related sarcomas. J Am Dent Assoc. 2008; 139: 1052 - 9.
37. Pandit H, Glyn-Jones S, McLardy-Smith P, Grundle R, Whitwell D, Gibbons CL, Ostlere S, Athanasou N, Gill HS, Murray DW. Pseudotumours associated with metal-on-metal hip resurfacings. J Bone Joint Surg Br. 2008; 90: 847 - 51.
38. Løvik G, Rolstad B. Naturlige drepeceller - viktig immunologisk førstelinjeforsvar. Tidsskr Nor Lægeforen. 2000; 120: 1542 - 6.
39. Chruickshank AH, McDonnel EM, Miller DG. Malignancy in scars, chronic ulcers, and sinuses. J Clin Pathol. 1963; 16: 573 - 80.
40. Peek RM, Jr, Mohla S, DuBois R N. Inflammation in the genesis and perpetuation of cancer: summary and recommendations from a national cancer institute-sponsored meeting. Cancer Res. 2005; 65: 8583 - 6.
41. Kneibel A, Singh V, Sharma MC. Inflammation, microenvironment, and the immune system in cancer progression. Curr Pharm. 2009: 15: 1949 - 55
42. Porta C, Larghi P, Rimoldi M, Totaro MG, Allavena P, Mantovani A, Sica A. cellular and molecular pathways linking inflammation and cancer. Immunobiology. 2009; 214: 761 - 77.
Adresse: Nils Jacobsen, Nordisk institutt for odontologiske materialer (NIOM as), postboks 3874, 0805 Ullevål stadion. E-post: n.j.jacobsen@niom.no
Artikkelen har gjennomgått ekstern faglig vurdering.
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Jacobsen N. Munnhulekreft, dentale biomaterialer og inflammasjon. Nor Tannlegeforen Tid. 2011;121:636-41. doi:10.56373/2011-10-7