Feilslag ved lokalanestesi – mekanismer, mulige årsaker og strategier
Forfattere
spesialistkandidat, Institutt for klinisk odontologi – endodonti, Universitetet i Bergen
førsteamanuensis, Institutt for klinisk odontologi – endodonti, Universitetet i Bergen
professor, Institutt for klinisk odontologi – endodonti, Universitetet i Bergen
Smertefri behandling er målsettingen ved bruk av lokalanestesi. Imidlertid viser studier at manglende anestesieffekt er relativt vanlig, spesielt ved ledningsanestesi i underkjevens molarområde. Det er også vist at inflammatoriske forandringer vil kunne påvirke anestesieffekten negativt på grunn av endringer i nervenes overflatereseptorer. Nyere kunnskap om virkningsmekanismer og neurokjemiske forandringer i nervesystemet i forbindelse med inflammasjon har økt vår forståelse rundt disse problemene. Ulike teknikker, enten brukt alene eller i kombinasjon, kan bidra til å sikre fullgod anestesi som er avgjørende for smertefri behandling. Denne oversikten har som målsetting å belyse anestesimidlers basale virkningsmekanismer og gjennomgå mulige årsaker og strategier når anestesimidlene ikke gir ønsket effekt.
Frykt for smerte er en av de viktigste årsakene til at pasienter unngår tannbehandling (1). Endodontisk behandling er forbundet med smerte, og bedøvelse gir ikke alltid ønsket resultat. Nitti prosent av allmennpraktiserende tannleger opplever fra tid til annen anestesiproblemer ved vanlig konserverende tannbehandling (2, 3) og blant endodontister angir 84 % at de ikke alltid oppnår fullstendig pulpaanestesi ved irreversibel pulpitt, til tross for leppeanestesi (4). Det er ingen klar sammenheng mellom leppeanestesi og pulpaanestesi, men ufullstendig leppeanestesi gir klar indikasjon på manglende pulpaanestesi (1). Anestesisuksess er definert som pulpaanestesi, det vil si antall individer som ikke oppnår to påfølgende sensibilitetsutslag ved bruk av elektrisk pulpatester eller EndoIce® (Hygenic Corporation, Akron, Ohio, USA) i løpet av 15 minutter, og som ikke får sensibilitetsutslag i løpet av 60 minutter etter injeksjon (1, 5).
Ledningsanestesi anses som teknisk mer vanskelig enn infiltrasjonsanestesi (6), og det er ved mandibular ledningsanestesi de fleste feilslagene skjer (2). Første molar i mandibelen er den tann hvor en oftest opplever anestesiproblem, etterfulgt av andre molar og første premolar. Dette gjelder både ved klinisk frisk pulpa og ved pulpitt (7–10).
Mekanismer for smerteoverføring i nervevev, årsaker til feilslag og strategier for å oppnå god molaranestesi, spesielt i underkjeven, vil bli gjennomgått.
Farmakologi
Lokalanestesi har molekylære fellestrekk. De inneholder en lipidgruppe forbundet med et amid eller en ester (klassifiseres derfor som amid- eller esterforbindelser) som igjen er knyttet til en karbonkjede. Karbongruppen er igjen forbundet med en hydrofil molekylgruppe (hydrogenklorid) som gjør anestesimidlet vannløselig (11, 12) (Figur 1).
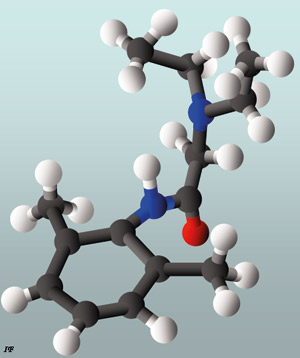
Figur 1. Lidokainmolekylet visuelt fremstilt. Hydrogenatomer er i hvit farge, karbon svart, nitrogen blå og oksygen rødt. Den kjemiske formel for lidokain er C14H22N2O.
Prokain, en estertype, ble tidligere brukt i tannbehandling. Medikamentet ble hydrolysert i plasma av enzymet pseudocholinesterase til para-amino benzosyre (PABA) som var potensielt allergifremkallende. Siden har mer effektive anestesimidler av amidtypen som lidokain (Xylocain®, AstraZeneka) kommet på markedet (13), noe som har medført at estertypen i dag er lite benyttet. Unntaket er benzocain (Topical®, Premier Dental Products Company, USA) som benyttes til overflateanestesi.
Tilgjengelige amidbaserte lokalanestesimidler kan være med eller uten karkontraherende midler, eller er i seg selv karkontraherende (14). Lokalanestesi som forhandles i Norge er bupivakain (Marcain®, Marcain-Adrenalin®, AstraZeneka), lidokain (Xylocain Dental adrenalin®, Dentsply), mepivakain (Carbocain Dental®, Dentsply), ropivakain (Naropin®, AstraZeneka), prilokain (Citanest dental Octapressin®, Dentsply) og artikain (Septocain® og Septocain Forte®, Septodent) (14). I litteraturen er det indikasjoner på at artikain (i mindre grad prilokain) kan gi neurotoksisk skade i form av parestesi i tunge og i nedre leppe/kinn ved ledningsanestesi (15). Forekomsten av parestesi etter bruk av artikain er beregnet å ligge mellom 1:27000–1:160000, men i 85–94 % av tilfellene er normal funksjon gjenopprettet innen 8 uker (16).
Mange anestesimidler foreligger som racemater, det vil si lik blanding av speilvendte molekyler. Anestesimidler er i en lett ionisert form, bestående av en syre- og en uladet basedel, og har en pH på 3–4. Ved denne pH er andelen av ionisert syreform større enn uladet baseform. Fordelingen av ladet syreform og uladet baseform følger Henderson-Hasselbalch ligningen; (pH-pKa) = log base/syre. Ionisert syreform er mer stabil og har lengre holdbarhet (17, 18). Forholdet mellom syredel og uladet basedel er avhengig av anestesimidlets og vevets pH (19). Anestesiløsninger har ulik løselighetskonstant (pKa). Løselighetskonstanten er den verdi ved en gitt pH hvor anestesiløsningen inneholder like deler av syreform og baseform. Lav pKa konstant gir større andel av uladet basedel ved pH 7,4 (normalt vev) og resulterer i hurtigere tilslag av anestesimidlet såfremt tilstrekkelig antall uladede molekyler når virkestedet (19).
Evnen til å diffundere over nervecellen er også avhengig av anestesimidlets fettløselighet. Et anestesimiddel med høy fettløselighet gir en mer effektiv anestesivirkning ved lavere konsentrasjoner enn mindre fettløselige anestesimidler (19). Bindingstyrken av anestesimidlet til membranproteinene er også forskjellig. Sterkere binding gir lengre varighet av anestesi (19, 20) (Tabell 1).
Anestesimiddel |
pK a |
Lipid løselighet |
Varighet |
|---|---|---|---|
bupivacain (Marcain) |
81 |
30 |
lang |
lidocain (Xylocain) |
79 |
4 |
moderat |
mepivacain (Carbocain) |
76 |
1 |
moderat |
prilocain (Citanest) |
79 |
15 |
moderat |
articain (Septocain) |
78 |
15 |
moderat |
Anatomi
Mandibularnerven er den tredje grenen av trigeminusnerven og denne forsyner underkjevens tenner gjennom avgreininger fra nedre alveolarnerve (Figur 2). Den består av en stor sensorisk del og en mindre motorisk del. Mandibularnerven avgir flere nervegrener underveis i sitt forløp.
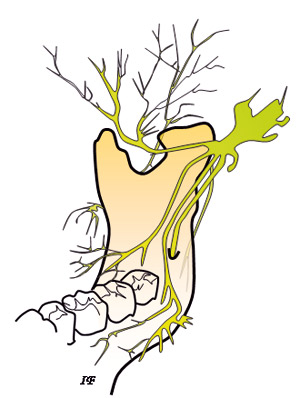
Figur 2. Forløp av trigeminusnerven og dens forgreininger sett fra lingualsiden.
Nervefibre kan være myeliniserte eller umyeliniserte med varierende tykkelse. Aδ-fibre er myeliniserte og formidler smerte fra tenner (nosiseptor). Aβ-fibre er myeliniserte og formidler berøring og proprioseptive stimuli (sensorisk reseptor som reagerer på endring i kroppens posisjon, balanse eller interne forhold). I tenner signaliserer Aβ-fibre også smerte (dentinsmerte). C-fibre har større diameter, er umyeliniserte og formidler smerte (polymodal nosiseptor) (21).
I en umyelinisert nervecelle, vil en impuls bevege seg langs aksonet ved depolarisering av cellemembranen. I en myelinisert nervecelle vil depolarisering kun skje i de Ranvierske knutepunktene (Figur 3A). Signaloverføring mellom nerveceller skjer via cellens synapser over en synapsespalte ved hjelp av vesikler som inneholder neurotransmittorsubstanser. Neurotransmittorsubstanser kan være forskjellige aminosyrer, monoaminer og andre som acetylcholin og histamin.
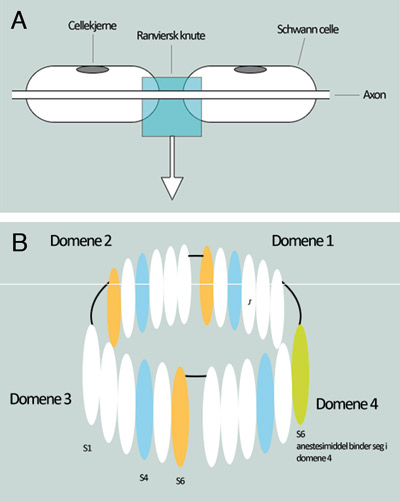
Figur 3. (A) Nerveakson med Ranviers knute hvor elektrisk depolarisering skjer (B) Utsnitt av en Na+-kanal i nervecellemembranen i Ranviers knute viser hvordan de transmembrane glukoproteiner er ordnet i 4 domener. Hvert domene er ordnet i seks transmembrane segmenter, S1-S6. Segment 4 (blå farge) påvirker åpning og segment 6 (oransje farge) lukking av Na+-kanalen. Anestesimiddelets syredel binder seg i domene 4, segment 6 (lysegrønn farge) (22).
Nervecellemembranen er bygget opp av transmembrane glukoproteiner med spesielle spenningsregulerte Na+-kanaler. Det finnes forskjellige typer Na+-kanaler, benevnt som tetrodoxin (TTX), PN3, NaN, Nav 1,8 og Nav 1,9 (22). Glukoproteinene i Na+-kanalene har stavform og er ordnet i tønnefasong (Figur 3B) (22).
Virkningsmekanismer
I hviletilstand er utsiden av cellemembranen positivt ladet på grunn av høy konsentrasjon av Na+-ioner. K+-ioner har høy konsentrasjon i cytoplasma, men cytoplasma er totalt sett negativt ladet på grunn av intracellulære molekyler med negativ ladning (23). Depolarisering skjer via S4 segmentet (Figur 3B) ved at Na+-ioner vandrer inn i cytoplasma. K+-ioner vandrer motsatt vei via egne spenningsregulerte K+-kanaler til utsiden av cellemembranen (24). Det elektriske spenningspotensialet over cellemembranen er mellom -60mV og -90mV (25).
Na+-kanalen har tre tilstander: hvile, aktivert og inaktivert. Na+-kanalen er stengt for ionegjennomstrømning i hvile og inaktiv tilstand (23). Stimulering av smertereseptorer fører til at et elektrisk aksjonspotensial settes opp og Na+-kanalene åpner seg i S4 segmentet. Dette medfører gjennomstrømning av Na+-ioner fra yttersiden av cellemembranen til cytoplasmasiden. Cellemembranens ytterside endrer ladning fra positiv til negativ. Na+-kanalen stenger spontant ved S6 segmentet (Figur 3B) og inaktivert tilstand opprettes etter depolarisering av cellemembranen. Innstrømming av Na+-ioner stopper da opp. En saktere utgående strøm av K+-ioner gjennom egne K+-spenningsporter repolariserer cellemembranen og gjenoppretter elektrisk nøytralitet (hvilestadiet) (26, 27). Hvilestadiets elektriske nøytralitet opprettholdes ved hjelp av det membranbudne energikrevende enzymet Na+-K+ ATPase som «pumper» ut tre Na+-ioner og absorberer to K+-ioner. I tillegg skjer det en viss selektert ionevandring over cellemembranen som ikke er spenningsavhengig (28).
Ved injeksjon av lokalanestesimiddel vil den nøytrale basedelen diffundere gjennom cellemembranens Na+-kanal og dissosieres i en ladet syre og nøytral basedel i den cytoplasmiske kanalregionen. Syredelen binder seg til reseptorer i segment 6 i domene 4 av Na+-kanalen (Figur 3B) og blokkerer kanalen for Na+-ioner. Anestesimiddelet har større potensial for binding i den inaktive fasen som følger etter aktivering og depolarisering av cellemembranen (29). Sterke stimuli medfører flere aksjonspotensialer, og nerven vil gå gjennom flere inaktive faser. Dette kan øke anestesimidlets muligheter for binding (25, 30).
Anestesimiddelet kan gradvis blokkere større deler av aksonet. Dette reduserer ledningshastigheten og tilslutt forårsakes total nerveblokkade (31, 32). Målinger av enkeltfibre i mandibularnerven indikerer at lokalanestesi blokkerer Aβ- og Aδ-fibre ved lavere konsentrasjon enn C-fibre (33). Dette kan forklare at leppeanestesi ikke er en sikker indikator for pulpaanestesi siden Aβ-fibre i hud formidler berøring og propriosepsjon, mens Aδ-fibre og C-fibre formidler smerte (34).
Det er nylig blitt lansert en alternativ modell til den klassiske elektriske spenningsmodellen beskrevet av Hodgkin-Huxley i 1956 (26). Forskere ved Niels Bohr Instituttet i Danmark har lansert en termodynamisk lydbølgeteori hvor de beskriver en spesiell lydbølge som de kaller soliton. Bølgen blir dannet i nervecellens lipidmembran og beveger seg i lipidmembranens overgangsfase mellom væske og fastform og beholder sin energi over lengre avstander. Solitonbølgen komprimerer (temperaturøkning) og ekspanderer (temperaturreduksjon) cellemembranen når den beveger seg langs nerveaksonet. En elektrisk spenningsforskjell oppstår mellom utsiden og innsiden av cellemembranen (35). Teorien kan forklare det forskning har observert at en pulsbevegelse endrer aksontykkelse i pulsretningen med en påfølgende temperaturøkning. Videre kan teorien forklare hvorfor kulde kan bidra til nedsatt impulsledning. Teorien er ny og det er behov for videre forskning (36).
Teorier om anestesifeilslag
Psykologiske faktorer
Frykt for tannbehandling påvirker virkningsgraden av lokalanestesi. Ubehag ved syn av nåler eller generell nålefobi, behandlingslyder, lukt eller negative forestillinger om tannbehandling, reduserer pasientens smerteterskel (37). Rotbehandling er ofte forbundet med frykt for smerte og påvirker grad av anestesitilslag (38). Pasienter med tidligere lokalanestesiproblemer har hyppigere feilslag (2).
Anatomiske årsaker
Ved injeksjon av anestesimiddel i det pterygomandibulære rom vil vevsmotstand kunne føre til avbøyning av nålespiss bort fra foramen mandibulare, med feilplassering av anestesiløsning som resultat (10). Det er foreslått å orientere nålens skråflate vekk fra foramen mandibulare for å motvirke nålens tendens til avbøyning (10).
Tilleggsinnervasjon fra afferente fibre i mylohyoidnerven er foreslått som mulig medvirkende årsak til feilslag (39). Likevel har ikke blokkering av denne nerven vist signifikant økning i pulpaanestesi (40). Det er også foreslått at afferente fibre fra lingual- og bukkalnerven, og at transversale cervikale fibre kan lede smerteimpulser fra tenner. Det er usikkert om manglende blokkering av disse forårsaker feilslag (41).
Den sentrale kjerneteori er i litteraturen ansett som en viktig begrunnelse for manglende ledningsanestesi. Teorien forklarer manglende pulsblokkering ved at mandibularnerven består av en samling nervefibre med ulik diameter, myeliniserte eller umyeliniserte, ordnet som en nervebunt. Myeliniserte fibre har varierende tykkelse og fibre med liten diameter har flere Ranvierske knuter per lengdeenhet enn fibre med større diameter (42). Diameteren til de umyeliniserte fibrene har også betydning for blokkering av nervepulsen (33). Anestesimiddelets evne til å redusere pulshastigheten i umyeliniserte fibre er lavere jo større diameter fibrene har (43). I tillegg tar det lengre tid å blokkere tykke enn tynne umyeliniserte fibre (42). Det er ikke funnet forskjell når det gjelder sensitivitet til anestesimiddel mellom små myeliniserte og umyeliniserte fibre (33).
Den sentrale kjerneteorien innebærer også at de ytterste fibre er mer tilgjengelig for anestesimiddelet. Anatomisk forsyner de ytterste fibrene molarene, mens de sentralt beliggende fibre forsyner underkjevens fortenner (42). Dette kan derfor ikke forklare problemer med anestesi i molarområdet.
Tachyphylaxis
Det er et kjent farmakologisk fenomen at en reseptoragonist (et legemiddel, eller annen substans, som binder seg til og stimulerer reseptorens aktivitet) kan føre til redusert virkning av påfølgende doser med samme medikament, kalt tachyphylaxis. Den inaktive formen av anestesimidlet, baseformen, blokkerer reseptormolekylet i S6 segmentet slik at den aktive formen, syredelen, ikke kan binde seg. Resultatet blir redusert respons til tross for økt dosering (44). Innvendinger mot denne teorien er at langtidsbruk av lokalanestesi hos kroniske smertepasienter ikke fører til tachyphylaxis (45, 46).
Lokal inflammasjon og pH i vev
Ved inflammasjon vil vevets pH gå ned, noe som fører til større andel av anestesimidlets syredel i vevet. Mengden av den uladede basedelen som kan diffundere over cellemembranen reduseres og gir færre basemolekyler som kan spaltes til blokkerende syremolekyler i den indre del av Na+-kanalen (18). Innvendinger mot at pH i vevet har betydning for anestesivirkning er at endring av surhetsgraden i vevet (lav pH) er liten. Studier har vist at inflammasjon i hud gir små endringer i pH. Funn viser reduksjon fra normal pH 7,4 til 5,8–7,2 (17). Videre er det indikasjoner på at inflammert vev har større bufferkapasitet enn uinflammert vev (17). Derfor vil redusert pH i inflammert vev ikke være stor nok til en ionefanging av anestesimidlet. Teorien kan forklare infiltrasjonteknikkens manglende effekt, men ikke ledningsanestesi hvor injeksjonsstedet er lengre unna inflammasjonsstedet (6).
Inflammasjon og lokal blodsirkulasjon
Inflammasjonsmediatorer gir vasodilatasjon i blodkar. Lokalanestesi uten tilsatt karkontraherende middel gir også vasodilatasjon. Ved injeksjon vil anestesimidlet bli absorbert via blodkar og gi lavere konsentrasjon av virksomt medikament (44). Tilsetting av karkontraherende middel reduserer denne effekten (44). Innvendinger mot at dette påvirker anestesieffekten er at vasodilatasjon skjer lokalt. Fenomenet kan forklare redusert anestesitilslag ved infiltrasjonsteknikk, men ikke for ledningsanestesi, hvor injeksjonsstedet er lengre unna inflammasjonsområdet.
Inflammasjon og smertereseptorer
Inflammasjonsmediatorer som blant annet bradykinin, serotonin og prostaglandin E2 (PGE2) har to hovedeffekter på smertereseptorer (nosiseptorer). De kan aktivere og sensitivisere nosiseptorer, samt endre deres strukturelle egenskaper (47). Bradykinin gir økt aktivitet i umyeliniserte C-fibre ved binding til bradykininreseptorene; BK1 eller BK2 (47).
PGE2 er et eksempel på en inflammasjonsmediator som reduserer nosiseptorens smerteterskel slik at lavterskelstimuli gir smerte. Smerte som følger hjerterytmen er et eksempel på lavterskelstimuli som PGE2 har oppgradert til smertestimuli (48). Perifer smertereseptorsensitivisering og aktivering synes å redusere effekten av lokalanestesi (48).
Inflammasjonsprosessen stimulerer også til økt produksjon av signalmolekyler som cytokiner, vekstfaktorer og peptider (49). Nervevekstfaktor (NGF) stimulerer de frie perifere nerveender til knoppskyting i inflammerte pulpa og periradikulære vev (50). De frie nerveender er polymodale reseptorer, dvs de kan reagere på mange forskjellige stimuli. Dette kan være kjemiske, mekaniske, termiske, men også stimuli som normalt ikke gir smerterespons (51). Knoppskyting av de frie perifere nerveender gir økt impulsspekter og økt aktivering av de stille (inaktive) nosiseptorer (51). Summasjon av stimuli som normalt ikke utløser smertepulser (allodyni), øker aktiviteten og flere smertepulser når det sentrale nervesystemet (51). Det er også vist at ved inflammasjon kan en nervefiber utvide sitt fysiske reseptorområde og motta stimuli fra et større område (51, 52).
Det komplekse samspillet mellom inflammasjonsmediatorer og nerver resulterer i at Na+-kanaler får endret sammensetning, fordeling og/eller aktivitet (47). Tetrodotoxin (TTX) type Na+-kanaler finnes normalt i pulpale nervefibre (53). Disse Na+-kanalene er kjennetegnet ved å være 4 ganger mindre sensitiv for lidokain ved inflammasjon (54) og ved eksponering for PGE2 dobler de sin aktivitet (47). Diffusjon av anestesi over nervecellemembranen kan da bli ufullstendig (42). Dette kan forklare hvorfor lokalanestesi ikke virker tilfredsstillende ved inflammasjon (6).
Inflammasjon og sentral sensitivisering
Lokal inflammasjon kan gi endringer mer sentralt i nervesystemet (55). Fra inflammert pulpa og periradikulært vev sendes store mengder smerteimpulser til trigeminuskjernene i nervestammen. Dette kan føre til aktivering og sensitivisering av andre ordens neuroner, også kalt «wide-dynamic-range neuroner» (WDR-neuroner). En sentral aktivering («wind-up») kan oppstå, det vil si at terskelnivå reduseres og de sentrale smertereseptorene oppfatter et bredere spekter av stimuli (56). Dette er antatt å skyldes endret syntese av peptider og endring i gentranskripsjonsfaktorer som c-Fos (57). Dette transkripsjonsproteinet stimulerer dannelse av proteiner som fører til oversensibilitet (57). Til tross for at lokalanestesi blokkerer mange perifere nervefibre, vil den sentrale overreaksjonen kunne føre til at pasienten fortsatt oppfatter smerte (58).
Strategier for bedret ledningsanestesi
Pasient-behandler relasjon
Ved å etablere et positivt og trygt pasientforhold i rolige omgivelser, hvor en unngår angstutløsende stimuli, øker dette pasientens smerteterskelnivå som kan påvirke anestesieffekten (59, 60).
Identifisering av pasienter med tidligere anestesiproblem, angst og fobier samt pulpadiagnose, gir viktig informasjon om mulige anestesiutfordringer (38, 61). For pasienter med velutviklet angst/fobier kan kognitiv adferdsbasert behandling eller premedisinering påvirke tilslaget av anestesi (61).
Premedisinering
Premedisinering med ikke-steroide antiinflammatoriske midler (NSAID), for eksempel ibuprofen eller steroider, er foreslått å bedre anestesiens virkning gjennom redusert PGE2 aktivering av TTX Na+-kanaler (62).
Angstdempende medikamenter som benzodiazepiner, for eksempel flunitrazepam (Flunipam®, Actavis), kan brukes ved uttalt angst for tannbehandling. Denne medikamentgruppen demper ikke smerte. Bruk av overflateanestesi reduserer ikke smerte ved ledningsanestesi (63, 64), men har vist effekt ved infiltrasjonsanestesi i overkjeven om virkningstiden er minst 5 minutter (64).
Anestesimiddel og tilsettinger
Tilsetting av adrenalin gir vasokonstriksjon som reduserer absorpsjon av anestesimidlet. Større mengde blir da værende i vevet. Ytterligere økning av adrenalin (ut over 1:80000) har ikke gitt signifikant bedre effekt (65, 66). En studie har derimot vist bedre tilslag ved økt konsentrasjon av karkontraherende middel på tenner uten pulpitt (67). Det er ingen studier som er utført på tenner som har irreversibel pulpitt.
Anestesimidler med lav pKa konstant gir flere uladede basemolekyler som kan diffundere over nervecellemembranen og øke midlets blokkeringsevne (18). Tre prosent mepivacain har lav pKa konstant og har i en klinisk studie vist samme effekt som 2 % lidokain med tilsatt adrenalin (68). Forskjellen mellom aktuelle anestesimidlers pKa verdier er imidlertid små (19), noe som gjør det vanskelig å trekke konklusjoner fra sammenligningsstudier. Derimot kan anestesimolekylers fettløselighet påvirke tilslagsevne (19). Mepivacain og artikain har høyere fettløselighet enn lidokain (18). Felypressin (brukt i Citanest dental Octapressin®) er et annet karkontraherende middel, men dette gir kontraksjon på venesiden og dermed ikke ischemi.
Anestesimiddel tilsatt natriumbikarbonat (NaHCO3) gjør vevet og anestesimiddelet mer basisk. Økning av anestesimidlets pH, fører til at flere uladede basemolekyler diffunderer over cellemembranen (69). I tillegg vil natriumbikarbonat øke karbondioksidnivået omkring nerven. Karbondioksid diffunderer over cellemembranen og reduserer pH i nervecellemembranens cytoplasmadel, noe som øker den virksomme konsentrasjonen av syredelen i anestesimiddelet som binder seg til S6 området (70). Karbondioksid kan også blokkere nerven direkte ved reduksjon av ledningshastigheten til aksjonspotensialet (71). Men så langt har studier ikke kunnet påvise forskjell mellom anestesi med eller uten natriumbikarbonat (72).
Injeksjonshastighet
Sakte injeksjon ved ledningsanestesi (60 s) er rapportert å bedre pulpaanestesi og gi mindre selvrapportert ubehag enn hurtig injeksjon (15 s) (73). Derimot er det ved gjentatt injeksjon i samme område rapportert bedre spredning og effekt av anestesimidlet ved hurtig injeksjon og bruk av større trykk (6). Uavhengig av injeksjonshastighet må en avvente behandling til full anestesieffekt er oppnådd.
Kanyleretning
Ved å vende nålens skråflate vekk fra foramen mandibulare unngår en at nålen bøyer seg mot midtlinjen, med det resultat at anestesimidlet kommer i nærmere kontakt med nerven (74). Den roterende teknikken som anbefales ved bruk av the Wand®-systemet (CompuDent, Milestone Scientific Inc, Deerfield, IL, USA) har derimot ikke vist seg å være bedre enn tradisjonell injeksjonsteknikk ved irreversibel pulpitt. Suksessraten for begge er lav (henholdsvis 50 % vs 56 %) og ikke tilfredsstillende (75).
Tilleggsinjeksjoner
Ved å øke dosering av anestesimiddel kan en lengre del av mandibulanerven bli eksponert for anestesi og dermed øker sannsynligheten for god ledningsblokade (33). I tillegg øker sjansen for at afferente sensoriske fibre som følger mylohyoidnerven blokkeres (39). Større dose kan muligens også gi økt blokade av TTX Na+-kanaler, ved at basedelen av anestesimiddelet lettere kan diffundere gjennom de anestesisensitive Na+-kanaler.
Bukkal infiltrasjonsanestesi med artikain er rapportert å gi bedre anestesivirkning i første molar sammenlignet med lidokain (88 % vs 71 %) ved uinflammert pulpa (76). Ved irreversibel pulpitt ga supplerende infiltrasjon lavere suksessrate (64,5 % vs 38,7 %), men likevel bedre effekt av artikain (77). Artikain kan derfor anbefales ved denne type tilleggsanestesi.
Lingual infiltrasjon i apikalområdet på en symptomatisk tann er også hevdet å gi bedre anestesivirkning. Ved å injisere i apikalområdet, enten lingualt for problemtann eller ved den distalt beliggende tann (19), kan dette gi pulpaanestesi. Eventuelle sensoriske fibre fra mylohyoidnerven vil ved denne injeksjonsformen blokkeres (78). En annen studie viser derimot ingen tilleggseffekt av lingual injeksjon (79).
Gow-Gates teknikk brukt som tilleggsinjeksjon, hvor en går høyt opp i det pterygomandibulære rom (Figur 4), har vist høy suksessrate (97 % i et material på 4275 pasienter) (80).
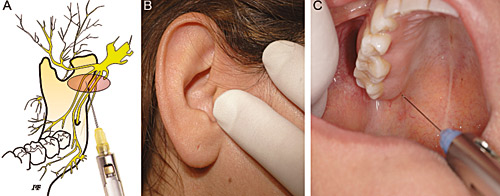
Figur 4. (A) Skjematisk tegning av injeksjonssted for Gow-Gates teknikk. (B) Klinisk bilde av pasient med maksimal gapeevne. Pil viser hvor nålespissen skal plasseres. Tommelfinger plasseres nær injeksjonssted og midtfinger på samme hånd plasseres med press ekstraoralt på integralknuten. Nålen settes distalt og kranialt for maksillens tuber i retning midtfinger som presser mot integralknuten. Nålen stikkes inn til den treffer bein på lateralsiden av kondylen, under feste for pterygoid muskelen. Anestesimidlet deponeres sakte. Det er få postoperative smerter siden anestesinålen går igjennom vev med lite eller ingen muskulatur, men trismus kan oppstå. (C) Midtfinger viser plassering på integralknuten.
Intraligamentær anestesi har vist seg å gi god effekt (75 %) og den øker ved reinjisering (95 %) (68). Injeksjon kan utføres med konvensjonell teknikk med tynne nåler eller med en datastyrt anestesipumpe (f. eks the Wand®, Figur 5). Smerteopplevelsen ved bruk av the Wand-systemet er rapportert å være mindre enn ved konvensjonell teknikk, men tilslagstiden er den samme (81). Fordelen er at systemet injiserer anestesimidlet inn i periodontal ligamentet med samme hastighet og jevnt trykk. Anestesivirkningen er vist å vare lenger ved denne injeksjonsformen enn ved intraossøs anestesi, men tiden for tilslag er lengre (82, 83).
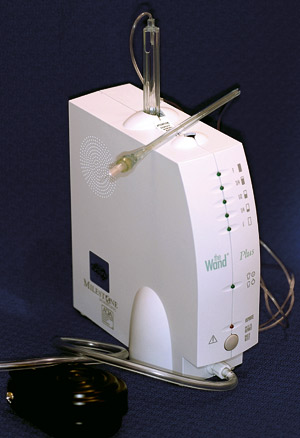
Figur 5. The Wand® er et eksempel på datastyrt intraligamentært injeksjonssystem. Den kan programmeres til å injisere med ulik hastighet, tid og trykk. Den styres med pedal og bruker konvensjonelle karpyler og nåler. Sprøyteholderen er tynn, kan bøyes og holdes med et pennegrep som gjør håndteringen lettere
Intraossøs anestesi har fordel fremfor intraligamentær injeksjon ved at anestesimiddel kommer direkte inn i margbein i nær kontakt med tannens apeks, i motsetning til intraligamentær injeksjon hvor kortikalt bein må passeres.
Stabident® (Fairfax dental Inc., Miami, FL, USA) og X-tip® systemet (X-tip Technologies, Lakewood, NJ, USA) er to intraossøse injeksjonssystemer som er undersøkt klinisk (Figur 6). Systemene krever et saktegående vinkelstykke og et spesialbor som perforer det kortikale beinet i nivå med eller litt koronalt for tannens apeks. Anestesi blir enten injisert direkte gjennom beinperforasjonen (Stabident) eller gjennom «guide-tippen» som står igjen etter boring (X-tip systemet). Infiltrasjonsanestesi settes bukkalt for tannen før perforasjon. Perforasjonsstedet bør ligge distalt for 1. molar eller mesialt for 2. molar hvor det er spongiøst bein som øker anestesiopptaket (84).
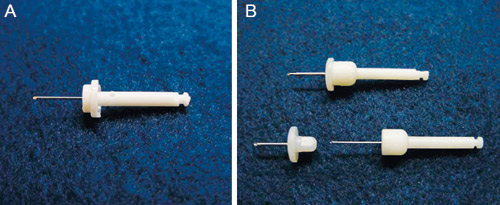
Figur 6. (A) Stabident® perforasjonsbor med skråformet spiss som brukes ved hjelp av et saktegående vinkelstykke. (B) X-tip® systemet (X-tip) består av en X-tip (øverst) som kan deles i 2 deler; boredrillen (nederst til høyre) og «guiden» (nederst til venstre).
Intraossøs injeksjon har en suksessrate på 86–91 %, og tilslaget skjer omgående og gir god varighet (85, 86). Det er rapportert moderat postoperativt ubehag i 2–15 % av tilfellene. Dette innbefatter hevelse og/eller eksudat fra perforasjonsstedet som kan skyldes overoppheting av bein i forbindelse med beinperforasjonen (87).
Intrapulpal anestesi er indisert når andre injeksjonsteknikker ikke gir tilfredsstillende smerteblokkering. Metoden har umiddelbart tilslag og ingen ekstra sprøyte eller nåler er nødvendig, men det må være etablert adkomst til pulpa. Anestesien må gis med vevsmotstand for å oppnå pulpaischemi som reduserer impulsledning i de intrapulpale nervefibrene (88). Direkte injeksjon i en symptomatisk pulpa er moderat til svært smertefullt, men smerteopplevelsen er kortvarig. (89). Teknikken har også den ulempe at varigheten av pulpaanestesi er kort (15–20 minutter).
Konklusjon
Anestesi er en viktig del av all tannbehandling. Tilfredsstillende virkning av ledningsanestesi er viktig i behandlingssituasjoner som kan være svært smertefulle. Anestesi i leppen er ikke alltid ensbetydende med fullgod pulpaanestesi. Elektrisk pulpatester eller kuldetest gir bedre informasjon om tilstrekkelig anestesi i molarområdet. Kjennskap til farmakologi, anatomi, anestesimidlers virkningsmekanismer og årsaker til feilslag er viktig kunnskap. Det er også viktig å beherske flere injeksjonsteknikker og kunne benytte disse på rett måte og til rett tid med tanke på å oppnå pulpaanestesi, spesielt ved irreversibel pulpitt.
English summary
Iden O, Bårdsen A, Fristad I
Local anaesthetic failures – mechanisms, causes and strategies
360–8.
Anaesthetic solutions are used for pain control during dental procedures. Nevertheless, studies have shown that incomplete anaesthesia is relatively common, especially following inferior alveolar nerve block procedures. Inflammatory changes in the pulp have been shown to negatively affect the anaesthetic success due to changes in neural receptor expression. Present knowledge concerning the action of different anaesthetic solutions and neurochemical changes during inflammation has increased our understanding of problems connected to anaesthetic failures. Different techniques, either alone or in combination, may secure proper pain control during dental procedures. This paper gives an overview of the known basic anaesthetic mechanism, discusses causes and strategies when local anaesthetic solutions give insufficient pain control.
Hovedbudskap | |
|---|---|
• |
Manglende anestesieffekt er relativt vanlig, spesielt ved ledningsanestesi i underkjevens molarområde |
• |
Leppeanestesi er ingen garanti for fullgod molaranestesi, men manglende leppeanestesi vil være ensbetydende med dårlig molaranestesi |
• |
Flere teorier forklarer manglende anestesieffekt |
• |
Inflammatoriske forandringer er kjent å påvirke anestesieffekten negativt |
• |
Ulike teknikker, enten alene eller i kombinasjon, kan være til hjelp for å oppnå god anestesivirkning. |
Referanser
1. Reader A, Nusstein J. Local anesthesia for endodontic pain. Endodontic Topics. 2002; 3: 14–30.
2. Weinstein P, Milgrom P, Kaufman E, Fiset L, Ramsay D. Patient perceptions of failure to achieve optimal local anesthesia. Gen Dent. 1985; 33: 218–20.
3. Kaufman E, Weinstein P, Milgrom P. Difficulties in achieving local anesthesia. J Am Dent Assoc. 1984; 108: 205–8.
4. Wallace JA, Michanowicz AE, Mundell RD, Wilson EG. A pilot study of the clinical problem of regionally anesthetizing the pulp of an acutely inflamed mandibular molar. Oral Surg Oral Med Oral Pathol. 1985; 59: 517–21.
5. Dreven LJ, Reader A, Beck M, Meyers WJ, Weaver J. An evaluation of an electric pulp tester as a measure of analgesia in human vital teeth. J Endod. 1987; 13: 233–8.
6. Hargreaves KM, Keiser K. Local anestethic failure in endodontics: Mechanism and management. Endodontic Topics. 2002; 1: 26–39.
7. Vreeland DL, Reader A, Beck M, Meyers W, Weaver J. An evaluation of volumes and concentrations of lidocaine in human inferior alveolar nerve block. J Endod. 1989; 15: 6–12.
8. Claffey E, Reader A, Nusstein J, Beck M, Weaver J. Anesthetic efficacy of articaine for inferior alveolar nerve blocks in patients with irreversible pulpitis. J Endod. 2004; 30: 568–71.
9. Nusstein J, Reader A, Beck FM. Anesthetic efficacy of different volumes of lidocaine with epinephrine for inferior alveolar nerve blocks. Gen Dent. 2002; 50: 372–5.
10. Hannan L, Reader A, Nist R, Beck M, Meyers WJ. The use of ultrasound for guiding needle placement for inferior alveolar nerve blocks. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1999; 87: 658–65.
11. Yagriela JA, Dowd FJ, Neidle EA. Pharmacology and Therapeutics for Dentistry
4th edition ed. Yagriela JA, Dowd FJ, Neidle EA, editors. St. Louis: Mosby; 2004. p. 251–70.
12. Dullenkopf A, Borgeat A. [Local anesthetics. Differences and similarities in the »-cains«]. Anaesthesist. 2003; 52: 329–40.
13. Haas DA. An update on local anesthetics in dentistry. J Can Dent Assoc. 2002; 68: 546–51.
14. Felleskatalogen A/S. Felleskatalogen 51 ed. Oslo: Fagbokforlaget; 2009.
15. Haas DA, Lennon D. A 21 year retrospective study of reports of paresthesia following local anesthetic administration. J Can Dent Assoc. 1995; , 61: 319–30.
16. Pogrel MA, Thamby S. Permanent nerve involvement resulting from inferior alveolar nerve blocks. J Am Dent Assoc. 2000; , 131: 901–7.
17. Punnia-Moorthy A. Buffering capacity of normal and inflamed tissues following the injection of local anaesthetic solutions. Br J Anaesth. 1988; 61: 154–9.
18. Malamed SF. Handbook of Local Anesthesia. 3rd ed. St Louis: Mosby; 1990. p.332.
19. Malamed SF. Management of Pain and Anxiety. In: Cohen S, Burns R, editors. Pathways of the pulp.7th ed. St. Louis: Mosby; 1998. p. 657–73.
20. Petersen JK. Artikain – Et nyt lokalanalgeticum i Danmark. Tandlaegebladet. 2001; 105: 324–6.
21. Reader A, Foreman DW. An ultrastructural quantitative investigation of human intradental innervation. J Endod. 1981; 7: 493–9.
22. Catterall WA. From ionic currents to molecular mechanisms: the structure and function of voltage-gated sodium channels. Neuron. 2000; 26: 13–25.
23. Catterall WA. Molecular properties of voltage-sensitive sodium channels. Annu Rev Biochem. 1986; 55: 953–85.
24. Stuhmer W, Ruppersberg JP, Schroter KH, Sakmann B, Stocker M, Giese KP, et al. Molecular basis of functional diversity of voltage-gated potassium channels in mammalian brain. EMBO J. 1989; 8: 3235–44.
25. Ragsdale DS, Scheuer T, Catterall WA. Frequency and voltage-dependent inhibition of type IIA Na+ channels, expressed in a mammalian cell line, by local anesthetic, antiarrhythmic, and anticonvulsant drugs. Mol Pharmacol. 1991; 40: 756–65.
26. Hodgkin AL, Huxley AF. Movement of sodium and potassium ions during nervous activity. Cold Spring Harb Symp Quant Biol. 1952; 17: 43–52.
27. Kellenberger S, Scheuer T, Catterall WA. Movement of the Na+ channel inactivation gate during inactivation. J Biol Chem. 1996; 271: 30971–9.
28. Butterworth JFt, Strichartz GR. Molecular mechanisms of local anesthesia: a review. Anesthesiology. 1990; 72: 711–34.
29. Ragsdale DS, McPhee JC, Scheuer T, Catterall WA. Molecular determinants of state-dependent block of Na+ channels by local anesthetics. Science. 1994; 265: 1724–8.
30. Grant AO, Dietz MA, Gilliam FR, Starmer CF. Blockade of cardiac sodium channels by lidocaine. Single-channel analysis. Circ Res. 1989; 65: 1247–62.
31. Fink BR, Cairns AM. Differential slowing and block of conduction by lidocaine in individual afferent myelinated and unmyelinated axons. Anesthesiology. 1984; 60: 111–20.
32. Raymond SA, Steffensen SC, Gugino LD, Strichartz GR. The role of length of nerve exposed to local anesthetics in impulse blocking action. Anesth Analg. 1989; 68: 563–70.
33. Franz DN, Perry RS. Mechanisms for differential block among single myelinated and non-myelinated axons by procaine. J Physiol. 1974; 236: 193–210.
34. Thalhammer JG, Vladimirova M, Bershadsky B, Strichartz GR. Neurologic evaluation of the rat during sciatic nerve block with lidocaine. Anesthesiology. 1995; 82: 1013–25.
35. Heimburg T, Jackson AD. On soliton propagation in biomembranes and nerves. Proc Natl Acad Sci U S A. 2005; 102: 9790–5.
36. Heimburg T, Jackson AD. The thermodynamics of general anesthesia. Biophys J. 2007; 92: 3159–65.
37. Dworkin SF. Anxiety and performance in the dental environment: An experimental investigation. J Am Soc Psychosom Dent Med. 1967; 14: 88–103.
38. Wong M, Lytle WR. A comparison of anxiety levels associated with root canal therapy and oral surgery treatment. J Endod. 1991; 17: 461–5.
39. Wilson S, Johns P, Fuller PM. The inferior alveolar and mylohyoid nerves: an anatomic study and relationship to local anesthesia of the anterior mandibular teeth. J Am Dent Assoc. 1984; 108: 350–2.
40. Clark S, Reader A, Beck M, Meyers WJ. Anesthetic efficacy of the mylohyoid nerve block and combination inferior alveolar nerve block/mylohyoid nerve block. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1999; 87: 557–63.
41. Roda RS, Blanton PL. The anatomy of local anesthesia. Quintessence Int. 1994; 25: 27–38.
42. Strichartz G. Molecular mechanisms of nerve block by local anesthetics. Anesthesiology. 1976; 45: 421–41.
43. Jaffe RA, Rowe MA. Differential nerve block. Direct measurements on individual myelinated and unmyelinated dorsal root axons. Anesthesiology. 1996; 84: 1455–64.
44. Vandermeulen E. [Pain perception, mechanisms of action of local anesthetics and possible causes of failure]. Rev Belge Med Dent. 2000; 55: 29–40.
45. Ang ET, Lassale B, Goldfarb G. Continuous axillary brachial plexus block–--a clinical and anatomical study. Anesth Analg. 1984; 63: 680–4.
46. Dahm P, Nitescu P, Appelgren L, Curelaru I. Efficacy and technical complications of long-term continuous intraspinal infusions of opioid and/or bupivacaine in refractory nonmalignant pain: a comparison between the epidural and the intrathecal approach with externalized or implanted catheters and infusion pumps. Clin J Pain. 1998; 14: 4–16.
47. Gold MS, Reichling DB, Shuster MJ, Levine JD. Hyperalgesic agents increase a tetrodotoxin-resistant Na+ current in nociceptors. Proc Natl Acad Sci U S A. 1996; 93: 1108–12.
48. Rood JP, Pateromichelakis S. Inflammation and peripheral nerve sensitisation. Br J Oral Surg. 1981; 19: 67–72.
49. Olgart L, Kostouros GD, Edwall L. Local actions of acetylcholine on vasomotor regulation in rat incisor pulp. Acta Physiol Scand. 1996; 158: 311–6.
50. Byers MR, Schatteman GC, Bothwell M. Multiple functions for NGF receptor in developing, aging and injured rat teeth are suggested by epithelial, mesenchymal and neural immunoreactivity. Development. 1990; 109: 461–71.
51. Byers MR, Närhi MV. Dental injury models: experimental tools for understanding neuroinflammatory interactions and polymodal nociceptor functions. Crit Rev Oral Biol Med. 1999; 10: 4–39.
52. Närhi M, Yamamoto H, Ngassapa D, Hirvonen T. The neurophysiological basis and the role of inflammatory reactions in dentine hypersensitivity. Arch Oral Biol. 1994; 39: 23S–30S.
53. Arbuckle JB, Docherty RJ. Expression of tetrodotoxin-resistant sodium channels in capsaicin-sensitive dorsal root ganglion neurons of adult rats. Neurosci Lett. 1995; 185: 70–3.
54. Roy ML, Narahashi T. Differential properties of tetrodotoxin-sensitive and tetrodotoxin-resistant sodium channels in rat dorsal root ganglion neurons. J Neurosci. 1992; 12: 2104–11.
55. Cervero F. Spinal cord mechanisms of hyperalgesia and allodynia: role of peripheral input from nociceptors. Prog Brain Res. 1996; 113: 413–22.
56. Woolf CJ, Doubell TP. The pathophysiology of chronic pain--increased sensitivity to low threshold A beta-fibre inputs. Curr Opin Neurobiol. 1994; 4: 525–34.
57. Hunt SP, Pini A, Evan G. Induction of c-fos-like protein in spinal cord neurons following sensory stimulation. Nature. 1987; 328: 632–4.
58. Lander J, Hodgins M, Nazarali S, McTavish J, Ouellette J, Friesen E. Determinants of success and failure of EMLA. Pain. 1996; 64: 89–97.
59. Walton RE, Torabinejad M. Managing local anesthesia problems in the endodontic patient. J Am Dent Assoc. 1992; 123: 97–102.
60. Johren P, Jackowski J, Gangler P, Sartory G, Thom A. Fear reduction in patients with dental treatment phobia. Br J Oral Maxillofac Surg. 2000; 38: 612–6.
61. Hargreaves KM, Keiser K. Development of new pain management strategies. J Dent Educ. 2002; 66: 113–21.
62. Modaresi J, Dianat O, Mozayeni MA. The efficacy comparison of ibuprofen, acetaminophen-codeine, and placebo premedication therapy on the depth of anesthesia during treatment of inflamed teeth. Oral Surg Oral Med Oral Path Oral Radiol Endod 2006; 102: 399–403.
63. Nusstein JM, Beck M. Effectiveness of 20 % benzocaine as a topical anesthetic for intraoral injections. Anesth Prog. 2003; 50: 159–63.
64. Meechan JG. Effective topical anesthetic agents and techniques. Dent Clin North Am. 2002; 46: 759–66.
65. Dagher FB, Yared GM, Machtou P. An evaluation of 2 % lidocaine with different concentrations of epinephrine for inferior alveolar nerve block. J Endod. 1997; 23: 178–80.
66. Buckley JA, Ciancio SG, McMullen JA. Efficacy of epinephrine concentration in local anesthesia during periodontal surgery. J Periodontol. 1984; 55: 653–7.
67. Knoll-Kohler E, Fortsch G. Pulpal anesthesia dependent on epinephrine dose in 2 % lidocaine. A randomized controlled double-blind crossover study. Oral Surg Oral Med Oral Pathol. 1992; 73: 537–40.
68. Cohen HP, Cha BY, Spångberg LS. Endodontic anesthesia in mandibular molars: a clinical study. J Endod. 1993; 19: 370–3.
69. Gosteli P, Van Gessel E, Gamulin Z. Effects of pH adjustment and carbonation of lidocaine during epidural anesthesia for foot or ankle surgery. Anesth Analg. 1995; 81: 104–9.
70. Catchlove RF. Potentiation of two different local anaesthetics by carbon dioxide. Br J Anaesth. 1973; 45: 471–4.
71. Bokesch PM, Raymond SA, Strichartz GR. Dependence of lidocaine potency on pH and PCO2. Anesth Analg. 1987; 66: 9–17.
72. Rood JP. Some anatomical and physiological causes of failure to achieve mandibular analgesia. Br J Oral Surg. 1977; 15: 75–82.
73. Kanaa MD, Meechan JG, Corbett IP, Whitworth JM. Speed of injection influences efficacy of inferior alveolar nerve blocks: a double-blind randomized controlled trial in volunteers. J Endod. 2006; 32: 919–23.
74. Davidson MJ. Bevel-oriented mandibular injections: needle deflection can be beneficial. Gen Dent. 1989; 37: 410–2.
75. Kennedy S, Reader A, Nusstein J, Beck M, Weaver J. The significance of needle deflection in success of the inferior alveolar nerve block in patients with irreversible pulpitis. J Endod. 2003; 29: 630–3.
76. Haase A, Reader A, Nusstein J, Beck M, Drum M. Comparing anesthetic efficacy of articaine versus lidocaine as a supplemental buccal infiltration of the mandibular first molar after an inferior alveolar nerve block. J Am Dent Assoc. 2008; 139: 1228–35.77. Kanaa MD, Whitworth JM, Corbett IP, Meechan JG. Articaine and lidocaine mandibular buccal infiltration anesthesia: a prospective randomized double-blind cross-over study. J Endod. 2006; 32: 296–8.
78. Stein P, Brueckner J, Milliner M. Sensory innervation of mandibular teeth by the nerve to the mylohyoid: implications in local anesthesia. Clin Anat. 2007; 20: 591–5.
79. Foster W, Drum M, Reader A, Beck M. Anesthetic efficacy of buccal and lingual infiltrations of lidocaine following an inferior alveolar nerve block in mandibular posterior teeth. Anesth Prog. 2007; 54: 163–9.
80. Malamed SF. The Gow-Gates mandibular block. Evaluation after 4.275 cases. Oral Surg Oral Med Oral Pathol. 1981; 51: 463–7.
81. Palm AM, Kirkegaard U, Poulsen S. The wand versus traditional injection for mandibular nerve block in children and adolescents: perceived pain and time of onset. Pediatr Dent. 2004; 26: 481–4.
82. Nusstein J, Wood M, Reader A, Beck M, Weaver J. Comparison of the degree of pulpal anesthesia achieved with the intraosseous injection and infiltration injection using 2 % lidocaine with 1: 100,000 epinephrine. Gen Dent. 2005; 53: 50–3.
83. Dower JS, Jr., Barniv ZM. Periodontal ligament injection: review and recommended technique. Gen Dent. 2004; 52: 537–42.
84. Gallatin E, Reader A, Nist R, Beck M. Pain reduction in untreated irreversible pulpitis using an intraosseous injection of Depo-Medrol. J Endod. 2000; 26: 633–8.
85. Bigby J, Reader A, Nusstein J, Beck M, Weaver J. Articaine for supplemental intraosseous anesthesia in patients with irreversible pulpitis. J Endod. 2006; 32: 1044–7.
86. Nusstein J, Kennedy S, Reader A, Beck M, Weaver J. Anesthetic efficacy of the supplemental X-tip intraosseous injection in patients with irreversible pulpitis. J Endod. 2003; 29: 724–8.
87. Gallatin J, Nusstein J, Reader A, Beck M, Weaver J. A comparison of injection pain and postoperative pain of two intraosseous anesthetic techniques. Anesth Prog. 2003; 50: 111–20.
88. VanGheluwe J, Walton R. Intrapulpal injection: factors related to effectiveness. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1997; 83: 38–40.
89. Nusstein J, Reader A, Nist R, Beck M, Meyers WJ. Anesthetic efficacy of the supplemental intraosseous injection of 2 % lidocaine with 1: 100.000 epinephrine in irreversible pulpitis. J Endod. 1998; 24: 487–91.
Adresse: Ole Iden, Institutt for klinisk odontologi – endodonti, Universitetet i Bergen, Årstadveien 17, 5009 Bergen. E-post: ole.iden@odont.uib.no
Artikkelen har gjennomgått ekstern faglig vurdering.