Betydning av spesifikk adhesjon for kolonisering av orale mikroorganismer
Årsmøtet til International Association for Dental Research (IADR) i 2010 fant sted i Barcelona, Spania 14.-17. juli med cirka 6 500 påmeldte deltagere. Det var registrert knapt 4 800 forskningsrapporter innbefattet symposier, og som vanlig ved disse møtene ble det avholdt en stor dentalutstilling. Flere sesjoner omhandlet temaet orale biofilmer.
Undertegnende var medforfatter på to orale forskningspresentasjoner om eksperimentelle orale biofilmer dannet in situ eller in vivo. Bakgrunnen for den ene rapporten var at biofilmstudier i løpet av det siste tiåret har vist at ikke-orale så vel som orale bakterier kan kolonisere multispecies orale biofilmer in vitro så sant bakteriene har egnete vekstvilkår. Både ikke-orale, potensielt probiotiske bakterier og subgingivale, potensielt periodontopatogene bakterier hadde sterk adhesjon til pellikelen i tidlig biofilmdannelse (etter 15–20 minutter). Disse funnene stiller spørsmål ved den allment aksepterte oppfatningen at oral mikrobiell kolonisering er en høyst selektiv prosess der primære plakkdannere har gjenkjennelsessystemer på overflaten (adhesiner) som binder spesifikt til reseptorer på pellikelen og at sekundære kolonisatorer er helt avhengige av koadhesjon til pionérbakteriene via adhesin-reseptor interaksjoner. Denne oppfatningen stammer i vesentlig grad fra forsøk med ikke-voksende bakterier blandet i suspensjon og har derfor liten relevans til den kliniske situasjonen.
Målet med vår undersøkelse var å teste in vivo-hypotesen at ikke-orale mikroorganismer vil feste seg til orale overflater men ikke kolonisere permanent fordi de elimineres gradvis på grunn av konkurranse om næringsstoffer med den etablerte orale mikrobiota.
Materiale og metode
For å teste hypotesen vår, utførte vi munnskylleforsøk med to ikke-orale mikroorganismer og undersøkte deres evne til å feste seg til orale overflater. Streptococcus thermophilus (Sthe) og Saccharomyces cerevisiae (Scer) ble brukt som testorganismer. Disse er begge harmløse mikroorganismer; Sthe brukes i meieriprodukter og Scer er en vanlig gjærsopp som brukes i bakverk og ved brygging.
Fem forsøkspersoner deltok. Tennene deres ble først rengjort grundig av en tannpleier. Deretter ventet de i 30 minutter for at det skulle dannes en pellikel (adsorberte proteiner og glykoproteiner fra saliva) på tannoverflatene. Hver forsøksperson skyllet så munnen i to minutter med 10 ml av en standardisert suspensjon (ca. 107 celler/ml) som inneholdt enten Sthe eller Scer i fysiologisk saltvann. Munnskyllingen ble etterfulgt umiddelbart av tre ett minutts munnskyllinger med 10 ml fysiologisk saltvann for å fjerne ikke-festete mikroorganismer. Etter lufttørking ble det tatt avtrykk av overkjeven 5, 30, 60 og 90 minutter etter munnskyllingen med mikroorganismene. Avtrykkene ble tatt med individuelle avtrykksskjeer som på forhånd var fylt med vekstagar som vist for Sthe i Figur 1. Avtrykkene ble inkubert i 72 timer.
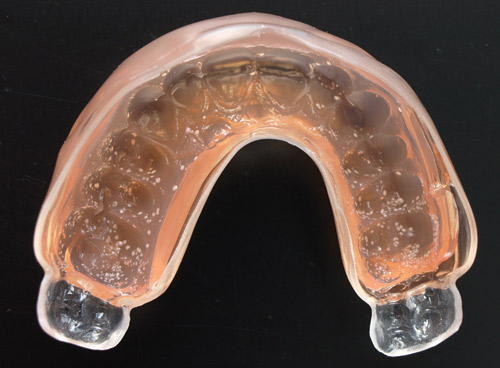
Figur 1. Streptococcus thermophilus kolonier på vekstagar i individuell avtrykksskje etter 72 timers inkubering. Avtrykket ble tatt 30 minutter etter munnskylling med bakteriesuspensjon. Foto: Martin Gander, Universitetet i Zürich.
Antallet kolonier av Scer ble telt direkte på agaravtrykkene fordi vekstmediet for Scer var selektivt. Vekstmediet for Sthe var derimot ikke selektivt. Etter inkubering ble derfor hvert avtrykk i agar fylt med fysiologisk saltvann, alle koloniene ble fjernet og resuspendert i fysiologisk saltvann. Deretter ble disse suspensjonene analysert ved fluorescerende in situ hybridisering. Ved denne teknikken brukes fluorescerende DNA-prober som binder spesifikt til 16S rRNA-sekvenser hos bakteriene som illustrert i Figur 2. Antallet Sther ble beregnet som prosentvis andel av det totale bakterietallet.
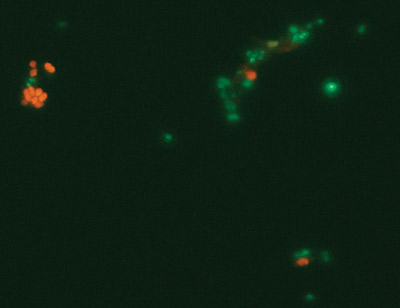
Figur 2. Bakterier farget ved fluorescerende in situ hybridisering. Streptococcus thermophilus celler er farget røde. Alle andre er farget grønne. Foto: Helga Lüthi-Schaller, Universitetet i Zürich.
Resultater og diskusjon
Både Scer og Sther festet seg til tenner og omliggende slimhinne. Antallet Scer-kolonier (N = 15) var i gjennomsnitt (SD) 52 (21), 37 (26), 22 (13) og 25 (22) henholdsvis 5, 30, 60 og 90 minutter etter munnskylling. Prosentvis andel Sther av det totale bakterietallet (N = 15) var i gjennomsnitt (SD) 5,4 % (2,6 %), 9,3 % (4,0 %), 8,1 % (3,9 %) og 6,6 % (4,0 %) henholdsvis 5, 30, 60 og 90 minutter etter munnskylling. Ikke uventet fant vi store forskjeller mellom individer og mellom gjentatte forsøk hos samme person. Begge organismene ble påvist hos alle forsøkspersonene ved samtlige tidspunkt bortsett fra hos én som ikke hadde Scer etter 90 minutter. Antallet Scer ble gradvis redusert med tiden. Økningen av antallet Sther fra 5 minutter til 60 minutter etter munnskylling forklares med celledeling fordi bakteriene vokste i et rikt vekstmedium før munnskylling og derfor hadde intracellulær opplagsnæring.
Konklusjon
Vi har vist at ikke-orale mikroorganismer som brukes i matvareproduksjon fester seg til tenner og omliggende slimhinne og at antallet reduseres med tiden. Våre funn stiller således spørsmål ved paradigmet at oral mikrobiell kolonisering reguleres av spesifikke reseptor-adhesin interaksjoner. Basert på våre funn vil vi hevde at: Orale vev har reseptorer for både orale og ikke-orale bakterier, men med ulik tetthet og affinitet; Rekkefølgen for kolonisering av de ulike orale bakterieartene reguleres av vekstbetingelsene; Ikke-orale mikroorganismer kan ikke konkurrere med den orale mikrobiota som har tilpasset seg dette økosystemet gjennom hundrevis til tusenvis av år.
Dette er nok et perfekt eksempel på Darwins teori om «The survival of the fittest» avsluttet professor emeritus Bernhard Guggenheim ved Universitetet i Zürich, Zürich, Sveits som presenterte rapporten. Foruten undertegnede var PD. Dr. Patrick Schmidlin og M.Sc. Deborah Hofer, begge fra Universitetet i Zürich og PhD Rodrigo Alex Arthur fra Piracicaba Dental School, Piracicaba, Brasil medforfattere.
Takk
Takk til Minnefond for Knut og Liv Gard og for Frans Berggren for økonomisk bidrag.
Odontologisk institutt
Universitetet i Oslo