Implantatbehandling af den medicinsk kompromitterede patient
Litteraturen indeholder ganske mange rapporter om medicinske tilstande som teoretisk set kunne påvirke implantatbehandling. Beskrivelserne har i mange tilfælde været allegoriske, og de seneste års systematiske oversigtsartikler har for mange af tilstandene haft vanskeligt ved at fremlægge egentlig evidens for hvordan tilstandene har påvirket implantatbehandlingen (1,2). Dette skyldes dels stor heterogenitet i patientmaterialet fra de inkluderede undersøgelser, og at mange af de medicinske tilstande kan være vanskelige at vurdere isoleret, idet der er mange interaktioner og baggrundsvariable (1).
Mange af de publicerede undersøgelser tager endvidere primært udgangspunkt i opnåelsen af osseointegration sv.t. implantatoverlevelsen på kort sigt (3,4). Andre variable så som behandlingsforløb og langtidsprognose for behandlingen set i relation til muligheden for andre behandlinger har også betydning, når indikationsgrundlaget for implantatbehandling skal vurderes.
I den kliniske situation har det således betydning hvorvidt den medicinske tilstand påvirker indikation eller er en kontraindikation for behandling samt hvilke forholdsregler der eventuelt skal tages og hvilken information der skal gives til patienten med henblik på vurdering af præ- og postoperativt forløb.
Formålet med artiklen var at beskrive hyppigt forekommende medicinske tilstande, som kunne tænkes at have en indflydelse på forløbet og resultatet af implantatbehandling samt angive nogle retningslinier for hvordan man skal forholde sig overfor implantatbehandling ved udvalgte medicinske tilstande.
Osteoporose (knogleskørhed)
Forekomsten af osteoporose blandt potentielle implantat patienter er høj. Således vurderede en WHO rapport at næsten 30 % af postmenopausale kvinder i USA har osteoporose (5). I Ugeskrift for Læger er det for nyligt blevet angivet at omkring 1/2 mill danskere har osteoporose, men at kun 10–15 % får behandling derfor (6). Som diagnostisk kriterium for osteoporose anvendes en værdi for knogle mineral tæthed («Bone Mineral Density» -BMD), der er mindre end 2.5 standard deviation fra middelværdien for unge raske kvinder (5). BMD måles normalt i hofteregion, underarm eller columna lumbalis ved hjælp af «Dual Energy X-ray Absorptiometry» (DEXA eller DXA-scanning), men udvikling af metoder til identifikation af osteoporose i tandlægepraksis er på vej og er for nyligt blevet beskrevet i det danske tandlægeblad (7).
Teoretisk set burde knoglesygdomme, herunder osteoporose, der påvirker knoglemassen influerer på prognosen for implantatbehandling (8). I systematiske oversigtsartikler, har det imidlertid været vanskeligt at påvise en sådan sammenhæng (1). Ovenstående oversigtsartikel inkluderede 17 artikler, der var modstridende i deres resultater omkring osteoporoses indvirkning på implantatprognosen. Artiklerne blev fundet meget heterogene og ikke alle anvendte samme definition af osteoporose. Studierne var hovedsageligt retrospektive og bestod af små patientgrupper med forskellig implantatlokalisation (9–11). De fleste af disse patientmæssigt mindre undersøgelser viste ikke signifikant sammenhæng mellem osteoporose og implantatoverlevelse.
I 2 nyere retrospektive undersøgelser på et stort patientmateriale blev der dog fundet en statistisk signifikant sammenhæng mellem osteoporose og tidlige implantattab (3,4). Cooper (12) angav i en oversigtsartikel at mens implantater placeret i relativt tætstruktureret knogle f.eks. fortil i underkæben, har en god prognose også på patienter med ubehandlet osteoporose behøver dette ikke at være tilfældet i mindre tætstruktureret knogle. Dette er i overensstemmelse med observationer fra flere studier (13,14).
Mange lægemidler påvirker endvidere knogleomsætningen og kan føre til osteoporose (15). Det er velkendt at osteoporose kan induceres af glukokortikoider og prednisoloninduceret osteoporose har således været anvendt i mange eksperimentelle studier (16,17). I et ikke publiceret studie fra Tandlægeskolen i København forsøgte vi at inducere osteoporose på kaniner med ovariectomi og Prednisolon. Vi konstaterede at enkelte dyr ved meget høje doser fik en kraftig afkalkning af lårbensknoglen (Figur 1). Der er dog ikke evidens for at kortikosteroid behandling med normale doser er en kontraindikation for implantatbehandling (2).

Figur 1. Lårbensknoglen fremstod «blød» og bøjelig efter at kaninen havde fået store koncentrationer af Prednisolon (fra studie af scholarstipendiat Tore Lefolii, 2007/2008).
Der er også fundet forøget tab af BMD ved anvendelse af antiepileptisk medicin, antidepressiva, antidiabetika, diuretika, mavesårsmedicin og vanligt anvendt smertestillende medicin som f.eks. paracetamol og ibuprofen i større doser og gennem længere tid (15).
På basis af ovenstående er det ikke kontraindiceret at indsætte implantater på patienter med osteoporose, men det er væsentligt at få klarlagt patienters medicinske tilstand og medicin forbrug inden en implantatbehandling iværksættes, således at patienten kan informeres bedst muligt.
Bisfosfonat behandling
Bisfosfonat (BF) behandling anvendes til at øge knogletætheden og knoglestyrken ved flere tilstande, heriblandt osteoporose og myelomatose samt knoglemetastaser fra f.eks prostatacancer og brystcancer. Mekanismen er at BF indbygges i knoglerne og hæmmer osteoklasterne, hvorved knoglenebrydningen hæmmes. BF har også en række andre effekter herunder påvirkning af osteoblasterne og en antiangiogenetisk effekt. Derfor kan f.eks. ses en forlænget helingstid af knoglealveolen efter en tandekstraktion. I dag er ca 58.000 danskere under behandling med BF for osteoporose, mens ca 2000 i Danmark er under behandling for forskellige knoglecancere og nogle sjældne sygdomme (18). På verdensplan antages 190 millioner mennesker at være i behandling med BF (19). De gunstige effekter af BF-behandling er øgning af knoglernes mineralindhold samt øget styrke, hvilket for myelomatosepatienterne medfører nedsat risiko for spontanfrakturer ved sammenfald i ryggen og for osteoporosepatienterne nedsat risiko for knoglefraktur ved fald. Hos patienter med knoglecancer kan BF endvidere bremse progression af sygdommen i knoglerne. Ostoporosepatienter behandles oftest peroralt (tabletbehandling) med f.eks. Alendronat, mens cancerpatienter behandles med højdosis intravenøs (IV) behandling med potente BF som Pamidronat og Zoledronat.
Komplikationer til BF-behandling omfatter bl.a. osteonekroser i kæberne (eng. forkortelse: BRONJ), der viser sig ved en blottelse af knoglen i enten mandibel (2/3) eller maxil (1/3). To tredjedele af BRONJ opstår efter et oral kirurgisk indgreb som tandekstraktion, hvor alveolen efterfølgende ikke vil hele (Figur 2) , mens én tredjedel opstår spontant. I opgørelser af patienter med BRONJ udgør cancerpatienter i højdosis IV behandling med BF ca 95 %, mens osteoporosepatienter i tabletbehandling kun udgør cirka 5 %. Risikoen for opståen af BRONJ er afhængig af en række faktorer, idet den øges med BF-dosis, BF-præparat (Zoledronat er meget potent), IV-behandling i forhold til tabletbehandling, behandlingsvarighed (risiko stiger efter 2–3 år), tobaksrygning, tidligere strålebehandling og steroidbehandling, samt tilstedeværelse af diabetes (20,21).
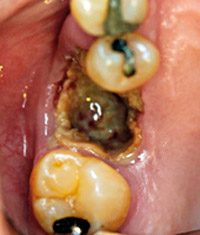
Figur 2. Osteonekrose i regio 6+ hos 59-årig kvinde med multiple myelomer og diabetes mellitus efter extraktion.
Flere kasuistikker har påvist opståen af BRONJ i relation til implantatbehandling hos patienter i BF-behandling (21). Imidlertid foreligger der aktuelt meget lidt videnskabelig evidens for risiko for BRONJ samt implantatoverlevelse og succesrater hos patienter i BF-behandling. En nylig rapport præsenterede en systematisk litteraturgennemgang (22). Et prospektivt studie fulgte 25 patienter med og 25 uden BF-tablet behandling, som havde modtaget BF gennem 1–4 år. Der blev indsat 102 og 108 implantater i henholdsvis BF-gruppen og i kontrolgruppen (23). Observationsperioden var 36 måneder og der fandtes ingen tilfælde af BRONJ. Succesraten af implantatindsættelse var 100 % i BF gruppen og 99,2 % i kontrolgruppen.
Tre retrospektive studier af implantatoverlevelse hos patienter i BF-tabletbehandling viste ingen øget risiko for BRONJ, og implantatoverlevelsen var 95–100 % (24–26). Kvaliteten af undersøgelserne var imidlertid mindre god, hvorfor konklusionerne må tages med forbehold.
Der foreligger ingen undersøgelser over incidens af BRONJ eller implantatoverlevelse i forbindelse med højdosis IV- BF-behandling hos cancerpatienter. En række kasuistikker og koncensusrapporter er enige om at implantatbehandling er kontraindiceret eller må frarådes ved højdosis IV-BF-behandling (22).
Skal patienter i BF-behandling holde pause i behandlingen i forbindelse med implantatbehandling?
Dette spørgsmål kan ikke besvares på baggrund af evidens, men nogle konsensus rapporter anbefaler ophør af BF behandling 3–6 måneder før og 3 måneder efter implantat indsættelse (22). BF optages i knoglerne og har lang halveringstid (10 år), og effekten af BF pausering er ukendt. En testmetode med påvisning af CTX (et kollagennedbrydningsprodukt) mængden i serum skulle kunne påvise evt øget risiko for BRONJ (21), men der savnes videnskabelig evidens for at testen kan vise en sådan sammenhæng (27).
På baggrund af ovenstående litteratur kan det konkluderes, at det kan betragtes som en sikker procedure at indsætte implantater i patienter, som har været i BF-tabletbehandling i mindre end 5 år mht risiko for udvikling af BRONJ. Indtagelse af BF påvirkede ikke kort tids implantatoverlevelsen (1–4 år).
Implantatbehandling hos patienter i højdosis IV BF behandling er kontraindiceret. Det er ukendt hvor vidt pausering af BF-behandling før implantatindsættelse bedrer prognosen eller nedsætter risikoen for BRONJ, men det anbefales af flere grupper.
Patienter, der er i BF behandling, skal altid informeres om eksisterende risiko for komplikationer ved implantatbehandling på baggrund af udgangssituationen.
Strålebehandling
Strålebehandling for hoved-halscancer har en række kendte akutte og kroniske bivirkninger. De akutte omfatter bl.a. strålemukositis og candidiasis, mens de kroniske viser sig ved spytkirtelpåvirkning og efterfølgende xerostomi, atrofi af mundslimhinder, og fibrose af bindevæv og muskler, der ofte medfører nedsat gabeevne. Mundtørheden kombineret med besværliggjort mundhygiejne medfører øget cariesaktivitet. Den alvorligste komplikation til strålebehandling er osteoradionekrose (ORN), der kan medføre nødvendig resektion af større dele af kæben, oftest mandiblen. Osteoradionekrosen har mange lighedspunkter med den bisfosfonat-relaterede osteonekrose. De fleste mundhule- og oro-pharynx cancere behandles med strålebehandling i fraktionerede doser på 2 Gy med i alt 66 eller 68 Gy. Risikoen for osteoradionekrose stiger ved stråledoser over 45 Gy, og er således tilstede ved såkaldt «fuld strålebehandling» på 68 Gy. Risikoen for ORN varierer noget i forskellige undersøgelser, men angives hyppigt til omkring 6 % efter postirradiative ekstraktioner (28). Størst risiko for udvikling af osteoradionekrose findes i molarområdet i underkæben, og især ved tungecancere og tonsilcancere, hvor der har været stor koncentration af stråledosis på underkæbens molarregion. Strålebehandling mange år tidligere er også en risikofaktor.
Den nedsatte helingstendens af knogle og slimhinde efter strålebehandling for hoved-hals cancer er af væsentlig betydning både for udfaldet af efterfølgende dento-alveolære indgreb som tandekstraktioner (28) som for implantatbehandlinger (2). Er implantatindsættelse indiceret bør man derfor få oplyst stråledosis og strålefelt. Ovenstående risikofaktorer for udvikling af osteo-radionekrose efter strålebehandling bør også betragtes som risikofaktorer ved implantatbehandling i en strålebehandlet kæbe.
En række undersøgelser dokumenterer at der er nedsat implantatoverlevelse i strålebehandlede kæber samt øget risiko for peri-implantit. Moy et al. (29) fandt således en øget relativ risiko for implantat tab ved strålebehandling på 2,73 i forhold til ingen strålebehandling. I samme studie var høj alder (>60 år), tobaksrygning og diabetes forbundet med øget risiko for implantattab.
I et nyligt studie af 100 implantater i 100 patienter fandt Karbach et al. (30) en prevalens af kliniske tegn på periimlantit hos 43 % af strålebehandlede, mens den tilsvarende hyppighed hos ikke strålebehandlede var 26 %.
En række patienter modtager en kombination af strålebehandling og kirurgi med rekonstruktion af fjernet kæbe (enten efter osteonekrose, eller efter fjernelse af tumorbærende kæbedel). Rekonstruktion foretages i reglen med mikrovaskulær kirurgi f.eks med brug af fibulaknogle, der indsættes sv. til den manglende mandibelknogle og med fri vaskulær hud-muskellap. Disse patienter har behov for rehabilitering med implantater i restkæben og i den transplanterede fibulaknogle (Figur 3a, b).
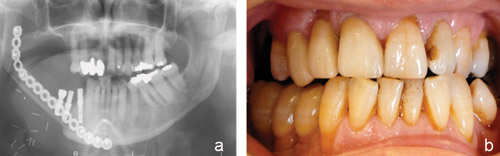
Figur 3. (a) Rekonstrueret patient efter resektion af højre side af mandiblen (kirurgi: Thomas Koefoed, Rigshospitalet, København. (b) Implantatunderstøttede kroner påsat de 3 implantater regio 4-, 5- og 6- (protetik: Trondur Joensen, Tandlægeskolen, København).
En undersøgelse fra Østrig viste en 8-års overlevelse af implantater i ikke-bestrålet restkæbe på 95 %, i bestrålet kæbe på 72 % og i transplanteret knogle på 54 %. Skønt implantatoverlevelsen er lavere i bestrålet og transplanteret kæbe er brug af implantater ofte velindiceret, da disse patienter hjælpes betydeligt med protetisk rehabilitering ved hjælp af protetik på implantater (31).
En engelsk undersøgelse omhandlede 81 patienter behandlet med bestråling samt fri mikrovaskulær lap for ossøs rekonstruktion af mandibel, som fik indsat 386 implantater 12 måneder efter rekonstruktionskirurgien. Follow-up periode var 4 år. 73 % af implantaterne var i funktion understøttende proteser. 15 % var tabt, resten ikke belastet (sleepers). Implantattab var størst i maxil og i transplanteret knogle (32).
Patienter med følger efter strålebehandling og/eller ossøs rekonstruktion efter kirurgi har ofte vanskelige vilkår for protetisk rehabilitering. Ud over broer eller proteser båret af implantater i processus alveolaris er anvendelse af zygomafixturer en fordel, i en række tilfælde med vanskelige protetiske forhold.
Hyperbar iltbehandling (trykkammerbehandling med oxygen) mhp at øge blodforsyningen til vævene har været anvendt i forbindelse med implantatbehandling, skønt effekten ikke er sikkert evidensbaseret.
Implantater kan på basis af ovenstående indsættes i strålebehandlede kæber samt i rekonstrueret kæbe med frit mikrovaskulært knogletransplantat. Der må forventes reduceret implantatoverlevelse hos disse patienter, men behandling er ofte velindiceret som led i rehabiliteringen af disse patienter som ubehandlet har betydelige tyggefunktionelle problemer og ofte problemer med at holde vægten. Implantologi og protetik på patienter behandlet for hoved hals cancer er vanskelig og betragtes som specialistopgaver. Patienten bør informeres om den øgede risiko for implantattab.
Kemoterapi
Kemoterapi anvendes til behandling af en række maligne tilstande (brystcancer, gastrointestinal cancer, leukæmi m.fl.) enten alene eller i kombination med kirurgisk cancerbehandling. Kemoterapeutika er stoffer der har en dødelig effekt på cancerceller. Imidlertid har kemoterapi også virkninger på de raske celler, heriblandt knoglemarven, som supprimeres. Knoglemarvs suppression medfører leukopeni og trombocytopeni, hvorfor patienten i behandlingsperioden er meget modtagelig for infektioner og vil have øget blødningstendens.
Der er endvidere en række generelle bivirkninger af kemoterapi i form af træthed, kvalme, appetitløshed, hårtab m.v. afhængig af kemobehandlingens art, dosis og varighed.
Generelt må implantatbehandling betragtes som kontraindiceret i forbindelse med igangværende kemoterapi og i en periode herefter på gr. af generelle behandlingsbivirkninger inkl. infektionsrisiko og blødningsrisiko.
Når en patient er klinisk af rask efter kemoterapi og blodværdierne er normaliseret (ingen leukopeni eller trombocytopeni) kan patienten være kandidat til implantatbehandling.
Der findes ingen kontrollerede undersøgelser over evt. effekt af kemoterapi på implantatoverlevelse. En række kasuistikker dokumenterer at implantatbehandling er mulig med succes hos patienter efter kemoterapi (33,34). Det er en generel antagelse, at en patient, der har modtaget kemoterapi og er fri af kemoterapiens bivirkninger og rask af canceren, kan opfattes som alle andre patienter med hensyn til implantatbehandling, om end der savnes evidens.
Implantatbehandling er således kontraindiceret hos patienter under kemoterapeutisk behandling. Når kemoterapien er overstået og man har sikret sig at knoglemarven er normal (ingen leukopeni eller trombocytopeni), ligesom den ansvarlige onkolog ikke finder kontraindikationer pga. canceren, vil patienten kunne behandles med implantatbehandling.
Der er ingen data der tyder på at der under disse forhold skulle være øget risiko ved implantatbehandling.
Antitrombotisk behandling
Ifølge lægemiddelstyrelsens statistik er der cirka 800.000 danskere i vedvarende behandling med blodtryksmidler og mindst halvdelen vurderes at være i behandling med blodfortyndende medicin.
En stor del af de patienter, der har behov for implantatbehandling indtager således blodfortyndende medicin. Det kan være som følge af hypertension eller andre kardiovakulære lidelser. I 2 retrospektive undersøgelser fra Universitetet i Leuven på et stort patientmateriale, henholdsvis 2004 og 283 konsekutivt implantatbehandlede patienter, blev der ikke fundet nogen sammenhæng mellem kardiovaskulære lidelser og incidensen af mislykkede implantater (3, 4). Det er derimod klart at anvendelsen af antitrombotiske behandling kan have stor betydning på behandlingsforløbet som følge af den potentielt øgede risiko for blødning under og efter implantatindsættelse. Denne risiko skal naturligvis opvejes mod livstruende tromboemboliske komplikationer, der kan være en følge af seponering af antitrombotisk behandling (22, 35, 36).
En nyligt publiceret oversigtsartikel i det danske tandlægeblad har netop vurderet behovet for seponering af antitrombotisk behandling i forbindelse med mindre dentoalveolær kirurgi herunder implantat behandling (36). I en netop afholdt workshop af European Association for Osseointegration (EAO) blev samme forhold undersøgt i en systematisk oversigtsartikel (22). Endvidere forefindes flere konsensusrapporter omkring emnet fra medicinske foreninger (35, 37). Baseret på blandt andet randomiserede, kontrollerede undersøgelser har samtlige af disse artikler konkluderet at seponering af oral antikoagulerende terapi (OAT) ikke kan anbefales ved mindre oral kirurgiske indgreb (22). Implantatbehandling må i langt de fleste tilfælde rubriceres som sådan, hvorfor patienter bør fortsætte med antitrombotisk behandling, når de får foretaget mindre implantatoperationer. For patienter i behandling med de vanligt anvendte trombocytaggregationshæmmende præparater som f.eks. Hjertemagnyl®, Persantin® og Plavix® er «International Normalized Ratio» (INR) værdier normalt noget mindre end 3 eller 3.5, når der ikke er andre interagerende medicinske præparater eller risikofaktorer tilstede (2). Lokal anvendelse af hæmostatiske præparater så som tranexamsyre (38) og gelatinesvamp, f.eks. Spongostan®, oxideret cellusosesvamp, f.eks. Surgicel®, kollagensvamp f.eks. TissuFleece® eller kombinationsprodukter, f.eks. TachoSil® har vist sig at være effektivt til at begrænse blødninger, hvorfor dette kan anbefaldes for alle patienter i OAT (36).
Ved behandling med vitamin K-antagonister som f.eks. Marevan® og Marcoumar® eller andre koagulationshæmmende præparater, hvor INR værdien kan være større end 3.5 bør denne måles indenfor 24 timer før en implantatindsættelse. For INR-værdier < 3.5 bør OAT normalt ikke seponeres, hvis implantatindsættelsen ikke indbefatter større knogletransplantater, oplukning af store slimhindelapper, og hvor der ikke er risiko for osteotomi præparation udenfor knogleafgrænsningen (2, 22). Hvis dette er tilfældet eller hvis INR-værdien er > 3.5 bør den antitrombotiske behandling og eventuelt seponering af denne planlægges i samråd med behandlende læge i god tid før implantatbehandlingen (22). Større blødninger efter implantatbehandling er sjældent forekommende, men kan teoretisk set føre til obstruktion af luftvejene, hvis de forekommer i mundbunden (2). Derfor bør man være meget opmærksom på dette ikke mindst på patienter i antitrombotisk behandling.
Diabetes (sukkersyge)
Diabetesforeningen i Danmark angiver at der er 20–25.000 danskere med diabetes type 1 og at gruppen er i stor vækst. Ifølge hjerteforeningen har op mod 150 000 mennesker i Danmark type 2 diabetes. Da 3 ud af 4 patienter med diabetes type 2 også på et tidspunkt får hjerte-karsygdomme kan dette ligesom andre følgesygdomme naturligvis også påvirke behandlingsforløbet og resultatet.Tre nyere systematiske oversigtsartikler (1, 2, 39) har beskrevet diabetes indflydelse på osseointegration af implantater og en nyligt publiceret oversigtartikel har systematisk vurderet effekten af diabetes på de peri-implantære forhold (40).
For at undersøge osseointegration af implantater har der været udført en del dyreeksperimentelle studier hvor diabetiske rotter og kaniner har fået indsat implantater (39). De fleste af disse studier viste at osseointegration fandt sted, men at den kvantitative og kvalitative knogleheling i diabetiske dyr var dårligere end på dyr uden diabetes (1, 39).
Hvad angår de kliniske undersøgelser er der modstridende oplysninger. Det patientmæssigt mest omfangsrige studie var et retrospektivt studie. Det indikerede en statistisk signifikant forøgelse af den relative risiko for tab af implantat hos patienter med diabetes (29). I modsætning til dette studie viste det eneste studie med en matchende kontrolgruppe ikke nogen forøget risiko for tab af implantat hos patienter med diabetes (41). Dette er i overensstemmelse med et andet prospektivt studie (42) og et større retrospektivt studie (3).
Flere studier anbefaler grundigt at undersøge hvor velkontrolleret patientens sukkersyge er; at anvende klorhexidinskylninger postoperativt og at anvende profylaktisk antibiotisk behandling i forbindelse med implantatindsættelsen (2, 43). En nyligt publiceret prospektiv undersøgelse af 20 personer med diabetes, der blev behandlet med implantater viste således en tydelig sammenhæng mellem blodets glucose niveau og stabiliteten af indsatte implantater (44).
Oversigtsartiklerne fastslår at der ikke er nogen evidens for at diabetes er en kontraindikation for implantatindsættelse, hvis sukkersygen er velkontrolleret (1, 2, 39). Dette understøttes også af en nyere prospektiv undersøgelse af 45 patienter med en gennemsnits glukosyleret hæmoglobin (HbA1c) værdi i blodet på 7,2 % i perioden omkring implantatindsættelse. Denne gruppe af patienter mistede ikke flere implantater ved konventionel og advanceret implantat terapi end en matchende kontrolgruppe (45). Implantatlokalisationen kan dog have en betydning, idet et nyt prospektivt studie på 32 patienter med diabetes fandt en significant sammenhæng mellem HbA1c-værdien og implantatet stabilitet under heling (44). Samme studie angav en forøget risiko for peri-implantitis. Dette indikeres også i en retrospektiv tværsnitsundersøgelse, hvor patienter med diabetes udviste en signifikant forøget risiko for udvikling af peri-implantitis sammenlignet med personer uden diabetes (46). Undersøgelsen inkluderede 212 brasilianere rehabiliteret med implantater for gennemsnitligt 31/2 år siden. De 29 patienter med diagnosen diabetes havde en prevalens af peri-implantitis på 24,1 %, hvorimod kun 6,6 % af patienterne uden diabetes havde peri-implantitis (46). Man kan således omvendt fremføre at der mangler evidens for at patienter med diabetes opnår en lige så god langtidsprognose for implantater, som patienter uden diabetes (40). Det er dog også et område, hvor der mangler velkontrollerede, prospektive undersøgelser.
Andre sygdomme og syndromer
I de foreliggende systematiske oversigtsartikler (1, 2) har man ikke fundet egentlige kontrollerede studier omkring tilstande som scleroderma, Parkinsons sygdom, Sjögrens syndrome, HIV, pemphigus vulgaris, Crohns sygdom eller immuno-suppressiv behandling efter organ transplantation. Der foreligger dog nogen artikler omkring disse tilstande i form af kasus rapporter og serier.
Efter trykningen af de ovennævnte oversigtsartikler er der blevet publiceret 2 retrospektive undersøgelser med et meget stort patientmateriale på henholdsvis 2004 og 283 konsekutivt implantatbehandlede patienter med i alt 7666 implantatindsættelser. Materialet blev analyseret med henblik på vurdering af lokale og systemiske faktores indflydelse på incidensen af tidlige implantatfejl. Undersøgelsen vurderede prevalencen af tidlige implantatfejl i forhold til medicinske tilstande som hypertension, antitrombotisk behandling, osteoporose, hypothyreodisme, hyperthyreodisme, diabetes type I og II, Crohn´s sygdom, gastriske problemer, rheumatoid arthritis, radical hysteriktomi, radiotherapy, hyperkolesterolæmi, steroid medicinering, antidepressiv medicinering, rygning samt andre mere lokale faktorer (3, 4). Ved regressionsanalyser blev fundet at Crohns sygdom og osteoporose var de to tilstande hvor patienterne viste signifikant dårligst osseointegration.
Hvad angår hypothyreodisme er der blevet gennemført en kontrolleret retrospektiv undersøgelse i Canada, som ikke viste nogen forskel i implantatoverlevelse for 27 patienter i medicinsk behandling for hypothyreodisme i forhold til en matchende kontrolgruppe uden hypothyreoidisme (41).
Et andet område, hvor der mangler kliniske undersøgelser er omkring patienter med Sjögren´s syndrome. Denne patientgruppe kan ofte hjælpes med implantatbehandling, da de hyppigt har vanskeligt ved anvendelse af aftagelige proteser. En undersøgelse fra Århus Tandlægeskole på 8 tandløse patienter med Sjögrens syndrom viste også hvordan den patientrapporterede tilfredshed blev klart forøget med implantatunderstøttede rekonstruktioner. Syv af patienterne havde også diagnosen rheumatoid arthritis og en scleroderma (47). Frekvensen af mistede implantater indenfor det første år var i denne lille gruppe større (16 %) end normalt. Dette bør dog ikke afholde tandlæger fra at foreslå patienter med Sjögrens syndrom implantatbehandling, da der foreligger kasus med gode resultater (48, 49), og da en behandling altid skal vurderes i forhold til andre mulige behandlinger. De to forfattere af nærværende artikel har da også gode erfaringer med behandling af patienter med Sjögrens syndrom med implantatunderstøttede rekonstruktioner. Ligesom for de fleste andre af ovenstående medicinske tilstande mangler der velkontrollerede, prospektive studier indenfor området.
Konklusioner
Implantatbehandling på patienter med osteoporose kan foretages, hvis der ikke foreligger medicinsk kompromitterende faktorer. Der er studier, som indikerer at implantatprognosen er dårligere i visse kæberegioner på patienter med osteoporose, men evidensen er svag.
– Implantatbehandling på patienter, som har været i peroral bisfosfonat (BF) behandling i mindre end 5 år kan gennemføres og implantatprognosen er god.
– Implantatbehandling på patienter i højdosis i.v. BF er kontraindiceret. Det mangler evidens for hvorvidt pausering af BF behandling før implantatindsættelse bedrer prognosen eller nedsætter risikoen for osteonekrose.
– Implantater indsat i strålebehandlede kæber samt i rekonstrueret kæbe er hyppigt indiceret, men der må forventes reduceret implantatoverlevelse i forhold til i ikke bestrålede kæber.
– Implantatbehandling på patienter strålebehandlet for hoved- eller halscancer er en specialistopgave.
– Implantatbehandling er kontraindiceret i forbindelse med igangværende kemoterapi. Når patienten er fri af kemoterapiens bivirkninger og rask af canceren kan implantatbehandling foretages.
– Seponering af antitrombotisk behandling er ikke standard i forbindelse med mindre implantatbehandlinger. Hvis der skal foretages større knogletransplantationer, oplukning af store slimhindelapper, hvis der er risiko for præparation udenfor knogleafgrænsningen eller hvis INR-værdien er > 3.5 bør den antitrombotiske behandling og evt. seponering af denne planlægges i samråd med den behandlende læge.
– Implantatbehandling på patienter med velkontrolleret diabetes kan udføres, men der er rapporteret en øget forekomst af peri-implantitis hos denne patientgruppe i forhold til patienter uden diabetes.
– Der mangler evidens for hvordan en række medicinske tilstande påvirker implantat helingen og langtidsprognosen.
English summary
Implant treatment in the medically compromised patient
The literature contains numerous observations on the significance of systemic disorders and medication as a contraindication for implant treatment. However, the evidence of implant efficacy in medically compromised patients is quite sparse.
The aim of the review was to describe selected systemic disorders and medications, which may influence the implant treatment and to suggest clinical recommendations.
The present review was based on recently published systematic reviews and studies evaluating implant treatment in the medically compromised patient.
Although there is no evidence that osteoporosis is a contraindication to implant treatment, there is evidence that high doses bisphosphonate therapy may be a contraindication. Patients in anticoagulation therapy with high INR-value should not have implant therapy before adjustment. Implant treatment of patients in chemo- or radiotherapy is contraindicated, and they should afterwards only be rehabilitated with implants by specialists. Patients should be informed that the implant failure rate is increased. There is no evidence that diabetes mellitus is a contraindication to implant treatment, but patient with diabetes seems to be more prone to develop peri-implantitis than patients without diabetes.
Referencer
1. Mombelli A, Cionca N. Systemic diseases affecting osseointegration therapy. Clin Oral Implant Res. 2006; 17 (Suppl. 2): 97–103.
2. Scully C, Hobkirk J, Dios PD. Dental endosseous implants in the medically compromised patient. J Oral Rehabil. 2007; 34: 590–9.
3. Alsaadi G, Quirynen M, Komárek A, van Steenberghe D. Impact of local and systemic factors on the incidence of oral implant failures, up to abutment connection. J Clin Periodontol. 2007; 34: 610–7.
4. Alsaadi G, Quirynen M, Michiles K, Teughels W, Komárek A, van Steenberghe D. Impact of local and systemic factors on the incidence of failures up to abutment connection with modified surface oral implants. J Clin Periodontol. 2008; 35: 51–7.
5. Kansis JA. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis: Synopsis of a WHO Report. Osteoporos Int. 1994; 4: 368–81.
6. Langdahl BL. Ny vejledning til udredning og behandling af osteoporose. Ugeskr Læger. 2009; 171(26): 2204.
7. Sewerin I. Identifikation I tandlægepraksis af patienter med osteoporose. Tandlægebladet. 2009; 113: 596–601.
8. Hobkirk J, Zarb G. Biological and social interfaces in prosthodontics. Implant Host. Study Group Report and Discussion. Int J Prostodont. 2003; 16: 47–51.
9. Becker W, Hujoel PP, Becker BE, Willingham H. Osteoporosis and implant failure: an explaratory case-control study. J Periodontol. 2000; 71: 625–31.
10. Von Wowern N, Gotfredsen K. Implant-supported overdentures, a prevention of bone loss in edentulous mandibles? A 5-year follow-up study. Clin Oral Implants Res. 2000; 33: 163–71.
11. Friberg B, Ekestubbe A, Mellström D, Sennerby L. Brånemark implants and osteoporosis: a clinical exploratory study. Clin Implants Dent Relat Res. 2001; 3: 50–6.
12. Cooper LF. Systemic effectors of alveolar bone mass and implications in dental therapy. Periodontol 2000. 2000; 23: 103–9.
13. Blomqvist JE, Alberius P, Isaksson S, Linde A, Hansson BG. Factors in implant integration failure after bone grafting: an osteometric and endocrinologic matched analysis. Int J Oral Maxillofac Surg. 1996; 25: 63–8.
14. August M, Chung K, Chang Y, Glowacki J. Influence of estrogen status on endosseous implant osseointegration. Int J Oral Maxillofac Surg. 2001; 59: 1285–9.
15. Vestergaard P, Rejnmark L, Mosekilde L. Osteoporose og frakturer, der er associeret med lægemidler. Ugeskr Læger. 2008; 170: 1550.
16. Gilsanz V, Roe TF, Gibbens DT, Schulz EE, Carlson ME, Gonzalez O, Boechat MI. Effect of sex steroids on peak bone density of growing rabbits. Am J Physiol. 1988; 255: 416–21.
17. Fujimoto T, Niimi A, Sawai T, Ueda M. (1998). Effects of steroid-induced osteoporsis on osseointegration of titanium implants. Int J Oral Maxilofac Implants. 13: 183–189.
18. Hallund M, Schiødt M. Fokussanering før bisfosfonatbehandling. Tandlægebladet. 2008; 112: 534–9.
19. American association of oral and maxillofacial surgeons position paper on bisphosphonate-related osteonecrosis of the jaws. Advisory task force on bisphosphonate-related osteonecrosis of the jaw. J Oral Maxillofac Surg. 2007; 65: 369–76.
20. Marx RE, Sawatari Y, Fortin M, Broumand V. Bisphosphonate-induced exposed bone (osteonecrosis/osteopetrosis) of the jaws; Risk factors, recognition, prevention, and treatment. J Oral Maxillofac Surg. 2005; 63: 1567–75.
21. Marx RE, Cillo JE, Ulloa JJ (2007) Oral bisphosphonate osteonecrosis: risk factors, prediction of risk using serum CTX testing, prevention, and treatment. J Oral Maxillofac Surg. 2007; 65: 2397–410.
22. Madrid C, Sanz M. What impact do systemically administered bisphosphonates have on oral implant therapy? A systematic review. Clin Oral Implants Res. 2009; 20 (Suppl 4): 87–95.
23. Jeffcoat MK. Safety of oral bisphonates: controlled studies on alveolar bone. Int J Oral Maxillofac Implants. 2006; 21: 349–53.
24. Fuggazzoto PA, Lightfoot WS, Jaffin R, Rumar A. Implant placement with or without simultaneous tooth extraction in patients taking oral bisphosphonates: postoperative healing, early follow-up, and the incidence of complications in two private practices. J Periodontol 2007; 78; 1664–69.
25. Bell BM, Bell RE. Oral bisphosphonates and dental implants: a retrospective study. J Oral Maxillofac. Surg 2008; 66: 1022–24.
26. Grant BT, Amenedo C, Freeman K Kraut RA. Outcome of placing dental implants in patients taking oral bisphosphonates: A review af 115 cases. J Oral Maxillofac Surg. 2008; 66; 223–30.
27. Bagan JV, Jimenez Y, HGomez D, Siera R, Poveda R, Scully C. Collagen telopeptide (serum CTX) and its relationschip with the size and number of lesions in osteonecrosis of the jaws in cancer patients on intravenous bisphosphonates. Oral Oncol. 2008; 44: 1088–9.
28. Thorn JJ. Behandling af dentale infektiøse tilstande før bestråling for hoved-hals-cancer. Tandlægebladet 2000; 104: 780–7.
29. Moy PK, Medina D, Shetty V, Aghaloo TL. Dental Implant failure rates and associated risk factors. Int J Oral Maxillofac Implants. 2005; 20: 569–77.
30. Karbach J, Callaway A, Kwon Y.-D, d’Hoedt B, AlNawas B. Comparison of five parameters as risk factors for peri-mucositis. Int J Oral Maxillofac Implants. 2009; 24: 491–6.
31. Yerit KC, Posch M, Seeman M, Hainich S, Dörtbudak O, Turbani D, Ozyuvaki H, Watzinger F, Ewers R. Implant survival in mandibles of irradiated cancer patients. Clin Oral Implants. Res 2006; 17: 337–44.
32. Shaw RJ, Sutton AF, Cawood JL, Howell RA, Lowe D, Brown JS, Rogers SN, Vaughan ED. Oral rehabilitation after treatment for head and neck malignancy. Head Neck. 2005; 27: 459–70.
33. Steiner M, Windchy A, Gould AR, Kushner GM, Weber R. Effects of chemotherapy in patients with dental implants. J Oral Implantol. 1995; 21: 142–7.
34. McDonald AR, Pogrel MA, Sharma A. Effects of chemotherapy on osseointegration of implants: a case report. J Oral Implantol. 1998; 24: 11–3.
35. Douketis JD, Berger PB, Dunn AS, Jaffer AK, Spyropoulos AC, Becker RC et al. The perioperative management of antithrombotic therapy: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2008; 133; 299–339.
36. Lætgaard CA, Schou S, Jensen SS, Nielsen JD. Mindre dentoalveolær kirurgi på patienter i antitrombotisk behandling. Tandlægebladet. 2009; 113: 444–52.
37. Randall C. Surgical management of the primary care dental patient on warfarin. Dent Update. 2005; 32: 414–6, 419–20, 423–4.
38. Carter G, Goss A. Tranexamic acid mouthwash – a prospective randomized study of a 2-day regimen vs 5-day regimen to prevent postoperative bleeding in anticoagulant patients requiring dental extractions. Int J Oral Maxillofac Surg. 2003; 32: 504–7.
39. Kotsovilis S, Karoussis IK, Fourmousis I. A comprehensive and critical review of dental implant placement in diabetic animals and patients. Clin Oral Implants Res. 2006; 17: 587–99.
40. Salvi GE, Carollo-Bittel B, Lang NP. Effects of diabetes mellitus on periodontal and peri-implant conditions: update on associations and risks. J Clin Periodontol 2008; 35 (Suppl 8): 398–409.
41. Elsubeihi E, Zarb GA (2002). Implant prosthodontics in medically challenged patients: The University of Toronto Experience: J Can Dent Asso. 68: 103–8.
42. Peled M, Ardekian L, Tagger-Green N et al. dental implants in patients with type 2 diabetes mellitus: a clinical study. Implant Dent. 2003; 12: 116–22.
43. Morris HF, Ochi S, Winkler S. Implant survival in patients with type 2 diabetes: placement to 36 months. Ann Periodontol. 2000; 5: 157–65.
44. Oates TW, Dowel S, robinson M, McMahan. Glycemic Control and Implant stabilization in type 2 diabetes mellitus. J Dent Res. 2009; 88: 367–71.
45. Tawill G, Younan R, Sleilati G. Conventional and advanced implant treatment in the type II diabetic patient; Surgical protocol and long-term clinical results. Int J Oral Maxillfac Implants. 2008; 23: 744–52.
46. Ferreira SD, Silva GLM, Cortelli JR et al. Prevalence and risk variables for peri-implant disease in Brazilian subjects. J Clin Periodontol. 2006; 33: 929–35.
47. Isidor F, Brøndum K, Hansen HJ et al. Outcome of treatment with implant-retained dental prostheses in patients with Sjögren Syndrome. Int J Oral Maxillofac Implants. 1999; 14: 736–43.
48. Binon PP. Thirteen-year follow-up of a mandibular implant-supported fixed complete denture in a patient with Sjögren´s syndrome: A clinical report. J Prosthet Dent. 2005; 94: 409–13.
49. Ocakir C, Balmer S, Mericske-Stern R. Implant-prosthodontic treatment for special care patients: a case series study. Int J Prosthodont. 2005; 18: 383–9.
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Gotfredsen K, Schiødt M. Implantatbehandling af den medicinsk kompromitterede patient. Nor Tannlegeforen Tid. 2010;120:38–44. doi:10.56373/2010-1-13