Utviklingen av tannens form og sensorisk nerveforsyning er samordnet
For å få en funksjonell tann er det nødvendig med en samtidig utvikling av flere ulike anatomiske og fysiologiske systemer og prosesser. Dette gjelder spesielt utvikling og modning av sensorisk innervasjon, som er vesentlig for funksjon og beskyttelse av tenner. Utvikling av tannens innervasjon er tett knyttet til utvikling av tannkrone, tannrot og tannens festeapparat. Nye molekylære eksperimentelle og genetiske analyser viser at lokale vevsinteraksjoner, som er del av molekylære signalnettverk, kontrollerer ikke bare utviklingen av tannens form og celledifferensiering, men styrer også utvikling og vekst av aksoner fra trigeminusgangliet. På den måten koordineres utviklingen av både tannanleggets form og den sensoriske nerveforsyningen.
Tannutvikling
En velutviklet sensorisk nerveforsyning i tenner er vesentlig for funksjon og beskyttelse mot ytre skader. Når tannen er brutt fram i munnhulen og kommet i okklusjon, og rotutviklingen er i sluttfasen og apeks lukkes, går samtidig utviklingen av tannens sensoriske nerveforsyning inn i en modningsfase der et spesielt innervasjonsmønster etableres både i tannkrone, rot og i tannens festeapparat (1).
Tannen utvikles som et resultat av vevsinteraksjoner mellom tannepitel, som stammer fra neurallisten, og tilgrensende ekto-mesenkymale vev, gjennom overlappende faser av tannutvikling. Disse fasene er definert som den initierende eller tidlige fase, den formative eller morfogenetiske fase og en celledifferensieringsfase, der de spesielle odontogene celler, odonto-, amelo- og sementoblaster, utdifferensieres. Nyere funn indikerer at signalmolekyler som medierer disse vevsinteraksjonene, også kontrollerer utvikling og organisering av sensoriske aksoner i tannanlegget (1). En sammenhengende fortykning av oralt epitel, kalt tannlisten, som dannes i begge kjever, er det første histologiske tegn på utvikling av tenner. Fra tannlisten dannes det i underliggende mesenkym ti epitelknopper i hver kjeve, hvorfra melketennene utvikles. For hvert tannanlegg folder tannepitelet seg og danner tannkronens kontur under påfølgende kappe- og klokkestadium. Den endelige kroneform etableres først når odontoblaster starter sin produksjon av predentin med påfølgende mineralisering til dentin, som igjen induserer den fulle differensiering av ameloblaster, som deretter produserer emalje (2). Etter at kronen er ferdig dannet, utvikles den Hertwigske epiteliale rotskjede som induserer rotutvikling og rotdentindannelse. Etter at rotutviklingen er kommet i gang, starter også den del av erupsjonsfasen hvor tannen beveger seg mot mukosa. Først når roten har nådd omtrent 2/3 av full lengde, vil tannen normalt bryte fram i munnhulen. Tannsekken som omgir emaljeorganet danner tannens festeapparat. Samtidig med utvikling av tannform og festeapparat utvikles nerveforsyning, blodkar og omliggende alveolært ben.
Tannutviklingen hos mus har betydelige likheter med utviklingen hos menneske (Figur 1) bortsett fra tiden de enkelte faser i utviklingen behøver for å fullføres. En annen forskjell er at mus har incisiver som vokser hele livet, de mangler hjørnetenner og premolarer og har bare ett tannsett (monophyodont), i motsetning til menneske som er diphyodont.
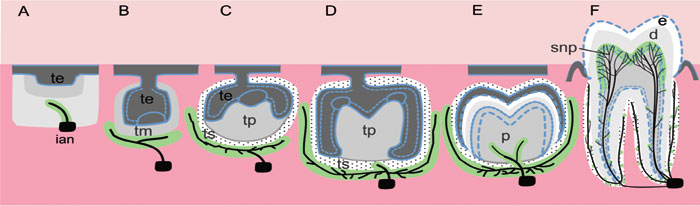
Figur 1. En skjematisk framstilling av samordning av utvikling av tannens form og sensorisk nerveforsyning. Bildene viser første molar i underkjeven ved forskjellige utviklingsstadier. (A-E) Pioneraksoner (markert svart) fra trigeminus følger en definert mesenkymal rute (markert grønt i A-E) og innerverer målområder i tannsekken som omgir anlegget til første underkjevemolar under den tidlige utviklingsperiode. Sensoriske fibre entrer tannpulpa (p) etter at hårdvevsavsetningen er påbegynt i kuspene og innerverer deretter viktige endelige odontoblast-dentin målområder i pulpa (markert i grønt i F). Illustrasjonen er basert på publikasjonene: (10), (13) og (14). Forkortelser: d, dentin; e, emalje; ian, inferior alveolar nerve; p, tannpulpa; te, tannepitel; tm, tann-mesenkym; tp, tannpapilla; ts, tannsekken; snp, subodontoblastisk nervepleksus.
Studier av tannanlegg har vist at før kappestadiet styrer det blivende tannepitel tannutviklingen, men deretter vil tannpapilla bestemme den videre utviklingen. I tillegg er den endelige differensiering av odonto- og ameloblaster avhengig av gjensidige signaloverføringer mellom tannanleggets epiteliale og mesenkymale celler. På samme måte er rotutviklingen avhengig av vevsinteraksjoner, der tannepitel, som utgjør den Hertwigske rotskjede, bestemmer tannens rotanatomi (2).
Molekylær styring av utvikling av tannens form og celledifferensiering
Tannen er et modellorgan der det i dag finnes mye kunnskap når det gjelder molekylær regulering av en utviklingsprosess. Denne informasjonen er et viktig bidrag for å belyse generelle molekylære mekanismer i organutvikling generelt, i tillegg til å gi spesiell kunnskap om hvordan utviklingen av tannanlegget er koordinert med utviklingen av nerveforsyningen. Som i andre vev og organer er noen spesielle familier av signalmolekyler slik som Fgf (Fibroblast growth factor) og Bmp (Bone morphogenetic protein) spesielt viktige i de epitel-mesenkymale interaksjoner under tannutviklingen (3) (Tabell 1). Mange av de viktige signalmolekylene er produsert av primær-, sekundær- og tertiær emalje-epitel-knute, signalsentra, som styrer utforming av tannkronen gjennom de forskjellige stadier av tannutviklingen (4, 5). Det foreligger mye forskningsresultater som viser hvordan de enkelte signalmolekyler deltar i komplekse, sammenhengende signalnettverk som styrer tannutvikling. Dette nettverket er, i sin tur, regulert av blant annet ulike spesifikke inhibitoriske signalmolekyler. Som det er vist i funksjonelle og genetiske analyser av Fgf-antagonist, Sprouty og Wnt-antagonist, Dickkopf, som hemmer funksjonen av henholdsvis Fgf og Wnt, synes en modulering av Fgf og Wnt-signaler å ha viktige funksjoner i tannens utvikling (6, 7).
Liste over noen gener som er involvert i regulering av utvikling av tannanleggets innervasjon og form
TGF
FGF (fibroblast-vekstfaktor) ble funnet i fibroblast-cellekultur som en faktor, som økte celledeling.
NGF (nerve-vekstfaktor) fremmer aksonvekst
GDNF («Glial cell-line derived nerve growth factor») fremmer aksonvekst
Netrin3 ser ut til å fremme aksonvekst
NCam («Neural cell adhesion molecule») ble funnet å aggregere nevronale celler
Sema3A hindrer nervevekst
Utvikling av tannens sensoriske nerveforsyning
For å kunne utøve en livslang fysiologisk funksjon og bli beskyttet mot overbelastning og skader, er en ferdig utviklet og funksjonell tannpulpa rikt utstyrt med sensoriske nervefibre fra trigeminusgangliet (se oversikt (8) (Figur 2). Sensoriske nervefibre i pulpa reagerer på og overfører smerteimpulser fra termiske, mekaniske, elektriske og kjemiske stimuli. Sensoriske nervefibre har også viktige funksjoner i å regulere blodgjennomstrømming og vevstrykk og i å delta i rekruttering av immunceller (9, 10). I tillegg viser nyere data at sensorisk innervasjon også ser ut til å regulere amelo-, odonto- og sementoblast-funksjon (11). Tannpulpa og festeapparat er også utstyrt med sympatisk nerveforsyning fra det superiore cervikale halsganglion. Sympatiske nervefibre innerverer ikke dentinet, men forsyner hovedsakelig blodkar i tannpulpa og i tannens festeapparat, og modulerer vevenes immunrespons (12).
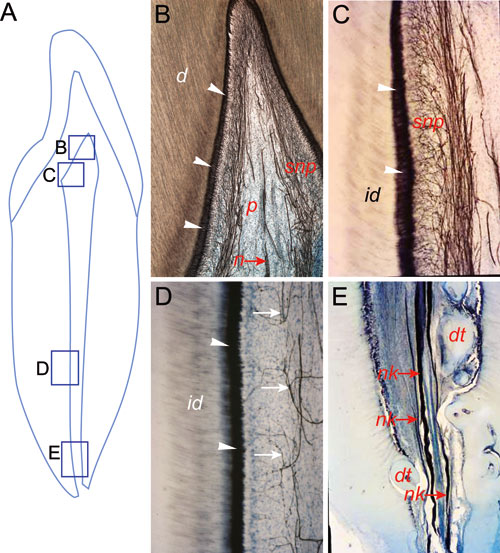
Figur 2. Nerveforsyningen i en incisiv påvist ved hjelp av PGP 9.5 (protein gene-product 9.5) antistoff hos en voksen person (40 år). A: Skjematisk oversikt med markering av utsnitt gjengitt i B, C, D, og E. B: Kronepulpa er rikelig forsynt med nervefibre (n) som følger blodkarene sentralt i pulpa (p) og danner uttallige forgreninger (snp) i kronepulpas periferi. Hvite pilespisser viser odontoblastlaget, som er sterkt farget med anti-PGP9.5 antistoff. C: Utsnitt fra kronepulpa og dentin som viser et uttalt nervepleksus (snp) i subodontoblastlaget. Pulpanært predentin og dentin er innervert (id). D: Utsnitt fra rotdentin og rotpulpa viser en sparsom nerveforgrening (hvite piler) i relasjon til odontoblastlaget (hvite pilespisser). E: Nerveforsyningen i apikalområdet er dominert av tykke nervebunter langs blodkar. Forkortelser: d, dentin; dt, dentikler; id, innervert dentin; nk, nervekar-bunt; p, pulpa; snp, subodontoblastisk nervepleksus.
Før utviklingen av tannens nerveforsyning kan gå over i en modningsfase, må nervefibrene ha utviklet seg og vokst over betydelige avstander for å nå sitt målorgan, dvs. det voksende tannanlegget. Første molar hos mus er en vanlig brukt modell for å analysere utviklingen av tannens sensoriske nervesystem. Ved å bruke denne modellen er det vist at navigering av sensoriske pionéraksoner, som utgår fra trigeminalgangliet, ikke er en tilfeldig prosess: aksonene utvikles og ledes etter et strengt regulert mønster (13, 14) (Figur 1). I underkjeven følger «molarnerven», som utgår først fra hovedgrenen til n. mandibularis, en vel definert rute mot anlegget til 1. molar, hvor den deler seg i en bukkal og en lingual nervegren (13). I kappe- og tidlig klokkestadium etableres et nervepleksus nær inngangen til tannpapilla. Sensoriske nervefibre får adgang til tannpulpa først etter at tannkronen er formet og dentin og emalje er avsatt i kuspene eller i incisalkanten (14, 15). Sensoriske nervefibre forgrener seg rikelig i subodontoblast-, odontoblast- og predentin-området i tannkronen der nervefibre også går et stykke (100 – 150 m) inn i dentinkanalene (her kalt odontoblast-dentin målområdet). Derimot er forgreningen av nervefibre i tilsvarende områder i rotpulpa betydelig mindre (Figur 2). De trigeminusfibrene som forblir utenfor tannpulpa, deltar i innervasjonen av tannens festeapparat når røttene utvikles. Samlet viser disse resultatene helt klart at innervasjon av tannpulpa og tannsekken foregår etter et nøye regulert mønster og under streng molekylær kontroll (1).
Vevsinteraksjoner regulerer navigasjonen av sensoriske aksoner i tannorganet
Generelle utviklingsstudier har vist at sensoriske nervefibre blir ledet til sine spesielle målområder av tiltrekkende og frastøtende signaler i omliggende vev (16). Det er økende eksperimentelle bevis, spesielt fra analyser av forskjellige transgene muselinjer, for at tannen styrer utviking av sin egen innervasjon, og at dette er kontrollert av molekyler som produseres lokalt i selve målorganet, dvs. i tannanlegget (1). De fleste av disse molekylene opptrer i takt med tannanleggets utvikling. Dette indikerer at lokale molekylære signalmekanismer, slik som interaksjoner mellom tannmesenkym og -epitel, kontrollerer når de enkelte molekyler skal komme på banen (1, 17). Dette ble nylig bekreftet for signalmolekylet Semaphorin3A (Sema3A) i tannanlegget (13). Under tannutviklingen opptrer Sema3A i bestemte områder som tydelig unngås av sensoriske nervefibre (se Figur 3, som viser hvor i tannanlegget Sema3A-uttrykk finnes på knoppstadiet). I transgene mus som mangler Sema3A, blir tannanlegget innervert tidligere enn normalt og mangler et normalt innervasjonsmønster, men har derimot mange aksoner som utvikler seg uorganisert i forhold til målorganet, fordi aksonene vokser til feil steder. Dette viser at Sema3A kontrollerer både tidspunkt og innervasjonsmønster av tannens sensoriske nerveforsyning (13).
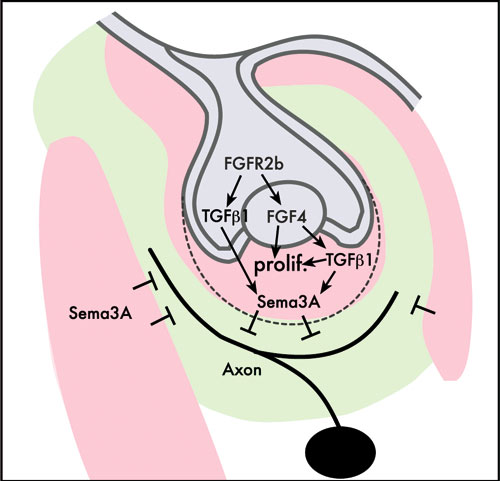
Figur 3. Skjematisk oversikt over de viktigste interaksjoner mellom dentalt epitel og mesenkym som koordinerer tannutvikling og sensorisk aksonvekst fra trigeminus. Bildet illustrerer første musemolar i underkjeven i kappestadiet. Fgfr2b regulerer uttrykk av vekstfaktorene Fgf4 og Tgf
Under tannutviklingen opptrer flere molekyler som regulerer aksonvekst samtidig som vevsinteraksjoner mellom epitel og mesenkym pågår. Generelt er dette blitt tolket slik at det er vevsinteraksjonene som egentlig bestemmer veien som aksonene skal ta og hvilke områder de ikke kan velge. Nylig fikk denne hypotesen sterk støtte da det ble vist at det er vevsinteraksjoner som regulerer hvordan Sema3A opptrer i tannanlegget. I tillegg ble det demonstrert at Wnt4 og Tgf
Koordinert utvikling av tannanleggets form og sensoriske innervasjon
For å samordne utvikling av tannens form og den sensoriske nerveforsyning til et funksjonelt tannorgan, må det finnes styringsmekanismer som kan integrere disse to tilsynelatende distinkte prosessene. Tilgjengelige data som er framkommet ved hjelp av eksperimentelle og genetiske analyser, indikerer at interaksjoner mellom tannepitel og -mesenkym kontrollerer både formgiving av tannorganet og utvikling av sensorisk nerveforsyning i tannen. Vevsinteraksjonene har dermed en viktig rolle i koordinering av utvikling av tannens ulike anatomiske strukturer til et funksjonelt organ i munnhulen.
English summary
Development of tooth form, and sensory nerve supply are strictly coordinated
To get a functional tooth, coordinated development of many anatomical structures and physiological systems is essential. Peripheral trigeminal sensory innervation is of high importance for the function and protection of the teeth. The development of the tooth innervation is intimately linked with advancing tooth formation. Recent molecular and genetic data have provided evidence that local epithelial-mesenchymal tissue interactions are part of the odontogenic signaling network that not only control the formation of the tooth organ proper but also the trigeminal axon navigation. Tissue interactions, thus, appear to provide the mechanisms to integrate formation of tooth shape and development of dental sensory innervation.
Kettunen P. Utviklingen av tannens form og sensorisk nerveforsyning er samordnet. Nor Tannlegeforen Tid. 2009;119:162–6. doi:10.56373/2009-3-3
Takk
Takk til Kjellfrid Haukanes for utmerket teknisk hjelp. Økonomisk støtte til dette arbeidet er gitt av L. Meltzers høyskolefond, Universitetet i Bergen og Helse Vest.
Hovedbudskap | |
|---|---|
• |
Tannen får sin sensoriske nerveforsyning fra trigeminus-gangliet |
• |
Tannanleggets innervasjon er sterkt knyttet til utvikling av tannanleggets form |
• |
Sema3A er et molekyl, som kontrollerer både tidspunkt og innervasjonsmønster av tannens sensoriske nerveforsyning |
• |
Fgfr2b er en vekstfaktorreseptor, som regulerer både utvikling av tannanleggets form og innervasjon |
Referanser
1. Luukko K, Kvinnsland IH, Kettunen P. Tissue interactions in the regulation of axon pathfinding during tooth morphogenesis. Dev Dyn 2005; 234: 482 – 8.
2. Thesleff I, Hurmerinta K. Tissue interactions in tooth development. Differentiation 1981; 18: 75 – 88.
3. Thesleff I. The genetic basis of tooth development and dental defects. Am J Med Genet A 2006; 140: 2530 – 5.
4. Jernvall J, Kettunen P, Karavanova I, Martin LB, Thesleff l. Evidence for the role of the enamel knot as a control center in mammalian tooth cusp formation: non-dividing cells express growth stimulating Fgf-4 gene. Int J Dev Biol 1994; 38: 463 – 9.
5. Luukko K, Løes S, Furmanek T, Fjeld K, Kvinnsland IH, Kettunen P. Identification of a novel putative signaling center, the tertiary enamel knot in the postnatal mouse molar tooth. Mech Dev 2003; 120: 270 – 6.
6. Fjeld K, Kettunen P, Furmanek T, Kvinnsland IH, Luukko K. Dynamic expression of Wnt signaling-related Dickkopf1, -2, and -3 mRNAs in the developing mouse tooth. Dev Dyn 2005; 233: 161 – 6.
7. Klein OD, Minowada G, Peterkova R, Kangas A, Yu BD, Lesot H, et al. Sprouty genes control diastema tooth development via bidirectional antagonism of epithelial-mesenchymal FGF signaling. Dev Cell 2006; 11: 181 – 90.
8. Fried K, Nosrat C, Lillesaar C, Hildebrand C. Molecular signaling and pulpal nerve development. Crit Rev Oral Biol Med 2000; 11: 318 – 32.
9. Fristad I, Heyeraas KJ, Jonsson R, Kvinnsland IH. Effect of inferior alveolar nerve axotomy on immune cells and nerve fibres in young rat molars. Arch Oral Biol 1995; 40: 1053 – 62.
10. Byers MR, Suzuki H, Maeda T. Dental neuroplasticity, neuro-pulpal interactions, and nerve regeneration. Microsc Res Tech 2003; 60: 503 – 15.
11. Fristad I, Vandevska-Radunovic V, Kvinnsland IH. Neurokinin-1 receptor expression in the mature dental pulp of rats. Arch Oral Biol 1999; 44: 191 – 5.
12. Haug SR, Heyeraas KJ. Modulation of dental inflammation by the sympathetic nervous system. J Dent Res 2006; 85: 488 – 95.
13. Kettunen P, Løes S, Furmanek T, Fjeld K, Kvinnsland IH, Behar O, et al. Coordination of trigeminal axon navigation and patterning with tooth organ formation: epithelial-mesenchymal interactions, and epithelial Wnt4 and Tgfbeta1 regulate semaphorin 3a expression in the dental mesenchyme. Development 2005; 132: 323 – 34.
14. Moe K, Kettunen P, Kvinnsland IH, Luukko, K. Development of the pioneer sympathetic innervation into the dental pulp of the mouse mandibular first molar. Arch Oral Biol 2008; 53: 865 – 73.
15. Fristad I, Heyeraas KJ, Kvinnsland IH. Nerve fibres and cells immunoreactive to neurochemical markers in developing rat molars and supporting tissues. Arch Oral Biol 1994; 39: 633 – 46.
16. Dickson BJ. Molecular mechanisms of axon guidance. Science 2002; 298: 1959 – 64.
17. Luukko K, Møe K, Sijaona A, Furmanek T, Kvinnsland IH, Midtbø M, et al. Secondary induction and the development of tooth nerve supply. Ann Anat 2008; 190: 178 – 87.
18. Jarvinen E, Salazar-Ciudad I, Birchmeier W, Taketo MM, Jervall J, Thesleff I. Continuous tooth generation in mouse is induced by activated epithelial Wnt/beta-catenin signaling. Proc Natl Acad Sci U S A 2006; 103: 18627 – 32.
19. Kratochwil K, Galceran J, Tontsch S, Roth W, Grosschedl R. FGF4, a direct target of LEF1 and Wnt signaling, can rescue the arrest of tooth organogenesis in Lef1(-/-) mice. Genes Dev 2002; 16: 3173 – 85.
20. Kettunen P, Spencer-Dene B, Furmanek T, Kvinnsland IH, Dickson C, Thesleff I, et al. Fgfr2b mediated epithelial-mesenchymal interactions coordinate tooth morphogenesis and dental trigeminal axon patterning. Mech Dev 2007; 124: 868 – 83.
Adresse: Päivi Kettunen, Institutt for biomedisin, Det medisinsk-odontologiske fakultet, Universitetet i Bergen, Jonas Lies vei 91, 5009 Bergen. E-post: paivi.kettunen@biomed.uib.no
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Kettunen P. Utviklingen av tannens form og sensorisk nerveforsyning er samordnet. Nor Tannlegeforen Tid. 2009;119:162–6. doi:10.56373/2009-3-3