Ultralydundersøkelser i hode og halsregionen
Forfattere
dr.odont.,associate professor, specialist in Oral and Maxillofacial Radiology, Department of Maxillofacial Radiology, Faculty of Dentistry, University of Oslo
ph.d.,specialist in Oral and Maxillofacial Radiology, Surgical Hospital, Department of Radiology, P.O.Box 263, FIN-00029, HUS, Finland, Phone (work) +358 – 40 – 5868994m satu.apajalahti@hus.fi
odont.dr., specialist in Oral and Maxillofacial Radiology, Department of Radiology, Sunderby Hospital, Luleå, Sweden
Tannleger bør ha et visst kjennskap til ultralyddiagnostikk i hode og halsregionen og hvordan ultralydundersøkelser i dag brukes som veiledning ved forskjellige typer inngrep. En ultralydundersøkelse er en ikke-invasiv prosedyre, der man benytter lydbølger framfor ioniserende stråling. Formålet med artikkelen er å gi et aktuelt sammendrag av hvordan ultralydundersøkelser brukes i diagnostikk av tilstander i spyttkjertler og lymfekjertler. Artikkelen vil også berøre hvordan ultralydveiledning brukes i forbindelse med nålebiopsier, injeksjonsbehandling og kirurgisk behandling. Ny forskning om intraorale ultralydundersøkelser innen diagnostikk av tenner og dentalveolært ben vil også bli presentert.
Tannleger har lenge vært «sin egen radiolog» og diagnostisert tilstander i tenner og omkringliggende benvev. I dag henviser mange tannleger i Norden til kjeve-og ansiktsradiolog eller medisinsk radiolog for utvidete radiologiske undersøkelser der det er indisert med mer avanserte metoder for å påvise alvorlige tilstander i skjelett og bløtvev.
Ultralydundersøkelser har vært anvendt som metode i medisinsk diagnostikk siden tidlig på 1950-tallet, da Wild og Reid (1), Howry og Bliss (2) klarte å avbilde indre organer ved hjelp av ultralyd. I dag brukes ultralydundersøkelser spesielt i forbindelse med svangerskapsdiagnostikk og diagnostikk av brystkreft, og mer generelt i diagnostikk av ulike indre organer og bløtvev, som store blodkar, muskulatur, nervevev og kjertelvev.
Generelt er ultralydundersøkelser, på grunn av typiske sonografiske vevskarakteristika godt egnet til å klassifisere inflammatoriske, neoplastiske, kongenitale, traumatiske og vaskulære lesjoner. I tillegg er ultralyd en utmerket undersøkelse for å lokalisere lesjoner i forhold til anatomi og til å følge lesjoners progresjon og regresjon. I hode- og halsområdet har ultralydundersøkelser fram til nå vært mest brukt til spyttkjerteldiagnostikk (3 – 5) og tumordiagnostikk (6 – 9), men er i senere tid også benyttet i forbindelse med diagnostikk av kjeveledd (10 – 12) og ved evaluering av hevelser i ansiktsmuskulatur (13).
Virkemåte
Ultralyd fungerer i prinsippet som et ekkolodd. Et ultralydapparat sender lydbølger inn i kroppen og «lytter» til ekkoet. Ultralydundersøkelser er basert på lydbølger med en frekvens på 1 – 20 Mega-Hertz (MHz), som er høyere enn det menneskets øre kan oppfatte. Lydhodet på et ultralydapparat virker både som en sender og en mottaker. En piezoelektrisk transduser, som sitter ytterst på lydhodet, settes i svingninger av elektriske signaler i Mega-Hertz-området. Lydbølger sendes inn i vevet, reagerer med vevet, reflekteres tilbake og produserer elektriske signaler, som igjen omdannes til et bilde på en skjerm.
Man kan gjøre både ekstraorale og intraorale undersøkelser, og det benyttes forskjellige lydhoder og forskjellig frekvens på lydbølgene, avhengig av hvor dypt strukturene man skal undersøke ligger. For dypereliggende strukturer anbefales at man bruker lydhoder med en frekvens på ca. 5 MHz. For mer overflatiske strukturer anbefales at man bruker lydhoder som har over 5 – 8 MHz. Sammenliknet med andre undersøkelsesmetoder er ultralydundersøkelser i særlig grad basert på undersøkerens anatomiske og patofysiologiske kunnskaper, manøvrering av lydhodet og tolking av ultralydsnittbilder i sann-tid (14). Fig. 1 viser en ultralydundersøkelse med vevskarakteristika av normal muskulatur og normalt kjertelvev.
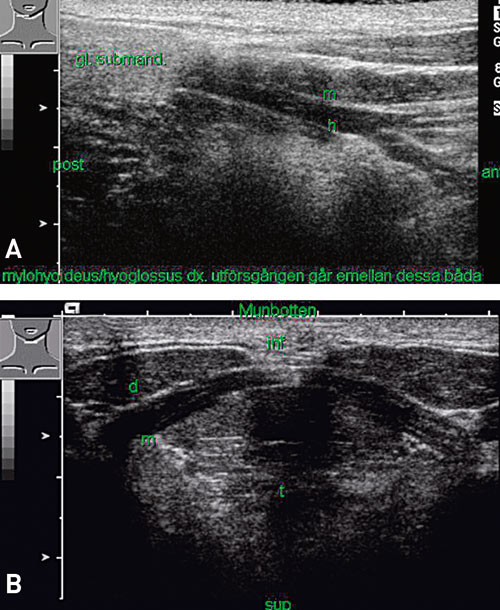
Fig. 1. Ultralydundersøkelse av munnbunnen. Skjematisk bilde viser plassering av lydhodet. A: Glandula submandibularis i bildets øvre venstre hjørne. B: Fremre del av munnbunnen. d = m. digastricus, m = m. mylohyoideus, t = tunga. Observer at bildene presenteres «opp – ned», slik som i klinikken.
Ultralydundersøkelser av spyttkjertler
Normalanatomi
Glandula submandibularis ligger i submandibulær-rommet på høyde med digastricusmuskelens anteriore buk. På ultralyd viser kjertelen en homogen struktur som er hyper-ekkogen i forhold til omgivende muskulatur. Iblant kan man se intraglandulære ganger som tynne hyper-ekkogene linjer. Kjertelen har to deler, en stor ytredel og en mer posterior, superior dyp del som omgir mylohyoideusmuskelens bakre kant. Hovedutførselsgangen, den såkalte Whartons duct, utgår fra hilus sentralt i kjertelen og løper medialt om m. mylohyoideus og glandula sublingualis fram til munningen i fremre munngulv ved caruncula sublingualis. Utførselsgangen er ofte vanskelig å identifisere i normale kjertler og framtrer tydeligst når den er patologisk utvidet. Glandula parotis ligger hovedsakelig dorsalt for bakre kant på ramus mandibulae og deles av facialisnerven i en ytre og en dypereliggende del. Parotiskjertelen sees på ultralyd som homogen og hyper-ekkogen i forhold til omgivende muskulatur. Det er ikke uvanlig at den ytterstedelen har en anterior utløper bukkalt for ramus mandibulae. Den dype delen er vanskelig å undersøke i sin helhet med ultralyd da den ligger i skyggen av underkjeven. Facialisnerven kan normalt ikke sees på ultralyd, men man kan ledes fram til dens posisjon der den ligger umiddelbart lateralt for vena retromandibularis og arteria carotis externa. Begge disse kareneløper gjennom parotiskjertelen og kan tydelig identifiseres med ultralyd Doppler.
Utførselsgangen, ductus parotidea, utgår sentralt i kjertelen, løper utenom m. masseter, svinger rundt fremre kant, trenger gjennom m. buccinator for å munne ut på innsiden av kinnet på høyde med andre overkjevemolar i papilla parotidea. Den framtrer på ultralyd som en høy-ekkogenlinje, men liksom i glandula submandularis kan utførselsgangen være vanskelig å identifisere når den ikke er patologisk utvidet.
Lymfekjertler sees normalt både submandibulært og i parotiskjertelen, vanligst pre-auriculært eller i den kaudale delen av parotis. Ultralydundersøkelse av mistenkt spyttkjertelpatologi omfatter som regel munngulvet (Fig. 1) samt de store spyttkjertlene glandula parotis og submandibularis bilateralt. Bilaterale forandringer kan nemlig tyde på systemsykdom, og ved unilateral patologi er det verdifullt å sammenlikne med utseendet på den «friske» siden. Vår erfaring er at høyoppløselig ultralydapparatur med arbeidsfrekvenser over 8 MHz er en forutsetning for undersøkelse av spyttkjertlene og et frekvens område omkring 12 – 15 MHz er optimalt. Undersøkelsesresultatet beror i stor grad på operatørens erfaring, dyktighet og fortrolighet med normalanatomien i området. Dette er en av svakhetene med ultralydteknikken.
Patologi
Ultralydteknikkens store fordel når det gjelder undersøkelse av spyttkjertler, er, foruten fraværet av potensielt skadelig røntgenstråling, at den har svært høy sensitivitet når det gjelder å oppdage svulster i spyttkjertlene. Ultralyd er således en bra førstelinjes utelukkingsmetode. Svulster i spyttkjertlene er uvanlige. De fleste er benigne (70 – 80 %) og ligger i glandula parotis (80 – 90 %). Enda bare 10 – 15 % av alle spyttkjertelsvulstene forekommer i glandula submandibularis, er den relative insidensen av maligne svulster så høy som cirka 50 % (15 – 17). De vanligste svulstene i de store spyttkjertlene er benigne pleomorfe adenom og Warthin`s tumor (cystadenolymfom). Såvel benigne som maligne svulster i spyttkjertlene er vanligvis hypo-ekkogene. Pleomorfe adenomer er som regel avrundede i sin avgrensing og homogene i sin struktur mens Warthins tumor ofte er oval og inhomogen med innslag av ekkofattige områder (Fig. 2). De vanligste maligne spyttkjertelsvulstene er mukoepidermoid karsinom og adenocystisk karsinom (Fig. 3).
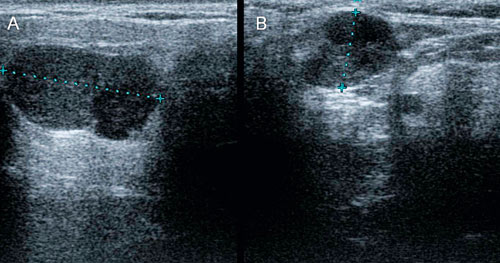
Fig. 2. A: Pleomorft adenom i glandula parotis. Noter tydelig definert avgrensing og homogen ekko-genesitet B: Whartins tumor. Noter ekkofattig område i tumorens øvre del som representerer cystisk forandring.
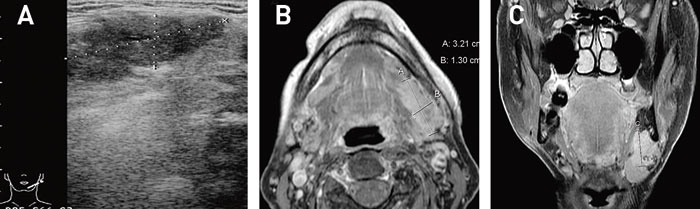
Fig. 3. Adenocystisk carcinom i venstre glandula submandibularis hos 73-årig kvinne. A: Ultralydbilde viser ujevnt avgrenset ekspansivitet med inhomogen ekko-genesitet. B: Transversal og C: Frontal magnetresonanstomografisk (MR) bilde av samme pasient. Kontrastforsterkede fettsuppremerte T1-vektede sekvenser. Svulsten er lokalisert i den anteriore delen av glandula submandibularis og måler 3,2 cm x 1,3 cm x 2,4 cm.
Disse svulstene har ofte en mer uregelmessig avgrensning og tegnes mer inhomogene enn pleomorfe adenom. Ingen av de beskrevne tegnene på ultralyd er imidlertid utslagsgivende for diagnosen av disse svulstene, og benigne svulster kan ikke differensieres sikkert fra maligne svulster enda det er rapportert om opptil 89 % sensitivitet (18). Ultralyd er imidlertid en utmerket metode til å styre prøvetaking gjennom finnålspunksjon eller grovnålsbiopsi, hvilket øker den diagnostiske treffsikkerheten (19,20).
Ultralyd har også en høy treffsikkerhet når det gjelder diagnostikk av sialolithiasis (spyttstener) og tilhørende følgetilstander som akutt sialoadenitt (spyttkjertelinflammasjon). Spyttstener forekommer oftest i glandula submandibularis, i følge litteraturen i opptil 90 % av tilfellene (21 – 24). Vår kliniske erfaring er at det sannsynligvis forekommer spyttstener oftere i parotiskjertelens utførselsgang enn det som angis i litteraturen. Muligens beror dette på at stener i ductus parotidea ofte ikke er forkalkede og således ikke er lette å oppdage med tradisjonelle røntgenmetoder. På ultralyd opptrer spyttstener som kraftig hyper-ekkogene foci som skygger bakenforliggende strukturer (4). Ofte ser man også dilaterte utførselsganger proksimalt for spyttstenen (Figs. 4, 5). En diagnostisk fallgrop kan være luft blandet med saliva fra munnbunnen som kanimitere spyttsten i utførselsgangen til glandula submandibularis (25). Akutte sialoadenittiske forandringer i spyttkjertelen oppstår regelmessig som en følge av obstruerte, symptomgivende spyttstener, selv om den vanligste genesen er viral eller bakteriell infeksjon. Ved akutt sialoadenitt viser den affekterte spyttkjertelen en lavere ekko-genesitet enn normalt, har en inhomogen struktur og er som regel forstørret. Utvidete utførselsganger kan iblant sees som hypo-ekkogene tubulære strukturer med hyper-ekkogene vegger (Figs. 4 – 6).
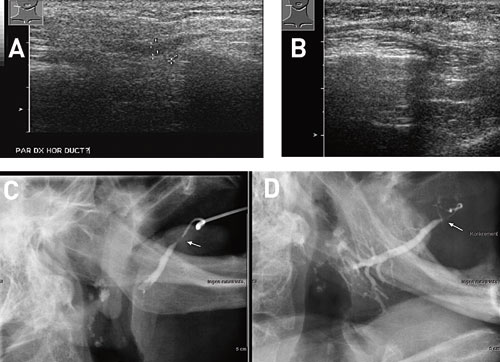
Fig. 4. 70-årig dame med anamnese på måltidsrelatert hevelse høyre kinn. A: En vid utførselsgang sentralt i parotiskjertelen, som viser noe inhomogen ekkogenesitet. B: Ultralyd viser på overflaten av m. masseter en høyekkogen struktur med bakskygge, som tolkes som forkalket konkrement. Noter dilatert utførselsgang proksimalt om konkrementet. C: Sialografi; lett kontrastinjeksjon viser konkrement som kontrastutsparing (pil) et par cm proksimalt for utførselsgangens munning og D) Etter å ha fjernet kanylen hindrer konkrementet tømming av kontrasten som ligger igjen i den dilaterte utførselsgangen proksimalt om konkrementet (pil).
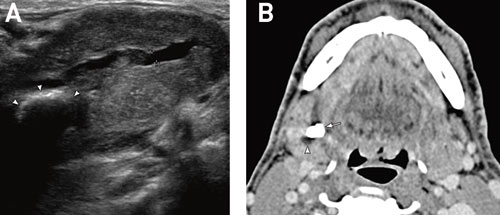
Fig. 5. Mann i 50-årsalderen kommer med smertefull hevelse høyre underkjeve, som ikke svarer på antibiotikaterapi. A: Ultralyd viser en kraftig utvidet utførselsgang sentralt i submanibulariskjertelen (+), samt en centimeterstor hyperekkogen struktur med ekkoskygge forenlig med en spyttsten (pilhodene). B: Computertomografi viser en tydelig forkalket spyttsten (pil) og utvidete utførselsganger intraglandulært proksimalt for stenen (pilhodet), som bekrefter funn på ultralyd. (Bilder fra Dr Lukin og Dr Jonsson, Kalix sjukhus).
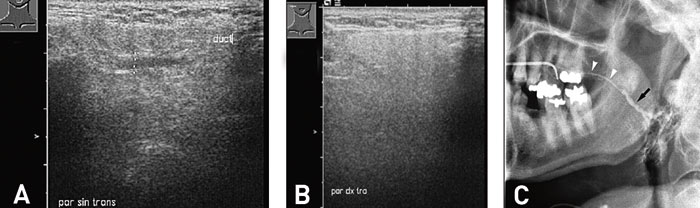
Fig. 6. Sialoadenitt. A: Ultralyd viser utvidet utførselsgang og inhomogen ekkogenesitet venstre glandula parotis og B: normal kjertel høyre side. C: Sialogram venstre glandula parotis viser tynn, delvis stenosert distalt segment av utførselsgangen med utvidete proksimale ganger intraglandulært (svart pil).
Andre tegn som innimellom kan sees på ultralyd ved akutt sialoadenitt (26), er økt blodgjennomstrømming og forstørrede lymfekjertler. Kroniske sialoadenitter viser som regel et mer uspesifikt bilde med små hypo-ekkogene lesjoner spredt i kjertelvevet. Liknende forandringer kan sees ved granulomatøse sykdommer som for eksempel sarcoidose, Sjögrens syndrom, lymfom og hivrelaterte forandringer (25). Ultralydundersøkelsen er i disse tilfellene ikke diagnostisk. Andre metoder som klinisk korrelasjon, laboratorieundersøkelser, finnåls-aspirasjons-biopsier (FNAB) og avanserte radiologiske metoder som sialografi, computertomografi (CT) eller magnettomografi (MRI) blir veiledende for diagnosen. Vi kan sammenfatte at ultralyd er en anvendelig førstelinjemetode for undersøkelse av spyttkjertlene. Metoden er ikke bare effektiv til å påvise eller ekskludere forekomsten av svulster, men kan i mange andre tilfeller gi oss en oppfatning av hvilken type spyttkjertelaffeksjon som foreligger.
Ultralydundersøkelser av cervikale lymfeknuter
Klassifisering av lymfeknuter
Det er omtrent 800 lymfeknuter i kroppen, hvorav 300 er lokalisert i halsområdet. American Joint Committee on Cancer (AJCC)-klassifiseringen av lymfeknuter deler palpable cervikale lymfeknuter inn i syv nivåer, basert på steds-spesifikk drenasje av den metastaserte svulsten (27) (Fig. 7). Det skal bemerkes at lymfeknutene i parotis, som alltid bør undersøkes systematisk på ultralyd, ikke er tatt med i klassifiseringen. Noen av lymfeknutene i AJCC-klassifiseringen kan ikke avbildes ved hjelp av ultralydundersøkelse.
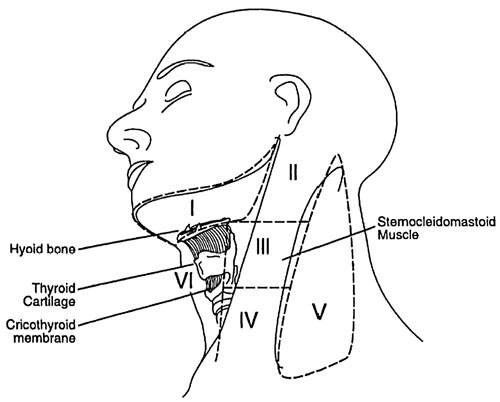
Fig. 7. AJCC-klassifisering av cervikale lymfeknuter; nivå I-lymfeknuter er submentale og submandibulære lymfeknuter; nivå II-lymfeknuter er jugulære lymfeknuter (ligger over hyoid benet); nivå III-lymfeknuter er midtre jugulære lymfeknuter (ligger mellom hyoidbenet og cricoidbrusken); nivå IV-lymfeknuter er nedre jugulære lymfeknuter (ligger nedenfor cricoidbrusken); nivå V er lymfeknuter i det bakre triangelet begrenset anteriort av m. sternocleidomastoideus; nivå VI er anteriore cervikale lymfeknuter. Nivå VII er øvre mediastinale lymfeknuter (ikke vist).
Cervikale lymfeknutemetastaser
Cervikale lymfeknutemetastaser er vanlig hos pasienter med plateepitelkarsinom i hode- og halsregionen allerede tidlig i sykdomsforløpet. Behandlingsplanlegging og prognose er basert på kunnskaper om tumors omfang (T-stadium) og graden av spredning til regionale lymfeknuter (N-stadium). Computertomografi og/eller magnettomografi er vanlig brukte bildemodaliteter. Ultralydundersøkelse blir brukt som tilleggsundersøkelse i halsområdet. Lymfeknutemetastaser på halsen er steds-spesifikke, og kunnskap om denne spesifikke utbredelsen hjelper til å identifisere metastaser. For eksempel ved munnhulekreft blir metastaser sendt primært til regio submentale, regio submandibulare og øvre region av halsen. Ultralyd er nyttig, spesielt i den postoperative fasen og når det er nødvendig med ultralydveiledet FNAB. En annen fordel med ultralyd er at man kan oppdage unormale tilstander i lymfeknutenes arkitektur og vaskularitet. Begrensningen med ultralydundersøkelser er relatert til det faktum at 25 – 40 % av pasientene har mikrometastaser til tross for normale funn på undersøkelsen (28).
Normale, reaktive og cervikale lymfeknutemetastaser
På ultralyd er lymfeknuter lette å identifisere innenfor det mer ekkogent omkringliggende bindevev og fettvev. Normale lymfeknuter viser seg hypo-ekkogene til ekkofrie og er vanligvis ovale eller flate (Fig. 8). En ekkogen hilus er et karakteristisk trekk ved normale cervikale lymfeknuter (Fig. 9). På flate lymfeknuter kan hilus bli sett som en tynn ekkogen linje. Lymfeknuter som inneholder spesielt mye fett, har en tykkere hilus, mens mindre lymfeknuter har mindre sannsynlighet for å ha en ekkogen hilus. Man bør merke seg at ultralyd Doppler kan vise normalt vaskulært mønster ved hilus selv om den ekkogene hilus ikke er synlig på gråskala-ultralyd.
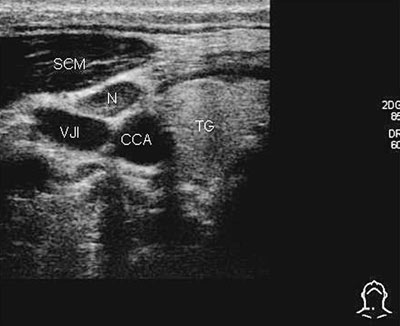
Fig. 8. Transversalt snitt av halsen venstre side. M. sternocleidomastoideus er markert med (SCM), vena jugularis interna (VJI), arteria carotis comunis (CCA), lymfeknute (N), glandula thyroidea (TG).
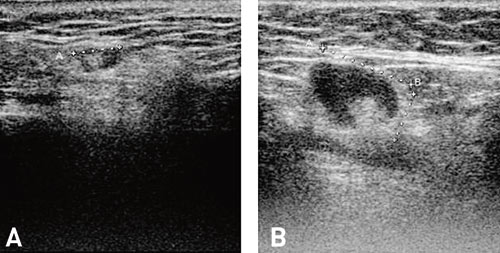
Fig. 9. A: Normal liten lymfeknute i glandula parotis med typisk beliggende ekkogen hilus (lengdesnitt). B: Normal submandibulær lymfeknute som viser en ekkogen hilus, som fortsetter over i omgivende fettvev.
Størrelsen på cervikale lymfeknuter kan variere i forskjellige områder på halsen. Normale jugulodigastricus-knuter, nær mandibelvinkelen, er vanligvis større enn lymfeknuter i andre regioner. Reaktive forstørrede lymfeknuter sees i forbindelse med akutte og langvarige kroniske inflammatoriske prosesser. Som normale lymfeknuter beholder reaktive forstørrede lymfeknuter en oval form og vanligvis en ekkogen hilus (Fig. 10). Lymfeknutemetastaser er runde og har sjelden en ekkogen hilus, et ultralydtrekk som gir sterk mistanke om malignitet (Fig. 11). Formen til lymfeknuter kan angis som forholdstallet mellom lymfeknutens korte og lange akse (short-to-long axis) S: L ratio. En S: L-ratio mindre enn 0,5 indikerer en oval lymfeknute, mens en lymfeknute med en S: L-ratio større enn 0,5 er en rund lymfeknute (29). Normale cervikale lymfeknuter har vanligvis en større diameter i lengderetningen (parallelt med vena jugularis interna) og en mindre diameter i transversalplanet.
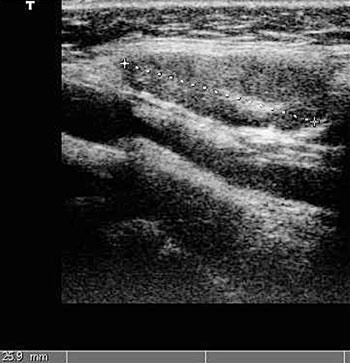
Fig. 10. Inflammatorisk submandibulær lymfeknute forårsaket av dental infeksjon på en 11-årig gutt. Lymfeknuten er oval med veldefinerte grenser og en ekkogen hilus.
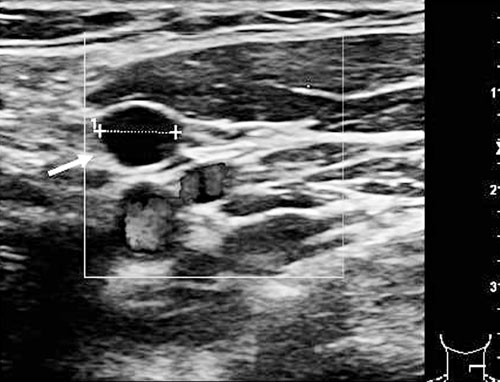
Fig. 11. Ultralyd Doppler viser en liten rund lymfeknute metastase (pil). Lymfeknuten er hypo-ekkogen, avaskulær og er uten en ekkogen hilus.
På pasienter med kreft i hode- og halsregionen skal alltid forstørrede lymfeknuter avstedkomme en mistanke om metastaser. Størrelse er det mest brukte kriterium for å differensiere lymfeknutemetastaser fra normale lymfeknuter. Sensitiviteten og spesifisiteten avhenger sterkt av den «cut-off»-verdien som blir brukt. Når man bruker størrelse som kriterium, anses den minste diameteren i transversalplanet som den mest pålitelige diameteren. Likevel kan ikke størrelse være det eneste kriterium når man undersøker lymfeknuter, andre ultralydkarakteristika må også vurderes.
Når man bruker ultralyd Doppler, har normale og reaktive lymfeknuter tendens til å se ut som de er vaskulariserte ved hilus eller er avaskulære (30). Maligne lymfeknuter viser tydelige kapsulære blodårer i tillegg til eller istedenfor normale blodårer ved hilus (31).
Intranodulær cystisk nekrose er et vanlig funn i lymfeknutemetastaser fra plateepitelkarsinom. Forekomsten av nekrose øker med størrelsen på lymfeknuten. Cystisk nekrose sees som et hypo-ekkogent område inne i lymfeknuten. Disse hypo-ekkogene områdene er vanskelig å identifisere, og det nekrotiske området må være større enn 3 mm for å kunne bli sett på ultralyd (32,33). Iso-ekkogent og til og med litt hyper-ekkogent mønster sees ofte i store lymfeknutemetastaser (Fig. 12). Solitære cystiske metastaser lateralt på halsen kan se pseudocystiske ut og må ikke feildiagnostiseres som en infeksiøs lateral hals-cyste (Fig. 13).
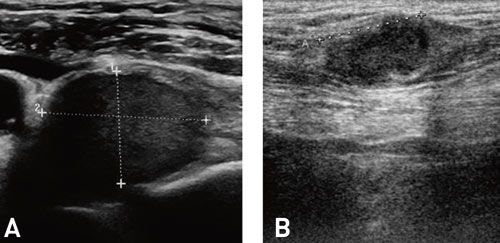
Fig. 12. A: Stor lymfeknute metastase med nekrose. B: Lymfeknute metastase med dårlig definerte grenser.
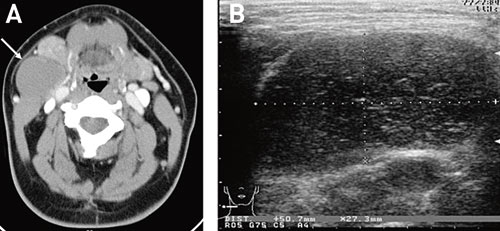
Fig. 13. A: Kontrastforsterket aksialt CT-bilde av en solitær cystisk hals lesjon (pil) på en 53-årig mann. Lesjonen er lokalisert mellom submandibulærkjertelen og m. sternocleidomastoideus på samme sted som en infeksiøs lateral hals-cyste. B: Ultralydbilde av samme lesjon minner om en benign infeksiøs lateral hals-cyste. Lesjonen viste seg å være en plateepitelkarsinom-metastase fra en ukjent primærtumor.
Ultralydveiledet undersøkelse og behandling
I dag brukes ultralydundersøkelser i økende grad som metode til å veilede eller «guide« radiologer og kirurger under biopsitaking, medikamentell behandling og før, under og etter kirurgiske inngrep.
Ultralydveiledet FNAB
Når det er behov for finnåls-aspirasjonsbiopsi for å diagnostisere lymfeknuter og andre lesjoner i hode- og halsområdet, utføres disse ofte i dag under ultralydveiledning. Ultralydveiledet FNAB kan oppdage metastaser i cervikale lymfeknuter når klinisk undersøkelse, CT- og MR-undersøkelse er negativ. Kunnskap om de forskjellige ultralydkarakteristika ved benigne og maligne lymfeknuter er helt nødvendig når man vurderer om det skal utføres finnålsbiopsi. På pasienter med kreft bør indikasjonen for ultralydveiledet FNAB vurderes meget raskt ved enhver mistenkelig lymfeknute, basert på de ultralydkarakteristika som er beskrevet ovenfor. Hos pasienter uten kjent malignitet kan vanlig ultralydkontroll være tilstrekkelig hvis en forstørret lymfeknute for øvrig er normal. I slike tilfeller er nøyaktig dokumentasjon vesentlig for en pålitelig etterkontroll. En økning i lymfeknutestørrelse på flere påfølgende undersøkelser gir mistanke om metastase.
Ultralydveiledet FNAB er førstevalg ved diagnostisering av overflatiske lesjoner i hode- og halsområdet (34). Ved dypereliggende lesjoner, som lymfeknuter i parapharyngealrommet, har intraorale ultralydveiledete undersøkelser ført til vellykket prøvetaking og diagnostisering. En av de største fordelene med en intraoral ultralydveiledet undersøkelse er at undersøkelsen gjør det mulig å visualisere de største blodårene og hindre ødeleggelse av blodårer under inngrep (34).
I senere tid er det vist at ultralydveildet FNAB i vesentlig grad kan bidra til å stille vanskelige diagnoser. Tuberkulose i glandula parotis er svært sjelden, og en tuberkuloseinfeksjon i glandula parotis er svært vanskelig å diagnostisere. Ultralydveiledet FNAB har vist seg å være en viktig metode når man skal stille diagnosen tuberkulose i parotis, etter at vanlig ultralydundersøkelse har utelukket tumor (35).
Ultralydveiledet injeksjonsbehandling
I kjeveleddene brukes injeksjoner med kortison og natriumhyaluronsyre som behandling av pasienter med sterke smerter og påvisbar osteoartritt i kjeveleddene (36,37). Behandlingen har vist god klinisk effekt på gape-evne og smertereduksjon. På grunn av anatomiske forhold er injeksjonene forholdsvis enkle å sette uten noen form for ultralydveiledning. I spyttkjertlene derimot, brukes ultralydveiledete injeksjoner av botulinumtoxin A på pasienter som har store sosiale problemer med økt spyttsekresjon (38). For pasienter med cerebral parese eller andre kroniske nevrologiske tilstander, brukes ultralydundersøkelse til å veilede behandleren inn i parotiskjertelen eller submandibularkjertelen før injiseringen av medikamentet. Anatomien av spyttkjertlene er svært forskjellig fra pasient til pasient, og det er vanskelige anatomiske forhold rundt kjertlene (39,40). En ultralydveiledet behandling sikrer at radiologen eller kirurgen injiserer medikamentet på rett sted i kjertelen og hindrer at medikamentet settes i vitale kar og blodårer.
Ultralydveiledet kirurgisk behandling
Ultralydundersøkelser er i dag non-invasive, billige, lett tilgjengelige og repeterbare undersøkelser som ikke innebærer ioniserende stråling for pasienten. Derfor brukes undersøkelsen i økende grad blant kirurger før, under og etter forskjellige typer kirurgisk behandling. Preoperativt og peroperativt kan undersøkelsen være nyttig til å lokalisere blodkar og nerver i operasjonsområdet. En ny in vitro studie har vist at lingualnerven, som har en meget nær beliggenhet til tenner og slimhinne, kan lokaliseres ved hjelp av ultralyd (41). Vanskelig lokaliserbare abscesser i ansiktet kan også lokaliseres ved hjelp av intraoperative ultralydundersøkelser. Thiruchelvam og medarbeidere (42) viser til en pasient med en stor hevelse på høyre side av ansiktet, der vanlig blind ekstraoral incisjon og drenasje ikke førte til reduksjon av hevelsen. Ved hjelp av intraoperativ ultralydundersøkelse klarte kirurgen å lokalisere resterende væske og pussansamlinger, legge inn et nytt dren og kontrollere at væskevolumet ble mindre.
CT-undersøkelse er blitt ansett av mange som «gull-standard«-undersøkelse for å identifisere og lokalisere fremmedlegemer. En ny studie har vist at 90 % av alle fremmedlegemer blir oppdaget ved hjelp av ultralyd, mot 70 % ved CT-undersøkelser (43). Hvis det går lang tid mellom en CT-undersøkelse og en operasjon, kan et fremmedlegeme ha beveget seg til et nytt område. Da er det berettiget med en ultralydundersøkelse under inngrepet for å lokalisere nøyaktig hvor fremmedlegemet ligger. Holmesog medarbeidere (2005) beskriver en mann der man på en CT-undersøkelse oppdager en metallkule under tungen (44). Under operasjonen finner man ingen kul og må sy igjen uten å ha fjernet metallkulen. Først etter å ha utført en intraoperativ ultralydveiledet undersøkelse greier man å lokalisere og fjerne kulen.
Ultralydveiledning kan også være til hjelp ved fjerning av spyttsten i små spyttkjertler i leppen (45) og til å bestemme svulsters yttergrense i forhold til friskt vev. Ved to tilfeller der maligne svulster hadde invadert hudoverflaten, var ultralyd overlegen i forhold til CT til å angi periferien av lesjonen (46). Ved hjelp av ultralyd kan kirurgen markere yttergrensene på hudoverflaten og planlegge en rekonstruksjon med frie reseksjonsrender samtidig som man kan bibeholde så mye hud som mulig.
Intraorale ultralydundersøkelser
Tradisjonelt har ultralydapparater vært store, dyre og hovedsakelig forbeholdt sykehusavdelinger. Innen medisinsk radiologi har intraorale ultralydundersøkelser vært brukt blant annet til å skille peritonsillære abscesser fra cellulitter fra 1990-tallet (47) og til å skille mellom medialt displasserte tonsiller forårsaket av tumor og forstørrede tonsiller forårsaket av inflammasjon (48).
Innen odontologi er anvendelsen av intraorale ultralydundersøkelser fortsatt på forsøkstadiet. Ulike ultralydsystemer med små lydhoder er under utvikling med hensyn på diagnostikk av tenner og alveolært ben, og bærbare ultralydapparater blir mer og mer vanlig.
Ny litteratur viser til spennende resultater der intraorale ultralydundersøkelser er forsøkt som metode til å diagnostisere karies (49), vurdere emaljetykkelse i forbindelse med erosjoner (50), emaljetap i forbindelse med abrasjoner (51), emaljesprekker i tenner (52) og til å vurdere periapikale benlesjoner og marginalt ben (53, 54). Gundappa og medarbeidere (2006) har utført en in vivo-studie, der målet var å undersøke hvor egnet ultralydundersøkelser, konvensjonelle og digitale røntgenundersøkelser var til å identifisere periapikal sykdom og hvordan modalitetene var til å differensiere periapikale cyster fra granulomer. De fant at ultralydundersøkelse var eneste metode blant de tre som kunne differensiere mellom granulom og cyste. Nylig ble det publisert en undersøkelse som indikerer at ultralyd kan være et alternativ til computertomografi når man skal vurdere bukkalt og lingualt ben etter implantatbehandling (54). Forskningsresultatene til nå antyder at intraorale ultralydundersøkelser kan ha et fremtidig potensiale som supplerende diagnostisk metode innen odontologien, men vil sannsynligvis kreve spesialkompetanse og utstyr med spesialtilpasset lydhode for vanskelig tilgjengelige områder i munnhulen.
English summary
Møystad A, Apajalahti S, Flygare L.
Ultrasound in the oral and maxillofacial region
106 – 13.
An ultrasound examination is a non-invasive, inexpensive and easily available examination, which does not include ionizing radiation for the patient. Therefore, it is increasingly used by radiologists and surgeons in the diagnosis and localization of lesions and foreign bodies in the head and neck region. Ultrasonography has a high sensitivity with regard to the detection of salivary gland tumours, and is commonly used as a complementary examination in the diagnosis of metastatic lymph nodes in patients with squamous cell carcinomas of the head and neck. Patients with benign or malignant lesions in the head and neck are rare but may occur in general dental practice. The intention of this paper is to summarize how ultrasonography is used today in the diagnosis of lesions in the head and neck region, focusing on salivary glands and cervical lymph nodes. Ultrasound-guidance during fine-needle aspiration biopsies (FNAB), intraglandular injections and surgical procedures, as well as research on intraoral ultrasound examinations will be discussed.
Litteratur
1. Wild JJ, Reid JM. Application of Echo-Ranging Techniques to the determination of structure of biological tissues. Science 1952; 115: 226 – 30.
2. Howry DH, Bliss WR. Ultrasonic visualization of soft tissue structures of the body. J Lab Clin Med 1952; 40: 579 – 92.
3. Howlett DC. High resolution ultrasound assessment of the parotid gland. Review. Br J Radiol 2003; 76: 271 – 7.
4. Alyas F, Lewis K, Williams M, Moody AB, Wong KT, Ahuja AT, et al. Diseases of the submandibular gland as demonstrated using high resolution ultrasound. Br J Radiol 2005; 78: 362 – 9.
5. Shimizu M, Okamura K, Yoshiura K, Ohyama Y, Nakamura S, Kinukawa N. Sonographic diagnostic criteria for screening Sjögren’s syndrome. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2006; 102: 85 – 93.
6. Shozushima M, Suzuki M, Nakasima T, Yanagisawa Y, Sakamaki K, Takeda Y. Ultrasound diagnosis of lymph node metastasis in head and neck cancer. Dentomaxillofac Radiol 1990; 19: 165 – 70.
7. Ng SY, Songra A, Ali N, Carter JL. Ultrasound features of osteosarcoma of the mandible--a first report. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2001; 92: 582 – 6.
8. To EW, Tsang WM, Cheng J, Lai E, Pang P, Ahuja AT, et al. Is neck ultrasound necessary for early stage oral tongue carcinoma with clinically N0 neck?Dentomaxillofac Radiol 2003; 32: 156 – 9.
9. Ariji Y, Maeda H, Naitoh M, Gotoh M, Izumi M, Aimiya H, et al. Ultrasonographic evaluation and differentiation of tumorous lesions in the floor of the mouth. Case reports and a review of the literature. Oral Sci Int 2006; 3: 135 – 44.
10. Manfredini D, Tognini D, Melchiorre D, Zampa V, Bosco M. Ultrasound assessment of increased capsular width as a predictor of temporomandibular joint effusion. Dentomaxillofac Radiol 2003; 32: 359 – 64.
11. Manfredini D, Tognini F, Melchiorre D, Bazzichi L, Bosco M. Ultrasonography of the temporomandibular joint: comparison of findings in patients with rheumatic diseases and temporomandibular disorders. A preliminary report. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2005; 100: 481 – 5.
12. Brandlmaier I, Bertram S, Rudisch A, Bodner G, Emshoff R. Temporomandibular joint osteoarthrosis diagnosed with high resolution ultrasonography versus magnetic resonance imaging: how reliable is high resolution ultrasonography? J Oral Rehabil 2003; 30: 812 – 7.
13. Sasaki J, Ariji Y, Sakuma S, Katsuno R, Kurita K, Ogi N, et al. Ultrasonography as a tool for evaluating treatment of the masseter muscle in temporomandibular disorder patients with myofascial pain. Oral Radiol 2006; 22: 52 – 7.
14. Bratland S Z, Ødegaard S. Ultralydundersøkelse-noe for allmennpraksis? Tidsskr Nor Lægeforen 2007; 127: 1923.
15. Bradley MJ. Salivary glands. In: Ahuja AT, Evans RM, editors. Practical head and neck ultrasound. London: Greenwich Medical Media; 2000; p. 19 – 33.
16. Silvers AR, Som PM. Salivary glands. Radiol Clin North Am 1998; 36: 941 – 66.
17. Renehan A, Gleave EN, Hancock BD, Smith P, McGurk M. Long-term follow-up of over 1000 patients with salivary gland tumours treated in a single centre. Br J Surg 1996; 83: 1750 – 4.
18. Wittich GR, Scheibe WF, Haget PC. Ultrasonography of the salivary glands. Radiol Clin N Am 1985; 23: 29 – 37.
19. Howlett DC. High resolution ultrasound assessment of the parotid gland. Br J Radiol 2003; 76: 271 – 7.
20. Howlett DC, Alyas F, Wong KT, Lewis K, Williams M, Moody AB, et al. Sonographic assessment of the submandibular space. Clin Radiol 2004; 59: 1070 – 8.
21. Escudier MP, McGurk M. Symptomatic sialadenitis and sialolithiasis in the English population: an estimate of the cost of hospital treatment. Br Dent J 1999; 186: 463 – 6.
22. Lustmann J, Regev E, Melamed Y. Sialolithiasis: a survey on 245 patients and a review of the literature. Int J Oral Maxillofac Surg 1990; 19: 135 – 8.
23. Marchal F, Dulgerov P, Becker M, Barki G, Disant F, Lehmann W. Specificity of parotid sialendoscopy. Laryngoscope 2001; 111: 264 – 71.
24. archal F, Dulgerov P, Becker M, Barki G, Disant F, Lehmann W. Submandibular diagnostic and interventional sialendoscopy: new procedure for ductal disorders. Ann Otol Rhinol Laryngol 2002; 111: 27 – 35.
25. Bialek EJ, Jakubowski W, Zajkowski P, Szopinski KT, Osmolski A. US of the major salivary glands: anatomy and spatial relationships, pathologic conditions, and pitfalls. Radiographics 2006; 26: 745 – 63.
26. Gritzmann N, Rettenbacher T, Hollerweger A, Macheiner P, Hubner E. Sonography of the salivary glands. Eur Radiol 2003; 13: 964 – 5.
27. Fleming ID, Cooper JS, Henson DE, Hutter RW, Kennedy BJ, Murphy GP, et al. American Joint Committee on Cancer Staging manual, 5th ed., Philadelphia: Lippincott Raven; 1997.
28. Dillon WP. Cervical nodal metastases: another look at size criteria. Am J Neuroradiol 1998; 19: 796 – 7.
29. Ying M, Ahuja A, Brook F, Brown B, Metreweli C. Nodal shape (S/L) and its combination with size for assessment of cervical lymphadenopathy: which cut-off value should be used? Ultrasound Med Biol 1999; 26: 1169 – 75.
30. Ying M, Ahuja M, Brook F, Metreweli C. Power Doppler sonography of normal cervical lymph nodes. J Ultrasound Med 2000; 19: 511 – 7.
31. Wu CH, Hsu MM, Chang YL, Hsieh FJ. Vascular pathology of malignant cervical lymphadenopathy. Qualitative and quantitative assessment with power Doppler ultrasound. Cancer 1998; 83: 1189 – 96.
32. Van den Brekel MW, Stel HV, Castelijns JA, Nauta JJ, van der Waal I, Valk J, et al. Cervical lymph node metastasis: assessment of radiologic criteria. Radiology 1990; 177: 379 – 84.
33. King AD, Tse GM, Ahuja AT, Yuen EH, Vlantis AC, To EW, et al. Necrosis in metastatic neck nodes: diagnostic accuracy of CT, MR imaging, and US. Radiology 2004; 230: 720 – 6.
34. Wong KT, Tsang RK, Tse GM, Yuen EH, Ahuja AT. Biopsy of deep-seated head and neck lesions under intraoral ultrasound guidance. Am J Neuroradiol 2006; 27: 1654 – 7.
35. Chou YH, Tiu CM, Liu CY, Hong TM, Lin CZ, Chiou HJ, et al. Tuberculosis of the parotid gland: sonographic manifestations and sonographically guided aspiration. J Ultrasound Med 2004; 23: 1275 – 81.
36. Bjørnland T, Gjærum AA, Møystad A. Osteoarthritis of the temporomandibular joint: an evaluation of the effects and complications of corticosteroid injection compared with injection with sodium hyaluronate. J Oral Rehabil 2007; 34: 583 – 9.
37. Møystad A, Mork-Knutsen BB, Bjørnland T. Injection of sodium hyaluronate compared to a corticosteroid in the treatment of patients with temporomandibular joint osteoarthritis: a CT evaluation. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2008; 105: e53 – 60.
38. Hassin-Baer S, Scheuer E, Buchman AS, Jacobson I, Ben-Zeev B. Botulinum toxin injections for children with excessive drooling. J Child Neurol 2005; 20: 120 – 3.
39. Banerjee KJ, Glasson C, O"Flaherty SJ. Parotid and submandibular botulinum toxin A injections for sialorrhoea in children with cerebral palsy. Dev Med Child Neurol 2006; 48: 883 – 7.
40. Lin YC, Shieh JY, Cheng ML, Yang PY. Botulinum toxin type A for control of drooling in Asian patients with cerebral palsy. Neurology 2008 22; 70: 316 – 8.
41. Olsen J, Papadaki M, Troulis M, Kaban LB, O"Neill MJ, Donoff B. Using ultrasound to visualize the lingual nerve. J Oral Maxillofac Surg 2007; 65: 2295 – 300.
42. Thiruchelvam JK, Songra AK, Ng SY. Intraoperative ultrasound imaging to aid abscess drainage--a technical note. Int J Oral Maxillofac Surg 2002; 31: 442 – 3.
43. Schlager D. Ultrasound detection of foreign bodies and procedure guidance. Emerg Med Clin N Am 1997; 15: 895 – 912.
44. Holmes PJ, Miller JR, Gutta R, Louis PJ. Intraoperative imaging techniques: a guide to retrieval of foreign bodies. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2005; 100: 614 – 8.
45. Ng S Y, Pinto P. Ultrasound-guided retrieval of labial minor salivary gland sialoliths. Dentomaxillofac Radiol 2000; 29: 319 – 22.
46. Ng SY, Songra AK, Hutchison IL. Novel use of ultrasound-guided surface marking of head and neck tumors invading facial skin. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2006; 101: 499 – 504.
47. Strong EB, Woodward PJ, Johnson LP. Intraoral ultrasound evaluation of peritonsillar abscess. Laryngoscope 1995; 105: 779 – 82.
48. Rebol J, Takac I, Bumber Z. Intraoral sonographic evaluation of parapharyngeal space tumors. J Clin Ultrasound 2001; 29: 302 – 5.
49. Matalon S, Feuerstein O, Calderon S, Mittleman A, Kaffe I. Detection of cavitated carious lesions in approximal tooth surfaces by ultrasonic caries detector . Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2007; 103: 109 – 13.
50. Huysmans MC, Thijssen JM. Ultrasonic measurement of enamel thickness: a tool for monitoring erosion? J Dent 2000; 28: 187 – 91.
51. Bozkurt FO, Tagtekin DA, Hayran O, Stookey GK, Yanikoglu FC. Accuracy of ultrasound measurement of progressive change in occlusal enamel thickness. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2005; 99: 101 – 5.
52. Culjat MO, Singh RS, Brown ER, Neurgaonkar RR, Yoon DC, White SN. Ultrasound crack detection in a simulated human tooth. Dentomaxillofac Radiol 2005; 34: 80 – 5.
53. Gundappa M, Ng SY, Whaites EJ. Comparison of ultrasound, digital and conventional radiography in differentiating periapical lesions. Dentomaxillofac Radiol 2006; 35: 326 – 33.
54. Bertram S, Emshoff R. Sonography of periimplant buccal bone defects in periodontitis patients: A pilot study. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2008; 105: 99 – 103.
Adresse: Anne Møystad, Avdeling for kjeve-og ansiktsradiologi, Institutt for klinisk odontologi, Postboks 1109 Blindern, 0317 Oslo. E-post: amoystad@odont.uio.no