Fremmedlegemer i gingiva
Bakgrunn: Fremmed materiale kan forårsake og forverre gingivale forandringer. Dette blir sjelden vurdert klinisk. Forandringene er resistente overfor ofte protrahert konvensjonell terapi. Fremmedlegemene er ofte ubetydelige og upåfallende og overses lett ved histopatologisk undersøkelse.
Materiale og metoder: 85 biopsier av gingivale forandringer med fremmedlegemer ble undersøkt med konvensjonell og polarisasjonsmikroskopi med fokus på fremmedlegemenes morfologi og optiske karakteristika. Supplert med resultater av røntgenenergidispersjonsanalyse (EDXA) ble den fremmede substans sammenlignet med vanlig anvendte dentalmaterialer.
Konklusjoner: Iatrogen introduksjon av dentalmaterialer under tannbehandling er årsak til de fleste fremmedlegemereaksjoner i gingiva og kan reduseres eller unngås ved profylakseprosedyrer. Fremmedlegemereaksjoner i gingiva er lite kjent blant klinikere. Patologen må undersøke gingivale biopsier omhyggelig og rutinemessig anvende polarisasjonsmikroskopi og om mulig EDXA for å gi en så fullstendig beskrivelse og diagnose som mulig og dermed bidra til økt fokus på fremmedlegemer som årsak til gingivale forandringer.
Fremmedlegemer forekommer ganske ofte i orale biopsier. Vi har tidligere identifisert slikt materiale i post-endodontiske granulomer og cyster, hvor det kan initiere og vedlikeholde en inflammatorisk reaksjon (1 – 3). Etter vår erfaring er fremmedlegemer også et vanlig funn i gingivale biopsier, spesielt i tilfeller av lokalisert terapiresistent gingivitt og marginal periodontitt. Non-mikrobiell gingivitt forbundet med uorganiske fremmedlegemer, bortsett fra amalgam som ofte er involvert, ble først rapportert av Daley og Wysocki (4). Basert på røntgenenergidispersjonsanalyse (EDXA) og anamnese ble det foreslått at den fremmede substans var av iatrogen opprinnelse. I en mer omfattende undersøkelse av 61 kasus fikk disse forandringene betegnelsen fremmedlegemegingivitt (FLG), og elementer forenlige med abrasiver og restaureringsmaterialer ble ofte identifisert (5, 6). Fremmedlegemer kan imidlertid også forårsake non-inflammatoriske gingivale forandringer, klinisk manifestert som oppdrivninger og/eller misfarginger, og vi foreslår betegnelsen fremmedlegemeindusert gingival reaksjon for både inflammatoriske og non-inflammatoriske gingivale forandringer med fremmedlegemer.
Bortsett fra tilfeller med åpenbar misfarging med klinisk diagnose amalgamtatovering, overveies fremmedlegemer sjelden som etiologisk faktor ved gingivale forandringer, og pasientene kan bli underkastet langvarig og kostbar non-kurativ periodontal behandling før eventuell biopsi. Dessuten er den fremmede substansen ofte minutiøs og upåfallende, og overses lett ved mikroskopering med mindre den spesielt ettersøkes av patologen.
Formålet med vår undersøkelse var å henlede oppmerksomheten på fremmedlegemeinduserte gingivale reaksjoner ved å granske et omfattende biopsimateriale, inkludert epidemiologiske data og vevsreaksjoner, med fokus på fremmedlegemenes morfologiske og optiske karakteristika ved konvensjonell og polarisasjonsmikroskopi.
Videre ble resultatene av EDXA sammenlignet med analyse av relevante dentalmaterialer mistenkt som opphav til fremmedlegemene.
Materiale og metoder
Totalt 120 gingivale biopsier med fremmedlegemer innsendt til Avdeling for patologi og rettsodontologi, Det odontologiske fakultet, Universitetet i Oslo fra 1990 – 97 og til Laboratorium for Patologi A/S, Oslo fra 1998 – 2000 ble hentet fra de respektive arkiver. Femogtredve kasus ble ekskludert pga. dårlig snittkvalitet eller for sparsomme eller ikke påviselige fremmedlegemer i snitt preparert for skanningelektronmikroskopi (SEM) med EDXA, slik at 85 kasus utgjorde materialet. Pasientenes alder og kjønn ble registrert fra biopsiremissene, likeledes forandringenes lokalisasjon som følger:
Maxilla, anteriort segment: Gingiva tann 3 – 3, inklusiv distale papill;
Maxilla, posteriort segment: Gingiva tann 4 – 8;
Mandibula, anteriort segment: Gingiva tann 3 – 3, inklusiv distal papill;
Mandibula, posteriort segment: Gingiva tann 4 – 8.
Histologiske og polarisasjonsmikroskopiske metoder
Biopsiene var blitt fiksert i 4 % vandig formaldehydløsning, fremført ifølge standard prosedyrer, parafininnleiret, skåret med 3 – 4 m tykkelse og farvet med H&E (hematoxylin og eosin) eller H&erythrosin & safranin.
Kriteriene for diagnose fremmedlegemeforandring var nærvær av fremmed materiale med omgivende inflammasjon eller fibrose, i minst to seriesnitt. Likeledes inkluderte vi forandringer der fremmed materiale tydeligvis var blitt displassert under skjæringen, og hadde etterlatt tomrom (displasseringsspor) med mulig omgivende inflammatorisk reaksjon eller fibrose/sklerose.
Fremmedlegemene ble undersøkt morfologisk ved konvensjonell og polarisasjonsmikroskopi, og største mål ble avlest på en mikrometerskala. I overenstemmelse med Gordon og Daleys gradering (5) ble fremmedlegemene registrert etter størrelse som små/ubetydelige (< 1 m i diameter), mellomstore (1 – 5 m i diameter) og store (> 5 mm i diameter). Den inflammatoriske reaksjon ble subjektivt gradert av en erfaren patolog (HSK) som mild, moderat eller intens kronisk eller subakutt, eller i en gruppe omfattende fremmedlegemereaksjoner med epiteloide celler med eller uten kjempeceller og granulomatøse forandringer.
Skanningelektromikroskopiske (SEM) og røntgenenergidispersjonsanalystiske metoder (EDXA)
Etter diagnostisering ble 3 – 4m tykke ufargede parafinsnitt montert på små plater dekket med karbon og undersøkt i enten et Philips SEM utstyrt med EDAX® 9900 analysator med en vindusfri ECON detektor, eller i et Philips XL 30 ESEM med en Phoenix røntgenstråleanalysator, hvor detektor og analysator kan påvise elementer med atomnummer 11 (Na) og høyere. Fremmedlegemene ble identifisert ved høykontrast tilbakespredd («back-scattered») deteksjon som muliggjorde å skille mellom overflatepartikler som kunne være kontaminasjoner og partikler lokalisert i vevet. Semikvantitativ analyse ble i hvert snitt utført på flere tilfeldig valgte partikler lokalisert med SEM og ble registrert på diagrammet.
EDXA av dentalmaterialer og utstyr
For sammenligning med fremmedmateriale i biopsiene ble prøver av dentalmaterialer mistenkt for å være introdusert i gingiva under tannbehandlingsprosedyrer, underkastet EDXA-undersøkelse. (Tabell 1, 2).
Materiale |
Elementer identifisert ved EDXA1,2 |
|---|---|
Temp Bond NETM. . Kerr Italia.S.p.A. Salerno, Italia |
Zn |
Temp Bond Modifier.Kerr Italia.S.p.A. Salerno, Italia |
Zn |
Opotrow Trial Cement.Teledyne Water Pik,Ft. Collins, Co., USA |
Si 4 , Ca, Zn |
GC Temporary Pack.G.C. America Inc., Alsip,Ill., USA |
Zn |
Coe-Pack catalyst periodontal dressing.G.C. America Inc., Alsip,Ill., USA2 |
Zn, MgStore partikler:Mg, Zn (spor).Små partikler:Zn, Mg (spor). |
Profylan® putspasta.Dental Pharma, Stockholm,Sverige.2 |
Ba, S, Si, Al,spor av K |
CCS Prophy Paste,RDA 250. CCS AB,Borlänge, Sverige. |
Fra fabrikant:Pimpstein, aluminium-hydroksid, dinatriumfosfat, titandioksid, natriumfluorid. |
Hawe Cleanic®Prophylaxis Paste.Hawe Neos Dental,Bioggio, Sveits.2 |
Si, Ti, Al, K, Fe |
Pimpstenpulver |
Si, litt Al, K, spor av Ca, Fe, Cl |
Karborundumpulver |
Si |
Aluminium oxide p.a.,Woelm, Eschwege,Tyskland3. |
Fra fabrikant:Al2O3 |
Krittpulver |
Ca |
Talkum |
Si, Mg |
Prøver av pulverkomponenten i tre temporære sementer og to periodontale pakninger, av pimpsten, karborundum, aluminiumoksid (korund), kritt og talkum ble inkludert. Videre ble prøver av to profylaksepastaer fire ganger oppløst i etylalkohol og aceton for å fjerne den organiske komponenten. Det uorganiske materialet fikk presipitere hver gang, og den organiske supernatanten ble pipettert av. Presipitatet ble tørket ved 100 ºC.
Prøvene ble fiksert på karbonplater ved hjelp av kolloidalt karbon (Leit – C, Conductive Carbon Cement, Neubauer Chemikalien, Münster, Tyskland). Karborundumprøven ble dekket med Au-Pd. Videre ble produsentens produktdeklarasjon for en tredje profylaksepasta inkludert (Tabell 1).
Ytterligere ble dentale strips, sandpapir, karborundumskiver, forskjellige dentale stener, dentale diamanter, stål- og wolframkarbidbor, gummikopp, gummipolérskive, ortodontisk metallbånd og ortodontisk tråd fiksert på karbondekkede skiver ved hjelp av dentalvoks og jordet med kolloidalt sølv (Silver Print, Provac AG, Balzer, Lichtenstein). Alle prøver ble undersøkt i SEM med EDXA (Tabell 2).
Materiale |
Elementer identifisert ved EDXA1 |
|---|---|
Dental metallstrips |
Ni, Al |
Sandpapirskive, hvit |
Al, spor av Si, Cl, Ti |
Sandpapirskive |
Si 2 , Al |
Slipeskive, brun, bløt |
Al, spor av Si, Cl, Ti |
Karborundum-slipeskive, sort, hård |
Si |
Sten, hvit |
Al, Si, K |
Arkansassten |
Al, Si, K, spor av Cl, Fe |
Sten, grønn |
Si, Al, K, spor av S, Cl, Ti, Fe, Cu, Zn |
Stenhjul, grått |
Si, Mg, Cl, spor av S, K, Ca |
Sten, grå-blå |
Si, spor av Al, K, Fe |
Sten, rosa |
Al, Si, spor av K, Ca Ti, Cr, Fe |
Viking green stone (H. Foss & Co. A/S, Fetsund, Norge) |
Oppgitt fra fabrikant: Silisium-karbid bundet i keram (leire) |
Viking white stone (H. Foss & Co. A/S, Fetsund, Norge) |
Oppgitt fra fabrikant: Aluminiumoksid bundet i keram (leire) |
Viking diamonds (H. Foss & Co. A/S, Fetsund, Norge) |
Oppgitt fra fabrikant: Diamanter bundet til rustfritt stålbor ved bruk av Ni og Cu |
Gummikopp |
Si |
Gummi, grønn, flammeformet |
Si, Cl, Ti, spor av S, Cr, Fe |
Wolframkarbidbor |
W, Co |
Stålbor |
Fe, spor av Si, Cr, Mn |
Ortodontisk bånd |
18 – 8 stål (Fe, Cr, Mn, Ni) |
Ortodontisk tråd |
18 – 8 stål (Fe, Cr, Mn, Ni) |
Sammenligninger ble også gjort med elementsammensetningen i dentalprodukter og -materialer oppgitt i lærebøker i dentalmaterialvitenskap (7). Sammenligningene ble utført av en erfaren kjemiker med spesialkompetanse i dentalmaterialvitenskap (RK).
Resultater
Biopsimaterialet
Pasientenes alder og kjønn og fremmedlegemeforandringenes anatomiske distribusjon
Pasientenes gjennomsnittsalder var 50,3 år, varierende fra 18 – 80 år. Forandringene forekom hyppigst i aldersgruppene 41 – 50 år (19 tilfeller, 22,4 %) og 51 – 60 år (20 tilfeller, 23,5 %) (Figur 1). 58 (68 %) av pasientene var kvinner og 27 (32 %) menn; ratio 2,1: 1; gjennomsnittsalder og aldersvariasjonsintervall var tilnærmet like for begge kjønn (Figur 1).
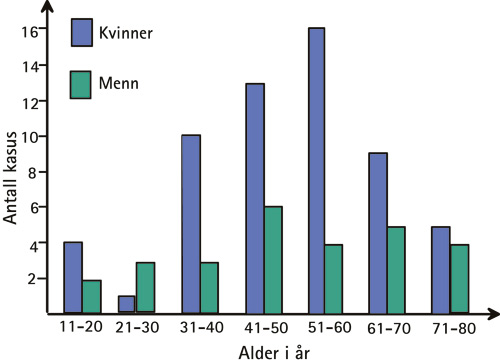
Figur 1. Aldersfordeling av 85 kasus med gingivale fremmedlegemeforandringer hos kvinner og menn.
Forandringene var lokalisert i over- og underkjevens posteriore segmenter i henholdsvis 29 (34 %) og 25 (29 %) av tilfellene, etterfulgt av overkjevens anteriore segmenter med 22 kasus (26 %). Ni (11 %) tilfeller forekom i underkjevens anteriore segmenter. Hos kvinner var forandringene hyppigst lokalisert i underkjevens posteriore segmenter (23 kasus, 39,7 %) og sjeldnest i underkjevens anteriore segmenter (7 kasus, 12 %); hos menn fant man de fleste forandringene i overkjevens anteriore og posteriore segmenter (henholdsvis 10 kasus, 37 % og 9 kasus, 33,3 %), mens underkjevens anteriore segmenter var minst hyppig affisert (2 kasus, 7,4 %) (Figur 2).
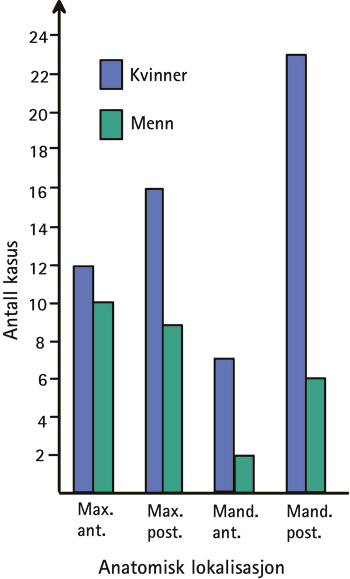
Figur 2. Anatomisk distribusjon av 85 kasus med gingivale fremmedlegemeforandringer hos kvinner og menn. Max.ant. = maxillær anterior region. Max.post. = maxillær posterior region. Mand.ant. = mandibulær anterior region. Mand.post. = mandibulær posterior region.
Klassifisering og gradering av inflammatorisk reaksjon
Den inflammatoriske reaksjonen ble gradert som mild kronisk i 14 tilfeller (16,5 %), moderat kronisk i 33 tilfeller (38,8 %), intens kronisk i 17 tilfeller (20,0 %), moderat subakutt i 1 tilfelle (1,2 %), intens subakutt i 2 tilfeller (2,4 %), og som fremmedlegemereaksjon med eller uten granulomatøs inflammasjon i 18 kasus (21,2 %) (Tabell 3). Fem tifeller (5,9 % av totalmaterialet) i gruppen med kronisk inflammasjon og 1 kasus (1,2 %) blant de granulomatøse inflammasjoner viste i tillegg fibrose eller bindevevssklerose.
Kasus |
||
|---|---|---|
Inflammasjonstype og -grad |
Antall |
% |
Mild kronisk |
14 |
165 |
Moderat kronisk |
33 |
388 |
Intens kronisk |
17 |
200 |
Moderat subakutt |
1 |
1,2 |
Intens subakutt |
2 |
24 |
Granulomatøs/fremmedlegeme- |
18 |
211 |
Totalt |
85 |
1 000 |
Den inflammatoriske reaksjon var dominert av lymfocytter, plasmaceller og makrofager og i tillegg polymorfonukleære (nøytrofile) granulocytter i de subakutte tilfeller. Fremmedlegemereaksjoner med eller uten granulomatøse forandringer var karakterisert av makrofager og ofte kjempeceller av fremmedlegemetypen, begge gjerne med fagocyttert fremmed substans, og sjelden med bidrag av lymfocytter.
Konvensjonelle og polarisasjonsmikroskopiske karakteristika
Ved konvensjonell lys- og polarisasjonsmikroskopi ble det funnet forskjellige typer fremmedlegemer (Figur 3). I 21 tilfeller (24 %) fremsto store, sorte, isotrope fragmenter med største mål 0,02 – 0,35 mm, ofte sammen med middels store eller minutiøse sorte/brunlige granula med diameter 1 – 4 m og knapt synlige med høy (40x) forstørrelse. Granula forekom i basalmembransonen og inkorporert i retikulære og kollagene fibre som også var diffust brunlig til gulig misfarvet (Figur 4).
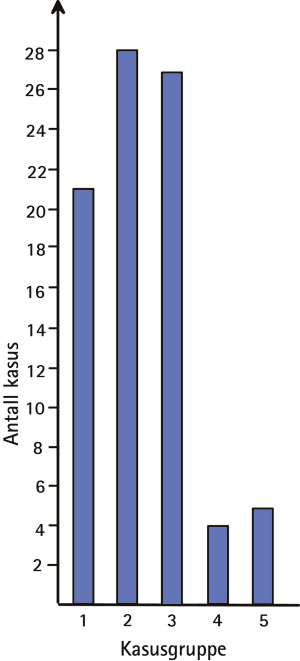
Figur 3. Gruppeinndeling av 85 kasus med gingivale fremmedlegemeforandringer ifølge fremmedlegemenes konvensjonelle lys- og polarisasjonsmikroskopiske karakteristika. 1: Kasus med fremmedlegemer utelukkende forenlige med metall. 2: Kasus med fremmedlegemer forenlige med metall og dessuten krystaller. 3: Kasus med krystallinske fremmedlegemer og minutiøse sorte granula. 4: Kasus med utelukkende krystaller. 5: Kasus med forskjellige/spor etter oppløste fremmedlegemer forskjellige fra dem i gruppe 1 – 4.
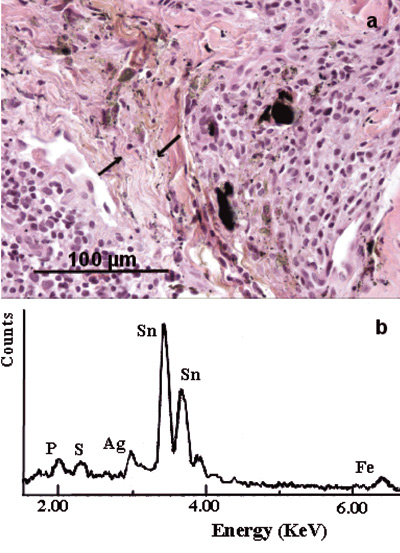
Figur 4. Gingival fremmedlegemeforandring. (a) Mikrofotografi viser sorte fragmenter og minutiøse sorte granula i et infiltrat av lymfocytter og makrofager og i nærliggende retikulære og kollagene fibre (piler). H&E. (b) EDXA-spekter viser hovedsakelig Sn og Ag, forenlig med amalgamkomponenter.
28 kasus (32,9 %) viste i tillegg farveløse, fragmenterte og nålformede translucente, anisotrope (krystallinske) strukturer med største mål 2 – 80 m (Figur 5), ofte i runde klynger (Figur 6). Krystallene kunne lett overses ved konvensjonell lysmikroskopi, og kom ofte først til syne under polarisert lys. Krystallene var hyppig forbundet med minutiøse sorte granula som også forekom intracellulært i nærliggende makrofager, men ikke i retikulære fibre (Figur 7). I 27 tilfeller (31,8 %) kunne man bare påvise krystaller og minutiøse sorte granula, mens 4 tilfeller (4,7 %) bare inneholdt krystaller. Fem tilfeller (5,9 %) viste heterogen fremmedsubstans som ikke passet inn i ovennevnte kategorier (for beskrivelse se originalpublikasjon, 8).
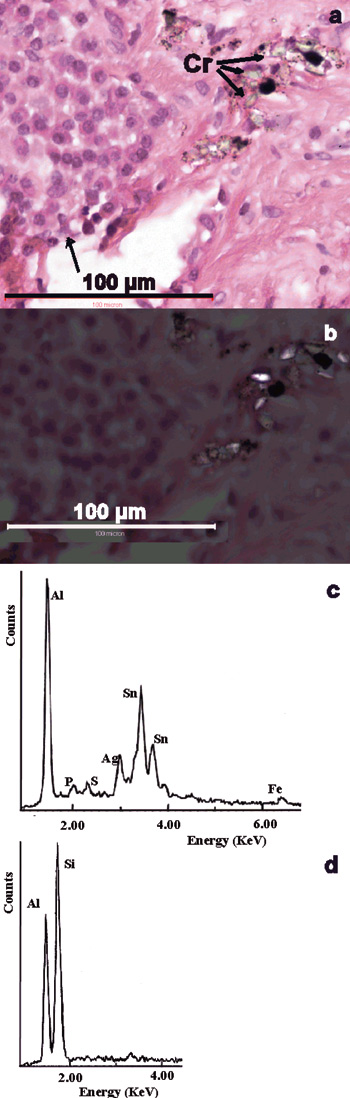
Figur 5. Gingival fremmedlegemeforandring. (a) Upåfallende, farveløse, translucente fragmenter (Cr), sorte fragmenter og minutiøse sorte granula i relasjon til et makrofaginfiltrat (pil). (b) Samme område viser i polarisert lys anisotrope fragmenter og nåler. H&E. (c) EDXA-spektrum av sorte fragmenter og granula viser Ag og Sn, forenlig med amalgamkomponenter, og også Al fra nærliggende krystaller, trolig korund. (d) EDXA-spektrum av andre anisotrope strukturer viser også Al og Si, forenlig med sand fra fin sandpapirskive.
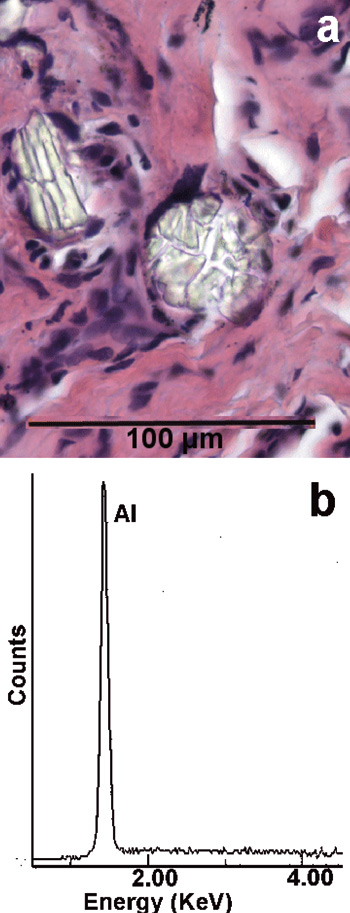
Figur 6. Gingival fremmedlegemeforandring. (a) Rund og avlang ansamling av translucente fragmenter. H&E. (b) EDXA-spektrum viser Al, forenlig med korund.
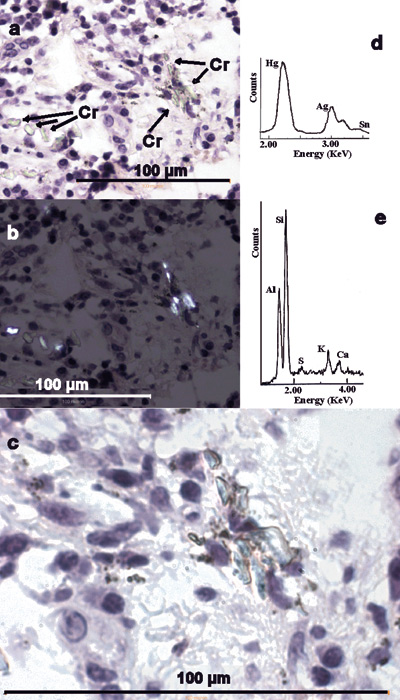
Figur 7. Gingival fremmedlegemeforandring. (a) Minutiøse, translucente fragmenter og nåler (Cr) overses lett og kan ofte ikke identifiseres uten polarisasjonsmikroskopi som i (b). H&E. (c) Høyere forstørrelse synliggjør fragmentene og nærliggende minutiøse sorte granula tydeligere. H&E. Oljeimmersjon. (d) EDXA-spektrum av sorte granula viser Hg, Ag og Sn, forenlig med amalgam. (e) EDXA-spektrum av krystallinske fragmenter identifiserer Si, Al og små mengder K, Ca og S, forenlig med silikat, trolig fra dental sten.
Resultatene av røntgenenergidispersjonsanalysene av fremmedlegemene beskrives i det følgende. For å unngå unødvendig repetisjon og for å gi en mest mulig enhetlig fremstilling, vil vi samtidig belyse fremmedlegemenes mulige opprinnelse ved sammenligning med EDXA-funn og kjent sammensetning av mulige skadelige substanser, spesielt dentalmaterialer og – ustyr/hjelpemidler (Tabell 1, 2).
EDXA av biopsiene og fremmedlegemenes mulige opprinnelse
Elementer identifisert med EDXA er fremstilt med avtagende frekvens i Tabell 4 og deres forenlighet med dentalmaterialer i Tabell 5. De hyppigst identifiserte grunnstoff var Ag i 67 %, Al i 66 %, Si i 61 %, Sn i 58 %, S i 55 %, Cu i 47 %, Ca i 41 %, P i 36 %, Fe i 35 % og Ti i 19 % av tilfellene (Tabell 4).
Kasus |
||
|---|---|---|
Element |
Antall |
% |
Ag |
57 |
67 |
Al |
56 |
66 |
Si |
52 |
61 |
Sn |
49 |
58 |
S |
47 |
55 |
Cu |
40 |
47 |
Ca |
35 |
41 |
P |
31 |
37 |
Fe |
30 |
35 |
Ti |
16 |
19 |
Mg |
15 |
18 |
Hg |
13 |
15 |
Se |
12 |
14 |
Zn |
10 |
12 |
Ba |
5 |
6 |
Pd |
4 |
5 |
Ni |
3 |
4 |
W |
2 |
2 |
Co |
1 |
1 |
Ga |
1 |
1 |
Mo |
1 |
1 |
Elementer/ element- kombinasjoner hyppigst identifisert ved EDXA1 |
Forenlighet med dentalmaterialer |
|---|---|
(Ag, Cu, Sn, Hg, Se, S, Zn, Au)2 |
Amalgam (restaurering) |
Al |
Korund (abrasiv). Aluminium-hydroksid (i profylaksepasta) |
Si |
Karborundum (abrasiv). Silisiumdioksid ( i profylakse-pasta) |
Si, Mg |
Talkum (polérmiddel) |
Si, Ca, Cr, P, S |
Silikat |
Al, Si, Ca |
Pimpsten (abrasiv og polérmiddel) |
Al, Si, Zn |
Temporær sement |
Si, Ca, P |
Temporær sement |
Ba, S |
Polérmiddel |
Ti |
Polérmiddel |
I de 49 tilfellene med sorte fragmenter og brunsorte granula, fant man vesentlig Ag, Cu, Sn, Zn og Hg i forskjellige kombinasjoner og undertiden samlokalisert med Au, og således forenlig med amalgamkomponenter. Au og Pd, av og til sammen med Ag og Cu, kunne også stamme fra støpelegeringer.
De 28 tilfellene som i tillegg inneholdt krystaller, de 27 tilfellene med krystaller og minutiøse sorte granula, de 4 tilfellene med utelukkende krystaller, og det fåtall tilfeller hvor krystaller ikke ble påvist ved konvensjonell lys- og polarisasjonsmikroskopi, oppviste generelt Al, forenlig med korund (Al2O3), Al kombinert med Si, og undertiden med Fe, Cr, Ca, P og S, forenlig med silikat, muligens fra sandpapirskive, poléringspasta, tannpasta, eller – mindre sannsynlig – tannfyllingsmateriale.
Ett tilfelle viste i tillegg Ba, muligens fra profylaksepasta (type Prophylan®). Ba forekom også sammen med S, og forenlig med BaSO4 fra polérmiddel. I noen tilfeller fant man Mg sammen med Si, komponentene i talkum, eller bare Si, forenlig med karborundum (SiO). Videre ble det identifisert kombinasjoner av Si, Al og Ca, forenlig med pimpsten. I noen tilfeller med krystaller og minutiøse (ª 1m i diameter) sorte granula, fant man også Ag, Sn, Zn og Hg, forenlig med amalgam, og i to tilfeller hvor bare krystaller ble observert i H&E-snitt, fant man også spor av Cu. Disse elementene forklarer granula som amalgampartikler. I ett tilfelle ble Fe, Cr og Ni identifisert, hvilket er forenlig med rustfritt stål, muligens fra ortodontisk bånd.
I ett tilfelle fant man W, trolig fra wolframkarbidbor, og også Al, forenlig med korund. Fem tilfeller (ª 5,9 %) oppviste morfologisk heterogent fremmedmateriale som ikke passet inn i overfor beskrevne grupper. For nærmere beskrivelse av disse henvises til originalpublikasjon, 8).
De 18 kasus med fremmedlegemereaksjon med epiteloide celler, kjempeceller eller fremmedlegemegranulomer viste hyppigst amalgamkomponentene Ag og Sn, begge i 9 tilfeller (50 %), og Cu i 7 tilfeller (39 %), for det meste samlokalisert. Al og Si ble begge påvist i 9 tilfeller (50 %), som oftest sammen og forenlig med sand, fra for eksempel slipesten, sandpapirskive eller polérmiddel (Tabell 6). I et fåtall tilfeller fant man Mg og Si sammen, indikativt for talkum, og likeledes kombinasjon av Si og Ca, som kan stamme fra temporær sement.
Element |
Antall kasus |
|---|---|
Ag |
9 |
Sn |
9 |
Al |
9 |
Si |
9 |
Cu |
7 |
Tre tilfeller viste subakutt inflammasjon som ble gradert som intens i to kasus hvor bare Al, forenlig med korund, ble identifisert. I det tredje kasus var inflammasjonen moderat subakutt. Her fant man Al, forenlig med korund, og Mg og Ca, som kan stamme fra temporær sement.
Fibrose eller innkapsling av det fremmede materialet av en sklerotisk bindevevssone og meget mild, mild eller moderat kronisk inflammasjon ble observert i fem tilfeller, derav fire med store, sorte partikler med største mål 23 – 300 m og med Ag og Sn som fellesnevner.
I tillegg viste ett kasus krystaller med Al forenlig med korund, og et annet kasus Al og Si, forenlig med Al-silikat (sand). Det femte kasus viste anisotrope strukturer og minutiøse sorte granula, men kun Al ble identifisert ved EDXA.
Hg ble funnet i 13 tilfeller (15 %) hvorav åtte viste moderat kronisk inflammasjon, mens tre kasus var intenst og ett kasus mildt kronisk inflammert, og ett kasus viste granulomatøs inflammasjon.
Diskusjon
Underdiagnostisering av gingivale fremmedlegemeforandringer
Gordon og Daley (5) fant fremmedlegemegingivitt i 0,3 % av totalt 19 534 biopsier i arkivmateriale ved sin oralpatologiske diagnostiske tjeneste og betraktet dette som et minimumsestimat for klinisk insidens av denne tilstand, da den sjelden erkjennes av klinikere, og de fleste tilfeller ikke underkastes biopsi.
Vi støtter sterkt dette syn, og vi har erfaring for at pasienter kan ha vært under langvarig konvensjonell periodontal terapi før det tas biopsi.
Kriterier for diagnosen gingival fremmedlegemeforandring
Kriteriene for diagnosen fremmedlegemegingivitt som definert av Gordon og Daley var: 1) nærvær av kronisk inflammasjon i en gingival biopsi, 2) nærvær av fremmedlegemer i et inflammert område, og 3) forekomst av disse fremmedlegemene i samme område i minst to seriesnitt (5).
Vi har også inkludert subakutt inflammasjon, som vi fant i tre kasus. En blandet kronisk og akutt inflammasjon ble også beskrevet i en senere kasuistisk rapport av Gordon (9). Nøytrofile granulocytter kan tiltrekkes til området hvis den fremmede substans er kjemotaktisk, men det er mer sannsynlig at disse cellene er til stede pga. preeksisterende eller superimponert infeksjon. Ytterligere har vi inkorporert forandringer der fremmedlegemene tydelig var blitt displassert under skjæring og hadde etterlatt skjærespor i vevet, eller tomrom hvis begrensning passet med fremmedlegemenes periferi.
Med anvendelse av disse kriteriene er det liten mulighet for å inkludere kasus med kontaminasjon fra laboratorieutstyr og -materialer, hvilket andre har påpekt som en mulighet (6). Endelig har vi funnet det riktig å inkludere kasus med vesentlig fibrose og innkapsling og ubetydelig bidrag av inflammasjonsceller. Vi foreslår derfor betegnelsen gingival fremmedlegemeforandring til erstatning for fremmedlegemegingivitt.
EDXA-begrensninger
Bortsett fra i nyutviklet utstyr er EDXA ikke absolutt kvantitativ, men kan gi elementenes relative mengder i det analyserte området. Metoden kan påvise elementer med atomnummer > 10, det vil si fra Na (atomnummer 11 (10), bortsett fra 0 (påvisning av dette krever spesielle tiltak, 11).
Som følge av disse forhold kan ikke organisk materiale, som bare består av C (atomnummer 6), O og H (atomnummer 1) identifiseres med angjeldende metode. Selv om EDXAs semikvantitative natur er en begrensende faktor for sikker bestemmelse av fremmedlegemers opprinnelse, tillater metoden konklusjoner med hensyn på forenlighet med kjente materialer og forbindelser. I 80 (94 %) av våre kasus var fremmedlegemene forenlige med en eller annen type dentalmateriale.
Mange elementer i dentalmaterialer og -produkter, så som Si, Al, Ca og P som kan introduseres/implanteres i gingiva, er også komponenter i ikke-dentale produkter. Dermed er det vanskelig, basert på EDXA alene å vise at et dentalmateriale er kilden til fremmed substans. En slik opprinnelse er imidlertid mulig, og til og med sannsynlig, når man erkjenner hvor hyppig disse elementene forekommer i dentalprodukter, inklusiv porselen, abrasiver, polérmidler og tannpastaer, og spesielt når man tar hyppigheten av profesjonelle eller selvadministrerte dentale og hygieneprosedyrer med i betraktningen (4, 6). Predileksjonen av disse forandringene i kjevesegmenter som hyppigst utsettes for tannbehandling, tyder også på at dentalmaterialer er årsak, og alternative kilder virker usannsynlige (6). Basert på disse betraktninger finner vi det berettiget å bruke betegnelser som forenlig med, overensstemmende med eller indikativt for visse dentalmaterialer ved gingivale fremmedlegemeforandringer.
Det må imidlertid tas i betraktning at sammensetningen av det fremmede materialet kan forandres over tid. Således er det hurtig tap av Cu og Zn og gradvis tap av Sn og Hg fra implantert amalgam, slik at bare Ag kan være tilbake i vevet (12, 13).
Ytterligere begrensende for bruk av EDXA er at i tilfeller med små mengder fremmed substans, kan denne ikke gjenfinnes i dypere snitt preparert for EDXA.
Det fremmede materialet blir lett oversett
Mens sorte fragmenter og brunsorte granula inkorporert i retikulære fibre og basalmembran, og forenlige med amalgamkomponenter, er relativt lette å observere, vil krystaller nok ofte overses fordi de er farveløse, translucente og ofte svært små. Vi finner det derfor viktig å undersøke alle gingivalbiopsier med polarisasjonsmikroskopi. Man må også omhyggelig lete etter de minutiøse sorte granula, tolket som amalgampartikler, som ofte forekommer i forbindelse med krystaller. Så vidt oss bekjent er samlokalisasjon av krystaller og minutiøse sorte granula ikke rapportert tidligere. Mens Gordon og Daleys undersøkelser ikke omfattet kasus med amalgamkomponenter, er det vår oppfatning at de bør inkorporeres ettersom de forekommer i hovedparten av tilfeller med gingivale fremmedlegemeforandringer, og ikke minst for å gjøre klinikerne oppmerksomme slik at de kan ta forholdsregler for å forhindre amalgamimplantering i gingiva (5, 6).
Den hyppige forekomst av amalgamkomponenter sammen med krystallinske strukturer (Al, Si) indikerer at de er blitt avløst under trimming/pussing/poléring av fyllinger.
De hyppigst påviste elementer ved EDXA og deres mest sannsynlige opprinnelse
De hyppigst identifiserte elementer ved EDXA var Ag (67 % av tilfellene), men også Sn og Cu forekom hyppig (i respektivt 58 % og 47 % av tilfellene), alle forenlige med amalgamkomponenter. Disse fremmedlegemenes morfologi og fordeling stemmer overens med tidligere rapporter (12, 14). Amalgamkomponenter forekom mindre hyppig i Gordon og Daleys materiale, som imidlertid ikke omfattet kasus med histologisk diagnose amalgamtatovering (6).
Disse forfattere fant hyppigst Si (61 % av tilfellene) og Al (46 % av tilfellene ); i vårt materiale fant vi hyppigere Al (Al 66 % av tilfellene; Si, 61 % av tilfellene). Andre elementer ble sjeldnere identifisert i begge undersøkelser.
Al og Si er hovedkomponenter i forskjellige slipemidler og -produkter, så som stener, skiver, sandpapirstrips, profylaksepasta, og også i porselen, glassionomere og kompositte fyllingsmaterialer, og de forekommer i nesten samtlige tannpastaer. Alle disse produkter kan gi opprinnelse til fremmedlegemer i gingiva.
Ca og P, som også hyppig ble identifisert (41 % og 37 % respektivt) forekommer overalt i humant vev, men også i tannpasta. Fe, som ble påvist i 35 % av tilfellene, kan stamme fra rustfritt stålbor med eller uten diamant. Ni, som inngår i metallisk bindingsmateriale i diamantbor (7) og har cytotoxiske egenskaper (15), ble funnet i bare 4 % av tilfellene.
Den inflammatoriske reaksjon
I tilfeller hvor fremmedlegemer utelukkende var forenlige med amalgamkomponenter, dominerte mild kronisk inflammasjon og fremmedlegemereaksjon, overensstemmende med bildet ved amalgamtatovering (12, 14). I kasus med både amalgamkomponenter og krystaller var moderat og intens kronisk inflammasjon fremherskende. Når krystaller og minutiøse sorte granula var samlokaliserte, var den inflammatoriske reaksjon overveiende moderat kronisk.
Mens de hyppigst identifiserte amalgamkomponenter, nemlig Ag og Sn, er allergene, er Al og Si, som var hovedelementene i de krystallinske strukturer, klassifisert som cytotoksiske med høy flogistisk effekt (6). Den mer intense reaksjon i tilfeller der amalgam og krystaller forekom sammen, skyldes trolig en synergistisk effekt av de tilstedeværende elementer.
Ved amalgamtatovering er det rapportert mer intens inflammasjon ved høyere Hg-innhold i vevet (13). Det foreliggende materiale kan ikke bekrefte dette, idet de fleste tilfellene hvor Hg ble identifisert, viste moderat kronisk inflammasjon.
Den lave forekomst av Hg (17 %) sammenlignet med andre amalgamkomponenter, spesielt Ag (67 %) og Sn (58 %) i vårt materiale, skyldes trolig utløsning av Hg fra amalgam med tiden, slik det er blitt vist ved amalgamtatovering (12). Det må tas i betraktning at metaller og deres degraderingsprodukter kan danne komplekser med proteiner i vevet og således medføre metallallergi (16). Cytotoksiske og allergene materialer induserer antageligvis lettere granulomatøse forandringer enn andre materialer (6). Identifiseringen av Al, Si, Ag og Sn i tilfeller av fremmedlegeme- og granulomatøs inflammasjon støtter denne oppfatning. Gordon og Daley fant imidlertid ingen relasjon mellom noen spesiell type fremmedlegemegingivitt og forekomst av allergene og cytotoksiske elementer, og indikerte at bare den rent fysiske tilstedeværelse av fremmedlegemer i gingivalt vev kan være tilstrekkelig stimulus for betennelsesutvikling (6).
I denne sammenheng må man ta hensyn til at trekk som fremmedlegemenes størrelse, form, posisjon (6, 17), overflatespenning, overflateladning, mekanisk kompatibilitet og elektrokompatibilitet (15), porøsitet, degraderingshastighet (18) og eksponeringstid (19), så vel som den individuelle vertsrespons kan påvirke vevsreaksjonen. Subakutt inflammasjon, som ble observert i tre kasus, kan skyldes sekundære faktorer (for eksempel plaquetoksiner, infeksjon). Men i alle disse tilfellene ble det påvist Al (alene i to tilfeller, sammen med Ca og Mg i ett tilfelle), hvilket er rapportert å fremkalle blandet kronisk og akutt inflammasjon i fibrøst vev rundt implantater (17).
Likeledes er det beskrevet granulomatøs inflammasjon overfor Al-forbindelser ( Al2O3, AlHO) benyttet som vaksineadjuvans (20). Al2O3 -partikler, som anvendes for rengjøring ved påblåsing av ti- implantater, har vist seg å aktivere makrofager og er blitt inkriminert for i implantatløsning (21).
Videre viste fem av de foreliggende kasus (5,9 %) uttalt fibrose, som undertiden innkapslet store fragmenter og fine granula av fremmed substans. Amalgamkomponenter ble identifisert i fire av disse tilfellene, hvorav ett i tillegg oppviste Al og et annet Al og Si. Det femte kasus viste bare minutiøse sorte granula og krystaller, men bare Al ble identifisert ved EDXA.
En sekvensiell prosess med innledningsvis akutt inflammasjon som viker plassen for en kronisk tilstand og slutter med fibrose, forekommer som respons overfor mange fremmede materialer (19). Når det gjelder amalgam, har imidlertid omfattende undersøkelser av eksperimentelt (22, 23) såvel som biopsimateriale (12) vist at partikkelstørrelsen er en viktigere og mer avgjørende faktor for fibroseutvikling enn eksponeringstiden. Således induserte store amalgambiter innkapsling fire uker etter implantering (22), mens små amalgampartikler forårsaket granulomatøs inflammasjon (12, 22, 23) som persisterte godt utover ett år (22).
Den påviste fibrose og innkapsling forbundet med store amalgampartikler i vårt materiale støtter tidligere undersøkelser (12, 22, 23), men våre kasus med slike forandringer er få, og en mulig synergistisk effekt av krystallinske fremmedlegemer i noen av tilfellene må tas i betraktning. Gordon og Daley beskrev uttalt forekomst av fibrøst vev i 5 % av sine tilfeller av fremmedlegemegingivitt, men beskrev ikke inflammasjonsgraden og relaterte heller ikke fibrosen til partikkelstørrelse eller elementer identifisert ved EDXA (5). Kasus med mikroskopisk diagnose amalgamtatovering var ikke inkludert i disse undersøkelsene.
Alders-, kjønns- og anatomisk fordeling
Aldersfordelingen i det foreliggende materiale dekket et vidt spenn, i motsetning til prevalensen ved konvensjonell gingivitt, som øker med alderen. Dette stemmer med tidligere rapporter (4, 5; gjennomsnittsalder 49,1 og 48 år respektivt). Mens Gordon og Daley (5) rapporterte de fleste tilfeller i aldersgruppene 41 – 50 år, viste vårt materiale omtrent lik forekomst i gruppene 41 – 50 år og 51 – 60 år, hvilket utgjorde henholdsvis 22,4 % og 23,5 % av tilfellene.
Økningen i fremmedlegemeinduserte gingivale forandringer opp til 50-årsalder kan tilskrives økt eksponering for dentalmaterialer. Den påfølgende reduksjon kan skyldes en mindre eldre befolkning, redusert eksponering for dentale prosedyrer pga. økende tannløshet, eller redusert tilbøyelighet til reaksjon med alderen (5). I overensstemmelse med den eneste omfattende tidligere rapport om fremmedlegemeinduserte gingivale forandringer, hvor 84 % forekom hos kvinner (5), viste også vårt materiale høyere frekvens av slike forandringer hos kvinner (68 %) enn hos menn (32 %), med en ratio på 2,1: 1. Dette kan skyldes at kvinner hyppigere søker dental og periodontal behandling og således i større grad eksponeres for dentalmaterialer (5). Det har også vært overveid om kvinner villigere samtykker til biopsi, og det har vært reflektert over mulig aggraverende hormonell påvirkning/innflytelse på gingivale forandringer hos kvinner (5). Lignende alders- og kjønnsfordeling er funnet for amalgamtatovering i munnslimhinnen, inklusiv gingiva (14).
Mens Gordon og Daley (5) ikke fant noe predileksjonssted for fremmedlegemegingivitt, viste det foreliggende materiale hyppigst forekomst av fremmedlegemeinduserte gingivale forandringer i under- og overkjevens posteriore segmenter (34 % og 29 % respektivt), etterfulgt av overkjevens anteriore region (26 %). Dette kan trolig tilskrives at det hyppig utføres tannbehandling i disse segmenter. En omfattende undersøkelse av amalgamtatovering viste at nesten halvparten av forandringene var lokalisert på gingiva, men hyppigere i overkjeven enn i underkjeven (14). Den lave forekomst av forandringer (11 %) i underkjevens anteriore region i vårt materiale kan likeledes foreklares ved at dentale prosedyrer sjelden utføres i denne lokalisasjon.
Patologens forpliktelse
Ved gingivale forandringer som er refraktære overfor konvensjonell terapi, må kliniker og patolog nøye overveie en fremmedlegemeindusert forandring. Det er påpekt at slike forandringer kan ligne lichen planus både klinisk og histologisk (5). Ved atrofisk og såkalt erosiv gingival lichen planus skades gingiva lett med avrivning av epitelet, og, som ved ulcerative former, kan fremmed substans lett introduseres i bindevevet.
Således kan en fremmedlegemeinflammasjon komme i tillegg til og være en følge av en preeksisterende inflammasjon (5). Vi har funnet støtte for dette hos en gruppe pasienter med både bukkal og gingival lichen planus og lichenoid reaksjon hvor de bukkale manifestasjonene mikroskopisk var vel forenlige med den kliniske diagnose, mens fremmedlegemer ved de gingivale forandringer kunne forklare en aggravert og mindre karakteristisk inflammasjon her (24).
Mens metallfragmenter relativt lett observeres ved konvensjonell lysmikroskopi, kan små metallkorn, og spesielt krystaller, som er optisk translucente, være upåfallende og kan svært lett overses. Patologen bør lete omhyggelig etter slike strukturer når fremmedlegemeinduserte gingivale forandringer overveies, og vi anbefaler sterkt rutinemessig polarisasjonsmikroskopi ved gingivale forandringer. Ettersom fremmedlegemene ofte er svært lokaliserte, vil vi også betone nødvendigheten av å granske snitt fra flere nivåer av biopsien. Samme overveielser gjelder for differensialdiagnoser ved fremmedlegemegranulomer versus granulomatøse inflammasjoner som Crohns sykdom, sarcoidose, tuberkulose og visse mykoser (5). I denne sammenheng bør man også være oppmerksom på muligheten for sakoidoseutvikling i silikonholdige arr (25, 26).
Noen mener at røntgenenergidispersjonsanalyse, om enn ønskelig, ikke er påkrevet ved de fleste tilfeller av fremmedlegemegingivitt, ettersom fremmedmaterialets sammensetning sannsynligvis ikke influerer på klinisk bilde og prognose (9). Etter vår mening er det imidlertid patologens forpliktelse å gi en så fullstendig og nøyaktig rapport som mulig innen praktisk rimelige grenser, som også argumentert for av andre (27).
Profylakse
Man må tilstrebe å minimalisere introduksjon av fremmedlegemer i gingiva/vev som er blitt ledert under dentale prosedyrer (28) eller som er blitt svekket eller ulcerert ved patologiske tilstander som lichen planus (5) eller pemfigoid. Klinikeren bør ha som ideelt mål å unngå traumatisering av gingiva ved applisering, trimming/pussing og poléring av restaureringer. Likeledes bør anvendelse av abraderende instrumenter, hjelpemidler og materialer nær gingiva holdes på et minimumsnivå og benyttes med stor forsiktighet. Profesjonelt utførte eller selvadministrerte profylaktiske prosedyrer bør utføres med forsiktighet, og det må gis god tid for tilheling etter periodontale prosedyrer før profylaktisk poléring utføres (6). I særdeleshet må anvendelse av «air flow»/påblåsing med abrasive komponenter (for eksempel silisiumoksid) betraktes som potensielt risikofylt.
Terapi
Nødvendigheten av biopsi for diagnose av gingivale forandringer som er refraktære overfor konvensjonell terapi, betones sterkt. Noen har tatt til orde for en varsom holdning med hensyn til ektomi av fremmedlegemeinduserte gingivale forandringer ettersom forandringene kan gå i regresjon med tiden, slik som amalgamtatovering (12, 14). Det er ikke overraskende at lokal anvendelse av steroider ikke har gitt varig reduksjon av symptomene (9). Andre har anbefalt eksisjon (29). Vi er enige i dette syn og anbefaler at i det minste lokaliserte gingivale fremmedlegemeforandringer bør reeksideres hvis fremmedmateriale kan antas å persistere, og denne holdning bør også overveies ved mer ekstensive forandringer.
Takk
Vi skylder Donna Beck og Anne-Beth Pedersen stor takk for teknisk ekspertise og Siv Jamtøya og Sonny Langseth-Manrique for manuskriptskriving/utferdigelse. Vi vil også uttrykke våre dype takk til refereer i J Oral Pathol & Med for høyst verdifulle kommentarer til forbedringer av originalpublikasjonen.
Vi takker også Norges Forskningsråd for støtte gjennom bevilgning nr. 120135/300.
English summary
Gingival foreign bodies. Characterization, tissue reactions and possible origin
Foreign material may cause and aggravate gingival lesions. This is rarely considered clinically. The lesions are resistant to frequently protracted conventional therapy. The foreign material is often inconspicuous and easily overlooked by the pathologist.
85 cases of gingival lesions containing foreign material were investigated by conventional and polarization light microscopy, focusing on the morphology and optical characteristics of the foreign substance. Supplemented with the results of x-ray energy dispersive analysis the foreign material was compared with commonly used dental materials.
The foreign material was most frequently compatible with amalgam. Inconspicuous crystals, often revealed only by polarization microscopy, were most commonly compatible with abrasives, particularly corundum and silicates, and mostly occurred together with amalgam particles/dust.
Iatrogenic introduction of dental materials during dental procedures explains most foreign body gingival lesions which could be reduced or avoided by prophylactic measures. Pathologists should meticulously scrutinize gingival biopsies routinely applying polarization microscopy.
Hovedbudskap | |
|---|---|
• |
Terapiresistente, ofte lokaliserte gingivale forandringer kan være forårsaket av fremmedlegemer. |
• |
Fremmedlegemene stammer som oftest fra dentalmaterialer og –utstyr og er iatrogent introdusert i vevet. |
• |
Tannlegen må overveie fremmedlegemeforandringer blant differensialdiagnosene ved gingivale forandringer, og ta forholdsregler for å hindre/redusere introduksjon av fremmedlegemer i gingiva. |
• |
Patologen må granske biopsier fra slike tilfeller nøye og rutinemessig anvende polarisasjonsmikroskopi og eventuelt røntgenenergidispersjonsanalyse. |
Referanser
1. Koppang HS, Koppang R, Solheim T, Aarnes H, Stølen SØ. Cellulose fibres from endontic paper points as an etiological factor in postendodontic periapical granulomas and cysts. J Endodont 1989; 15: 369 – 72.
2. Koppang HS, Koppang R, Stølen SØ. Identification of common foreign material in postendodontic granulomas and cysts. J Dent Assoc S Africa 1992; 47: 210 – 6.
3. Koppang HS, Koppang R, Stølen SØ. Periapicale fremmedlegemer – hva består de av, hvor stammer de fra, og hva gjør de? Nor Tannlegefor Tid 1993; 103: 630 – 9.
4. Daley TD, Wysocki GP. Foreign body gingivitis: An iatrogenic disease? Oral Surg Oral Med Oral Pathol 1990; 69: 708 – 12.
5. Gordon SC, Daley TD. Foreign body gingivitis. Clinical and microscopic features of 61 cases. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1997; 83: 562 – 70.
6. Gordon SC, Daley TD. Foreign body gingivitis. Identification of the foreign material by energy-dispersive x-ray microanalysis. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1997; 83: 571 – 6.
7. Anusavice KJ. Phillips´ Science of Dental Materials. 10th ed. Philadelphia: Saunders; 1996: p. 663 – 80.
8. Koppang HS, Roushan A, Srafilzadeh A, Stølen SØ, Koppang R. Foreign body gingival lesions: distribution, morphology, identification by x-ray dispersive analysis and possible origin of foreign material. J Oral Pathol Med 2007; 36: 161 – 72.
9. Gordon S. Foreign body gingivitis associated with a new crown: EDX analysis and review of the literature. Operative Dent 2000; 25: 344 – 7.
10. Ghadially FN. Invited review. The technique and scope of electron-probe x-ray analysis in pathology. Pathology 1979; 11: 95 – 110.
11. Shin HJ, Taylor WE, Hagler H, Eigenbrodt ML. Barium sulphate in a fine needle aspiration biopsy specimen from a neck mass in a patient with squamous cell carcinoma. A case report. Acta Cytol 1993; 37: 221 – 5.
12. Harrison JD, Rowly PSA, Peters PD. Amalgam tattoos: Light and electron microscopy and electron-probe micro-analysis. J Path 1977; 121: 83 – 92.
13. Forsell M, Larsson B, Ljungqvist A, Carlmark B, Johansson O. Mercury content in amalgam tattoos of human oral mucosa and its relation to local tissue reactions. Eur J Oral Sci 1998; 106: 582 – 7.
14. Buchner A, Hansen LS. Amalgam pigmentation (amalgam tattoo) of the oral mucosa. A clinicopathological study of 268 cases. Oral Surg 1980; 49: 139 – 47.
15. Freitas RA Jr. Nanomedicine.Vol II A: Biocompatibility. Austin, Texas: Landes Bioscience; 2003: 83, 125 – 54.
16. Hallab N, Jacobs JJ, Black J. Hypersensitivity to metallic biomaterials: a review of leukocyte migration inhibition assays. Biomaterials 2000; 21: 1301 – 14.
17. Darvell BW, Samman N, Luk WK, Clark RKF, Tideman H. Contamination of titanium castings by aluminium oxide blasting. J Dent 1995; 23: 319 – 22.
18. Hunt JA, McLaughlin PJ, Flanagan BF. Techniques to investigate cellular and molecular interactions in the host response to implanted biomaterials. Review. Biomaterials 1997; 18: 1449 – 59.
19. Rigdon RH. Tissue reaction to foreign materials. CRC critical reviews in toxicology, 1975; 3: 435 – 76.
20. Morgan AM. Localized reactions to injected therapeutic material. Part I. Medical agents. J Cutan Pathol 1995; 22: 193 – 214.
21. Göske J, Uter W, Holzwarth U, Kachler W, Zeiler G, Schuh A. Surface characterization of corundum-blasted implants in hip arthroplasty. Microscopy and Analysis 2004; 18: 9 – 11.
22. Eley BM. Tissue reactions to implanted dental amalgam, including assessment by energy dispersive x-ray micro-analysis. J Pathol 1982; 138: 251 – 72.
23. Eley BM, Cox SW. Renal cortical mercury levels associated with experimental amalgam tattoos: effects of particle size and amount of implanted material. Biomaterials 1987; 8: 401 – 3.
24. Rimkuviene J, Kvaal SI, Koppang HS, Barkvoll P. Histopathological characteristics of gingival lichen planus and lichenoid reaction. In: Rimkuviene J. Oral lichen planus and lichenoid reactions. (Thesis). Oslo: University of Oslo, 2005; Paper II: 1 – 26.
25. Harms M, Masouyé I, Saurat J-H. Silica granuloma mimicking granulomatous cheilitis. Dermatologica 1990; 181: 246 – 7.
26. Pimentel L, Barnadas M, Vidal D, Sancho F, Fontarnau R, Alomar A. Simultaneous presentation of silicone and silica granuloma. Dermatology 2002; 205: 162 – 5.
27. Daley TD, Gibson D. Practical applications of energy dispersive x-ray microanalysis in diagnostic oral pathology. Oral Surg Oral Med Oral Pathol 1990; 69: 339 – 44.
28. Damm DD, Fantasia JE. Chronic gingival erythema and tenderness. Gen Dent 2001; 49: 574, 658.
29. Newland IR. Oral and maxillofacial pathology case of the month. Granulomatous (foreign body) gingivitis. Texas Dent J 2002; 119: 449, 465.
Adresse: Hanna Strømme Koppang, Avd. for patologi og rettsodontologi, Det odontologiske fakultet, postboks 1109 Blindern, 0317 Oslo. E-post: hanna@odont.uio.no
Artikkelen har gjennomgått ekstern faglig vurdering.
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Koppang HS, Roushan A, Srafilzadeh A, Stølen SØ, Koppang R. Fremmedlegemer i gingiva. Nor Tannlegeforen Tid. 2008;118:288–98. doi:10.56373/2008-5-3