Keratocystisk odontogen tumor – keratocysten har fått nytt navn
Forfattere
spesialistkandidat, oral kirurgi og oral medisin, dr.odont., godkjent oral patolog. Odontologisk klinikk, Det medisinsk-odontologiske fakultet, Universitetet i Bergen
professor, dr.odont. og lic.odont., Avdeling for patologi og rettsodontologi, Institutt for klinisk odontologi, Det odontologiske fakultet, Universitetet i Oslo. Konsulent i oral patologi, Laboratorium for Patologi AS, Oslo
professor, dr.odont. og cand.med., Gades Institutt, Det medisinsk-odontologiske fakultet, Universitetet i Bergen og Avdeling for patologi, Haukeland universitetssykehus, Bergen
Odontogen keratocyste har tradisjonelt vært klassifisert som en cyste. I den siste utgaven av WHO-klassifikasjonen av svulster i hode-hals-regionen er den største undergruppen av keratocyster blitt reklassifisert til en benign odontogen svulst med navnet keratocystisk odontogen tumor. Den andre typen av keratocyster som er langt sjeldnere, oppfattes fremdeles som en odontogen cyste. Denne betegnes nå ifølge WHO ortokeratinisert odontogen cyste. Bakgrunnen for reklassifiseringen er keratocystens kliniske opptreden med stor residivtendens, dens spesielle histologiske bilde, samt nyere immunhistokjemisk og genetisk forskning.
Odontogen keratocyste (primordialcyste) har, som navnet tilsier, tradisjonelt vært klassifisert som en cyste. Navnet keratocyste var brukt for første gang i 1956 for å beskrive en odontogen cyste med keratinisert epitel (1). I den siste WHO-klassifikasjonen av svulster i hode-hals-regionen er den største undergruppen av odontogene keratocyster blitt reklassifisert til en benign svulst med navnet keratocystisk odontogen tumor (2). I den siste utgaven av boken «Cysts of the oral and maxillofacial regions» konkluderte også Shear og Speight med at det finnes understøttende bevis fra flere studier for at angjeldende gruppe av keratocyster er en benign svulst (3). Keratocystisk odontogen tumor defineres som en benign uni- eller multicystisk intraossøs tumor av odontogen opprinnelse, med karakteristisk parakeratinisert flerlaget plateepitel (cellekjernene persisterer i keratinlaget) og potensial for aggressiv og infiltrativ vekst (2). Den andre undergruppen av keratocyster, som har ortokeratinsert epitel (ingen cellekjerner i keratinlaget), oppfattes fremdeles som en odontogen cyste og betegnes nå ifølge WHO ortokeratinisert odontogen cyste. I denne oversiktsartikkelen presenteres kliniske, immunhistokjemiske og genetiske funn som indikerer at den tidligere betegnelsen odontogen keratocyste omfatter to vidt forskjellige forandringer: keratocystisk odontogen tumor, en odontogen cystisk svulst, og ortokeratinisert odontogen cyste, en ekte odontogen cyste.
Keratocystisk odontogen tumor
Keratocystisk odontogen tumor kan forekomme i alle aldersgrupper, men hyppigst i 10 – 30-årsalderen. Den opptrer hyppigere hos menn enn kvinner og hyppigere i underkjeven enn i overkjeven. I underkjeven ses svulsten hyppigst i den posteriore del. Som oftest er keratocystisk odontogen tumor en smertefri cystisk forandring som oppdages under rutine-røntgenundersøkelse, men den kan også gi opphav til smerte, hevelse eller drenering av væske gjennom slimhinnen. Imidlertid beskriver flere rapporter også en solid variant av keratocystisk odontogen tumor (4–6). Generelt er keratocystisk odontogen tumor solitær, men multiple svulster kan forekomme, spesielt som en del av nevoid basalcellecarcinomsyndrom (NBCCS, Gorlin-Goltz syndrom). NBCCS arves som et autosomal dominant syndrom og omfatter bl.a. multiple nevoide basalcellecarcinomer på hud, keratocyster i kjevene, medfødte skjelettdefekter, deriblant bifide ribber og forandringer i øyne og sentralnervesystemet (2, 3).
Røntgenundersøkelse av keratocystisk odontogen tumor viser en liten rund eller oval, unilokulær (Figur 1A) eller en større multilokulær radiolucens med bølget (polycyklisk) avgrensning (Figur 1B) med distinkt radiopak periferi. Svulstene i overkjeven er ofte mindre, men kan bli ekstensive. Svulstene i underkjeven er ofte større og ikke sjelden multilokulære (2). Tennene i området kan forskyves, men resorpsjon av røttene forekommer sjelden. Ved hjelp av MRI og CT kan invasiv vekst påvises (7, 8). Keratocystisk odontogen tumor er kjent for sin spesielt høye recidivtendens etter kirurgisk behandling (2, 3), varierende fra 3 – 62 % i forskjellige studier (3) (Tabell 1).
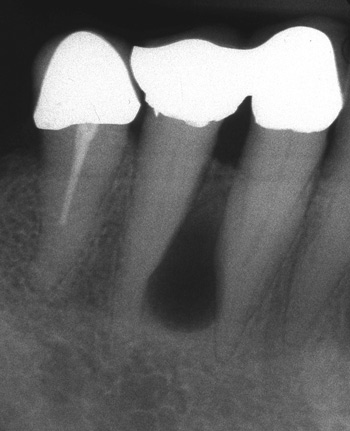
Figur 1A. Røntgenbilde av en unicystisk keratocystisk odontogen tumor i regio 43 – 44. Dette er et noe uvanlig bilde av en keratocystisk odontogen tumor.
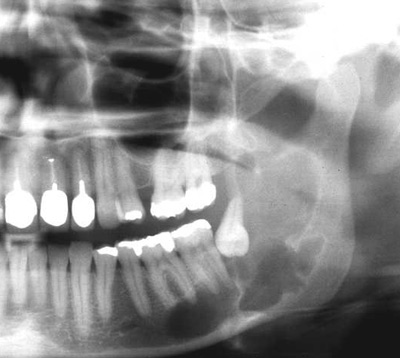
Figur 1B. Røntgenbilde av en multicystisk keratocystisk odontogen tumor. Større multilokulær radiolucens i corpus og ramus mandibulae og med bølget avgrensning med distinkt radiopak periferi. Retinert tann 38 er invertert og forskjøvet opp i ramus. Bildet er utlånt av professor Trond Inge Berge ved Universitetet i Bergen.
Kjennetegn |
Keratocystisk odontogen tumor |
Ortokeratinisert odontogen cyste |
|---|---|---|
Alder |
Alle aldre, hyppigst 10 – 30 år |
30 – 50 år |
Forekomst |
5 – 15 % av odontogene cyster |
20 ganger sjeldnere |
Kjønn |
Menn > Kvinner |
Menn = Kvinner |
Vanligste lokalisasjon |
Posteriore del av underkjeve |
Posteriore del av underkjeve |
Antall cyster |
Solitære eller multiple |
Solitære |
Symptomer |
Ofte asymptomatisk |
Asymptomatisk |
Røntgen |
Uni- eller multicystisk |
Unicystisk |
Vekstmønster |
Aggressivt og infiltrativt |
Ikke aggressivt eller infiltrativt |
Residivtendens |
3 – 62 % |
Ingen eller lav |
Relatert syndrom |
Nevoid basalcellecarcinom-syndrom i 5 % |
Ingen |
Keratocystisk odontogen tumor har sin opprinnelse fra odontogent epitel (rester av tannlisten) eller fra oralt overflateepitel (2). Histologisk viser tumor ett eller flere cystiske hulrom kledd av et jevntykt parakeratinisert flerlaget plateepitel, vanligvis 5 – 8 cellelag, uten retelister. Basalcellelaget består av palisadestilte sylindriske eller kubiske celler med sterkt basofil cellekjerne polarisert bort fra basalmembranen (Figur 2A–D) (2). Dette er et viktig kjennetegn som atskiller keratocystisk odontogen tumor fra ortokeratiniserte cyster. Den parakeratiniserte overflaten har et småbølget forløp, og avstøtt keratin kan sees i cystens lumen. Der ses spredte mitoser suprabasalt. En sjelden gang kan det ses dysplasi i plateepitelet, og malign transformasjon til plateepitelkarsinom kan forekomme. Dersom det er tilkommet betennelse, mister epitelet sine karakteristiske kjennetegn, men som regel vil enkelte typiske områder gjenstå, slik at korrekt diagnose kan stilles.
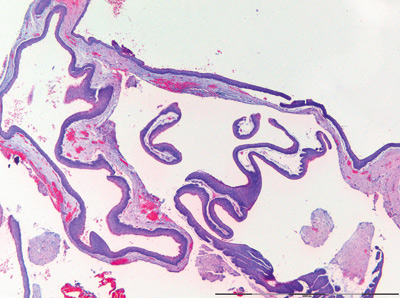
Figur 2A. Oversiktsbilde av vevsnitt fra keratocystisk odontogen tumor som viser tynnvegget cyste som gir inntrykk av å være multilokulær. Epitelet er tynt og foldet og er delvis løsnet fra bindevevet. Opprinnelig forstørrelse: 25x.
Figur 2B. Nærbilde av cysteveggen fra en keratocystisk odontogen tumor. Der sees et flerlaget parakeratinisert plateepitel med palisadestilte basalceller med sterkt fargete kjerner. Overflaten har et småbølget forløp. Opprinnelig forstørrelse: 200x.
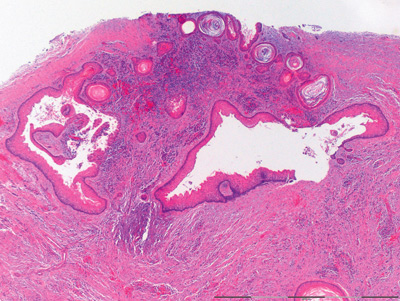
Figur 2C. Oversiktsbilde av vevssnitt fra keraocystisk odontogen tumor som viser tallrike mindre «dattercyster» med for det meste glatt overflate og lave basalceller på grunn av trykk fra keratinmassene i lumen. Opprinnelig forstørrelse: 25x.
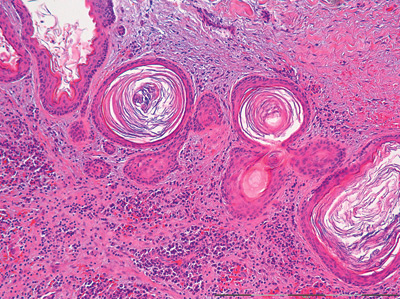
Figur 2D. Nærbilde av 2C. Her sees keratinfylte små «dattercyster» med de samme kjennetegn i cysteepitelet som beskrevet ovenfor (Fig 2B). Opprinnelig forstørrelse: 100x.
Ortokeratinisert odontogen cyste
Ortokeratinisert odontogen cyste er en ekte cyste som forekommer hyppigst i 30 – 50-årsalderen, uten kjønnspredileksjon og ca. 20 ganger sjeldnere enn keratocystisk odontogen tumor. Ortokeratinisert odontogen cyste og keratocystisk odontogen tumor har samme predileksjon for den posteriore delen av underkjeven (9). Klinisk karakteriseres den ved asymptomatisk vekst og liten eller ingen residivtendens. Røntgenologisk beskrives den som en solitær ikke-ekspanderende, radiolucent forandring (10). Ortokeratinisert odontogen cyste er ikke knyttet til NBCCS. Histologisk har ortokeratinisert odontogen cyste et tydelig granulært cellelag (stratum granulosum) umiddelbart under en jevn ortokeratinisert overflate (Figur 2E). Det basale cellelaget er ikke uttalt eller polarisert slik som i keratocystisk odontogen tumor (10).
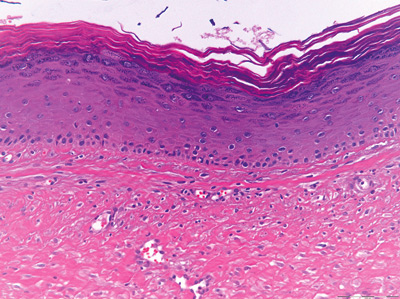
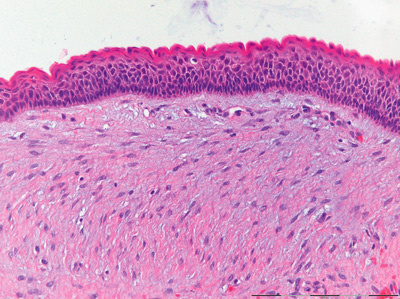
Figur 2E. Nærbilde av cysteveggen fra en ortokeratinisert odontogen cyste. Der sees et flerlaget plateepitel med et tykt hornlag som er ortokeratinisert, et tydelig granulærcellelag og lave basalceller. Opprinnelig forstørrelse: 200x.
Immunhistokjemiske funn som tyder på neoplastiske egenskaper hos keratocystisk odontogen tumor
Det finnes en rekke immunhistokjemiske studier som har sammenlignet keratocystisk odontogen tumor med ortokeratinisert odontogen cyste og andre odontogene cyster som radikulær-, lateral periodontal- og follikulærcyster. Immunhistokjemiske studier av celledelingsmarkører som PCNA og Ki-67 og onkoproteinet TP53 har påvist økt forekomst av disse proteinene i keratocystisk odontogen tumor sammenlignet med andre typer cyster som radikulær- og follikulærcyster. Innen gruppen keratocystisk odontogen tumor peker også cystene relatert til NBCCS seg ut som en egen gruppe (sammenfattet i ref. 11 og Tabell 2).
Immunhistokjemiske og genetiske funn |
|---|
Økt proliferasjon Ki-67, PCNA |
Økt utrykk av anti-apoptotiske BCL2-proteiner |
Økt uttrykk av onkoproteiner TP53, Cyclin D1, EGFR |
Forandringer i kromosomer 3p, 9p, 9q, 11q, 12q, 13q, 17p |
Inaktivering av tumorhemmende gener PTCH, TP53, TP16 (CDNK2A), FHIT, MCC, KAI-1 |
Studier tyder på at også bindevevet i cysteveggen i keratocystisk odontogen tumor er involvert i den neoplastiske prosessen. Ved bruk av proliferasjonsmarkøren H3-thymidin ble det påvist at bindevevsveggen i keratocystisk odontogen tumor prolifererer samtidig med epitelet i enkelte områder (12). I tillegg er det vist at keratocystisk odontogen tumor har kollagene fibre som ligner mer på stroma i odontogene svulster enn i cyster (13). Keratocystisk odontogen tumor produserer interleukin (IL)-1a, IL-6 og matrix metalloproteinaser (MMP-2, MMP-9), og disse proteinene spiller en viktig rolle i benresorpsjon og infiltrasjon av omgivende vev (14). IL-1a-produksjon og MMP-aktivitet er mer uttalt i keratocystisk odontogen tumor enn i radikulære og follikulære cyster (15, 16).
Genetiske funn
Levanat og medarbeidere har forslått en «to-angreps-hypotese» i patogenesen for NBCCS og keratocystisk odontogen tumor. Det første angrepet, som skjer tidlig i embryogenesen, er tap av heterozygositet av kromosom 9q22 der PTCH-genet er lokalisert (17). Senere studier har påvist at PTCH-genet er mutert i begge typer av keratocystisk odontogen tumor (18), noe som indikerer en felles molekylær patogenese. Etter to-angreps-hypotesen, trenger personer som har forandring i det tumorhemmende PTCH-genet kun én genetisk forandring senere i livet for å utvikle keratocystisk odontogen tumor (17). Andre forandringer i kromosomene 3p14 (FHIT), 9p21 (TP21), 11q23, 12q13, 13q12.1 og 17p13 (TP53) er også rapportert i keratocystisk odontogen tumor (19, 20). Det er interessant at forandringer i 3p14, 9p12 og 17p13 også er beskrevet i orale plateepitelkarsinomer (21, 22), og dette kan muligvis bidra til å forklare tilfellene av plateepitelcarcinomutvikling i keratocystisk odontogen tumor (23).
Konklusjon
Kliniske og genetiske studier har påvist at keratocystisk odontogen tumor har et ukontrollert, progressivt og aggressivt vekstmønster sammenlignet med andre odontogene cystiske forandringer. Uttrykk av flere proliferasjons-, apoptose- og onko-proteiner viser at keratocystisk odontogen tumor har mer til felles med odontogene svulster enn med odontogene cyster. Disse forhold er bakgrunnen for at WHO i sin siste klassifikasjon av odontogene svulster har omdøpt og reklassifisert parakeratiniserende keratocyste til keratocystisk odontogen tumor.
Keratocystisk odontogen tumors neoplastiske atferd er knyttet til spesifikke genetiske kromosomforandringer (i 3p, 9p, 9q, 11q, 12q, 13q, 17p) som også har vært relatert til orale plateepitelcarcinomer. Enkelte tumorhemmende gener, blant andre PTCH, TP53 og TP16, er inaktivert i keratocystisk odontogen tumor. De ortokeratiniserte keratocystene er ekte odontogene cyster og har fått navnet ortokeratinisert odontogen cyste.
Til tross for WHOs reklassifikasjon, er det i dag ingen internasjonal konsensus når det gjelder navnendring av odontogen keratocyste. Navnet «odontogen keratocyste» eller «keratocyste» er så innarbeidet blant klinikere og patologer at navnet etter manges mening kan opprettholdes, selv om det blir konsensus på at keratocysten er virkelig neoplastisk (3). Etter vår mening er det imidlertid av vesentlig betydning å gjøre klinikeren oppmerksom på forandringens tumorkarakter, ved f. eks. i en overgangsfase å sidestille cystebetegnelsen og tumorbetegnelsen i diagnostikken slik: Keratocystisk odontogen tumor / parakeratiniserende keratocyste.
English summary
Loro LL, Koppang HS og Johannessen AC.
Keratocystic odontogenic tumour – the keratocyst is reclassified
164 – 8.
Odontogenic keratocyst has traditionally been classified as a cyst. In the last edition of the WHO-classification of head and neck tumours, the largest subgroup of keratocysts has been reclassified to a benign odontogenic tumour with the name keratocystic odontogenic tumour. The other type of keratocysts, which occurs far less frequently, is still considered to be an odontogenic cyst, and is described as orthokeratinized odontogenic cyst in the WHO-classification. The background for the reclassification is the clinical features with high recurrence rate, its specific histological picture, in addition to recent immunohistochemic and genetic research.
Hovedbudskap | |
|---|---|
• |
WHO har reklassifisert den største gruppen av odontogene keratocyster til keratocystisk odontogen tumor |
• |
Reklassifiseringen er gjort på bakgrunn av klinisk opptreden, histologisk bilde samt nyere forskning |
• |
En mindre gruppe odontogene keratocyster oppfattes fremdeles som cyster og betegnes nå ortokeratinisert odontogen cyste |
Referanser
1. Philipsen H. Om keratocyster (kolesteatomer) i kæberne. Tandlægebladet 1956; 60: 963 – 8.
2. World Health Organisation Classification of Tumours. Pathology and genetics of head and neck tumours. Barnes L, Eveson J, Reichart P, Sidransky D, editors. Lyon: IACR Press; 2005. p. 306 – 7.
3. Shear M, Speight PM. Cysts of the oral and maxillofacial regions. 4th ed. Oxford: Blackwell Publishing; 2007. p. 6 – 58.
4. Ide F, Mishima K, Saito I. Solid-cystic tumor variant of odontogenic keratocyst: an aggressive but benign lesion simulating keratoameloblastoma. Virchows Arch 2003; 442: 501 – 3.
5. Vered M, Buchner A, Dayan D, Shteif M, Laurian A. Solid variant of odontogenic keratocyst. J Oral Pathol Med 2004; 33: 125 – 8.
6. Daley TD, Multari J, Darling MR. A case report of a solid keratocystic odontogenic tumor: is it the missing link? Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2007; 103: 512 – 5.
7. Lovin J, Talarico C, Wegert S, Gaynor L, Sutley SS. Gorlin"s syndrome with associated odontogenic cysts. Pediatr Radiol 1991; 21: 584 – 7.
8. Janse van Rensburg L, Nortje C, Thompson I. Correlating imaging and histopathology of an odontogenic keratocyst in the nevoid basal cell carcinoma syndrome. Dentomaxillofac Radiol 1997; 26: 195 – 9.
9. Crowley T, Kaugars G, Gunsolley J. Odontogenic keratocysts: a clinical and histologic comparison of the parakeratin and orthokeratin variants. J Oral Maxillofac Surg 1992; 50: 22 – 6.
10. Regezi J, Sciubba J, Jordan RCK. Oral Pathology, Clinical Pathologic Correlations. 4th ed. St. Louis, Missouri: Saunders; 2003.
11. Shear M. The aggressive nature of the odontogenic keratocyst: is it a benign cystic neoplasm? Part 2. Proliferation and genetic studies. Oral Oncol 2002; 38: 323 – 31.
12. Scharffetter K, Balz-Herrmann C, Lagrange W, Koberg W, Mittermayer C. Proliferation kinetics-study of the growth of keratocysts. Morpho-functional explanation for recurrences. J Craniomaxillofac Surg 1989; 17: 226 – 33.
13. Hirshberg A, Sherman S, Buchner A, Dayan D. Collagen fibres in the wall of odontogenic keratocysts: a study with picrosirius red and polarizing microscopy. J Oral Pathol Med 1999; 28: 410 – 2.
14. Kubota Y, Oka S, Nakagawa S, Shirasuna K. Interleukin-1(alpha) enhances type I collagen-induced activation of matrix metalloproteinase-2 in odontogenic keratocyst fibroblasts. J Dent Res 2002; 81: 23 – 7.
15. Meghji S, Harvey W, Harris M. Interleukin 1-like activity in cystic lesions of the jaw. Br J Oral Maxillofac Surg 1989; 27: 1 – 11.
16. Kubota Y, Ninomiya T, Oka S, Takenoshita Y, Shirasuna K. Interleukin-1 alpha-dependent regulation of matrix metalloproteinase-9 (MMP-9) secretion and activation in the epithelial cells of odontogenic jaw cysts. J Dent Res 2000; 79: 1423 – 30.
17. Levanat S, Gorlin RJ, Fallet S, Johnson DR, Fantasia JE, Bale AE. A two-hit model for developmental defects in Gorlin syndrome. Nat Genet 1996; 12: 85 – 7.
18. Barreto DC, Gomez RS, Bale AE, Boson WL, De Marco L. PTCH gene mutations in odontogenic keratocysts. J Dent Res 2000; 79: 1418 – 22.
19. Henley J, Summerlin DJ, Tomich C, Zhang S, Cheng L. Molecular evidence supporting the neoplastic nature of odontogenic keratocyst: a laser capture microdissection study of 15 cases. Histopathology 2005; 47: 582 – 6.
20. Heikinheimo K, Jee KJ, Morgan PR, Nagy B, Knuutila S, Leivo I. Genetic changes in sporadic keratocystic odontogenic tumors (odontogenic keratocysts). J Dent Res 2007; 86: 544 – 9.
21. Prime SS, Eveson JW, Guest PG, Parkinson EK, Paterson IC. Early genetic and functional events in the pathogenesis of oral cancer. Radiat Oncol Investig 1997; 5: 93 – 6.
22. Partridge M, Emilion G, Pateromichelakis S, Phillips E, Langdon J. Location of candidate tumour suppressor gene loci at chromosomes 3p, 8p and 9p for oral squamous cell carcinomas. Int J Cancer 1999; 83: 318 – 25.
23. Makowski GJ, McGuff S, Van Sickels JE. Squamous cell carcinoma in a maxillary odontogenic keratocyst. J Oral Maxillofac Surg 2001; 59: 76 – 80.
Adresse: Anne Christine Johannessen, Avdeling for patologi, Haukeland universitetssykehus, 5021 Bergen. E-post: anne.johannessen@gades.uib.no
Artikkelen har gjennomgått ekstern faglig vurdering.