Fra dødelig syndrom til kronisk sykdom
Forfattere
Infeksjonsmedisinsk avdeling, Ullevål universitetssykehus, 0407 Oslo
Artikkelen er tidligere publisert i Tidsskrift for Den norske Lægeforening nr. 23, 2006 side 3121 – 4.
Bakgrunn. I 1981, på det tidspunktet da aids ble oppdaget, førte sykdommen raskt til døden. Kombinasjonsbehandling med minst tre medikamenter har nå radikalt endret leveutsiktene.
Materiale og metode. Studien omfatter alle hivpasienter kontrollert ved Infeksjonsmedisinsk avdeling, Ullevål universitetssykehus, i perioden 1982 – 2005. Utvikling av immunsvikt, morbiditet og dødsårsaker er registrert prospektivt. Dødsårsakene er vurdert med henblikk på sammenheng med hivinfeksjonen og behandlingen.
Resultater. 1 632 pasienter er kontrollert ved avdelingen. 32 % av dem er døde. Andelen døde per femårsperiode er sunket fra 35 % i perioden 1991 – 95 til 8 % i perioden 2001 – 05. Mange dør fortsatt fordi de kommer sent til behandling eller har fått insuffisient behandling. I siste tiårsperiode døde 22 pasienter selv om de startet behandling med minst tre medikamenter – sju av kreft, seks pga. behandlingssvikt, én av ukjent årsak og åtte av andre årsaker. De seks som døde som følge av behandlingssvikt, hadde ved diagnosetidspunktet meget lave CD4-nivåer og alvorlige opportunistiske infeksjoner som man ikke fikk kontroll over.
Fortolkning. Prognosen for dem som starter med trippelbehandling mot hiv og klarer å gjennomføre behandlingen er god, men de har sannsynligvis økt risiko for ikke-aidsdefinerende kreft og hjerte- og karsykdom. Hiv/aids er blitt en kronisk sykdom med god prognose.
Aids/hivinfeksjon er siden oppdagelsen i 1981 den sykdom som de siste tiår har hatt størst innvirkning globalt på endrede leveutsikter.
I 1981 var leveutsiktene for en aidspasient i gjennomsnitt 6 – 8 måneder, og sykdomsforekomsten økte eksponentielt. De dystreste prognosene for økning av forekomsten i Norge og andre vestlige land er ikke blitt virkelighet – sannsynligvis hovedsakelig pga. oppmerksomhet omkring sykdommen, kartlegging av smittemåter og forebyggende tiltak. I global sammenheng er imidlertid hiv/ aids den sykdom som dreper flest unge voksne mennesker. UNAIDS anslår at det finnes opptil 46 millioner hivinfiserte, og hvert år er det over tre millioner som dør av sykdommen (1). Epidemien har stagnert i Vesten, men øker fortsatt i de fleste utviklingsland.
I Norge påvises det 200 – 250 nye hivsmittede årlig, hvorav 50 – 100 antas å være smittet innenlands. Resten (nordmenn og innvandrere) er trolig smittet utenlands (2).
Det ble etter oppdagelsen av hiv som årsak til aids snart klart at selv om sykdommen hos noen hadde et raskt dødelig forløp, kunne mange leve i flere år uten symptomer. Gjennomsnittlig tid fra infeksjon til aids hos pasienter uten antiviral behandling er beregnet til 8 – 10 år (3). Bedret behandling og forebygging av opportunistiske infeksjoner og behandling med zidovudin økte i siste del av 1980-årene og første del av 1990-årene levetiden til nærmere to år etter aidsdiagnosen (4, 5). Effekten av zidovudin og andre antiretrovirale midler var forbigående, og det ble snart klart at dette skyldtes resistensutvikling. Først da man i 1996 – 97 rutinemessig gikk inn for behandling med minst tre antivirale midler, klarte man å supprimere infeksjonen over lang tid, med vedvarende immunrekonstitusjon og reversering av sykdomstegn (6).
Vi har nå over ti års erfaring for at denne suppresjonen varer ved, og det er ikke holdepunkter for å anta at effekten vil fortape seg på et senere tidspunkt. Denne effekten forutsetter imidlertid en medikamentetterlevelse vi aldri tidligere har måttet kreve av våre pasienter. Viruset ligger fortsatt latent som DNA i kjernene til den infisertes T-lymfocytter og vil begynne å replikere igjen så snart behandlingen stoppes.
Resistensutvikling hos hivpositive skyldes nå som oftest dårlig medikamentetterlevelse. Lipodystrofi, utvikling av hjerte- og karsykdom sekundært til endring i blodlipidene og andre bivirkninger som får pasienten til å avbryte behandlingen er usikkerhetsfaktorer som kan ha betydning for langtidsprognosen.
Når det gjelder maligne sykdommer hos hivinfiserte, har man diskutert om den dramatiske reduksjonen i forekomst av opportunistiske infeksjoner er mindre for de såkalte aidsdefinerende maligne sykdommer (Kaposis sarkom og malignt lymfom) og andre kreftformer (7 – 9). Det er også funnet en økning i dødsfall pga. leversykdom (10).
Risikoen for bivirkninger på kort og lang sikt, faren for dårlig medikamentetterlevelse og ulempene for pasientene med stadige kontroller og følelse av sykeliggjøring har gjort at vi i Norge hele tiden har vært tilbakeholdne med å starte tidlig behandling, mens det i USA og en del andre land ofte har vært anbefalt å begynne med antivirale midler så snart hivinfeksjon har vært påvist. I de fleste land bruker man imidlertid nå indikasjoner for å starte behandling som er nokså like dem vi stort sett hele perioden har brukt i Norge (11), nemlig: CD4-positive lymfocytter < 0,20 · 109/l eller kliniske tegn på immunsvikt, aids eller lettere manifestasjoner som oral candidiasis og residiverende herpes zoster (klinisk stadium C (aids) eller B) (12) (ramme 1).
Ramme 1 |
|---|
|
Centers for Disease Controls definisjon av klinisk stadieinndeling av hivinfeksjon (12)
|
Vi har nå over 20 effektive medikamenter å velge mellom, og behandlingen styres ved måling av hiv-RNA i plasma, effekten på CD4-nivået og resistensbestemmelse av virus. Ved bivirkninger er det nå også i de fleste tilfellene mulig å endre på medikamentkombinasjonene slik at pasienten tolererer behandlingen uten plagsomme bivirkninger på kort sikt. Behandlingen blir stadig mer pasientvennlig. I global sammenheng er det av stor betydning at WHO har tvunget den farmasøytiske industri til å godta at det produseres generiske kombinasjonspreparater som kan gis som én tablett to ganger daglig. I sommer ble det i USA godkjent en kombinasjonspille med tre medikamenter, noe som også i Vesten muliggjør hivterapi med én pille én gang daglig.
Sammenliknet med tiden før innføring av kombinasjonsbehandling med minst tre antiretrovirale medikamenter er reduksjonen i dødelighet dramatisk. De fleste hivpasienter i vestlige land kan nå regne med en levetid på linje med den til personer med andre kroniske sykdommer, f.eks. diabetes.
Ved sammenlikning av pasienter diagnostisert før 1994 med pasienter hvor hivinfeksjonen ble påvist etter 1.1. 1997 har vi funnet at relativ risiko for død i perioden 1996 – 2004 er redusert fra 22,6 til 3,96 (13). Risikoen ligger imidlertid fortsatt høyere enn risikoen for gjennomsnittsbefolkningen, og undersøkelsen viser at overdødeligheten sannsynligvis er relatert til hiv. Selv om hivinfeksjonen tilsynelatende bringes under kontroll, er det derfor usikkerhet om i hvor stor grad sykelighet og levetidsutsikter er normalisert.
1.1. 2006 var det 3 263 personer med påvist hivinfeksjon i Norge, hvorav 1 632 har vært kontrollert ved Infeksjonsmedisinsk avdeling, Ullevål universitetssykehus. Vi har i denne undersøkelsen studert utviklingen av hiv/aids hos våre pasienter, dødelighet og dødsårsaker.
Materiale og metode
Omtrent 60 % av de behandlingstrengende hivpasientene i Norge har vært fulgt opp ved Ullevål universitetssykehus. Alle som har vært kontrollert fra 1982 til utgangen av desember 2005 er inkludert. Det har for alle vært standardiserte laboratorieprøver og klinisk kontroll hver 3. måned – oftere hvis indisert. Hos enkelte med meget stabil status har kontrollintervallene vært forlenget til 4 – 6 måneder.
Fra starten av epidemien har vi systematisk registrert demografiske data, medikasjon, laboratorieverdier, forekomst av hivrelaterte sykdommer, andre sykdommer, død og dødsårsaker.
For pasienter diagnostisert før de kom til avdelingen eller der hivdiagnosen ble stilt på et senere tidspunkt er supplerende data innhentet fra andre institusjoner, hvis mulig ved f.eks. undersøkelse av lagrede serumprøver. Majoriteten av de døde er obdusert.
For dem som døde utenfor sykehuset er det innhentet opplysninger fra andre sykehus, sykehjem, Rettsmedisinsk institutt og Statistisk sentralbyrå.
Studien har vært godkjent av regional etisk komité og Datatilsynet. Tillatelse til innhenting av data fra andre helseinstitusjoner er godkjent av Statens helsetilsyn (fritak for taushetsplikt). Dødstallene er kontrollert opp mot data i folkeregisteret registrert per 30.6. 2006 for å få med alle dødsfall i 2005 (pga. forsinkelser i registreringen).
Journaler, obduksjonsrapporter m.m. ble gjennomgått av tre av forfatterne, som er erfarne klinikere. Dødsårsakene ble klassifisert som «hivrelatert» og «sannsynlig hivrelatert» hvis de falt inn under de diagnoser som kvalifiserer for stadium B eller C av hivinfeksjon etter kriterier utarbeidet av Centers for Disease Control (11). Død som følge av suicid, voldelig død, ikke-aidsdefinerende malign sykdom, leverlidelser og hjerte- og karsykdom ble klassifisert separat.
For pasienter som døde i de siste to femårsperioder ble opplysningene gjennomgått og vurdert med henblikk på mulig forklaring på eventuell manglende effekt av antiretroviral behandling.
Resultater
Fordeling av pasientene for hver femårsperiode i ulike risikogrupper er vist i tabell 1. Homofile menn utgjør over 40 % av pasientene, intravenøse stoffmisbrukere 18 %, sannsynlig heteroseksuelt smittede nordmenn og innvandrere henholdsvis 16 % og 20 %. Homofile menn var den klart største gruppen initialt og er fortsatt den største gruppen blant de pasienter som følges ved avdelingen. Andelen stoffmisbrukere var størst i perioden 1986 – 90, mens innvandrere som sannsynligvis er smittet heteroseksuelt før de kom til Norge har utgjort en stor andel de siste årene.
Risikogruppe |
1981 – 85 |
1986 – 90 |
1991 – 95 |
1996 – 2000 |
2001 – 05 |
Totalt |
|---|---|---|---|---|---|---|
Homofile menn |
25 (61) |
207 (45) |
295 (46) |
297 (43) |
388 (39) |
677 (41) |
Intravenøse stoffmisbrukere |
11 (27) |
176 (38) |
188 (29) |
136 (20) |
116 (12) |
292 (18) |
Kombinasjon homofil mann og intravenøs stoffmisbruker |
8 (2) |
9 (1) |
5 (1) |
4 (0) |
13 (1) |
|
Heteroseksuell smitte |
2 (5) |
37 (8) |
84 (13) |
133 (19) |
195 (20) |
264 (16) |
Innvandrere |
1 (2) |
19 (4) |
52 (8) |
101 (15) |
233 (24) |
320 (20) |
Blodprodukter |
5 (1) |
5 (0) |
||||
Ukjent |
2 (5) |
7 (2) |
16 (2) |
21 (3) |
48 (5) |
61 (4) |
Total |
41 |
461 |
648 |
696 |
985 |
1 632 |
Døde i perioden |
7 (17) |
98 (21) |
227 (35) |
115 (17) |
78 (8) |
525 (32) |
CD4-nivået ved inklusjon var i første femårsperiode 0,62 · 109/l (spredning 0,17 – 1,52) og har senere sunket gradvis til 0,34 · 109/l (0,001 – 1,39) i siste femårsperiode.
Figur 1 viser antall hivpasienter kontrollert hvert år siden 1981. Den første pasienten ble diagnostisert i avdelingen i 1983, men retrospektive data fra én pasient er inkludert fra 1982. Behandling med zidovudin ble startet i 1987, og andelen pasienter som har fått antiretroviral behandling har steget til 70 % (563/810) i 2005.
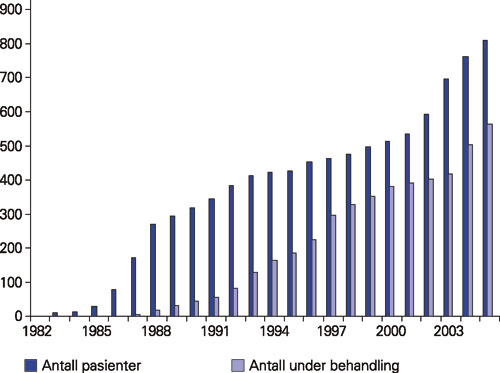
Figur 1. Hivpasienter fulgt ved Ullevål universitetssykehus 1983 – 2005.
Antallet nye pasienter med aids var høyest i 1992, med 42, det sank til 14 i 2000, mens det sist år var 17.
Figur 2 og tabell 2 viser antall aidsdefinerende manifestasjoner og antall døde blant pasienter med hivinfeksjon. Omtrent en tredel av dødsfallene rammet pasienter som ikke hadde utviklet aids, og de siste to årene har det vært flere som dør før de får aids enn de som dør etter at de har utviklet syndromet. Av tabell 2 fremgår det at til tross for betydelig nedgang i antall dødsfall er det fortsatt mange som dør av sannsynlig eller mulig hivrelatert årsak. En del av disse er innvandrere eller andre som har fått insuffisient behandling pga. at de emigrerer eller har vanskelig for å følge opp behandling og kontroll. Når det gjelder maligne sykdommer, er det en tydelig nedgang i antall aidsdefinerende maligne sykdommer. En tilsvarende nedgang synes ikke å ha skjedd når det gjelder ikke-aidsdefinerende maligne sykdommer. Hos 31 pasienter er hjerte- og karsykdom tilgrunnliggende eller medvirkende dødsårsak.
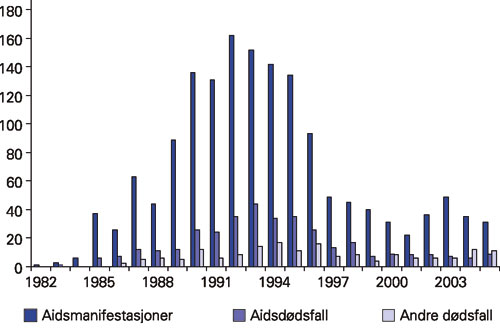
Figur 2. Antall aidsdefinerende manifestasjoner og dødsfall hos pasienter ved Ullevål universitetssykehus.
1981 – 85 |
1986 – 90 |
1991 – 95 |
1996 – 2000 |
2001 – 05 |
Totalt |
||
|---|---|---|---|---|---|---|---|
Døde |
Totalt |
7 |
98 |
227 |
115 |
78 |
525 |
Med aids |
7 |
68 |
169 |
72 |
37 |
353 |
|
Uten aids |
0 |
30 |
58 |
43 |
41 |
172 |
|
Av aids |
6 |
48 |
112 |
51 |
28 |
245 |
|
Død hivrelatert |
6 |
49 |
129 |
57 |
34 |
275 |
|
Aidsmalignitet |
4 |
14 |
34 |
19 |
7 |
78 |
|
Død sannsynlig hivrelatert |
0 |
0 |
3 |
5 |
3 |
11 |
|
Mulig hivrelatert |
1 |
18 |
56 |
21 |
18 |
114 |
|
Suicid |
0 |
7 |
3 |
2 |
3 |
15 |
|
Annen voldelig død/ intoksikasjon |
0 |
3 |
0 |
2 |
3 |
8 |
|
Ikke-aidsmalignitet |
1 |
2 |
9 |
7 |
8 |
27 |
|
Hjerte- og karsykdom1 |
0 |
1 |
12 |
10 |
8 |
31 |
|
Tabell 3 viser antatt årsak til død hos pasienter i de to siste femårsperioder, vurdert ut fra om de hadde fått effektiv hivbehandling og oppfølging. Periodene før 1996 er ikke inkludert, da det må antas at alle de døde da må ha fått insuffisient behandling. 117 av de døde hadde ikke fått adekvat behandling. 22 pasienter døde til tross for adekvat behandling, én av disse pga. bivirkning av behandlingen. 15 personer døde av ulike årsaker som ikke umiddelbart kan sies å skyldes hiv. Av de seks resterende som døde til tross for adekvat antiretroviral behandling i over én måned, debuterte to med alvorlige opportunistiske infeksjoner som man ikke fikk kontroll over (kryptokokk-meningoencefalitt, amøbeencefalitt), to hadde meget lave CD4-nivåer ved diagnosetidspunktet (< 0,01 · 109/l) uten at tallet steg over dette nivået til tross for over et halvt års effektiv behandling, én pasient fikk et sekundært fall i CD4-nivået i tilslutning til cytostatikabehandling for Kaposis sarkom og døde av progredierende multifokal leukoencefalopati. Den siste døde av intraktabel pulmonal hypertensjon, en komplikasjon som er assosiert med hivinfeksjon (14).
Dødsårsak |
1996 – 2000 |
2001 – 2005 |
Totalt |
|---|---|---|---|
Ingen antiretroviral behandling eller behandling i < 1 md. |
33 |
21 |
54 |
Insuffisient behandling1 |
75 |
42 |
117 |
Død tross HAART i > 1 md.2 |
7 |
15 |
22 |
Bivirkning av antiretroviral behandling2 |
1 |
0 |
1 |
Cancer2, 3 |
2 |
5 |
7 |
Intoksikasjon/overdose/suicid2 |
2 |
1 |
3 |
Leversvikt pga. kronisk hepatitt B/C2 |
0 |
2 |
2 |
Behandlingssvikt2, 3 |
1 |
5 |
6 |
Ikke-hivrelatert/ukjent dødsårsak2, 4 |
1 |
2 |
3 |
Totalt |
115 |
78 |
193 |
I et tilfelle som ble klassifisert som bivirkningsrelatert dødsfall, døde pasienten av hjerteinfarkt, antatt utløst av behandlingsindusert anemi som ikke ble oppdaget fordi vedkommende ikke møtte til anbefalt kontroll. Et annet dødsfall i denne perioden var også bivirkningsrelatert. Det gjaldt en pasient som døde av alvorlig laktacidose (vedkommende hadde også fått inadekvat behandling og utviklet resistens overfor mange antiretrovirale midler).
Diskusjon
Et betydelig antall av dødsfallene er klassifisert som «sannsynlig ikke-hivrelatert». Blant disse kan i tillegg suicid, voldelig død og bivirkninger av medikamentene også ha en direkte sammenheng med hivinfeksjonen. Toksiske bivirkninger som anemi, nyresvikt og pankreatitt kommer oftest tidlig. Forverring av metabolsk syndrom, insulinresistens, lipodystrofi, økt frekvens av hjerte- og karsykdom og følger av mitokondrietoksisitet er bivirkninger som kan komme etter mange år. Deler av vår kohort inngår i materialer der det er vist en lett økning i forekomsten av hjerte- og karsykdom (15), og vi har påvist både økt forekomst av metabolsk syndrom (16) og mitokondrietoksisitet (17) uten at det har vært assosiert med annet enn enkeltstående dødsfall.
Vi har tidligere også vist at det hos hivpasienter er økt forekomst av maligne sykdommer som ikke er inkludert i aidsdefinisjonen (18). Det har vært diskutert om moderne behandling kan ha mindre effekt når det gjelder å unngå malign aidsdefinerende sykdom (7 – 9).
Det fremgår av tabell 2 at det har skjedd en dramatisk nedgang også i forekomsten av aidsdefinerenede kreftformer – det passer med nyere resultater fra en fransk kohort (19). Våre resultater kan imidlertid tyde på at det ikke er blitt noen reduksjon i forekomsten av ikke-aidsdefinerende kreft. I risikogrupper som homofile menn og stoffmisbrukere er det ofte en koinfeksjon med hepatitt B eller hepatitt C. Hos to pasienter som fikk adekvat antiretroviral behandling var dødsårsaken kronisk hepatitt. Dette aktualiserer nødvendigheten av å gi adekvat behandling for denne infeksjonen, noe som fortrinnsvis bør gjennomføres før de trenger behandling for hivinfeksjonen.
Avslutning
For dem som starter med trippelbehandling for hiv og klarer å gjennomføre den, er prognosen god. De kan antakelig regne med en levetid som er sammenliknbar med levetiden til personer med andre kroniske sykdommer – og ikke mye kortere enn i normalbefolkningen. Noen søker lege sent og blir diagnostisert først etter at de har fått alvorlige komplikasjoner og et meget lavt antall CD4-celler. Prognosen hos disse avhenger av at de kommer seg av sine initiale komplikasjoner og får en bedring av immunforsvaret. Økt frekvens av hjerte- og karsykdom og muligens også ikke-aidsdefinerende kreftformer kan hos dem med vellykket behandlingseffekt for øvrig gi noe økt dødelighet.
Hovedbudskap | |
|---|---|
• |
Prognosen hos hivpasienter som får effektiv kombinasjonsbehandling er god |
• |
Enkelte pasienter dør fordi de kommer sent til lege og diagnosen først blir stilt når de har fått alvorlige komplikasjoner |
English summary
Bruun JN, Skeie L, Mæland A, Dudman SG, Sannes M, Ormaasen V
HIV/AIDS – From lethal syndrome to chronic disease with a good prognosis? Disease progression in HIV-patients at Ullevål University Hospital 1982 – 2005
102 – 6.
Background. At its discovery in 1981, AIDS was a fatal syndrome that rapidly led to death Combination treatment with at least three medicines has radically improved the prognosis.
Material and methods. The study comprises all HIV-patients controlled at the Department of Infectious Diseases, Ullevål University Hospital from 1982 to 2005. Development of immune deficiency, morbidity and causes of death were registered prospectively. Possible connections between death and HIV-infection and treatment were evaluated.
Results. 1632 patients were followed at our department. 32 % of these patients have died. The number of patients who died annually during the 5 years from 1991 to 1995 was 35 % and this was reduced to 8 % in 2001 – 05. Many patients still die because they either present too late for treatment or have received insufficient treatment. 22 patients have died during the last 10 years irrespective of starting treatment with at least 3 antiretroviral drugs: 7 died from non-AIDS defining cancers, 6 from treatment failure and 2 from non-HIV related causes. The 6 patients who died from treatment failure had very low CD4 counts and serious opportunistic infections that could not be treated effectively at the time of diagnosis.
Interpretation. Patients who start and adhere to treatment with 3 HIV-medications have a good prognosis, but they may still have an increased risk of non-AIDS defining cancers and cardiovascular disease. HIV/AIDS has become a chronic disease with a good prognosis.
Litteratur
1. UNAIDS: 2006 report on the global AIDS epidemic. Genève: WHO, 2006. www.unaids.org/en/ HIV_data/2006GlobalReport/default.asp (23.10.2006).
2. Nilsen Ø, Blystad H, Aavitsland P. HIV-situasjonen i Norge per 31. desember 2005. MSIS-rapport 2006; 34: 7B.
3. Rutherford GW, Lifson AR, Hessol NA et al. Course of HIV-I infection in a cohort of homosexual and bisexual men: an 11 year follow up study. BMJ 1990; 301: 1183 – 8.
4. Fischl MA, Richman DD, Grieco MH et al. The efficacy of azidothymidine (AZT) in the treatment of patients with AIDS and AIDS-related complex: a double-blind, placebo-controlled trial. N Engl J Med 1987; 317: 185 – 91.
5. Chaisson RE, Keruly J, Richman DD et al. Pneumocystis prophylaxis and survival in patients with advanced human immunodeficiency virus infection treated with zidovudine. The Zidovudine Epidemiology Group. Arch Intern Med 1992; 152: 2009 – 13.
6. Mocroft A, Ledergerber B, Katlama C. Decline in the AIDS and death rated in the EuroSIDA study: an observational study. Lancet 2003; 362: 22 – 9.
7. Ledergerber B, Telenti A, Egger M. Risk of HIV related Kaposi’s sarcoma and non-Hodgkin’s lymphoma with potent antiretroviral therapy: prospective cohort study. BMJ 1999; 319: 23 – 4.
8. International Collaboration on HIV & Cancer. Highly active antiretroviral therapy and incidence of cancer in human immunodeficiency virus-infected adults. J Natl Cancer Inst 2000; 92: 1823 – 30.
9. Cheung MC, Pantanowitz L, Dezube BJ. AIDS-related malignancies: emerging challenges in the era of highly active antiretroviral therapy. Oncologist 2005; 10: 412 – 26.
10. Mocroft A, Soriano V, Rockstroh J et al. Is there evidence for an increase in the death rate from liver-related disease in patients with HIV? AIDS 2005; 19: 2117 – 25.
11. Ormaasen V, Bruun JN, Sandvik L et al. A search for optimal criteria in initiating antiretroviral therapy in chronic HIV-infection focusing on CD4-count and HIV-RNA. Scand J Infect Dis 2002; 34: 910 – 7.
12. 1993 revised classification system for HIV infection and expanded surveillance case definition for AIDS among adolescents and adults. MMWR Morb Mortal Wkly Rep 1992; 41: RR-17.
13. Ormaasen V, Sandvik L, Dudman SG et al. HIV related and non-HIV related mortality before and after the introduction of highly active antiretroviral therapy (HAART) in Norway compared to the general population. Scand J Infect Dis 2006: akseptert for publisering.
14. Weiss JR, Pietra CG, Scharf. Primary pulmonary hypertension and human immunodeficiency virus: report of two cases and review of the literature. Arch Intern Med 1995; 155: 2350 – 3.
15. D: A: D: Study Group. Cardio- and cerebrovascular events in HIV-infected persons. AIDS 2004; 18: 1811 – 7.
16. Bergersen BM, Schumacher A, Sandvik L et al. Important differences in components of metabolic syndrome between HIV-patients with and without highly active antiretroviral therapy. Scand J Infect Dis 2006; 38: 682 – 9.
17. Maagaard A, Holberg-Petersen M, Kvittingen EA et al. Depletion of mitochondrial DNA copies/cell in peripheral blood mononuclear cells (PBMC) in HIV-1 infected treatment-naive patients. HIV Med 2006; 7: 53 – 8.
18. Goplen AK, Liestøl K, Dunlop O et al. High incidence and agressive growth of non-AIDS-defining cancers among AIDS patients in Oslo. APMIS 1996; 104: 729 – 33.
19. Bonnet F, Balestre E, Thiébaut R et al. Factors associated with the occurrence of AIDS-related non-Hodgkin lymphoma in the era of highly active antiretroviral therapy: Aquitaine cohort, France. Clin Infect Dis 2006; 42: 411 – 7.
Manuskriptet ble mottatt i Tidsskrift for Den norske lægeforening 22.8. 2006 og godkjent 24.10. 2006. Medisinsk redaktør Erlend Hem.