Oral biofilm – når bakterier snakker sammen
Nå er det kanskje på tide å pensjonere ordet plakk og gå over til å kalle bakteriebelegget på tennene for oral biofilm. Anne Aamdal Scheies presentasjon om biofilm på landsmøtet var en nyttig introduksjon til Elin Giertsens forelesning om forskning på biofilm i Bergen og Zürich. Nederlandske Linda Peters satte det hele inn i en klinisk sammenheng da hun snakket om behandling av endodontiske infeksjoner og apikal periodontitt.
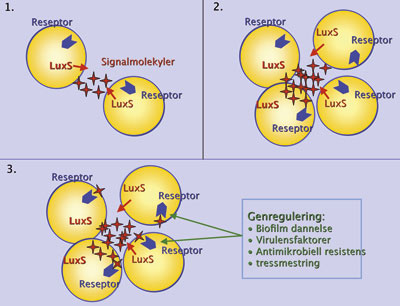
«Quorum sensing»-kommunikasjon i bakterier skjematisk illustrert. Bakteriene produserer signalmolekyler som slippes ut i det omgivende miljø (1). Mengden signalmolekyl øker parallelt med antall bakterier (2). Når konsentrasjonen av signalmolekyl når en viss terskelverdi, registreres signalet av bakteriene og fører til opp- eller nedregulering av ulike gener, for eksempel gener knyttet til biofilmdannelse, uttrykk av virulensfaktorer, antibiotikaresistens og stressmestring (3). Foto: Anne Aamdal Scheie.
Nyere forskning viser at bakterier i naturen fester seg til overflater og danner velorganiserte samfunn som er svært resistente både overfor antimikrobielle midler og vertsorganismens forsvar. Biofilmene er komplekse tredimensjonale samfunn av bakterier som kommuniserer med hverandre på forskjellige «språk», både med sine slektninger og med andre bakteriearter. Det vi hittil har kalt dentalt plakk, er det nå riktigere å kalle dental biofilm. Tidligere har forskerne studert bakterier i flytende medier i laboratoriet. Når man nå har fått mulighet til å studere hvordan bakteriene regulerer gener via kommunikasjonsprosesser i biofilmen, kan det etter hvert bli mulig å utvikle nye strategier for å forebygge og bekjempe sykdommer forårsaket av biofilm-bakterier.
Dette og mer til fortalte professor Anne Aamdal Scheie fra Institutt for oral biologi, UiO i en vel strukturert forelesning, støttet av gode bilder som gjorde det lettere å forstå det kompliserte stoffet. Mer om biofilm og bakteriekommunikasjon kan man lese i hennes artikkel i Tidende nr. 2, 2006.
Professor Elin Giertsen ved Odontologisk institutt, UiB, har i flere år forsket på biofilm i samarbeid med forskere i Zürich. Hun presenterte en modell de har utviklet, som etterligner supragingivalt plakk: Fem bakterier samt Candida albicans dyrkes på skiver av hydroksylapatitt eller bovin emalje (emalje fra storfe). De «fores» med saliva og et medium som inneholder glukose og sukrose. Biofilmen undersøkes på forskjellige tidspunkt ved hjelp av diverse teknikker, blant annet immunfluorescens. Det har vist seg at alle bakteriene i biofilmen har sterk adhesjon til pellikelen og at koadhesjon spiller liten rolle i tidlig fase av biofilmdannelsen.
Biofilmens diffusjonsegenskaper har betydning for utviklingen av karies. Det har vært antatt at biofilm inneholder kanaler, men forskergruppen mener å ha vist at den ikke inneholder kanaler, men hulrom med en diameter på opptil 11 nm. Her kan makromolekyler snirkle seg sakte gjennom de mikrobielle massene. Småmolekylære stoffer diffunderer raskere, sannsynligvis gjennom porer på 2,6 – 4,6 nm.
I denne modellen er det også mulig å studere effekten av antimikrobielle midler som klorheksidin og triclosan i konsentrasjoner som benyttes i klinikken. Skivene dyppes i middelet ett minutt tre ganger per døgn, og resultatene stemmer med plakkhemmende effekt målt i tidligere kliniske studier. Modellen egner seg derfor til utprøving av nye produkter. Den er også brukt for å studere effekten av xylitol. Forskergruppen har ikke funnet noen veksthemmende effekt og kan derfor ikke støtte påstanden om at xylitol skal virke kariesforebyggende. Giertsen viste til slutt at modellen er egnet til å studere de- og remineralisering av bovin emalje under biofilmen ved hjelp av en optisk metode.
Endodontisten Linda Peters fra Amsterdam trakk den nye kunnskapen om biofilm inn i klinikken og videre inn i rotkanalen. Hun sa at suksessraten for endodontisk behandling har ligget rundt 83 % de siste 20 årene, med henholdsvis 79 % der det har vært en apikal periodontitt og 94 % ved vitale tenner.
I dag vet vi at det fins både planktoniske (frittflytende) bakterier og biofilm i kanalen. Tidligere studier har vært det Peters kalte «paper point studies» som har fokusert på de planktoniske bakteriene. For å fjerne infeksjonen helt og oppnå et vellykket resultat etter en rotbehandling, er det imidlertid nødvendig også å fjerne biofilmen i kanalen, noe som ikke lar seg gjøre uten å fjerne et lag dentin. Dette kan være vanskelig på grunn av tannanatomien, og Peters råd var å benytte ultrasonisk irrigasjon etter forutgående mekanisk rensing av rotkanalen.