Utvecklingsbiologiska genombrott inom odontologin
Den revolution som skedde inom genteknologin under 1980-talet gjorde nya genetiska forskningsmetoder tillgängliga för alla forskare. Det innebar att utvecklingsbiologin kom att bli ett av de biovetenskapliga forskningsfält som utvecklades allra snabbast. Anledningen är att embryots utveckling är en process som styrs av gener och att yttre faktorer bara har en minimal betydelse. Tänderna är typiska exempel på organ vars utveckling i detalj definieras i generna. I dag känner man redan till ett par hundra gener som reglerar tandutvecklingen. I många av dessa gener har man identifierat fel som orsakar störningar i utvecklingen. Med förståelse för utvecklingen på cell- och gennivå lägger man grunden till nya behandlingsmetoder för tandsjukdomar, till exempel regeneration av tänder och tändernas stödvävnader.
Embryots utvecklingsprogram finns kodat i generna som ju reglerar alla funktioner i våra celler: celldelningen, differentieringen till olika celltyper (till exempel muskelceller, nervceller, epitelceller), cellernas rörelser och den programmerade celldöden (apoptos).
Den genetiska styrningen av tändernas utveckling
Eftersom generna dubbleras under celldelningen innehåller alla celler samma uppsättning gener. Cellerna utvecklas till olika celltyper genom att de läser av och ger uttryck för olika gener. Ameloblasterna till exempel, de celler som producerar tändernas emalj, uttrycker de gener som kodar för emaljproteiner, exempelvis amelogenin. Kroppens övriga celler har också emaljproteinkodande gener i sin kärna men använder dem inte.
Den utvecklingsbiologiska forskningen strävar efter att klargöra varför cellerna väljer olika utveckling, vilka gener som styr utvecklingen av olika vävnader och organ samt hur genuttrycket, den process som läser av generna, regleras (1).
Forskningen kring tändernas utveckling på gennivå inleddes vid sekelskiftet mellan 1980- och 90-talen. Då hade det blivit möjligt att kartlägga genuttrycket i vävnader under utveckling. Med hjälp av så kallad in situ-hybridisering kunde man hitta budbärar-RNA (m-RNA) i tandanlag som visar genaktiviteten på cellnivå. Vår forskningsgrupp var bland de första som tillämpade metoden och vi lyckades lokalisera den första signalen som visat sig vara viktig för initieringen av en tand på den plats i munnens epitel där tandutvecklingen börjar (2). Den signalmolekyl det var fråga om är BMP4 (bone morphogenetic protein). Detta protein hade upptäckts redan på 1960-talet som det protein som främjar differentieringen av benceller.
Med genteknologiska metoder kunde man framställa signalproteiner som så kallade rekombinantproteiner som vi använde i experiment där vi odlade tänder under utveckling i organodlingar. Vi visade att proteinet BMP4 i mesenkym framkallade transkriptionsfaktorn Msx1, som senare visat sig vara nödvändig för tandutvecklingen hos både möss och människor (Fig. 1). Man hade redan långt före den genteknologiska revolutionen varit medveten om att tandens utveckling styrs av intercellullär kommunikation. Studier som experimentella embryologer inlett redan under 1950-talet visade att tandens utveckling regleras genom en samverkan mellan tandepitelet som härstammar från munnens ektoderm och underliggande stroma eller mesenkym. Vår forskningsgrupp hade identifierat den första signal som förmedlar kommunikationen mellan epitel och mesenkym.
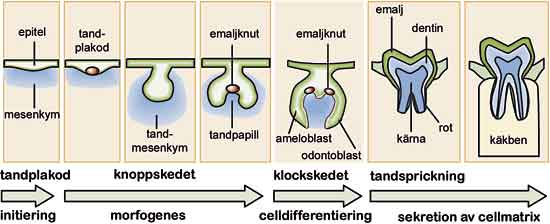
Fig. 1. Tandens utvecklingsstadier. Tandplakor och emaljknuten är signalcentra som styr utvecklingen.
Från och med början av 1990-talet kunde många laboratorier lokalisera flera genprodukter som var viktiga för tandutvecklingen. Majoriteten är signaler som förmedlar kommunikation, deras receptorer samt transkriptionsfaktorer som regleras av signaler i mottagarcellerna. En av medlemmarna i vår grupp, Pekka Nieminen, började samla in gener som är viktiga för tandutveckligen i en databas som han fortfarande upprätthåller och uppdaterar på Internet (www.bite-it.helsinki.fi). Databasen innehåller för närvarande över 300 olika geners uttrycksmönster och har visat sig vara en värdefull och välbesökt informationskälla för forskare över hela världen.
En viktig slutsats av forskningen som belyser den genetiska styrningen av tändernas utveckling är att samma signalmolekyler används vid alla viktiga skeden i tändernas utveckling. BMP4 är ett bra exempel; förutom att den initierar tandutvecklingen från epitelet, sätter BMP4 från mesenkym igång bildandet av en emaljknut i epitelet under tandens knoppstadie (3,4). När epitelcellerna i tandens klockstadie specialiserar sig och börjar producera emalj är det BMP4 från odontoblaster som startar ameloblasternas differentiering (Fig. 1) (5). Olika BMP sätter också igång differentieringen av odontoblaster som bildar dentin, cementoblaster som bildar cement och de benbildande osteoblasterna (Fig. 2).
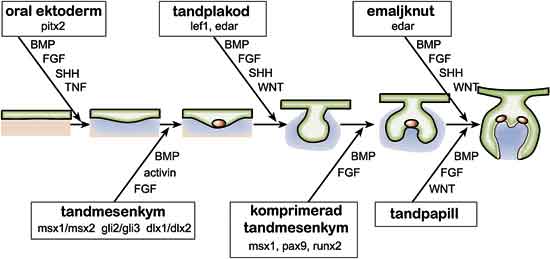
Fig. 2. Tanden utvecklas ur munnens epitel (grønt) och underliggande mesenkym (blått). Kommunikationen mellan vävnaderna sker med hjälp av signalmolekyler. De viktigaste signalmolekylerna är BMP (bone morphogenetic protein), FGF (fibroblasttillväxtfaktor), SHH (sonic hedgehog) och Wnt. De styr utvecklingen genom att påverka viktiga geners uttryck (i rutorna). Med hjälp av knockout-möss vars tandutveckling har avstannat har man kunnat visa vilka gener som än nödvändiga för tandutvecklingen. Mutationer i vissa av dessa gener orsakar ärftlig avsaknad av tänder hos människan. Genom att slå ut de gener som nämns i rutorna i figuren kan man stoppa utvecklingen av mösständer i initieringsskedet. Hos människor orsakar mutationer i generna pitx2, msx1 och pax9 avsaknad av tänder.
Genetiska verktygslåda gemensam för alla djur
Det var spännande tider för de forskare som arbetar med tändernas utveckling när de tillsammans med övriga utvecklingsbiologer kunde bygga upp en helhetsbild av de processer som styr tandutvecklingen. Forskarna började nämligen inse att den genetiska styrningen är överraskande konservativ. I tänder under utveckling upptäckte man redan under första hälften av 1900-talet medlemmar av alla de viktigaste signalfamiljer som styr utvecklingen; förutom BMP är de FGF (fibroblasttillväxtfaktor), Hedgehog och Wnt. Och som en följd av arbetet vid ett stort antal utvecklingsbiologiska laboratorier kunde man samtidigt konstatera att samma signaler även förekom i många andra organ.
Samma gener styr dock inte enbart utvecklingen i olika organ, utan även hos alla undersökta djurarter. Generna har alltså varit i bruk under hela evolutionens lopp, det vill säga hundratals miljoner år. Det är till exempel känt att människan och bananflugan i huvuddrag har samma utvecklingsgener. Trots att flugor och maskar inte har tänder är de flesta gener som behövs för tandutveckling även avgörande för flugors och maskars utveckling. Ett bra exempel är att BMP4 visat sig vara en av de viktigaste molekyler som styr vingarnas utveckling hos flugor.
Vi vet nu att utvecklingsgenerna utgör ett slags verktygsuppsättning som används för att reglera utvecklingen i alla vävnader och organ. Vi vet också att dess viktigaste funktion är att förmedla kommunikation mellan cellerna. Verktygen omfattar en mängd signalmolekyler som cellerna skickar till varandra samt receptorer som tar emot signalerna. Dessutom innehåller verktygsuppsättningen molekyler som transporterar signaler från cellernas yta till kärnan och transkriptionsfaktorer som styr genuttrycket i kärnan (1).
Det är anmärkningsvärt att man, förutom emaljproteinerna, ännu inte funnit en enda gen vars uttryck skulle vara specifikt för tänder. I huvudsak styrs alltså tandutvecklingen av samma gener som övriga vävnader och organ. Det är av stor klinisk betydelse när man studerar utvecklingsstörningar i tänderna eftersom man kan utgå från att de genfel som uppstått också kan störa utvecklingen i andra strukturer.
Genmanipulerade möss
Det faktum att både de mekanismer som styr utvecklingen och organismens genuppsättning varit oförändrad inom djurvärlden innebär att forskningen kan välja försöksdjur efter hur väl djuren lämpar sig för forskningsändamålet. För att studera tandutveckling har man i allmänhet använt möss. Mössens tanduppsättning påminner om människans och man har även lärt sig att manipulera deras gener.
På mitten av 1990-talet blev det vanligt att använda så kallade knock-out-möss. År 1994 kom de första rapporterna om genmanipulerade möss hos vilka tandutvecklingen slagits ut. Genom att hindra Msx1-genens funktion kunde man bromsa upp tandutvecklingen i knoppstadiet (dessutom utvecklade dessa möss gomspalt) (6). Även genom att blockera Lef1-genen stannade mössens tandutveckling upp i knoppstadiet (7). Mössen gav ett direkt bevis för signalrutternas avgörande betydelse för tändernas uppkomst eftersom Msx1 medverkar i överföring av BMP-signalen och Lef1 överför Wnt-signalen i cellkärnan. Senare visade man med knock-out-möss att både FGF och Hedgehogs signalrutter var avgörande för tandutvecklingen (8,9). Hittills har man rapporterat över tio knock-out-muslinjer som saknar tänder (i allmänhet saknas alla tänder) (Fig. 1). I samtliga dessa fall är generna komponenter i olika signalnätverk.
Transgena möss används numera rutinmässigt vid forskning om tandutvecklingen och teknologin för genmanipulation hos möss utvecklas snabbt. Numera kan man till exempel med hjälp av sofistikerade metoder blockera en gens funktion vid en bestämd tidpunkt eller i en bestämd vävnad. Metoden är mycket användbar i synnerhet om den gen som man undersöker är viktig redan under embryots tidiga utveckling. Om den specifika genen blockeras dör till exempel mössens ungar redan innan tänderna börjat utvecklas.
Den första studie där man använde vävnadsspecifik blockering av en gen för att undersöka tandutveckling publiserades år 2002 (10). Målet var Sonic Hedgehog (Shh), en av de viktiga signalmolekyler som styr embryots utveckling. Knock-out-möss dör normalt tidigt men om man kunde slå av genens funktion enbart i embryots hud (vilket innebar att den inte heller fungerade i tänderna) klarade sig mössen fram till födelsen. Det visade sig att Shh är nödvändigt för att tandkronan ska formas och speciellt för celldelningen.
Signalcentra
År 1994 gjorde Jukka Jernvall en avgörande upptäckt då det gäller att förstå hur generna styr tanden. Han lade märke till att tänder under utveckling har ett signalcentrum mitt på tanden under det stadie då den så kallade emaljknuten (enamel knot) bildas i mössan (cap) (Fig. 3). I klockstadiet upptäcktes liknande centra där kusperna höll på att bildas. Dessa centra fick namnet sekundära emaljknutar (Fig. 1) (11). I emaljknutarna har man under årens lopp funnit över tio olika signaler som hör till de fyra viktiga signalfamiljerna. Senare fann man förutom emaljknutarna ett ännu tidigare signalcentrum vid den så kallade tandplakoden i tandutvecklingens initieringsskede.
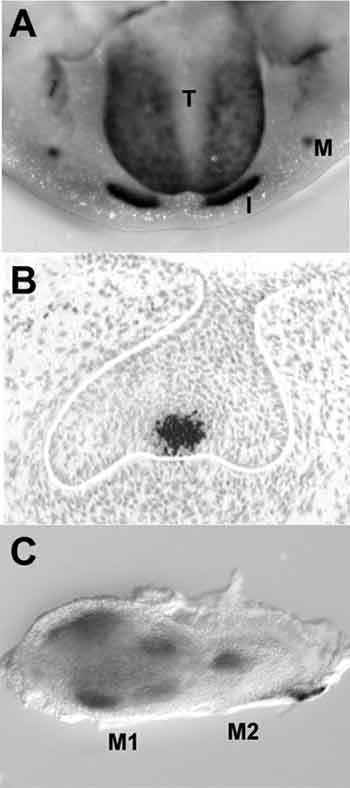
Fig. 3. Plakoder och emaljknutarna är signalcentra som producerar talrika signalmolekyler. A: I musens underkäke ser man plakoder som sätter i gång utvecklingen av framtänder (I) och kindtänder (II) (T, tunga). Med svart färg visas Sonic hedgehog signaleringen. B: Histologiskt utsnitt av emaljknuten från en tand som är i mösstadiet och som producerar FGF4-signalen. C: Förstamolar i klockstadiet och andramolar i mösstadiet okklusalt. Sekundära emaljknutar hos kommande kusper hos förstamolar producerar en Shh-signal. Andramolar i samma utvecklingsskede som förstamolaren i Fig. B. I dess emaljknut lokaliseras produktion av Shh-signal.
Signalcentran är anhopningar av epitelceller som producerar flera olika signaler samtidigt. De uppstår i epitelet just innan olika kritiska utvecklingsstadier; först vid tändernas initieringsskede, sedan när kronan börjar bildas och till slut när enskilda kusper uppstår (Fig. 1 – 3). Under initieringen tränger plakoderna som en följd av signalering in i mesenkymet och bildar tandknoppen. Signalerna från de första emaljknutarna behövs för att knoppen ska omformas till mössan som definierar tandkronas storlek och form. Signalerna bestämmer också platserna för de sekundära emaljknutarna som i sin tur reglerar kuspernas utveckling.
Man har bekräftat emaljknutarnas centrala betydelse för hur tandens form utvecklas med hjälp av transgena möss där man förändrat generna i signalmolekyler eller deras hämmare (inhibitorer). Om man blockerade ektodin (en antagonist till BMP) sammanklumpades molarerna och deras kusper förändrades dramatiskt så att mössens tänder kom att likna noshörningständer (12). Jukka Jernvall har tillsammans med sina kolleger tagit fram en matematisk modell där man kan förutsäga tändernas kuspstruktur. Den baserar sig på skillnader i koncentration och utbredningshastighet hos signalmolekyler och de molekyler som blockerar dem (13). Med hjälp av modellen kan man åstadkomma en nästan obegränsad mängd former på tandkronorna. Det är sannolikt att utvecklingen av olika tandformer är en följd av en finjustering av de signaler som definierar kuspernas samt åsarnas placering och höjd.
Ektodermal dysplasi
Vissa gener som är viktiga för tandutvecklingen har man även funnit med human genetik. Det har skett i samband med att man identifierat genfel bakom olika syndrom. Det första genfyndet av det slaget var genen bakom anhidrotisk (hypohidrotisk) ektodermal dysplasi (HED). Genen heter ektodysplasin (Eda) och identifierades av en internationell forskargrupp under ledning av professor Juha Kere år 1996 (Fig. 4) (14). Det har visat sig att upptäckten var mycket betydelsefull eftersom man med dess hjälp kunde identifiera en helt ny signalrutt som styr utvecklingen. Utifrån denna upptäckt har man lärt sig att förstå signalcentras funktion vid utvecklingen av tänder och andra ektodermala organ, till exempel hår och körtlar.
Fig. 4. A: Mutationer i Eda-genen orsakar Ektodermal dysplasi med omfattande avsaknad av tänder. B: Mutationer i Runx2-genen orsakar kleidokranial dysplasi med övertaliga tänder.
Vår grupp har i flera år studerat ektodysplasins verksamhetsmekanismer med hjälp av muterade möss. Vi har visat att den inverkar specifikt på signalcentra eller plakoder och emaljknutar samt att det stimulerar deras tillväxt (15). Hos Tabby-möss (HED:s musmodell) fungerar inte Eda-genen och det bildas alltså ingen signal. Tabby-möss saknar ofta tredjemolaren (normala möss har tre molarer) och förstamolaren är liten och saknar vissa kusper. Transgena möss (som har extra ektodysplasingener) utvecklar en extra kindtand och de övriga kindtänderna har en avvikande kuspstruktur samt liknar kängurutänder (Fig. 5). Baserat på våra iakttagelser har vi nyligen konstaterat att ektodysplasin även kan ha spelat en avgörande roll för utvecklingen av tändernas morfologiska mångfald (16).
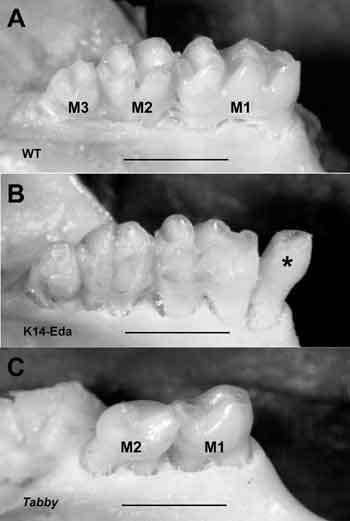
Fig. 5. Mutationer i Eda-genen orsakar även ektodermal dysplasi hos möss. A: Möss har normalt tre kindtänder. B: En transgen mus med extra Eda-gener får en extra tand på utsidan av en molar som liknar en premolar (normalt har möss inga premolarer eller hörntänder). Molarerna är stora och deras kuspstruktur är förändrad och liknar kängurutänder. C: En defekt i Eda-genens funktion gör att tredjemolaren saknas. Andramolarerna är små och saknar kusper.
En iakttagelse som schweiziska forskare publicerade år 2003 är av mycket stor betydelse: injicering av ektodysplasin i en Tabby-mushona botar den ektodermala dysplasin hos avkomman (17). HED är alltså den första medfödda utvecklingsstörning som man kunnat bota med en kortvarig rekombinantproteinbehandling.
Övriga gener som påverkar antalet tänder
Förutom EDA-genen har man också funnit många andra genmutationer hos släkter med ärftlig avsaknad av tänder. Dessa släkter har saknat flera tänder (oligodonti) vilket är relativt ovanligt. Först fann man mutationer av MSX1-genen och sedan PAX9-genen. Båda hade tidigare visat sig vara avgörande för tandutvecklingen hos knock-out-möss. Vid oligodonti förekommer oftast utvecklingsstörningar även i andra organ (19). I allmänhet (till exempel HED) förekommer dessa utvecklingsstörningar i ektodermala organ som hår och körtlar. Det är lätt naturligt eftersom även tandutvecklingen sker från ektoderm och deras tidiga utveckling påminner om övriga ektodermala organs utveckling. Därför är det i stor utsträckning samma gener som styr deras utveckling.
Det senaste genfyndet som är associerat med tandavsaknad hos människan är AXIN2 som man vet deltar i förmedlingen av Wnt-signaler. Upptäckten är unik på det sättet att det är den första genmutation som predisponerar inte bara för hypodonti utan också för cancer. I detta fall fann man tjocktarmscancer hos patienten (18,19). Upptäckten understryker sambandet mellan utvecklingsgener och cancer. Vi ser också hela tiden nya exempel på detta samband.
Ett genombrott för forskningen om benutveckling var när man år 1997 fann den genmutation som orsakar kleidokranial dysplasi. Samma gen är också viktig för tändernas utveckling (20). Personer som lider av kleidokranial dysplasi har karakteristiska brister i benvävnadens utveckling och övertaliga tänder (Fig. 4B). Tillståndet orsakas av mutationer i Runx2-genen som kodar för en transkriptionsfaktor som är avgörande för benceller. Hos Runx2-knock-out-möss sker därför ingen benutveckling. De övertaliga tänderna verkar dock inte höra samman med störningen i benutvecklingen. I tänderna behövs Runx2 för att förmedla dialogen mellan epitel och mesenkymet samt speciellt för FGF-signalens funktion (21).
Speciellt intressant blir Runx2-genen eftersom de övertaliga tänderna utvecklas som en slags tredje omgång tänder. Det tycks alltså vara så att Runx2-genens funktion är förhindra att tanduppsättningen kontinuerligt förnyas. Det skulle betyda att vi alla har potential att utveckla en tredje uppsättning tänder men att Runx2-genen hindrar en sådan utveckling. Skulle man då genom att studera Runx2 kunna hitta en väg att utveckla nya tänder hos människan? Det kanske är möjligt i en avlägsen framtid men i dag hjälper forskning kring Runx2 oss att förstå hur tänderna förnyas. Den mekanism som sätter igång utvecklingen av permanenta tänder från mjölktänder är fortfarande inte kartlagd. I min forskningsgrupp använder vi Runx2-knock-out-möss för att studera den mekanismen. Upptäckten att Runx2 hindrar uttrycket av den Shh-signal som behövs för att initiera nya tänder är det första steget i riktning mot att förstå förnyelsen av tanduppsättningen på gennivå (22).
Stamceller och konstruktion av vävnader
Stamceller och deras potential att kunna bygga upp vävnader hamnade i rampljuset för några år sedan. Det var då man lärde sig att odla stamceller från människoembryon i cellinjer. Det var även då man upptäckte multipotenta stamceller i vävnader från vuxna. Stamceller är ingen ny upptäckt. Aktiv forskning kring stamceller har redan pågått i flera decennier och forskningen har länge varit inriktad på att man skulle kunna använda stamceller för att reparera vävnader.
Stamceller från tidiga musembryon har odlats som cellinjer i ett tjugotal år och man har känt till att cellerna är totipotenta och kan ge upphov till alla olika vävnader i en mus. Skapandet av knockout-möss baserar sig till exempel på användandet av stamcellinjer. Man skapar en mutation i stamceller som kombineras med celler från tidiga musembryon. På det sättet kan den gen som slagits ut föras över till embryots celler och ersätta den normala genen. Stamcellinjer från musembryon har också använts mycket för att undersöka cellernas differentiering. Därmed har man lärt sig mycket om hur cellernas differentiering styrs i olika riktningar till att bilda till exempel nerv- eller muskelceller beroende på vilka signalmolekyler de utsätts för. Att behärska differentieringen är dock fortfarande mycket svårt. Forskningen kring stamceller från människor rör sig ännu till största delen kring att utveckla bättre odlingsförhållanden. Egentliga genombrott har ännu inte skett när det gäller att använda embryonala stamceller vid vävnadsregenerering.
Stamceller definieras som celler som har behållit förmågan till både delning och differentiering (Fig. 5). Med andra ord innehåller samtliga vävnader som kan förnyas hos en vuxen, till exempel blod, hud och hår, stamceller. Bortsett från de stamceller som finns i blodet har vi i dag bara begränsad kunskap om stamceller hos vuxna.
Under de senaste åren har man hittat stamceller i många vävnader (inklusive hjärnan) som man inte trott har förmåga att kunna förnya sig. I vissa organ (exempelvis hår och tarmepitel) har man lokaliserat stamceller samt identifierat dels de gener som reglerar deras differentiering och de gener som upprätthåller deras existens. Det är intressant men inte överraskande att de hör till signalurvalet i utvecklingens verktygsuppsättning. Det vore i själva verket förvånande om celldifferentieringen styrdes av andra system hos vuxna individer än under fosterstadiet.
Stamcellers plasticitet, deras förmåga till differentiering i olika riktningar hos vuxna individer är i dag ett hett forskningsområde. Många studier har antytt att stamceller från till exempel hjärnan eller huden som sätts in i en ny miljö kan differentiera till celler som hör till den nya vävnaden. Om detta stämmer står vi inför möjligheten att använda stamceller som isolerats från vuxna för att reparera många olika vävnader. I de mest fantastiska framtidsvisionerna skulle man till exempel kunna ta stamceller från huden och få dem att bli hjärnceller och på det sättet kunna bota Parkinsons sjukdom. Skulle man då också kunna skapa nya tänder med hjälp av stamceller?
Konstruktion av tänder med stamceller
Fortfarande har man inte gjort några egentliga genombrott inom forskningen om tändernas stamceller. Det är över huvud taget en stor utmaning att tänka sig att man skulle kunna bygga hela organ av stamceller eftersom organ består av olika celltyper och uppstår genom en samverkan mellan dessa. Även om vi redan vet ganska mycket om den genetiska styrningen av tandutvecklingen (Fig. 6) är det svårt att föreställa sig hur man skulle kunna initiera processen genom att till exempel sätta till signalmolekyler i en stamcellsodling.
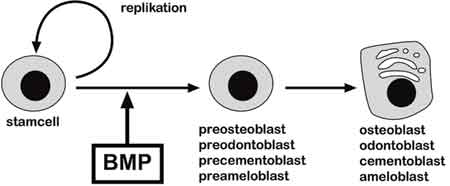
Fig. 6. Stamceller kan dela sig, producera nya stamceller och differentiera till olika celltyper, till exempel muskelceller, nervceller och stödjevävnad. BMP är en viktig signalmolekyl som framkallar tandens hårdvävnader och differentieringen av benproducerande celler.
Den enda realistiska möjligheten vore att hitta den cellpopulation eller de cellpopulationer som har förmåga att initiera en tand och sedan låta tanden bygga upp sig själv. Forskningsresultat inom den experimentella embryologin har under de senaste 50 åren visat att tanden har all information den behöver för sin utveckling redan i initieringsskedet. Om man till exempel transplanterar ett tidigt tandanlag under njurkapseln utvecklas det till en hel tand, komplett med rot och allt. Det visar att tandanlaget inte är beroende av styrning från käkområdet för att kunna utvecklas. Gamla undersökningar visar också att de direktiv som styr utvecklingen under initieringen finns i munnens epitel och att uppgifterna i knoppstadiet har flyttats över till mesenkymet.
Var skulle man kunna hitta de celler som behövs för att regenerera en tand? Tyvärr har vi inget svar på den frågan ännu även om det under senare år publicerats studier som fått stor publicitet. I den första visade forskarna att om ett kindtandsanlag från ett grisfoster som delats upp i celler sprutades in i ett poröst material och sedan transplanterades till en råtta utvecklades det till små molarer (23). I den andra studien visade man att ett tidigt tandepitel från musembryon bildade tandstrukturer om det transplanterades tillsammans med mesenkymala stamceller från benmärg (24). I studierna härstammade den vävnad som innehöll «tandinformationen» från tänder under utveckling hos fostret. Därför kan man konstatera att båda dessa studier i huvudsak upprepade resultat från gamla utvecklingsbiologiska undersökningar.
För att kunna bygga upp en tand måste man försöka isolera stamceller från vävnader på vuxna individer (helst från tänder). Dessa stamceller har kvar de instruktioner som behövs för att kunna skapa en ny tand. Problemet är att människans tänder inte förnyas på naturlig väg (jämfört med till exempel hud och hår). Därmed är det möjligt att det inte har bevarats regenerationsdugliga stamceller i en färdig tand.
I människans tandpulpa identifierade man år 2000 mesenkymala stamceller som när de transplanterades till muskelvävnad differentierade till odontoblaster och började producera dentin (25). Cellernas förmåga att programmera bildning av en tand har inte undersökts. Man bör därför sträva efter att isolera epitelvävnad som tillsammans med mesenkymala stamceller kan delta i att bygga upp en tand. Det enda återstående epitelet i människans tänder är de så kallade Malassez-epitelcellerna på rotytan. De är en potentiell källa till stamceller vars egenskaper inte har undersökts.
Den japanske forskaren Hidemitsu Harada har upptäckt de enda epiteliala stamceller man hittills funnit i tänder (26). Cellerna fanns i framtänder på möss. Mössens framtänder växer kontinuerligt och därmed bör de ha stamceller som kan utvecklas till emaljförnyande ameloblaster. Stamcellerna finns vid rotspetsen i epitellänken där de långsamt delar sig och producerar både nya stamceller och celler som övergår till specialiserade ameloblaster. Man kan naturligtvis inte använda dessa celler för att regenerera människotänder. Men om man studerar deras egenskaper och kartlägger differentieringen kan man få ny kunskap om regenerationen av tandepitel vilket kan göra det lättare att identifiera liknande epitel på andra ställen.
Efter den här genomgången väcks en kritisk fråga: Är det över huvud taget ett förnuftigt mål att sträva efter att bygga tänder av stamceller? Många tandläkare frågar sig säkert om det ens är teoretiskt möjligt att bygga tänder som patienten vill ha; tänder som har rätt storlek, form, färg och struktur? Det är svårt att föreställa sig hur man ens i en avlägsen framtid skulle kunna bygga upp en perfekt, individuell krona av stamceller. Dessutom är både protetiker och tandtekniker duktiga på sina jobb.
Det lönar sig alltså knappast att sikta på att kunna bygga kronor av stamceller. Däremot finns det ett klart behov av rötter. Även om implantat oftast fungerar bra växer benet fast i dem och de saknar tandens stödjevävnader. Implantat saknar även parodontalligament och därigenom förmågan att bland annat styra alveolarbenets tillväxt och utformning. Implantat är till exempel inte ett bra alternativ för växande barn.
Det är i princip möjligt att antingen bygga upp en helt ny rot av stamceller och sedan göra en protetisk krona på den eller att utveckla parodontalligament på ytan av implantat med hjälp av stamceller. I dag känner man dock inte till rotens utvecklingsmekanismer särskilt väl främst på grund av att tandrötterna utvecklas relativt sent och är svåra att komma åt inne i käkbenet. Om man vill bygga upp en rot av stamceller förutsätter det troligtvis att man först utvecklar en krona eftersom roten normalt börjar utvecklas ur celler från en redan nästan färdig krona. Det faktum att man nyligen har rapporterat att man funnit stamceller i parodontiet (27) kan visa sig vara revolutionerande. Stamcellerna har förmågan att bilda olika slags specialiserade celler som normalt finns i parodontiet. Med hjälp av dessa specialiserade celler kan det bli möjligt att regenerera parodontium på ytan av implantat.
English summary
Breakthroughs in the developmental biology of teeth
Developmental biology is one of the biomedical fields where the progress of research has been extremely rapid during the last twenty years. Also tooth development starts to be understood at the level of genes and molecules. Significant breaktroughs in this area include the elucidation of molecules in conserved signalling networks regulating the morphogenesis of teeth and formation of dental hard tissues. The discovery of signalling centers in tooth germs has led to an understanding how tooth crowns acquire their shapes. Mouse models generated for human dental aberrations now help in the elucidation of their pathogenesis and in designing new treatments and ways for prevention of dental defects in the future.
Thesleff I. Utvecklingsbiologiska genombrott inom odontologin. Nor Tannlegeforen Tid. 2006;116:24–30. doi:10.56373/2006-1-6
Litteratur
1. Sariola H, Frilander M, Heino T, Jernvall J, Partanen J, Sainio K, et al., editors. Solusta yksilöksi. Kehitysbiologia (Textbook in developmental biology). Duodecim: Helsinki; 2003; 311.
2. Vainio S, Karavanova I, Jowett A, Thesleff I. Identification of BMP-4 as signal mediating secondary induction between epithelial and mesenchymal tissues during early tooth development. Cell 1993; 75: 45 – 58.
3. Jernvall J, Åberg T, Kettunen P, Keränen S, Thesleff I. The life history of an embryonic signaling center: BMP-4 induces p21 and is associated with apoptosis in the mouse tooth enamel knot. Development 1998; 1251: 71 – 169.
4. Bei M, Kratochwil K, Maas L. BMP4 rescues a non-cell-autonomous function of Msx1 in tooth development. Development 2000; 127: 4711 – 8.
5. Wang X-P, Suomalainen M, Jorgez CJ, Matzuk MM, Werner S, Thesleff I. Follistatin regulates enamel patterning in mouse incisors by asymmetrically inhibiting BMP signaling and ameloblast differentiation. Dev Cell 2004; 7: 719 – 30.
6. Satokata I, Maas R. Msx1 deficient mice exhibit cleft palate and abnormalities of craniofacial and tooth development. Nat Genet 1994; 6: 348 – 56.
7. van Genderen C, Okamura RM, Farinas I, Quo RG, Parslow TG, Bruhn L, et al. Development of several organs that require inductive epithelial-mesenchymal interactions is impaired in LEF-1-deficient mice. Genes Development 1994; 8: 2691 – 703.
8. Celli G, Larochelle WJ, Mackem S, Sharp R, Merlino G. Soluble dominant-negative receptor uncovers essential roles for fibroblast growth factors in multi-organ induction and patterning. EMBO J 1998; 17: 1642 – 55.
9. Hardcastle Z, Mo R, Hui CC, Sharpe PT. The shh signaling pathway in tooth development – defects in gli2 and gli3 mutants. Development 1998; 125: 2803 – 11.
10. Dassule HR, Lewis P, Bei M, Maas R, McMahon AP. Sonic hedgehog regulates growth and morphogenesis of the tooth. Development 2000; 127: 4775 – 85.
11. Jernvall J, Kettunen P, Karavanova I, Martin LB, Thesleff I. Evidence for the role of the enamel knot as a control center in mammalian tooth cusp formation: non-dividing cells express growth stimulating Fgf-4 gene. Int J Dev Biol 1994; 38: 463 – 9.
12. Kassai Y, Munne P, Hotta Y, Penttilä E, Kavanagh K, Ohbayashi N, et al. Regulation of mammalian cusp patterning by ectodin. Science 2005; 309: 2067 – 70.
13. Salazar-Ciudad I, Jernvall J. A gene network model accounting for development and evolution of mammalian teeth. Proc Natl Acad Sci USA 2002; 99: 8116 – 20.
14. Kere J, Srivastava AK, Montonen O, Zonana J, Thomas N, Ferguson B, et al. X-linked anhidrotic (hypohidrotic) ectodermal dysplasia is caused by mutation in a novel transmembrane protein. Nature Genetics 1996; 13: 409 – 16.
15. Mustonen T, Ilmonen M, Pummila M, Kangas A, Jaatinen R, Laurikkala J, et al. Ectodysplasin-A1 promotes placodal cell fate during early morphogenesis of ectodermal appendages. Development 2004; 131: 4907 – 19.
16. Kangas AT, Evans AR, Thesleff I, Jernvall J. Nonindependence of mammalian dental characters. Nature 2004; 432: 211 – 4.
17. Gaide O, Schneider P. Permanent correction of an inherited ectodermal dysplasia with recombinant EDA. Nat Med 2003; 9: 614 – 8.
18. Nieminen P, Arte S. Genetiken bakom avsaknad av tänder. Nor Tannlegeforen Tid 2005; 115: 14 – 22.
19. Lammi L, Halonen K, Pirinen S, Thesleff I, Arte S, Nieminen P. A missence mutation in PAX9 in a family with distinct phenotype of oligodontia. Am J Hum Genet 2003; 11: 866 – 71.
20. Mundlos S, Otto F, Mundlos C, Mulliken JB, Aylsworth AS, Albright S, et al. Mutations involving the transcription factor CBFA1 cause cleidocranial dysplasia. Cell 1997; 89: 773 – 9.
21. Åberg T, Wang X-P, Kim J-H, Yamashiro T, Bei M, Rice R, et al. Runx2 mediates FGF signalling from epithelium to mesenchyme during tooth morphogenesis. Dev Biol 2004; 270: 76 – 93.
22. Wang X-P, Åberg T, James M.J, Levanon D, Groner Y, Thesleff I. Runx2 (Cbfa1) affects Shh signalling and prevents the budding of putative successional teeth in mouse embryos. J Dent Res 2005; 84: 138 – 43.
23. Duailibi MT, Duailibi SE, Young CS, Bartlett JD, Vacanti JP, Yelick PC. Bioengineered teeth from cultured rat tooth bud cells. J Dent Res 2004; 83: 523 – 8.
24. Modino SA, Sharpe PT. Tissue engineering of teeth using adult stem cells. Arch Oral Biol 2005; 50: 255 – 8.
25. Gronthos S, Mankani M, Brahim J, Robey PG, Shi S. Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo. Proc Natl Acad Sci USA 2000; 97: 13625 – 13630.
26. Harada H, Kettunen P, Jung H-S, Mustonen T, Wang YA, Thesleff I. Localization of putative stem cells in dental epithelium and their association with Notch and FGF signaling. J Cell Biol 1999; 147: 105 – 20.
27. Seo BM, Miura M, Gronthos S, Bartold PM, Batouli S, Brahim J, et al. Investigation of multipotent postnatal stem cells from human periodontal ligament. Lancet 2004; 364: 149 – 55.
Korrespondens: Professor, Research Director Irma Thesleff, Institute of Biotechnology, University of Helsinki, Viikki Biocenter, P.O.Box 56, FIN-00014 Helsinki, Finland. E-mail: Irma.Thesleff@helsinki.fi
Översättning av Anders Bergman.
Referensgranskad artikel.
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Thesleff I. Utvecklingsbiologiska genombrott inom odontologin. Nor Tannlegeforen Tid. 2006;116:24–30. doi:10.56373/2006-1-6