Akutte infeksjoner
Artikkelen gir en oversikt over odontogene og andre akutte orale infeksjoner hos pasienter med normalt infeksjonsforsvar. Akutte infeksjoner kan spre seg raskt og få dramatisk forløp. Tannlegen må kjenne til hvilke infeksjoner som kan behandles i allmennpraksis og i hvilke situasjoner akuttpasienten vil være bedre tjent med direkte henvisning til spesialist eller innleggelse i sykehus. Hensikten med artikkelen er å bidra til at allmennpraktikeren kan treffe riktige og raske avgjørelser i denne sammenheng. Artikkelen omtaler indikasjoner for mikrobiologisk prøvetaking, hvordan slike prøver tas og prøvesvar tolkes. Videre gjennomgås undersøkelsesmetodikk, kliniske tegn og symptomutvikling. Viktige faresignaler nevnes og hvilke svar som bør søkes besvart ved grovdiagnostikk. Basert på vurderingen av lokale funn og pasientens helsetilstand må tannlegen velge et adekvat behandlingsopplegg. Artikkelen gjennomgår videre vurdering og behandling av pulpitt, apikal periodontitt og mulig spredning til omgivelsene, inkludert bihulebetennelse og osteomyelitt. Andre mer sjeldne spredningsformer omtales også. Indikasjoner, valg og dosering når det gjelder supplerende behandling med antibakterielle midler gitt systemisk inngår i omtalen. Den akutte virale infeksjonen artikkelen omhandler er herpetisk gingivo-stomatitt. Artikkelen synes å være den første i sitt slag.
Sjelden eller aldri har en pasient større behov for rask og effektiv odontologisk behandling enn ved en akutt infeksjon. Det er derfor overraskende at Internettsøk i databasen PubMed ikke ga mer enn 21 treff med søkeordene acute odontogenic infections eller acute dental infections (oktober 2004). Ingen av disse artiklene er oversiktsartikler, men ofte dramatiske kasuistikker, og flere er publisert i ikke-engelskspråklige tidsskrifter utenom Skandinavia.
Fig. 1 viser hvordan en pulpainfeksjon kan spre seg periapikalt og manifestere seg der som ostitt. Uten adekvat behandling kan ostitten utvikle seg til en abscess eller bre seg diffust i omliggende bløtvev (flegmone, celulitt). Andre lokale spredningsveier er langs muskelfascier og i tilgrensende losjier eller til benmarg (osteomyelitt). Hematogen spredning kan gi hjerneabscess, men dette forekommer nå meget sjelden. Før effektive antimikrobielle midler ble tilgjengelige kunne slike infeksjoner medføre blodforgiftning (sepsis) og død. Akutte kjeveinfeksjoner kan være primære eller skyldes eksaserbasjon av kronisk infeksjon eller infisert cyste.
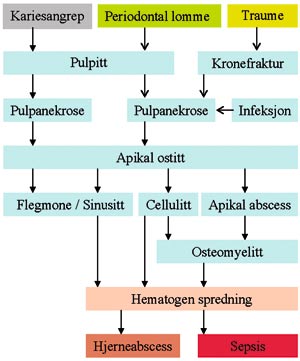
Fig. 1 . Årsaker til rotkanalinfeksjon som ubehandlet gir akutt periapikal ostitt med mulighet for videre lokal eller hematogen spredning.
Orale bakterier ved akutte infeksjoner
Ca. 300 forskjellige orale bakteriearter fra mennesker har latt seg dyrke hittil (1). Ved hjelp av molekylærbiologiske identifikasjonsmetoder, der dyrking unngås, er dette tallet nå økt til over 500 (2), men det antas at mange arter i den humane orale mikrofloraen fortsatt er uidentifiserte.
Et relativt stort antall kjente orale bakteriearter er blitt satt i forbindelse med akutte infeksjoner hos mennesker. Det er ikke hensikten med denne artikkelen å gi en oversikt over alle disse. Tabell 1 er en oppstilling av opportunistiske bakterier som hyppig blir diagnostisert ved forskjellige akutte infeksjoner hos personer med normalt infeksjonsforsvar og som derfor antas å være av etiologisk betydning. Ved nedsatt infeksjonsforsvar kan mikroorganismer som ellers ikke gir akutt opportunistisk infeksjon være årsak. Denne artikkelen omhandler akutte infeksjoner hos personer med normalt infeksjonsforsvar.
Infeksjon |
Obligat anaerobe arter av slektene |
Fakultativt anaerobearter av slektene |
|---|---|---|
Endodontisk |
Porphyromonas (G-st)* |
Eikenella (G-st) |
Prevotella (G-st) |
Capnocytophaga (G-st) |
|
Fusobacterium (G-st) |
Neisseria (G-k)** |
|
Wolinella (G-st) |
Streptococcus (G+k)*** |
|
Actinomyces (G+st)**** |
Lactobacillus (G+st) |
|
Periapikal abscess |
Porphyromonas |
Streptococcus |
Prevotella |
Staphylococcus (G+k) |
|
Peptostreptococcus (G+k) |
Streptococcus |
|
Veillonella (G-k) |
Neisseria |
|
Perikoronitt |
Prevotella |
Streptococcus |
Fusobacterium |
Capnocytophaga |
|
Cellulitt/flegmone |
Stort sett de samme bakteriene som isoleres fra akutte periapikale abscesser |
|
Kjeveosteomyelitt |
Prevotella |
Streptococcus |
Porphyromonas |
Fusobacterium |
|
Bacteroides (G-st) |
Staphylococcus |
|
Enterococcus (G+st) |
||
Mikrobiologiske prøver
Indikasjoner
Det er behandlerens ansvar at det foreligger indikasjon for prøvetakingen. Feber og ellers påvirket allmenntilstand og rask infeksjonsspredning er klare indikasjoner for mikrobiologisk prøvetaking. Prøven bør taes før behandling med antibakterielle legemidler startes. Slike midler omfatter antibiotika (produsert av mikroorganismer) og kjemoterapeutika. For enkelthets skyld omtales disse nedenfor som antibiotika. Hvis det foreligger resistens mot påbegynt antibiotikabehandling, vil viktig tid være spart med tanke på skifte av preparater dersom bakterieprøve allerede er tatt. En opplagt indikasjon for prøvetaking er manglende klinisk effekt innen 24 – 48 timer etter start. Forutsatt adekvat antibiotikadosering og –administrasjon skal mikrobiologisk prøve tas omgående for resistensbestemmelse slik at skifte av antibiotika ikke blir forsinket.
Utstyr og prøvetaking
Før prøve tas, isoleres prøvestedet med bomullsruller for å unngå salivakontaminasjon, prøvestedet tørkes av med steril tupfer eller liknende og desinfiseres. Skal det tas prøve med bomullspensel fra slimhinne, sløyfes desinfeksjonen. Rotkanalprøver tas etter at kofferdam er satt på og arbeidsfeltet er desinfisert. Pussprøver fra abscess eller bihule aspireres med steril engangssprøyte påsatt 16 – 18G (gauge) sprøytespiss som føres inn i abscessen der en venter å finne puss. Kontroller at det er kommet puss inn i sprøyten før den trekkes ut. Foreligger fistel med pussekresjon, stikkes en steril papirspiss (papirpoint) ved hjelp av steril pinsett så langt som mulig inn i fistelen og holdes der ca. 10 sekunder før den trekkes ut. For å sikre nok prøvemateriale bør det tas minst to papirspissprøver fra en fistel.
Sterile papirspisser nyttes også ved prøvetaking fra rotkanal. Alternativt kan sterilt saltvann sprøytes inn i rotkanalen og suges tilbake i sprøyten. Sterile bomullspinner eller spesielle prøvetakingspinner nyttes til slimhinneprøvetaking (penselprøver). Orale virologiske prøver tas ved at pasienten skyller munnen med prøvetakingsvæske (alternativt sterilt fysiologisk saltvann) og lar væsken renne tilbake i prøverøret.
Transport og forsendelse av mikrobiologiske prøver
Straks prøven er tatt, skal den overføres aseptisk til et anaerobt transportmedium. Transportmediet skal sørge for at mikroorganismene i en prøve overlever transporten uten å formere seg nevneverdig, slik at det relative mengdeforholdet mellom ulike mikroorganismer er mest mulig uendret ved ankomst til laboratoriet. Prøver fra forskjellige prøvesteder hos samme pasient skal på separate prøverør. Alle prøverør skal være merket med pasientens navn og prøvetakingsdato. Prøver som av praktiske grunner ikke kan sendes samme dag, oppbevares i kjøleskap og ekspederes neste dag.
Remissen som følger prøvene skal inneholde pasientopplysninger (navn, postadresse, personnummer, eventuell tidligere undersøkelse for samme lidelse, hvem som skal betale for prøven) og rekvirentopplysninger (navn, postadresse, telefonnummer). Videre kliniske opplysninger (problemstilling, prøvemateriale, prøvetakingssted, prøvetakingstidspunkt, eventuell antimikrobiell behandling) og hva prøven ønskes undersøkt på (vanlig bakteriologisk undersøkelse, anaerobe bakterier, sopp, virus, antimikrobiell følsomhets-/resistensbestemmelse). Ved flere prøver fra samme pasient, skal numrene på prøverørene og de tilhørende prøvetakingsstedene angis i remissen.
Prøvetakingsutstyr, transportmedier, remisser og emballasje til forsendelsen kan rekvireres fra det mikrobiologiske laboratoriet.
Prøvesvar
Laboratoriet sender skriftlig prøvesvar til rekvirenten. Dersom den kliniske tilstanden tilsier det eller det tar lang tid før prøven er ferdig analysert, vil laboratoriet ofte gi telefonisk tilbakemelding om de foreløpige funnene.
Jo mer representativ prøven er for mikrofloraen på prøvetakingsstedet (nok prøvemateriale, ingen kontaminasjon med mikroorganismer fra annet sted, prøven er ikke blitt stående for lenge før forsendelse, riktig transportmåte), dess større er sannsynligheten for at de diagnostiserte mikroorganismene representerer infeksjonsfloraen.
Tolkning av prøvesvar
Nesten uten unntak skyldes akutte infeksjoner i munnen patogene bakterier (opportunister) som tilhører normalfloraen. Ved slike endogene infeksjoner er oftest flere opportunistiske bakterier involvert (patogen symbiose). Tolkning av prøvesvar kan derfor være vanskelig med tanke på den/de bakterien(e) som er ansvarlig(e) for infeksjonen. Prøvesvar «normal munnflora» er av liten praktisk verdi. Det er behandlende tannlege som har ansvar for at prøvesvar nyttes til beste for pasienten. Ved tvil kan laboratoriet kontaktes for mulig tilleggsinformasjon. Ved påvist antibiotikaresistens er fortolkningen av prøvesvar mindre problematisk fordi aktuelle, virksomme antimikrobielle alternativer vil være oppgitt i svaret.
Andre laboratorieprøver
Ved akutte infeksjoner i allmenn tannlegepraksis kan det i tillegg til prøver til mikrobiologisk undersøkelse være aktuelt å rekvirere enkle hematologiske undersøkelser med tanke på vurdering av allmennpåvirkning og behov for hastehenvisning. Slike prøver kan omfatte senkningsreaksjon, telling av hvite blodlegemer og C-reaktivt protein (CRP). For tolkning av resultatene, se senere i artikkelen. Slike prøver kan rekvireres direkte fra laboratorier eller legekontorer.
Abscess versus cellulitt og flegmone
Abscess er en lokalisert ansamling av puss (leukocytter, bakterier og vevsrester) avgrenset av en mer eller mindre tydelig fibrinkapsel. Den kan bestå av ett eller flere rom, med eller uten forbindelse. Ved aspirasjon og incisjon vil man kunne påvise og drenere pusset.
Cellulitt (synonymt flegmone) er en bakteriell infeksjon med pussdannelse som sprer seg diffust i løst bindevev, spesielt dypt subkutant vev, og noen ganger også langs muskler. Utgangspunkt kan være infiserte sår eller andre hudlidelser, men odontogen etiologi er ikke uvanlig. De aktuelle bakteriene (Tabell 1) hindrer dannelsen av fibrinkapsel, og infeksjonen spres derfor raskt over et større område. Ved forsøk på aspirasjon og incisjon vil man vanligvis ikke finne purulent materiale.
Undersøkelsesmetodikk (3,4)
Anamnese
Vanlige subjektive symptomer ved akutte infeksjoner er smerte og hevelse. Sekundærsymptomer som trismus (gapebesvær) og dysfagi (svelgebesvær) er vesentlige for vurdering av infeksjonsspredning. Det er viktig å klarlegge utviklingen av symptomene og deres hastighet og rekkefølge. I tillegg er opplysninger om predisponerende allmennmedisinske tilstander som f.eks. diabetes, immunsuppresjon, steroidbehandling etc. av betydning for vurdering av behandlingsnivå.
Klinisk undersøkelse
Ekstraoralt – Lokalt vil man i varierende grad finne de fem klassiske betennelsestegnene: rubor, calor, tumor, dolor, functio laesa. Ved undersøkelse kan man finne hevelse, asymmetri, hudrødme og sensibilitetsutfall. Hevelsen kan være diffus eller mer markert avgrenset, og konsistensen kan variere. Fluktuasjon indikerer væske, f.eks. puss, dypere i vevet. Varme og rødhet i huden over hevelsen indikerer at infeksjonen ligger nær overflaten (Fig. 2). Fistler kan forekomme, men er ikke vanlige i den mest akutte fasen. Spontanperforering og drenasje av en abscess er gjerne tegn på overgang til mer kronisk fase. Reaktivt ødem, f.eks. via lymfestase, kan vise seg som øyelokksødem («gjenklistret» øye). Trismus kan utvikles relativ tidlig og vil være uttrykk for direkte påvirkning av tyggemuskulaturen. Oftest er masseterslyngen affisert. Dysfagi vil kunne forekomme etter en tid, og indikerer påvirkning av svelgmuskulaturen.
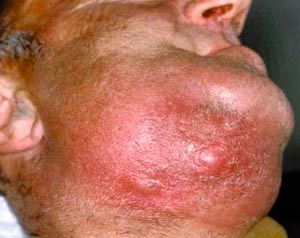
Fig. 2. Submandibulær abscess med spredning subkutant.
Intraoralt – Hevelse er vanlig, og man skal være spesielt oppmerksom når den utvikler seg i munngulv/tunge. Slik hevelse kan imidlertid være vanskelig å få oversikt over pga. trismus. Fistler forkommer også intraoralt. Lingvalt kan disse være vanskelig å oppdage, men når pasienten angir dårlig smak i munnen, kan dette være tegn på spontandrenasje av puss. Enkeltstående ømme og mobile tenner indikerer gjerne et etiologisk fokus, mens flere tenner med slike symptomer i et segment kan være tegn på sirkulasjonsforandringer typiske for osteomyelitt eller sinusitt.
Allmenntilstand
Denne må vurderes ved akutt infeksjon. Nedsatt allmenntilstand i form av tretthet, slapphet, feber, kvalme, brekninger, hodepine og leddsmerter kan forekomme. Man skal være spesielt oppmerksom på redusert væskeinntak, f.eks. i forbindelse med dysfagi. Det kan føre til dehydrering og terapisvikt ved peroral administrasjon av f.eks. antibiotika.
Røntgen
Ortopantomogram (OPG) er best egnet for grovdiagnostikk. Undersøkelsen kan gi informasjon om utgangspunktet for infeksjoner, slik som dentale foci, frakturer og fremmedlegemer. Det kan eventuelt suppleres med intraorale opptak, men denne muligheten begrenses ofte pga. trismus i den akutte fasen. Ved utredning i sykehus brukes computertomografi (CT) og eventuelt magnetisk resonans-(MR-)undersøkelse for påvisning av pusslommer. Dette kan være til hjelp ved planlegging av kirurgisk drenasje.
Laboratoriefunn
CRP er et akuttfaseprotein som produseres i leveren ved betennelse. Betennelse kan skyldes vevsskade på grunn av traume eller infeksjon. I tilfelle av alvorlig bakteriell infeksjon kan CRP stige til tresifret verdi (normalverdi er <10). CRP er sensitivt for endringer og brukes til å overvåke infeksjonsforløp eller behandlingseffekt. Lav CRP-verdi og kliniske symptomer tyder på virusinfeksjon eller liten allmennpåvirkning.
Spørsmål som bør søkes besvart ved grovdiagnostikk (3)
Skyldes symptomene bakteriell eller viral infeksjon?
Er pasienten allment påvirket? Hvis ja, vurder henvisning.
Finnes pussansamling (abscess) som kan dreneres? Hvis fluktuasjon, incider. Er pussansamlingen vanskelig tigjengelig? Hvis ja, vurder henvisning.
Er det fare for eller manifest spredning medialt, sublingvalt, posteriort eller mot orbita? Hvis ja, henvis pasienten.
Er væske- og peroralt medikamentinntak kompromittert? Hvis svaret er ja, henvis pasienten.
Er det fare for dehydrering og terapisvikt? Hvis svaret er ja, henvis pasienten.
Henvisningsadresse er normalt en sykehustilknyttet poliklinikk eller akuttmottak avhengig av hastegrad.
Behandlingsprinsipper (3 – 6)
Man tar initialt sikte på å reversere spredningen av infeksjonen. Det mest effektive tiltaket vil være evakuering av pussansamlinger dersom dette er mulig. Man skal derfor alltid vurdere incisjon og drenasje ved bakterielle infeksjoner. Incisjon av en typisk dentoalveolær abscess er vist i Fig 3.
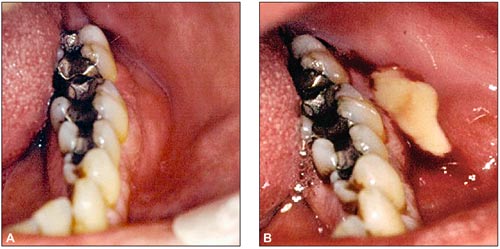
Fig. 3. Dentoalveolær abscess bukkalt for 7. A: Før incisjon. B: Etter incisjon med pusstømming.
Antibiotika i tillegg til drenasje må vurderes ut fra hvor alvorlig infeksjonen er. Slik behandling skal ideelt sett være målrettet etter dyrkning og resistensbestemmelse (se foran). Tre viktige prinsipper må legges til grunn:
Behandlingen skal startes så snart som mulig, og uten å vente på resultatet av eventuell resistensbestemmelse.
Doseringen må være høy for å sikre tilgjengelighet lokalt i vevet.
Behandlingen må ha tilstrekkelig varighet.
Før svar på eventuell resistensbestemmelse foreligger, startes systemisk behandling med antibiotika (5 – 7). Førstehåndsvalget bør være fenoxymetylpenicillin (penicillin V) f.eks. 1000 mg x 4 – 6 per døgn, og metronidazol 400 mg x 3 per døgn. Ved penicillinallergi brukes klindamycin 300 mg x 4 – 5 per døgn. Det tar 24 – 48 timer før sikker klinisk effekt kan registreres.
Når infeksjonen er under kontroll, dvs. når spredningen er reversert, og det er bedret allmenntilstand og betydelig redusert dysfagi, trismus og hevelse, foretaes sanering av eventuelle foci. Dette vil oftest bestå i ekstraksjon eller endodontisk behandling av aktuelle tenner.
Faresignaler (3,8)
Pasientens allmenntilstand viser hvor medtatt pasienten er.
Dysfagi – Indikerer spredning til eller involvering av farynxmuskulatur. På grunn av fascielosjer vil det være risiko for vertikal spredning til skallebasis og mediastinum.
Respirasjon – Ved alvorlige infeksjoner kan spredning mot hypofarynx påvirke luftveiene slik at respirasjonen blir anstrengt (dyspné), eventuelt med kompensatorisk økt respirasjonsfrevens og stridor (høyfrekvent hås pustelyd pga. forsnevret luftpassasje). Sistnevnte er et meget alvorlig tegn som betinger øyeblikkelig hjelp og innleggelse i sykehus. Fig. 4 viser forskyvning av luftveiene i forbindelse med en retromaksillær infeksjon.
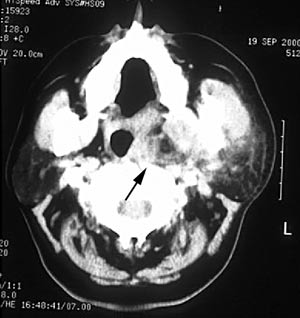
Fig. 4. Retromaksillær infeksjon med forskyvning av luftveiene.
Kliniske tegn, symptomutvikling og behandling
Pulpitt
Pulpavevet reagerer på infeksjon og andre irritamenter med en inflammasjon kalt pulpitt. Pulpitter kan være reversible eller irreversible, avhengig av grad av inflammasjon før tiltak settes inn for å begrense forløpet. Smerte kan ofte avsløre tilstanden (symptomatisk pulpitt), selv om pulpitter oftest er asymptomatiske.
Pulpavevet er i stand til å begrense en infeksjon (9,10), og en pulpitt vil normalt ikke representere fare for dramatisk infeksjonsspredning (se Fig. 1). Behandlingen begrenser seg til å fjerne årsaken til inflammasjonen og i tillegg foretas passende pulpainngrep. Som smertekontroll gis smertestillende middel etter behov. Antibiotika er ikke indisert. Ubehandlet vil en slik tilstand før eller siden resultere i en nekrotisk pulpa og rotkanalinfeksjon.
Apikal periodontitt og odontogen abscess
En pulpakanal med nekrotisk vev er lett mottakelig for infeksjon fordi kroppens cellulære og molekylære forsvar ikke har adgang. En infisert rotkanal utgjør hovedårsaken til vedvarende mikrobiell irritasjon i det periradikulære vev (11,12). Apikal periodontitt er ikke alltid smertefull og kan forbli udiagnostisert over tid. Smerte kan opptre i akutte faser, som ved akutt apikal periodontitt, eller ved eksaserbasjon av kronisk apikal periodontitt.
Behandling er å fjerne disponerende faktorer, og/eller eliminere den mikrobielle faktoren ved kjemo-mekanisk rensing av rotkanalen.
Anatomiske forhold gjør at antibiotika alene ikke kan eliminere infeksjonen. Systemisk antibiotikabehandling vil kun være støtte til mer kausal behandling ved f.eks. mistanke om ekstraradikulær infeksjon.
Den vanligste formen for ekstraradikulær infeksjon er akutt periapikal abscess, som i tidlig fase kan være vanskelig å skille klinisk fra akutt apikal ostitt. Årsaken til ekstraradikulær infeksjon er oftest rotkanalinfeksjon. Studier har vist forekomst av en rekke forskjellige bakterier (Tabell 1) og sopp i behandlede og ubehandlede endodontiske kasus (11 – 16). Porphyromonas endodontalis har fått artsnavnet sitt fordi den nesten utelukkende påvises ved endodontiske infeksjoner. Periapikal aktinomykose forekommer sjelden, men representerer et diagnostisk og behandlingsmessig problem (17).
En akutt periodontal abscess har utgangspunkt i en dyp periodontal lomme og er lokalisert til gingivalranden. Symptomatologien er som ved en akutt periapikal abscess, som kan være en aktuell differensialdiagnose. Akuttbehandling av periodontal abscess omfatter incisjon og drenasje, og systemisk antibiotika ved feber og påvirket allmenntilstand. Senere kommer periobehandling, eventuelt ekstraksjon av tannen.
Når en akutt abscess dannes, vil trykkøking i vevet føre til at den dreneres minste motstands vei. Odontogene absesser vil slik kunne spres til dypere vev og forårsake cellulitt/flegmone eller etablering av intraoral eller ekstraoral drenering i form av fistel. I sjeldne tilfeller kan drenasje til sinus maxillaris eller nesekavitet forekomme (4,18). Abscesser med fistel vil ubehandlet gå over i en kronisk fase.
Akutt apikal abscess vil kunne gi sterk smerte, spesielt like før gjennombrudd av periost (subperiostal abscess), hevelse og gjerne feber. Slike abscesser krever rask og effektiv behandling for å hindre spredning av involverte mikroorganismer. Behandling er drenasje som kan skje ved incisjon eller via rotkanal, dersom pasienten kan gape. Antibiotika er kun indisert dersom det er tegn på cellulitt, systemisk sykdom, lokal invasjon av andre strukturer eller infeksjon som utvikler seg svært raskt.
Sinusitt (3,4,18)
Sinusitt er infeksjon i paranasale bihuler. Den akutte formen vil ofte innebære empyem, dvs. pussansamling i et preformert hulrom (sinus). Symptomene er smerter lokalisert til laterale overkjeve med hevelse og ømhet over kinnet/kinnknuten. Det er vanlig med purulent nasalsekret, mest fra den aktuelle siden. Ømme og eventuelle mobile tenner kan forekomme i segmentet. Pasienten angir gjerne fluktuasjon og smerter ved bevegelse, f.eks. når vedkommende bøyer seg fremover eller går i trapper. Sensibilitetsutfall av nervus infraorbitalis kan forekomme. Sammenliknet med en primært rhinogent betinget sinusitt vil en odontogen sinusitt oftest initialt være unilateral med mer påvirket allmenntilstand og sen involvering av andre paranasale bihuler. Infeksjonsparametrene (leukocyttall, senkningsreaksjon, CRP) vil være moderat forhøyet, og røntgenundersøkelse vil kunne vise totalfortetting, eventuelt væskespeil i aktuelle kjevehule.
Behandlingen omfatter pussdrenasje, eventuell henvisning til allmennlege/øre-nese-hals-spesialist for sinusskylling. Videre standard antibiotikabehandling og slimhinneavsvellende midler i nesen.
Perikoronitt (3,18)
Dette er en infeksjon i bløtvev og ben i forbindelse med en partielt eruptert tann, som regel en visdomstann. Infeksjonen oppstår i follikkelrommet rundt kronen, og er vanlig ved partielt erupterte tenner i kronisk/asymptomatisk form (19). Dersom forholdene lokalt endres, f.eks. ved endret bakteriell virulens, endret vertsresistens eller forverrede lokale drenasjeforhold, f.eks. etter skylling med klorheksidinløsning, kan infeksjonen gå over i akutt fase og vil da gi tydelige subjektive og kliniske symptomer. Vanlige symptomer ved akutt perikoronitt vil være tidligere ubehag i området, økende smerte og senere hevelse i kinnet, eventuelt i bakre del av munngulvet, utvikling av markert trismus, senere dysfagi, feber og redusert allmenntilstand. En aktuell differensialdiagnose til akutt perikoronitt med spredning, kan være peritonsillær abscess (4). Denne utvikles gjerne med inititial dysfagi, og senere i forløpet utvikles trismus. Typisk klinisk tegn for tilstanden er deviasjon av uvula mot den friske siden.
Behandlingen av perikoronitt er avhengig av akuttgrad og spredning. I utgangspunktet brukes standard infeksjonsbehandling med incisjon og drenasje, eventuelt antibiotika systemisk. Incisjon og innlagt vekedren ved perikoronitt er vist i Fig. 5. Senere, i en rolig fase, fjernes tannen, eventuelt antagonisten først dersom denne bidrar til akutte symptomer ved påbiting. Unngå skylling i incisjonsområdet med lokalirriterende etanolholdige løsninger, f.eks. klorheksidin.
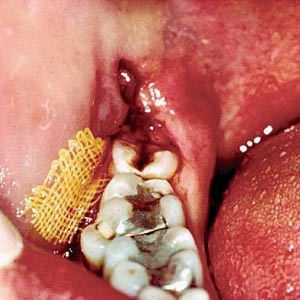
Fig. 5. Incisjon og dren ved perikoronitt tann 8.
Osteomyelitt (4,20,21)
Akutt osteomyelitt forekommer sjelden. Hos voksne pasienter er mandibelen mest utsatt. Odontogene utgangspunkt er periapikal infeksjon, subgingival scaling i forbindelse med akutt gingivitt/periodontitt, åpne sår og åpne frakturer. Symptomene er relativt ukarakteristiske og vil omfatte feber, redusert allmenntilstand og meget sterke, bankende og dype smerter i kjeven. Intraoralt kan fistler og mobile og ømme tenner forekomme. Ekstraoralt vil det ofte være trismus og hevelse. Hevelsen er initialt diffust ødematøs, men senere kan den bli fastere, blant annet som følge av subperiostal benpåleiring. Sensibilitetsutfall eller parestesi i underleppen gir styrket mistanke om osteomyelitt. Røntgenologiske benforandringer (f.eks. på OPG) vil opptre først etter 10 – 14 dager og vises som områder med manglende trabekulært mønster og diffust avgrensede radiolucente områder. Infeksjonsparametrene (leukocyttall, senkningsreaksjon, CRP) vil være forhøyet. Det vil ofte være vanskelig å finne representativt materiale for bakteriologisk undersøkelse.
Pasienter med akutt osteomyelitt bør henvises som øyeblikkelig hjelp til sykehusavdeling. Det er viktig å komme i gang tidlig med effektiv intravenøs antimikrobiell behandling og eventuell kirurgisk drenasje. Dette for å unngå utvikling til kronisk osteomyelitt, som kan kreve langvarig og omfattende behandling.
Sialoadenitt (22)
Den mest vanlig forekommende spyttkjertelinfeksjon hos barn er parotitis epidemica (kusma). Bakteriell spyttkjertelinfeksjon forekommer sjelden. Glandula parotis er oftest involvert. Symptomene er akutt hevelse, smerter og sprengfølelse i kjertelområdet. Obstruksjon i kjertelens gangsystem kan føre til økt sprengfølelse ved måltider. Puss kan eksprimeres fra utførselsgang/munning, og bakterieprøve bør sikres til dyrkning. Allmenntilstanden er oftest moderat påvirket, og infeksjonsparametrene (leukocyttall, senkningsreaksjon, CRP) kan være noe forhøyet. Predisponerende faktorer kan være stendannelse i ductus, redusert spyttsekresjon f.eks. som følge av dehydrering (institusjonspasienter), strålebehandling eller medikamentbruk. En viktig patogen mekanisme ved bakteriell sialoadenitt er tilbakestrømming av bakterieholdig saliva inn i kjertelparenchymet.
Akutt sialoadenitt behandles vanligvis med systemisk antibiotika. Førstevalg vil være penicillin V. Tiltak for å stimulere spyttsekresjon kan være til hjelp i behandlingen og vil kunne forebygge residiv. Ved eksaserbasjon av kronisk sialoadenitt bør henvisning vurderes fordi ekstirpasjon av kjertelen kan bli nødvendig.
Nekrotiserende periodontale sykdommer og stomatitt
Sykdommene omfatter nekrotiserende ulcererende gingivitt (NUG) og nekrotiserende ulcererende periodontitt (NUP) og følgetilstanden nekrotiserende stomatitt (23). NUG erstatter de tidligere benevningene akutt nekrotiserende ulcererende gingivitt (ANUG) og akutt ulcererende gingivitt (AUG)(24).
NUG – Denne gingivittformen preges av bakteriell invasjon i affisert gingiva og akutte kliniske symptomer (Tabell 1). Rask klinisk effekt av plakkfjerning og/eller behandling med antibakterielle legemidler verifiserer bakterienes primære etiologiske betydning for utviklingen av AUG. Predisponerende faktorer er psykisk stress, tobakksrøking, underernæring, eksisterende gingivitt, traume og immundefekter, men NUG kan også forekomme uten påvist predisposisjon (18). Infeksjonen skyldes en kombinasjon av Fusobacterium nucleatum og orale spiroketer.
NUG utvikles raskt, og affisert gingiva er så smertefull ved berøring at pasienten oftest sterkt motsetter seg lommedybdemåling og mekanisk plakkfjerning uten lokalanestesi. Den akutte gingivitten starter med en eller flere ulcererte interdentalpapiller og gingival blødning. Ulcerasjonene kan spre seg til den marginale gingiva som nekrotiserer. Nekrose fører til tap av interdentalpapiller og at den festete gingiva blir redusert i bredde. Nekrotiserte papiller viser kraterliknende sår, som ubehandlet er dekket av en pseudomembran bestående av nekrotisk vev, fibrin, betennelsesceller og bakterier. Fjernes pseudomembranen, avdekkes en underliggende blødende sårflate. Forekomst av dårlig ånde (foetor ex ore), som kan variere fra moderat til påtrengende, feber, sykdomsfølelse og submandibulær, eventuelt også cervikal, lymfadenitt vil variere, avhengig av nekrosens omfang.
Ved sykdomsfølelse og feber startes systemisk antibiotikabehandling samtidig med mekanisk periodontalbehandling (25).
NUP – Dette er en infeksjon som i motsetning til NUG ikke bare gir gingival nekrose, men også nekrose av rothinne og interdentalt alveolarben (24). NUP starter med samme nekrose av interdentalpapiller som NUG, noe som kan tyde på at NUP er en fortsettelse av sistnevnte. Interdentale krater kjennetegner NUP og sees oftest hos hiv-infiserte, sterkt underernærte og immunsupprimerte, men er også beskrevet hos pasienter uten redusert infeksjonsforsvar (26).
Dersom pasienten har feber eller lokal periodontalbehandling ikke stanser sykdomsprogresjonen, er systemisk antibiotikabehandling indisert (25).
Herpetisk gingivo-stomatitt
Nesten alle personer infiseres med herpes simplex-virus type 1 (HSV-1) i småbarnsalderen. De få som unnslipper vil gjennomgå HSV-1-infeksjonen senere (Fig. 6). På langt nær alle HSV-1-infiserte småbarn får kliniske symptomer. Ved klinisk forløp med orale symptomer er gingiva og munnslimhinnen stekt erytematøs. Gingivaleksudasjon fører til at tennene får et fibrinlag langs gingivalranden. Feber forekommer relativt ofte. Tilstanden er selvbegrensende og går over av seg selv i løpet av 10 – 12 dager.
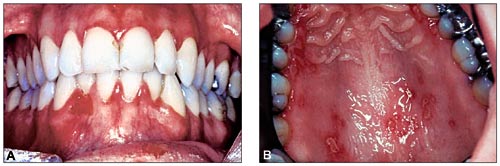
Fig. 6. Akutt gingivo-stomatitt hos voksen pasient. A: Gingivitt. B: Stomatitt.
Det er ingen spesiell behandling av tilstanden hos barn, men det anbefales at tenner og tannkjøtt holdes rene ved hjelp av bomullspinner («ørepinner») eller fuktet klut. Hos ellers friske voksne med feber og sykdomsfølelse er systemisk antiviral behandling sjelden indisert, men pasientens lege bør konsulteres i tvilstilfeller.
Sjeldne, men dramatiske kliniske infeksjonsbilder
Sinus cavernosus-trombose (20,27)
Tilstanden er livstruende, men sjelden resultat av bakteriespredning fra f.eks. odontogene infeksjoner i overkjeven. Infiserte venøse tromber transporteres via venepleksus i ansiktet/orbita til sinus cavernosus. Karakteristiske symptomer vil være markert øyelokksødem med misfarging(cyanose), eksoftalmus (protruderende øyeeple), lysstiv pupill og opphevete øyebevegelser. Pasienten vil være høyfebril med betydelig redusert allmenntilstand.
Ludwigs angina (4,20)
Infeksjonen er oppkalt etter den tyske kirurgen von Ludwig og er en flegmone bilateralt i munngulvet eller submandibulært. Infeksjonen kan true luftveiene pga. ødem i glottisområdet. Symptomer vil være hevelse i munngulvet, hevet og protrudert tunge, uttalte talevansker, dysfagi, trismus, dyspné, redusert allmenntilstand og feber.
Nekrotiserende fasciitt (4,20,28)
Dette er en sjelden, men potensielt livstruende infeksjon i subcutis og dype fascier. Høyvirulente gruppe A-streptokokker er ansvarlig for utvikling av hudnekrose pga. trombose i tilførende blodkar. Infeksjonen kan true luftveiene. Symptomer utvikles raskt, blant disse er erytem og ødemutvikling spesielt iøynefallende. Hudaffeksjonen kan være mer eller mindre velavgrenset, den er initialt ømfintlig, men blir senere anestetisk. Fargen utvikles til purpur og blåsvart.
English summary
Acute infections
This paper is a review on odontogenic and other acute oral infections in immunocompetent individuals. Acute infections often spread quickly and may have a dramatic course. The general practitioner should know which acute patients she/he is competent to treat and which should be referred to a specialist or hospitalized. The aim of the review is to contribute to the best decision-making in the patient’s interest as soon as possible. The review describes indications for microbial sampling, how samples from different types of infections are taken and how to understand the laboratory report. Diagnostic procedures, clinical signs and symptoms and screening of patients according to severity of infection are reviewed. Pulpitis and its possible local spread and distant dissemination, some more rare bacterial infections as well as acute herpetic gingivo-stomatitis are included. The rationales for systemic treatment with antimicrobial agents are indicated. This review seems to be the first report of its kind in a professional journal.
Forfattere ., Skaug N, Berge TI, Bårdsen A. Akutte infeksjoner. Nor Tannlegeforen Tid. 2005;115:30–7. doi:10.56373/2005-1-7
Litteratur
1. Moore WE, Moore LV. The bacteria of periodontal diseases. Periodontol 2000 1994; 5: 66 – 77.
2. Paster BJ, Boches SK, Galvin JL, Ericson RE, Lau CN, Levanos VA, et al. Bacterial diversity in human subgingival plaque. J Bacteriol 2001; 183: 3770 – 83.
3. Peterson LJ. Principles of management and prevention of odontogenic infections. Complex odontogenic infections. Odontogenic diseases of the maxillary sinus. In: Peterson LJ, Ellis E III, Hupp JR, Tucker MR, editors. Contemporary oral and maxillofacial surgery. St Louis: Mosby; 1998. p. 409 – 82.
4. Marciani RD. Odontogenic infections: Anatomic and microbiologic considerations. Clinical considerations in head and neck infections. In: Peterson LJ, Indersano AT, Marciani RD, Roser SM, editors. Principles of oral and maxillofacial surgery. Philadelphia: Lippincott; 1992. p. 149 – 200.
5. Heimdahl A, Nord CE. Treatment of orofacial infections of odontogenic origin. Scand J Infect Dis 1985; 46 (Suppl): 101 – 5.
6. Swift JQ, Gulden WS. Antibiotic therapy – managing odontogenic infections. Dent Clin North Am 2002; 46: 623 – 33.
7. Heimdahl A. Antibiotika i käkkirurgisk verksamhet. Nor Tannlegeforen Tid 2002; 112: 86 – 90.
8. Meurman JH, Lindqvist C. Livshotande odontogena infektioner. Nor Tannlegeforen Tid 2002; 112: 10 – 3.
9. Sunde PT, Olsen I, Debelian GJ, Tronstad L. Microbiota of periapical lesions refractory to endodontic therapy. J Endod 2002; 28: 304 – 10.
10. Byers MR, Taylor PE, Khayat BG, Kimberly CL. Effects of injury and inflammation on pulpal and periapical nerves. J Endod 1990; 16: 78 – 84.
11. Sundquist G. Bacteriological studies of necrotic dental pulps (thesis). Umeå: University of Umeå; 1976.
12 Möller ÅJR, Fabricius L, Dahlén G, Öhman AE, Heyden G. Influence on periapical tissues of indigenous oral bacteria and necrotic pulp tissue in monkeys. Scand J Dent Res 1981; 89: 475 – 84.
13. Sjögren U, Happonen RP, Kahnberg KE, Sundqvist G. Survival of Arachnia propionica in periapical tissue. Int Endod J 1988; 21: 277 – 82.
14. Sunde PT, Tronstad L, Eribe ER, Lind PO, Olsen I. Assessment of periradicular microbiota by DNA-DNA hybridization. Endod Dent Traumatol 2000; 16: 191 – 6.
15. Li X, Tronstad L, Olsen I. Brain abscesses caused by oral infection. Endod Dent Traumatol 1999; 15: 95 – 101.
16. Li X, Kolltveit KM, Tronstad L, Olsen I. Systemic diseases caused by oral infection. Clin Microbiol Rev 2000; 13: 547 – 58.
17. Happonen R-P. Periapical actinomycosis: A follow-up study of 16 surgically treated cases. Endod Dent Traumatol 1986; 2: 205 – 9.
18. Birn H, Bystedt H. Den akuta odontogena infektionen och dess spridningsvägar. I: Hjørting-Hansen E, Nordenram Å, Aas E, red. Oral kirurgi. Nordisk lærebok i tann- munn- og kjevekirurgi. 3. udg. København: Munksgaard; 1986. p. 121 – 32.
19. Berge TI. Incidence of infection requiring hospitalization associated with partially erupted third molars. Acta Odontol Scand 1996; 54: 309 – 13.
20. Cawson RA, Langdon JD, Eveson JW. Surgical pathology of the mouth and jaws. Oxford: Wright; 2000. p. 16 – 37.
21. Bernier S, Clermont S, Maranda G, Turcotte J-Y. Osteomyelitis of the jaws. J Can Dent Assoc 1995; 61: 441 – 8.
22. Seifert G, Miehlke A, Haubrich J, Chilla R, editors. Diseases of the salivary glands. Pathology – diagnosis – treatment – facial nerve surgery. Stuttgart: Thieme; 1986. p. 112 – 5.
23. Rowland RW. Necrotizing ulcerative gingivitis. Ann Periodontol 1999; 4: 65 – 73.
24. Consensus Report. Necrotizing periodontal diseases. Ann Periodontol 1999; 4: 78.
25. Corbet EF. Diagnosis of acute periodontal lesions. Periodontol 2000 2004; 34: 204 – 16.
26. Mobelli A, Samaranayake LP. Topical and systemic antibiotics in the management of periodontal diseases. Int Dent J 2004; 54: 3 – 14.
27. Ogundiya DA, Keith DA, Mirowski J. Cavernous sinus thrombosis and blindness as complications of an odontogenic infection: Report of a case and review of literature. J Oral Maxillofac Surg 1989; 47: 1317 – 21.
28. Ugboko VI, Assam E, Oginni FO, Amole AO. Necrotising fasciitis of the head and neck: a review of the literature. Niger J Med. 2001; 10: 6 – 10.
Søkeord for nettversjon: www.tannlegetidende.no: Antibiotika; Bakterie; Behandling; Diagnose; Infeksjon
Korrespondanse: Professor Nils Skaug, Laboratorium for oral mikrobiologi, Armauer Hansens hus, 5021 Bergen, Norge. E-post: nils.skaug@odont.uib.no
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Forfattere., Skaug N, Berge TI, Bårdsen A. Akutte infeksjoner. Nor Tannlegeforen Tid. 2005;115:30–7. doi:10.56373/2005-1-7