Framstilling av tenner ved hjelp av stamceller – en nyvinning for klinisk odontologi i framtiden?
Forfattere
1.amanuensis, dr.odont.
professor, dr.odont.
1.amanuensis, dr.odont.
Forskningsgruppen i kraniofacial utviklingsbiologi, Seksjon for anatomi og cellebiologi, Institutt for biomedisin, Det medisinske fakultet, Universitetet i Bergen
Det er fortsatt protetisk behandling, kjeveortopedi og implantater som er de aktuelle behandlingsalternativ der hvor det mangler tenner. Betydelig framgang i basal, odontologisk utviklingsbiologi og stamcelleforsk-ning har styrket mulighetene til å framstille tenner ved hjelp av biologiske metoder. Nylig har forskere greid å lage biologiske musetannanlegg i kultur ved hjelp av voksne stamceller fra mus. I tillegg har de greid å transplantere og dyrke embryonale musetannanlegg i voksne musekjever. Selv om det ennå er mange utfordringer som må overvinnes før biologisk designede humane tenner kan bli et tilbud i klinisk behandling, indikerer de nye framskritt i forskningen at tilbudet kan bli virkelighet en gang i framtiden.
Behandling relatert til erstatning av manglende tenner som følge av sykdom, traumer eller genetiske avvik har vært en utfordring for tannleger til alle tider, og det funksjonelle og estetiske behandlingsresultat blir nødvendigvis ikke alltid like optimalt. Behandlingsmetodene kan ha ugunstig virkning på resttannsettet som inngår i behandlingen, på tannens festeapparat og alveolært ben, og resultatene varer ikke alltid livet ut. Derfor vil tenner som framstilles fra pasientens egne celler kunne representere det best mulige behandlingsalternativ i framtiden.
Mulighet til å framstille tenner på et biologisk grunnlag er framkommet gjennom basalforskning i kraniofacial utvik-lingsbiologi og stamcellebiologi. Studier i tannens utvikling har pågått i mer enn 100 år og har gitt nødvendig, grunnleggende kunnskap om reguleringsmekanismer som styrer tannutviklingen. Denne informasjonen kombinert med ny kunnskap om stamceller har åpnet for realistiske muligheter til å lage biologiske tenner.
Hva vet vi om tannens utvikling?
Det er vist at to vevstyper er nødvendig for å utvikle en tann – dentalt epitel og mesenkymalt vev, dvs. udifferensiert embryonalt bindevev, som stammer fra embryonal neuroektoderm (neurallisten). Tannutviklingen styres av interaksjoner mellom disse to vevene (1, 2). Interaksjonene er gjensidige og kontinuerlige, og de kontrollerer alle stadier av tannens utvikling, slik som oppstart av utviklingen, utvikling av tannkronen, dentin og emaljeproduksjon og rotutvikling (1 – 5).
Molekylær utviklingsbiologi har vist at utveksling av de styrende signaler mellom de to vevene overføres ved hjelp av signalmolekyler som benytter forskjellige signalveier i et sammenhengende signalnettverk (6). Utviklingsprosessen med påfølgende utforming av dentalt epitel og kroneform, styres bl.a. av viktige «nøkkelmolekyler» slik som Fgfs (fibroblast growth factors), Bmps (Bone morphogenetic proteins), Wnts and Shh (sonic hedgehog). Mange av disse er spesifikt lokalisert til henholdsvis primære og sekundære emaljeorganknuter som regnes som signalsentra (7 – 10) lokalisert i selve emaljeorganet. Emaljeorgan-knutene er ansamlinger av epitelceller som en mener regulerer tannkronens form i de forskjellige stadier av utviklingen. I tillegg ser det ut til at avstand, høyde og lokalisasjon av de enkelte kusper i tannkronen styres gjennom et samarbeid mellom den sekundære emaljeorganknuten og et nylig påvist tredje (tertiært) signalsenter og et bukko-lingualt bånd av spesielle epiteliale celler mellom disse to emaljeorganknutene (10) (Fig. 1).
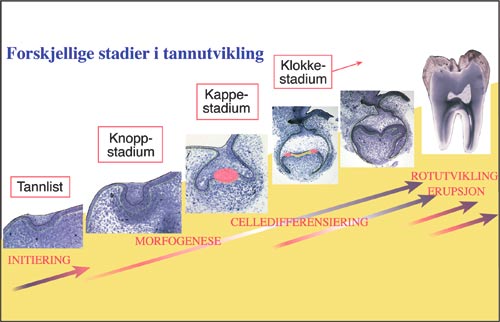
Fig. 1. Morfologiske stadier av tannutvikling. Tidlig dentalt epitel, knopp-, kappe- og klokkestadier, celledifferensiering og rotutvikling. Signalsentrene primær og sekundær emaljeorganknute i henholdsvis kappe- og i klokkestadiet, er merket med rød farge. Et bånd av signalceller som ligger mellom emaljeorganknutene er merket med gul farge.
Vi vet i dag at induksjon av tannutviklingen utgår fra tidlig, embryonalt dentalt epitel som instruerer og regulerer utviklingen av tannanlegget i de påfølgende tidlige faser (1, 2). Allerede i denne fase av tannkronens utvikling, i knoppstadiet, blir den odontogene informasjon, dvs. evne til å instruere vev av forskjellig opprinnelse til å danne tenner, overført til dentalt mesenkym, som senere blir til tannpulpa (1, 4) (Fig. 2A). Mesenkymet som nå har overtatt styringen (den odontogene informasjon), evner i fortsettelsen å instruere tannutviklingen selv om dette mesenkymet kombineres med embryonalt, ikke-dentalt epitel. Det er vel kjent at pulpaceller har potensial til å utdifferensiere nye odontoblaster som kan produsere reparasjonsdentin, når de originale odontoblaster skades og går tapt etter visse typer av pulpaskade (11). Til tross for dette ser det ut til at tannpulpa fra en voksen tann har mistet de instruktive evner til å utvikle nye tenner. I tillegg vil epitelceller som differensieres til emaljeproduserende celler forsvinne under tannframbruddet og ny emalje kan derfor ikke dannes senere.
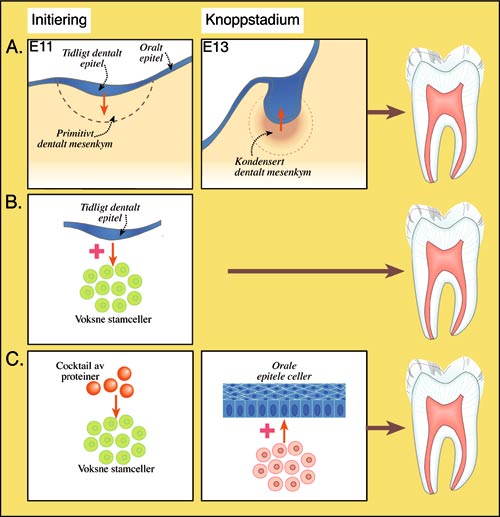
Fig. 2. A: Embryonalt, dentalt epitel (blå) har odontogen informasjon og initierer og styrer tannens tidlige utvikling (rød pil). Fram til knoppstadiet blir odontogen informasjon, dvs. evne til å instruere vev av forskjellig opprinnelse til å danne tenner, overført til dentalt mesenkym (oransje). Dette vevet styrer tannutviklingens sluttføring (rød pil). B og C: To mulige metoder for å framstille en tann hos mus ved bruk av stamceller. B: Embryonalt tannepitel induserer tannutviklingsprogram i stamceller fra benmarg hos voksen mus. Sammen danner disse vevene en tann. C: Eksperimentelt kan en prøve om det vil være mulig å få en cocktail av signalproteiner til å initiere tannutviklingsprogram i voksne stamceller, som deretter kan kombineres med orale epitele celler for å få utviklet en tann. Denne siste metoden kan muligens appliseres hos menneske
Stamceller og tannutvikling
Identifikasjon av stamceller har åpnet for nye muligheter til å lage kunstige vev og organer, slik som tenner, for å erstatte eller reparere syke, skadde eller tapte vev og organer som og kan mangle på grunn av genfeil. Stamceller er udifferensierte celler som har et omfattende potensial for selvfornyelse og kan differensieres til forskjellige celletyper. Embryonale stamceller kan differensiere til alle celletyper i kroppen. De finnes bl.a. i et befruktet egg og i den indre cellemasse i en blastocyst, som er et tidlig fosterstadium. I tillegg til de embryonale stamceller, er stamceller nylig påvist i voksne vev og organer slik som hud, benmarg, nervevev og i retina (12). Stamceller fra voksne synes å ha begrensede egenskaper mht. differensiering (13). De utgjør en liten minoritet av alle celler i et organ og er dessuten vanskelig å isolere. Disse såkalte adulte stamceller synes å representere reservene som skal sikre normal fornying og muliggjøre reparasjon av vevene i kroppen.
Kraniofacial basalforskning har nylig greid å vise at også en ferdig utviklet tann synes å inneholde stamceller. I den kontinuerlig voksende incisiv hos mus inneholder den cervikale fold epitale stamceller som differensieres til ameloblaster (14). Riktignok er epiteliale stamceller så langt ikke påvist i humane tenner. Malassez epitel, som utgår fra Hertwigske rotskjede og dentalt epitel, har evne til å proliferere og danne cyster (15). Malassez epitel kan være en mulig kilde for slike stamceller. I tannpulpa derimot, er det nylig påvist celler med stamcellekarakter både fra permanente tenner og melketenner (16, 17). Disse adulte stamcellene viste evne til å differensiere til forskjellige celletyper som nervelignende celler, fettceller og odontoblastlignende celler når de ble dyrket i kultur (16, 17). At pulpa har stamceller, kan forklare pulpavevets evne til å utdifferensiere nye odontoblaster under påvirkning av signalproteiner som Bmp2 (Bone morphogenetic protein 2) (18).
Det har lenge vært kjent at dentalt epitel i en tidlig fase har potensial til å danne tenner selv når de dyrkes i kombinasjon med bindevev av forskjellig opprinnelse. I en ny artikkel (19), har en gruppe forskere i England, som arbeider med kraniofacial utviklingsbiologi, vist den mest lovende framstilling av biologiske tenner til nå (19). Ved å kombinere embryonalt dentalt epitel med embryonale stamceller, neurale stamceller eller celler fra benmarg som inneholder stamceller hos voksne mus (se Fig. 2B), utviklet disse celle-vev-kombinasjonene seg til tannanlegg i nyrekapsel i mus. Resultatene viser at det er mulig å framstille tannanlegg med emalje og dentin omgitt av ben ved bruk av adulte stamceller i kultur. I tillegg viste dette at tannanlegg (i kappestadiet), som ble transplantert under slimhinnen i det tannløse området i musekjeven, kan videreutvikles i kjeven. Selv om eksperimentet ble avsluttet før røttene utviklet seg og tennene brøt fram i munnen, var tannen omgitt av bløtvev som muligens kunne videreutvikles til festeapparat.
Utfordringer ved å framstille tenner
Til tross for de oppløftende resultater hos mus som nå er publisert, er det ennå mange praktiske problemer som må finne en løsning før det kan være mulig å framstille humane tenner. De største utfordringer er, som nevnt, ikke tilgang på stamceller som kan utvikles til tannpulpa, men at stamceller trenger instruksjon for å utvikle seg til de ønskede celler og vev. Embryonalt, dentalt epitel og deretter mesenkym er de eneste vev som kan styre tannutviklingen. Fordi humant, embryonalt tannvev ikke kan brukes for biologisk framstilling av humane tenner, må andre løsninger søkes. I forsøkene som er beskrevet ovenfor, ble dette problemet løst ved å bruke dentalt epitel fra musefoster som «instruktør» (19). Kanskje, ved hjelp av en «coktail» av signalproteiner, kan pasientens egne stamceller instrueres til å starte et tannutviklingsprogram, og deretter kan stamcellene videreføre utviklingen sammen med oralt epitel for å få dannet en tann (Fig. 2C). På denne måten vil man kunne unngå etiske og praktiske problemer som ellers er forbundet med bruk av embryonale stamceller eller stamceller fra en annen person. I tillegg vil en omgå problemer med vevsavstøting, og en trenger ikke å ofre pulpavev fra pasientens egne, friske tenner for å få stamceller til biologisk tannframstilling.
Til tross for at en vet mye om signaler som behøves for å initiere tannutvikling, må det likevel understrekes at den spesifikke kombinasjonen av signalmolekyler som er nødvendig for å starte en utviklingsprosess av ulike tenner (incisiver, hjørnetenner, premolarer eller molarer) ikke er kjent. Studier på mus som bare har incisiver og molarer, har vist at proteiner, slik som Fgf8 (fibroblast growth factor 8) og Bmp4 (bone morphogenetic protein 4), som signaliserer fra tidlig, embryonalt oralt epitel til underliggende mesenkym, er med og bestemmer tanntype (20). Disse molekyler kan være mulige kandidater som kan brukes for å initiere et mesenkymalt, odontogent program i stamceller hos menneske. Med andre ord er det viktig å identifisere de kritiske signalmolekylene som er nødvendige for at utviklingen for en bestemt tanntype kan starte. Deretter går tannens utvikling videre av seg selv.
Selv om det er gjort flere framskritt når det gjelder biologisk framstilling av tenner hos mus, er tidsaspektet for utviklingen av en permanent tann hos menneske en betydelig begrensning og utfordring i seg selv. Hos mus tar det mindre enn én måned for en molar å utvikles og å bryte fram, mens hos menneske tar det mange år for å få en permanent tann. Framstilling av tenner kan komme til å bli et mulig behandlingstilbud for barn og unge som har agenesi på grunn av genetiske årsaker eller som mangler tenner av andre grunner. Biologisk produserte tannanlegg som implanteres i kjeven hos barn kan da få tid til å utvikle seg og kan bryte fram sammen med de øvrige tenner i tannsettet. For at en slik behandlingsmetode skal kunne erstatte implantater og protetisk behandling hos voksne, må det utvikles trygge metoder for å forkorte den biologiske utviklingstiden betydelig.
Kraniofacial utviklingsbiologi og stamcelleforsking har frambrakt viktige nyvinninger i retning av biologisk framstilling av tenner. Av spesiell betydning er funnene hos mus som viser at stamceller fra voksne vev kan inngå i framstilling av tenner, og at transplanterte embryonale tannanlegg kan utvikle seg videre under oral mukosa i en voksen kjeve. Dette kan kanskje åpne for muligheter til å lage biologiske tenner også hos menneske en gang i framtiden. Men det er fortsatt betydelige utfordringer som må overvinnes før et slikt tilbud kan bli til nytte i klinisk odontologi.
Takk
Gruppens forskningsvirksomhet er blitt støttet av Den norske kreftforening, Norges forskningsråd (141679/310); Meltzerfondet, Universitetet i Bergen og Sparebanken Vest, Bergen.
English summary
Luukko K, Kvinnsland IH, Kettunen P.
Engineering of biological teeth using stem cells – a possible therapeutic option in dental practice in the future?
Different kinds of treatment including prosthodontics, orthodontics and dental implants are currently used to replace missing or lost teeth in man. Recent advances in craniofacial developmental biology and stem cell research have opened up new possibilities to create biological teeth. Recently, researchers initiated mouse tooth formation using adult stem cells combined with the early embryonic dental epithelium. In addition, they showed that transplanted embryonic tooth germs developed in the adult mouse jaw. Although there are still many obvious challenges to be met before the bioengineered teeth become part of clinical practice, these results indicate that this may be possible some time in the future.
Referanser
1. Mina M, Kollar EJ. The induction of odontogenesis in non-dental mesenchyme combined with early murine mandibular arch epithelium. Arch Oral Biol 1987; 32: 123 – 7.
2. Lumsden AG. Spatial organization of the epithelium and the role of neural crest cells in the initiation of the mammalian tooth germ. Development 1988; 103 Suppl: 155 – 69.
3. Thesleff I, Lehtonen E, Saxen L. Basement membrane formation in transfilter tooth culture and its relation to odontoblast differentiation. Differentiation 1978; 10: 71 – 9.
4. Kollar EJ, Baird GR. Tissue interactions in embryonic mouse tooth germs. II. The inductive role of the dental papilla. J Embryol Exp Morphol 1970; 24: 173 – 86.
5. MacNeil RL, Thomas HF. Development of the murine periodontium. I. Role of basement membrane in formation of a mineralized tissue on the developing root dentin surface. J Periodontol 1993; 64: 95 – 102.
6. Thesleff I, Sharpe P. Signalling networks regulating dental development. Mech Dev 1997; 67: 111 – 23.
7. Ahrens K, Die Enwicklung der menschlichen Zähne. Wiesbaden : Arb. Anat. Inst. 1913; 48: 169 – 266.
8. Jernvall J, Kettunen P, Karavanova I, Martin LB, Thesleff I. Evidence for the role of the enamel knot as a control center in mammalian tooth cusp formation: non-dividing cells express growth stimulating Fgf-4 gene. Int J Dev Biol 1994; 38: 463 – 9.
9. Thesleff I, Jernvall J. The enamel knot: a putative signaling center regulating tooth development. Cold Spring Harb Symp Quant Biol 1997; 62: 257 – 67.
10. Luukko K, Løes S, Furmanek T, Fjeld K, Kvinnsland IH, Kettunen P. Identification of a novel putative signaling center, the tertiary enamel knot in the postnatal mouse molar tooth. Mech Dev 2003; 120: 270 – 6.
11. Schröder U. Effects of calcium hydroxide-containing pulp-capping agents on pulp cell migration, proliferation, and differentiation. J Dent Res 64 1985; Spec No: 541 – 8.
12. Fuchs E, Tumbar T, Guasch G. Socializing with the neighbors: stem cells and their niche. Cell 2004; 116: 769 – 78.
13. Alonso L, Fuchs E. Stem cells in the skin: waste not, Wnt not. Genes Dev 2003; 17: 1189 – 200.
14. Harada H, Kettunen P, Jung HS, Mustonen T, Wang YA, Thesleff I. Localization of putative stem cells in dental epithelium and their association with Notch and FGF signaling. J Cell Biol 1999; 147: 105 – 20.
15. Kvinnsland IH, Tadokoro O, Heyeraas KJ, Kozawa Y, Vandevska-Radunovic V. Neuroendocrine cells in Malassez epithelium and gingiva of the cat. Acta Odontol Scand 2000; 58: 107 – 12.
16. Gronthos S, Brahim J, Li W, Fisher LW, Cherman N, Boyde A, et al. Stem cell properties of human dental pulp stem cells. J Dent Res 2002; 81: 531 – 5.
17. Miura M, Gronthos S, Zhao M, Lu B, Fisher LW, Robey PG, Shi S. SHED: stem cells from human exfoliated deciduous teeth. Proc Natl Acad Sci USA 2003; 100: 5807 – 12.
18. Iohara K, Nakashima M, Ito M, Ishikawa M, Nakasima A, Akamine A. Dentin regeneration by dental pulp stem cell therapy with recombinant human bone morphogenetic protein 2. J Dent Res 2004; 83: 590 – 5.
19. Ohazama A, Modino SA, Miletich I, Sharpe PT. Stem-cell-based tissue engineering of murine teeth. J Dent Res 2004; 83: 518 – 22.
20. Tucker AS, Matthews KL, Sharpe PT. Transformation of tooth type induced by inhibition of BMP signaling. Science 1998; 282: 1136 – 8.
Søkeord for nettversjon: www.tannlegetidende.no: Biologi; Genteknologi; Molekylærbiologi
Adresse: Keijo Luukko, Seksjon for anatomi og cellebiologi, Institutt for biomedisin, Det medisinske fakultet, Jonas Lies vei 91, N-5009 BergenE-post: keijo.luukko@pki.uib.no