Diagnostikk av periodontale sykdommer
En forutsetning for å kunne stille en riktige periodontal diagnose og planlegge nødvendig behandling, er at vi foretar en grundig undersøkelse, både klinisk og røntgenologisk, og samler inn nødvendige data. Denne artikkelen redegjør for de vanligste periodontale diagnoser og differensialdiagnoser. Selv om gingivitt er utbredt i den voksne befolkning, er det bare et mindretall pasienter som opplever å få store problemer med alvorlig festetap rundt flere tenner. I dag kan vi ikke skjelne mellom en «uskyldig» gingivitt og en «farlig» gingivitt. Det er derfor viktig å kunne oppdage tegn til periodontal nedbrytning på et tidlig tidspunkt, eller kunne vurdere videre forløp etter behandling. Metodene vi benytter når vi foretar våre undersøkelser blir gjennomgått, og validiteten og den prediktive verdien av de registreringer vi gjør, vil bli diskutert.
Epidemiologiske undersøkelser fra mange deler av verden viser at periodontale sykdommer er utbredt i befolkningen. Hos de fleste vil skadene utvikle seg langsomt og ikke utgjøre store problemer. Men hos ca. 8 – 10 % vil en ubehandlet marginal periodontitt kunne føre til store ødeleggelser av tennenes feste og tap av tenner (1). Sykdommen utvikler seg vanligvis med meget svake eller ingen kliniske symptomer, og det kan være vanskelig for pasienten selv å registrere at noe er galt. Sykdommen blir derfor i mange tilfeller først oppdaget når skadene er omfattende og mulighetene for en vellykket behandling usikker. For den enkelte pasient er det viktig å få stilt en diagnose på et tidlig tidspunkt, og det er viktig at tannleger som regelmessig undersøker pasienter er spesielt oppmerksomme på tidlig tegn på periodontitt, slik at behandling kan igangsettes. Da vil behandlingen være enklere, rimeligere og forholdene ligge bedre til rette for en god prognose.
I tillegg til en grundig anamnese er en systematisk klinisk og røntgenologisk undersøkelse en forutsetning for å kunne diagnostisere periodontale sykdommer. De funn og data vi samler inn, gjør det mulig å stille en riktig diagnose, planlegge behandling og vurdere prognosen. Det er derfor av stor betydning at vi har de nødvendige kunnskaper og hjelpemidler for å kunne foreta de riktige undersøkelser og vurdere våre funn på en fornuftig måte.
Gingivitt og periodontitt betraktes som forskjellige sykdommer. Gingivitt må være tilstede for at periodontitt skal utvikle seg, men gingivitt trenger ikke nødvendigvis føre til periodontitt. Utviklingen av marginal periodontitt er heller ikke kontinuerlig, men foregår i utbrudd med påfølgende rolige perioder (2). Når en gingivitt er «farlig» og vil gå over å bli en periodontitt med ødeleggelse av støttevev, kan vi ikke gi klare svar på i dag. Vi kan heller ikke skille mellom en aktiv og en passiv periodontitt.
Gingivitt kan kureres uten varige skader på periodontiet. Marginal periodontitt, derimot, fører til permanent svekkelse av tennenes feste. Det er derfor viktig å kunne diagnostisere en begynnende periodontitt, slik at risikopasienter kan identifiseres og nødvendig behandling igangsettes før store ødeleggelser har skjedd. Siden vi ikke kan registrere om vi har en aktiv sykdom tilstede eller ikke, må vi isteden registrere symptomer og tegn på sykdom. Det er heller et spørsmål om sannsynlighet når vi stiller en diagnose. Den prediktive verdien av de registreringene vi gjør er derfor av stor betydning.
Gingivitt
Gingiva er den del av den orale mucosa som dekker alveolarprosessen og den cervikale del av tannen. Klinisk frisk gingiva er blek rosa, har ofte en stiplet overflate (som appelsinskall), fast konsistens, og den går over i den mørkere røde alveolære mucosa, adskilt ved mukogingivallinjen. Palatinalt har man ingen mukogingivallinje. Under friske forhold er gingiva i tett kontakt med emaljeoverflaten, og den ligger som en tett muffe rundt tannen. Man har derfor ingen lomme. I overgangen mellom emalje og gingiva dannes sulcus. Mot munnhulen er gingiva dekket med et flerlaget, keratinisert plateepitel med tapper (rete pegs) ned i bindevevet. Mot emaljeoverflaten er gingiva dekket med et tynnere, ikke-keratinisert epitel uten epiteltapper, som er festet til tannen med hemidesmosomer og danner kontaktepitelet (junctional epithelium). I approksimalrommet danner gingiva interdentalpapillen. Den delen av gingiva som ligger apikalt for emalje-sementgrensen kalles festet gingiva, mens fri gingiva dekker emaljen.
Når bakteriplaque samler seg på tannoverflaten, vil gingiva etter noen dager vise kliniske tegn på inflammasjon, gingivitt (Fig. 1). Den blir sterkere rødfarget, får en blank overflate, blir ødematøs og kan blø lett ved berøring. Fra sulcus får man utsivning av en klar væske, gingivalvæske. Hevelsen og fargeforandringen skyldes økt vaskularisering og akkumulering av væske i vevet. Samtidig vil lommeepitelet danne epiteltapper slik at overflaten mot bindevevet øker. Kronisk gingivitt i ett eller flere områder finner man hos en stor del av den voksne befolkning. Gingivitt fører vanligvis ikke til smerter. Økt blødningstendens er det pasientene vanligvis reagerer på. Gingivitt er en reversibel tilstand, dvs. den kan helbredes uten varige skader.
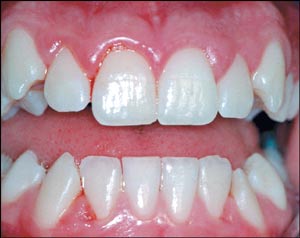
Fig. 1. Gingivitt hos en ung pasient. Gingiva er inflammert som følge av plaque på tennene.
Det er vist eksperimentelt at gingivitt skyldes ansamling av bakterielt plaque på tennene, og at man kan behandle gingivitt ved å fjerne plaque og opprettholde en god munnhygiene (3). Gingivitt finner man mest utbredt på steder hvor tannrengjøring er vanskelig, som for eksempel approksimalt. For å registrere gingivitt er det utviklet en rekke såkalte indeks. Gingival Index (4) (Tabell 1) er et eksempel på et slikt indeks. Her registreres forandringer i farge, konsistens, form og blødningstendens og hver tannflate gis en score fra 0 til 3. En enkel metode for å registre gingivitt er å presse en trekantet tanstikker in i hvert approksimalrom for deretter å registrere hvilke approksimalrom som viser blødning (5) (Fig. 2). Siden pasientene ofte er meget omhyggelige med å rengjøre tennene før et tannlegebesøk, vil ofte graden av gingivitt i munnen gi en bedre indikasjon på pasientens munnhygiene enn registrering av plaque på tennene.
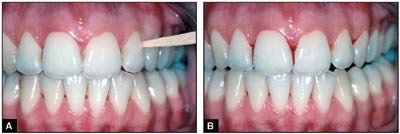
Fig. 2. En enkel metode for å registrere gingivitt: A: En tannstikker presses inn i approksimalrommene. B: Antall blødende papiller registreres, og på den måten kan man få et uttrykk for graden av inflammasjon.
Criteria for the Gingival Index System (GI) | |
0 = |
Normal gingiva. |
1 = |
Mild inflammation – slight change in color, slight oedema. No bleeding on probing. |
2 = |
Moderate inflammation – redness, oedema and glazing. Bleeding on probing. |
3 = |
Severe inflammation – marked redness and oedema. Ulceration. Tendency to spontaneous bleeding. |
Each of the four gingival areas of the tooth is given a score from 0 – 3; this is the GI for the area. The scores from the four areas of the tooth may be added and divided by four to give the GI for the tooth. The scores for individual teeth (incisors, premolars and molars) may be grouped to designate the GI for the group of teeth. Finally, by adding the indices for the teeth and dividing by the number of teeth examined, the GI for the individual is obtained. | |
Spesielle former for gingivitt
Nekrotiserende ulcerøs gingivitt (NUG) er en akutt form for gingivitt. Den starter med ulcerøse og nekrotiserte interdentalpapiller. Tilstanden brer seg etter hvert til den marginale gingiva. Gingiva er delvis dekket av en grågul hinne, som hovedsakelig består av fibrin, bakterier, nekrotisk vev, leukocytter og erytrocytter. Denne hinnen benevnes ofte pseudomembran, men den er egentlig ikke en membran. Den kan lett løsnes fra underlaget, og blottlegger da en ulcerøs gingiva som blør lett ved berøring. Spontanblødning er heller ikke uvanlig. Tilstanden er meget smertefull. Nekrotiserende ulcerøs gingivitt ledsages ofte av foetor ex ore, og pasientene klager ofte over metallsmak i munnen. Feber er ikke vanlig, men kan forekomme. På grunn av sterke smerter klarer ikke pasientene å opprettholde en tilstrekkelig munnhygiene, og man finner ofte store mengder plaque. NUG er en destruktiv tilstand, og de nekrotiserte papillene resulterer i groper interdentalt, og det oppstår negative papiller. Ubehandlet kan tilstanden føre til destruksjon av tennenes støttevev. Tilstanden går da over til å bli en nekrotiserende ulcerøs periodontitt (NUP), som er en alvorlig tilstand. I ekstreme tilfeller kan større eller mindre deler av munnhulen affiseres, og man har da en nekrotiserende ulcerøs stomatitt (NUS). NUG er en relativt sjeldent forekommende lidelse i de skandinaviske land, men den kan sees hos personer som er hiv-positive eller har andre immundefekter.
Under graviditet får man en økning i østrogen- og progesteronnivået i blodet. Dette fører til karforandringer med økt permeabilitet i gingivale kapillærer, noe som fører til den typiske graviditetsgingivitt, med rød og ødematøs gingiva, økt blødningstendens og økt utsivning av gingivalvæske. Denne tilstanden finner man spesielt i 2. og 3. trimester av graviditeten (6, 7). Dette er en kraftig respons på bakterielt plaque, og den kan behandles med en grundig depurasjon og en god munnhygiene. Økte nivåer av progesteron og estradiol favoriserer også vekst av Prevotella intermedia og Porphyromonas gingivalis i subgingivalt plaque. Av og til finner man hos gravide et pyogent granulom, som er en smertefri tumorlignende utvekst vanligvis med utspring i et interdentalrom. Det opptrer oftere i maxilla enn i mandibula, og forekommer hos 0,5 – 5,0 % av gravide. Pyogent granulom er ikke en ekte tumor, men er en inflammatorisk respons på et irritament, og det forsvinner som oftest etter nedkomsten. Graviditet kan også føre til hypermobilitet av tennene, noe som avtar etter nedkomst. Graviditetsgingivitt fører ikke til permanent festetap (7).
Bruk av prevensjonspiller kan føre til en gingivitt som ligner på graviditetsgingivitt. Som ved graviditetsgingivitt, får man en økt inflammasjonsrespons på plaque. Dagens prevensjonspiller har imidlertid en langt lavere konsentrasjon av hormoner enn tidligere, og den gingivale reaksjonen er derfor også mye mildere enn tidligere beskrevet. I forbindelse med hormonforandringer under puberteten er også en pubertetsgingivitt beskrevet, med økt inflammasjon og blødningstendens som reaksjon på bakterieplaque på tennene (8).
Gingival hyperplasi (Fig. 3) ser man som regel i forbindelse med bruk av enkelte medikamenter, antiepileptika (phenytoin), kalsiumkanalblokkere (dihydropyridinderivater, verapamil, diltiazem) og cyclosporin A. Disse medikamentene har det til felles at de hindrer opptak av kalsium i cellene, selv om de brukes i behandlingen av vidt forskjellige sykdomstilstander. De fører til de samme kliniske og histologiske forandringer i gingiva, nemlig en epitelial hyperplasi (akantose) med proliferasjon av gingivale fibroblaster og økt mengde kollagene fibre i bindevevet. Hyperplasiene begynner vanligvis i interdentalpapillene, og spesielt i fronten. De gingivale forandringene starter vanligvis 2 – 3 måneder etter at man har begynt å bruke medikamentene, og incidensen varierer fra 20 – 50 % (9). Det er hevdet at enkelte pasienter har subpopulasjoner av fibroblaster, som ved påvirkning av medikamentene fører til overproduksjon av kollagen, og at dette kan være en årsak til hyperplasien. Det er også mulig at aktivering av kollagenase nedsettes fordi fibroblastenes evne til å oppta folsyre hemmes slik at de ikke kan danne kollagenase-aktivator-enzym. Imidlertid er mye av patofysiologien fremdeles ukjent. Plaquekontroll kan i stor grad redusere omfanget av hyperplasiene (10), men det er usikkert om fravær av plaque fullstendig vil kunne hindre gingival hyperplasi.
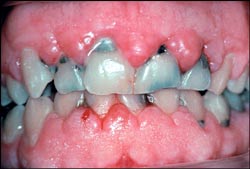
Fig. 3. Gingival hyperplasi hos en pasient som bruker phenytoin for behandling av epilepsi. Hyperplasiene starter gjerne i interdentalpapillene, og er mest vanlig i fronten.
Infeksjon med herpes simplex I-virus er en lidelse som ikke er helt uvanlig (11). Primærinfeksjonen kommer som regel tidlig i barneårene, men kan også opptre i voksen alder. Vanligvis er den helt uten symptomer, men hvis den manifesterer seg klinisk opptrer den gjerne som herpetisk gingivostomatitt, en smertefull lidelse som kan omfatte større deler av gingiva og munnslimhinnen for øvrig. Det dannes små vesikler som rupturerer og danner åpne sår. Tilstanden ledsages av feber og lymphadenopati. Den helbredes av seg selv etter 1 – 2 uker uten varige skader. Virus blir liggende latent i ganglion trigeminus, vanligvis i den maksillære og mandibulære delen, og kan reaktiveres av forskjellige faktorer som uv-lys, trauma, feber o.a. Residiverende herpesinfeksjon har ikke et så dramatisk forløp som primærinfeksjon. Den presenterer seg ofte som herpes labialis, men forekommer også relativt ofte som herpetisk gingivitt. Karakteristisk er små vesikler som raskt rupturerer og danner sår i festet gingiva. Som regel involveres ikke interdentalpapillene, i motsetning til hva man finner ved nekrotiserende ulcerøs gingivitt (NUG). Symptomene vil forsvinne uten permanente skader etter ca. 2 uker.
Marginal periodontitt
En ubehandlet kronisk gingivitt kan holde seg stabil i lang tid. Hos enkelte vil tilstanden etter hvert føre til at noe av tannens feste, kollagenfibre og alveolarben, går tapt som følge av inflammasjonen. Tilstanden går over til å bli en marginal periodontitt – som er en inflammasjon i gingiva med festetap (Fig. 4). Hva som gjør at en gingivitt går over til å bli en periodontitt vet man ikke, selv om mye forskning er gjort når det gjelder å forstå inflammasjonsprosessene.
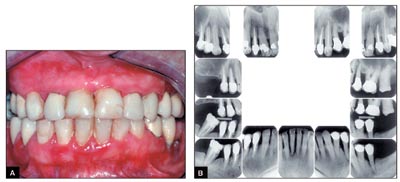
Fig. 4. Kronisk marginal periodontitt hos en 57 år gammel kvinne. Klinisk ser man store mengder plaque og tannsten, inflammert gingiva og tap av periodontalt feste (A). Røntgenbilder av samme pasient viser redusert benhøyde rundt de fleste tenner (B).
Lommedybde/festetap
Når epitelet vokser ned langs rotoverflaten, vil kollagenfibre og alveolarben brytes ned, og vi får utvikling av marginal periodontitt med festetap og lommedannelse. Denne nedbrytningen av festeapparatet kan registreres med en gradert sonde, lommedybdemåler. Den brukes til å måle dybden på lommene, såvel som til å måle festetap. Lommedybden er avstanden fra gingivalranden til lommens bunn (Fig. 5) (12). Ved planlegging av behandling er vi interessert i hvor dype lommene er, for å kunne avgjøre hvorvidt man kan fjerne belegg på rotoverflaten med eller uten kirurgi. Det er da fornuftig å registrere lommedybden. Gingivalranden kan ha forskjellig beliggenhet, og den kan forandre seg. Ved longitudinelle undersøkelser er derfor gingivalranden et usikkert referansepunkt. Måling av festetap betyr at man måler avstanden fra emalje-sementgrensen til lommens bunn (Fig. 5) (12). Det kan ofte i praksis være vanskelig å definere emalje-sementgrensen nøyaktig fordi den ligger subgingivalt, eller den er dekket av tannstein eller restaureringer. Når man skal følge forandringer i festetap over tid, kan det kan da være gunstig å benytte andre faste referansepunkter på tannen, f.eks. okklusalflaten eller incisalkanten.
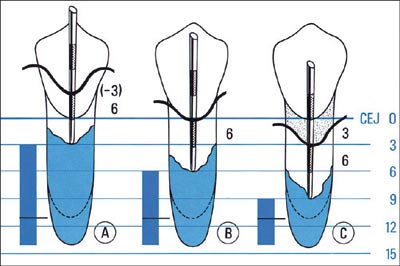
Fig. 5. Lommedybde måles fra gingivalranden til lommens bunn. Klinisk festetap måles fra emalje-sementgrensen til lommens bunn. Figuren viser tre forskjellige festetap (A: 3 mm, B: 6 mm, C: 9 mm), men samme lommedybde (6 mm). (Etter (12)).
På markedet finnes en rekke lommedybdemålere. De kan ha forskjellig fasong, ulike tykkelser og forskjellige intervaller mellom markering av dybde. Alt dette vil influere på våre registreringer. I tillegg vil plassering og trykk på sonden innvirke på resultatene.
Lommedybdemåleren skal plasseres mest mulig parallelt med tannens akse og føres langs rotoverflaten, slik at ikke sondespissen butter imot lommeepitlet med underregistrering som resultat. Plasseres den i en vinkel til tannen, vil dette kunne gi ulike måleresultater. Særlig approksimalt i premolar- og molarregionen kan det være vanskelig å foreta en korrekt registrering. Ved longitudinelle undersøkelser er det viktig at lommedybdemåleren plasseres på samme måte ved hver måling. Har tennene store restaureringer, kan det være vanskelig å finne et fast referansepunkt for målingene, slik at en eventuell progresjon av støttevevstap kan registreres.
Måling av lommedybde eller festetap foretas gjerne til nærmeste millimeter. I oppfølgingsstudier kan dette medføre falske negative registreringer, dvs. at tap av feste ikke blir registrert selv om festetap har skjedd. Dette fordi lommedybdemåleren benytter en relativt grov skala.
Når man bruker lommedybdemåler er det vanskelig å standardisere den kraften man benytter på sonden. Lommedybden vil variere med trykket på sonden. Ved registrering av festetapsforandringer over tid er det viktig at man kalibrerer måleteknikken. Det finnes derfor sonder som kan kontrollere for kraften man bruker. Det anbefales å benytte en relativt liten kraft, 0,25 til 0,30 N. Lang et al. (13) målte lommer på frisk gingiva med forskjellig kraft på sonden. Det viste seg at når kraften oversteg 0,25 N provoserte man blødning i frisk gingiva. Tendensen til blødning steg nesten lineært med økning i sondetrykket. Det betyr at ved for stor kraft på sonden traumatiseres epitelet, og sonden forsvinner inn i bindevevet.
Hvor ender spissen på lommedybdemåleren når vi måler lommedybden? Armitage et al. (14) førte standardiserte akryl-sonder ned i gingivallommene på hunder med henholdsvis frisk gingiva, gingivitt og periodontitt. Kraften på sonden var 0,3 N. Sondene ble fiksert, og det ble laget biopsier. Resultatene viste at ved gingivitt endte sondespissen omtrent ved emalje-sementgrensen, mens under friske forhold kom ofte ikke sonden så langt. Ved periodontitt penetrerte sonden epitelet og gikk ut i det inflammerte vevet og stanset først ved de periodontale fibrene eller alveolarbenet. I sykt vev kan målefeilen bli så stor som 2 mm. Dette betyr at inflammasjonsgraden i gingiva vil influere på målingene våre. Det betyr også at den reduksjonen i festetap man oppnår som følge av vellykket periodontittbehandling, for en stor del skyldes forandringer i inflammasjonsgraden som skissert ovenfor, og ikke en virkelig nydannelse av festet. Manuelle sonder vil på grunn av usikkerhet ved målingen bare kunne registrere forskjeller i vevstap på 2,5 – 3,0 mm eller mer (15), hvilket ytterligere vil gjøre målingene våre usikre.
Til lommedybdemåling benytter man vanligvis en butt sonde. Fasongen på sondespissen kan imidlertid variere både i form og tykkelse. Den kan være rektangulær, rund eller sfærisk, med en diameter fra 0,4 – 1,0 mm. Dette vil influere på målingene. Presset per flateenhet fra sonden mot vevet (N/cm2) vil være proporsjonal med den kraften vi bruker på sonden, men omvendt proporsjonal med kvadratet av arealet på sondespissen. En forandring av sondediameteren vil derfor ha en mye større innvirkning på målingen enn en tilsvarende forandring av kraften. Hvis kraften på sonden f.eks. økes fra 20 til 40 gram, vil presset økes med en faktor på 2. Hvis diameteren dobles fra 0,4 til 0,8 mm, vil derimot presset reduseres med en faktor på 4. Når målinger skal sammenlignes er det derfor viktig å ta hensyn både til kraften og diameteren på sondespissen. Som beskrevet tidligere, vil inflammasjon i vevet redusere motstanden mot lommedybdemåleren slik at sonden vil trenge dypere ned i vevet med samme kraft. Hvis man benytter en sonde med mindre diameter, vil presset på sondespissen øke og sonden vil penetrere mye dypere inn i det inflammerte vevet. Ved periodontittbehandling, enten man utfører scaling med rotplanering eller flap-operasjoner, blir resultatet ofte et langt kontaktepitel (junctional epithelium) med redusert lommedybde og redusert inflammasjon. Lommedybdemåleren benyttes derfor til å måle de terapeutiske forandringene, men ikke beliggenheten av de periodontale fibrene, siden denne vanligvis ikke forandres etter behandling. For å oppnå dette bør presset være ca. 50 N/cm2. Benyttes et press på 200 N/cm2 eller mer, vil sonden penetrere til basis av kontaktepitelet og ikke vise den eventuelt reduserte lommedybde. Med en kraft på lommedybdemåleren på ca. 20 gram (0,20 N) bør diameteren på lommedybdemåleren være 0,6 til 0,7 mm for at presset skal være 40 – 50 N/cm2. Med dette presset vil sondespissen være plassert i den koronale enden av kontaktepitelet og dermed kunne demonstrere at man har fått dannet et langt kontaktepitel. Ønsker man imidlertid å måle en eventuell regenerasjon av periodontale fibre anbefales en sonde med 0,4 mm diameter og 20 – 25 gram trykk (16).
Festetapsmålinger er ikke helt reproduserbare mellom forskjellige undersøkere eller hos samme undersøker, selv etter standardisering og kalibrering. For å overkomme disse vanskelighetene i kliniske studier har man foreslått å benytte den såkalte «toleransemetoden» for å bestemme terskelverdien for festetap basert på bruk av lommedybdemåler (15). Denne metoden benytter to på hverandre følgende målinger for hvert site. Standardavviket for målingene blir så utregnet, og terskelverdien for hvert individ anses å være 3 standardavvik av gjennomsnitts forskjell mellom de parvise målingene. I én undersøkelse (15) ble standardavviket beregnet å være 0,82 mm, noe som fører til en toleranse på individ og site nivå på 2,46 mm. Benytter man denne metoden, vil det si at enhver forandring i festetap under 3 mm er upålitelig. Det er derfor umulig å måle små forandringer i festetap ved å benytte manuelle sonder.
Ved longitudinelle undersøkelser kan det være ønskelig med mer nøyaktige målinger. De automatiske sondene er mye bedre enn de manuelle, både når det gjelder reproduserebare målinger og for å registrere små avvik. Sondetrykket kan standardiseres, det er enklere å registrere emalje-sementgrensen og målingene gjøres elektronisk og blir registrert direkte på en computer. På enkelte sonder er det også en innretning slik at man kan ha et fast referansepunkt. Med slike sonder kan man måle forandringer i festetap på 0,5 – 1,0 mm.
I kliniske forsøk hvor man f.eks. ønsker å evaluere effekten av behandling, oppgis ofte resultatet som gjennomsnittlig gevinst av feste. En slik gjennomsnittsverdi gir imidlertid ingen opplysninger om man samtidig har fått gevinst og/eller tap av feste i forskjellige områder. Store forandringer i festetap/gevinst kan ha forekommet uten at det gir utslag på gjennomsnittsverdien. Bare når man vurderer festetapsforandringene i hvert område for seg, kan man si om forbedringen skyldes økning av antall områder med gevinst av feste og ikke et lavere antall områder med festetap.
Man skal være oppmerksom på at økt lommedybde ikke alltid betyr festetap på grunn av marginal periodontitt. Fig. 6 viser en pasient hvor man oppdaget en dyp lomme mesialt for 13, som var en bropilar. Røntgenbildet viser en stor bendefekt i området, samt at tannen er rotfylt og har en metallstift i roten. Ved kirurgisk oppklapping kunne man se en langsgående fraktur av roten. Dette hadde da forårsaket det store festetapet.
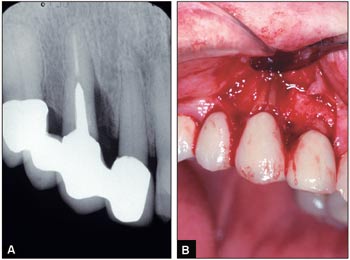
Fig. 6. A: Røntgenbilde av 13 viser stor bennedbrytning samt en kraftig stiftforankring i roten. B: Ved kirurgisk oppklapping ble det registrert en langsgående rotfraktur. Denne hadde forårsaket bennedbrytning og festetap.
Inflammasjon
I tillegg til registrering av festetap er inflammasjon et viktig funn ved marginal periodontitt. Registrering av inflammasjon ved gingivitt er tidligere beskrevet. I tillegg kan man ved periodontitt også registrere inflammasjon i dypet ved å sondere med en lommedybdemåler ned i lommene. Blødning fra lommen ved sondering (Bleeding on probing, BOP) vil være et tydelig tegn på betennelse.
Vil blødning ved sondering (BOP) også kunne fortelle noe om videre periodontal nedbrytning? I en periode på 30 mnd. ble en gruppe pasienter undersøkt med formål å finne ut dette (17). Pasientene ble undersøkt 4 ganger, og ved alle sites ble festetap og blødning registrert. Økning i festetap > 2 mm i løpet av 30 mnd. ble definert som progresjon av festetap. Den prediktive verdien av blødning ved henholdsvis 1 av 4 gange, 2 av 4 ganger, 3 av 4 ganger og 4 av 4 ganger var henholdsvis 3 %, 6 %, 14 % og 30 %. Bare 30 % av de områdene som blødde alle 4 gangene de ble undersøkt, viste festetap, og det ble konkludert med at blødning ved sondering var en usikker prediktor for aktiv periodontal nedbrytning. På den annen side fant man at blødning ved sondering ga en høy spesifisitet, dvs. det ble funnet få falske positiver. Fravær av blødning er altså en meget god diagnostisk metode når det gjelder å forutsi stabile forhold. Disse konklusjonene har også andre kommet frem til. Det synes som om den prediktive verdien for aktiv periodontitt vil være 20 – 40 % når man registrerer blødning. Tilstedeværelse av supragingivalt plaque har enda dårligere sammenheng med fremtidig festetap. Det er imidlertid en klar korrelasjon mellom dype lommer og videre nedbrytning (18). Grunne lommer er derimot en god prediktor for stabile forhold. Hos personer med dype lommer og festetap vil sjansen for progresjon av festetapet på personnivå være signifikant større hos personer med et stort antall blødende områder, sammenlignet med personer med lite blødning (19).
Gingivalvæske er et inflammatorisk eksudat som kommer ut fra lommen og samler seg ved gingivalranden som en klar væske. I forskningssammenheng kan oppsamling av gingivalvæske benyttes som et mål for gingival inflammasjon, men i en klinisk sammenheng har måling av gingivalvæske liten betydning.
Suppurasjon av puss fra lommen sees ikke så sjelden ved marginal periodontitt. Et annet navn på periodontitt, som ble mye benyttet tidligere, er pyorrhea alveolaris, som betyr puss fra alveolen. Når man presser forsiktig mot gingiva, kan man av og til se at det kommer en hvitlig til gul væske ut fra lommen. Det er puss, som i hovedsak består av gingivalvæske og en stor konsentrasjon av nøytrofile granulocytter. Dette er et tydelig tegn på inflammasjon. Av og til kan store ansamlinger av puss samle seg i lommen. Hvis drenasje gjennom lommen blir vanskelig, oppstår en periodontal abscess. Dette kan være meget smertefullt. Abscessen kan enten tømme seg gjennom lommen eller danne en fistel ut mot munnhulen og tømme seg der. Det kan ofte være vanskelig å vite om en abscess skyldes en apikal eller marginal periodontitt. Anamnesen vil kunne gi viktige opplysninger, og i tillegg vil sensibilitetstest av tannen og et røntgenbilde med kontrast (for eksempel en guttaperkapoint) gjennom fistelen være til stor hjelp for å stille riktig diagnose.
Furkasjonsinvolvment
På flerrotede tenner kan festetapet føre til at furkasjonene blir involvert. Vi får da furkasjonsinvolvment. Furkasjonsåpningen kan ofte være vanskelig å sondere med en rett sonde, og en kyrette kan med fordel benyttes (Fig. 7). Graden av furkasjonsinvolvment må registreres, da dette har betydning for behandling og prognose. En vanlig klassifisering av furkasjonsinvolvment er vist i Tabell 2 (20).
Grad I |
Horisontalt tap av støttevev < 1/3 av tannbredden. |
Grad II |
Horisontalt tap av støttevev > 1/3 av tannbredden. Furkasjonen er ikke gjennomgående. |
Grad III |
Furkasjonen er gjennomgående. |
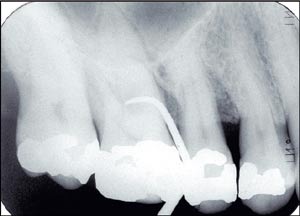
Fig. 7. Furkasjonsinvolvment kan være vanskelig å registrere med en rett sonde. I mange tilfeller vil en kyrette komme lettere til inn i furkasjonen, slik som vist på dette røntgenbildet av 16.
Tannvandring – mobilitet
Andre tegn på marginal periodontitt kan være tannvandring og økt mobilitet. Tannvandring i voksen alder skyldes ofte dype inflammerte lommer. Økt mobilitet finner man ved redusert tannfeste og inflammasjon, men også andre tilstander kan gi økt mobilitet (økt funksjon, apikal periodontitt etc.). En grundig undersøkelse er derfor nødvendig for å fastslå årsaken. Mobiliteten kan graderes som vist i Tabell 3 (20).
Grad I |
Liten til moderat økning i mobilitet i horisontal retning (0,2 – 1,0 mm). |
Grad II |
Sterk økning i mobilitet i horisontal retning (>1,0 mm), men ingen vertikal mobilitet. |
Grad III |
Markert mobilitet både horisontalt og vertikalt. |
Gingivale retraksjoner
Retraksjoner i gingiva (Fig. 8) forekommer spesielt på bukkalflatene, og kan skyldes kraftig mekanisk traume mot gingiva, for eksempel som følge av tannpuss. En inflammasjon som følge av plaque og tannsten kan også føre til retraksjoner. Ofte er det en følge av flere faktorer. Som regel kan man stoppe utviklingen av retraksjoner og til en viss grad redusere den ved å instituere en adekvat plaque-kontroll og modifisere pusseteknikken. Imidlertid vil man av og til ha behov for å behandle gingivale retraksjoner med operative teknikker. Hvorvidt man lykkes med behandlingen avhenger i stor grad av omfanget av retraksjonene. Det er derfor foreslått en gradering av gingivale retraksjoner (21) (Tabell 4). Ved grad I og II kan det være mulig med kirurgisk behandling å få fullstendig dekke av roten, ved grad III er det mulig bare å få delvis dekke av rotoverflaten, mens man ved grad IV har små sjanser for å lykkes.
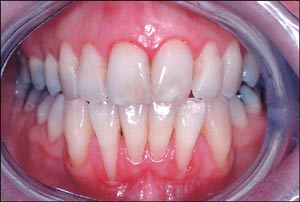
Fig. 8. Gingivale retraksjoner i underkjevens front hos en 29 år gammel kvinne.
Klasse I |
Marginale retraksjoner som ikke når til mukogingivalgrensen. Ikke tap av periodontalt feste approksimalt. |
Klasse II |
Marginale retraksjoner som går til eller forbi mukogingivalgrensen. Ikke tap av periodontalt feste approksimalt. |
Klasse III |
Marginale retraksjoner som går til eller forbi mukogingivalgrensen. Festetap approksimalt, eller malposisjon av tenner. |
Klasse IV |
Marginale retraksjoner som går til eller forbi mukogingivalgrensen. Stort festetap approksimalt, eller alvorlig malposisjon av tenner. |
Røntgendiagnostikk
Et annet viktig hjelpemiddel for periodontal diagnostikk er røntgenbildet. Røntgenbilder er først og fremst nyttige når det gjelder diagnostikk i approksimalområdene. Theilade (22) viste ved røntgenopptak på skallemateriale at røntgenbildet underestimerte det bukkale og linguale benet. Men nedbrytningen starter approksimalt, slik at for tidlig diagnostikk er røntgenbilder svært nyttige. Bentapet kan være horisontalt hvis nedbrytningen har vært jevn. Er bennedbrytningen i et område ujevn, vil vi få vertikal nedbrytning med benlommer.
Intraorale røntgenbilder foretrekkes på grunn av skarphet og detaljrikdom. Kvaliteten er avhengig av vinklingen av sentralstrålen og filmens plassering. Det er viktig å benytte long-cone teknikk med parallelle røntgenstråler mest mulig vinkelrett på roten og røntgenfilmen for å få minst mulig forstyrrelser på grunn av vinklingen (23). For å undersøke den marginale benrand kan bite-wing røntgenbilder med fordel også benyttes. Når det gjelder røntgenbilder, skal man være klar over at et tredimensjonalt objekt gjengis todimensjonalt. Dette resulterer i et komplekst bilde hvor forskjellige anatomiske strukturer projiseres ovenpå hverandre. Det kan derfor av og til være vanskelig å identifisere hva man ser.
Validiteten av de kriteriene en bruker for å fastslå bentap er av stor betydning. Det er mange faktorer som kan influere på vår diagnostikk. På røntgenbildene kan vi se tennenes relasjon til kjevebenet. Langs roten kan vi skimte periodontalspalten. Denne avgrenses mot kjevebenet av en kompakt benlamell, corticalis, eller lamina dura. Innenfor lamina dura har vi spongiøst ben. Den knivskarpe emalje-sementgrensen representerer midtpunktet bukko-lingualt av krone-rotgrensen. Utseendet kan imidlertid variere noe med strålevinkelen og morfologien i området.
Bredden på periodontalmembranen påvirkes av en rekke faktorer, som kraftig bruk av tennene, mangel på funksjon, eller kjeveortopedisk behandling. Det er vist at dersom kontrasten mellom periodontalspalten og det omgivende ben er stor, så vil også det subjektive inntrykket være at spalten er utvidet. Validiteten av å bruke utvidet periodontalspalte som kriterium på tidlig periodontitt er derfor svært tvilsom. Det røntgenologiske bildet av den marginale del av alveolarspalten varierer med den horisontale vinklingen av røntgenstrålene. En utvidelse her, som uttrykk for en patologisk prosess, er tvilsom. Hvis tennene er tippet, kan det se ut som om man har en benlomme.
Utseendet av den marginale del av lamina dura har vært diskutert. Det er imidlertid vist at tilstedeværelse eller fravær ikke har noen sammenheng verken med inflammasjon, blødning ved sondering eller tap av feste (24). Forandringer her skyldes heller variasjoner i kontrast, fremkalling, variasjoner i kV, eller eksponeringstid. Dette kan føre til at lamina dura blir borte i enkelte områder. En diagnose basert på lamina duras utseende er derfor usikker. I en longitudinell studie over 36 mnd. hvor man undersøkte relasjonen mellom lamina dura og periodontal sykdomsaktivitet, konkluderte man med at tilstedeværelsen av lamina dura viste positiv assosiasjon med stabile periodontale forhold, mens fravær av lamina dura ikke var noen god prediktor for fremtidig festetap (25).
På røntgenbilder kan man ikke registrere aktiv periodontal nedbrytning, bare resultatet av tidligere nedbrytning. Man skal også være oppmerksom på at man vanskelig registrerer forandringer på røntgenbildet før ca. 50 % av mineralinnholdet i benet er tapt. Da bennedbrytningen dessuten som regel starter approksimalt, vil man ofte kunne registrere festetap på et tidligere tidspunkt klinisk enn man kan gjøre røntgenologisk, fordi benet bukkalt og lingualt vil maskere nedbrytningen inne i approksimalrommet. Ved mistanke om benlommer kan det derfor være nyttig å plassere guttaperkapoints eller sølvstifter i lommen under røntgenopptak. På røntgenbildet vil disse kunne indikere lommens bunn.
Når det gjelder hva som er optimal avstand mellom emalje-sement grensen og kjevebenet hos unge mennesker, er det delte meninger. Oppfatningene varierer fra 1 mm til 3 mm. En undersøkelse foretatt på svenske skolebarn med perfekte gingivale forhold viste at den normale avstanden varierte noe mellom tanngruppene (26). I overkjeven var avstanden noe større enn i underkjeven, men på alle tennene lå verdien på < 2 mm. Man går derfor ut ifra at en avstand på 2 mm eller mindre mellom emalje-sementgrensen og alveolarbenet ligger innenfor det normale. Større avstand indikerer periodontal nedbrytning.
Vanlige røntgenbilder gir begrensede muligheter til å diagnostisere de aller tidligste forandringene i kjevebenet. Andre røntgenteknikker er derfor utviklet, f.eks. subtraksjonsradiografi. Dette er egentlig en gammel teknikk utviklet for å oppdage små forandringer i kjevebenet mellom to røntgenbilder av det samme området tatt på forskjellige tidspunkter. Hvis et positiv av et røntgenbilde legges over et tilsvarende negativ av samme område, vil resultatet bli grått. Dette fordi det ene bildet subtraherer det andre. Er bildene tatt til forskjellige tidspunkter, vil forandringer i kjevebenet fremstå som mørkere eller lysere områder, alt etter om man har fått nedbrytning eller påleiring av ben. I dag blir bildene digitalisert og analysen utført i en computer. Bendestruksjon eller benpåleiring blir da gjengitt som sorte eller hvite felter. Det finnes også computer-programmer som gjengir resorbsjon eller påleiring av ben i farger. Denne metoden er meget sensitiv for registrering av benforandringer. Så lite som 5 % tap av mineralinnholdet i benet kan registreres med mer enn 90 % nøyaktighet. Teknikken har vist seg verdifull når det gjelder evaluering av behandlingsmetoder og i longitudinelle studier.
I Buskerud fylke, Norge, gjennomførte vi for noen år siden en undersøkelse av periodontal bennedbrytning hos ungdom (27). Bite-wing røntgenbilder ble samlet inn av alle 15-åringer i fylket, i alt 2 409 personer. Festetap ble registrert dersom avstanden fra emalje-sement grensen oversteg 2 mm. Tydelige tegn på vertikal bennedbrytning ble registrert for seg, da dette kunne innebære en begynnende juvenil periodontitt. Tegn på marginalt festetap ble funnet hos ca. 11 % av ungdommene. Ca. 0,5 % viste tegn på vertikal nedbrytning. Tilsvarende undersøkelser fra andre steder viser at tidlig tegn på marginalt festetap ikke er helt uvanlig å finne hos unge pasienter (28, 29). Bentapet finnes hyppigst ved 6-årsmolarene i overkjeven. Med enkle midler kan man altså registrere risikopersoner på et tidlig tidspunkt, og gi dem nødvendig behandling og opplæring i egenomsorg (sekundær profylakse). Bite-wing røntgenbilder tas vanligvis allikevel ved den årlige tannundersøkelsen i den offentlige tannpleien, og i tillegg til kariesregistrering egner de seg utmerket til å registrere begynnende periodontal bennedbrytning (Fig. 9).
Mikrobiologisk diagnostikk
Nytten av bakterieprøver for periodontal diagnostikk er diskutabel, og slike prøver benyttes vanligvis ikke for å stille en periodontal diagnose. Det er også tvilsomt om marginal periodontitt er en spesifikk infeksjon, og i dag har den økologiske plaquehypotese erstattet den non-spesifikke og den spesifikke sykdomsmodell (30). Mikrobiologisk diagnose kan imidlertid være svært nyttig ved manglende respons på konvensjonell behandling, slik at man kan supplere en behandling med effektive kjemoterapeutika og antibiotika. Man kan da enten ta bakterieprøver for dyrking, eller benytte spesielle testmetoder som påviser bakterieprodukter eller deler av bakterienes DNA-molekyl. Flere bakterier har vært satt i sammenheng med aggressive former for periodontitt, spesielt Actinobacillus actinomycetemcomitans (Aa), Porphyromonas gingivalis (Pg), Prevotella intermedia (Pi), Bacteroides forsythus (Bf) og Campylobacter rectus (Cr). Selv om en lang rekke studier har vist en sammenheng mellom spesielle mikroorganismer og periodontal nedbrytning, er det bare et fåtall av disse som tilfredsstiller strenge krav til kvalitet. En nylig publisert systematisk gjennomgang av studier hvor man stilte strenge kvalitetskrav, konkluderte man med at tilstedeværelse eller ikke av Aa, Pg, Pi, Bf eller Cr ikke kan skille individer med en aggressiv form for periodontitt fra de med en kronisk stabil form for periodontitt (31). Derimot var diagnosen aggressiv periodontitt mer sannsynlig ved funn av Aa enn der hvor man ikke fant Aa. Spesielt finnes en spesiell leukotoksisk variant av Aa kun hos pasienter med aggressiv periodontitt. På den annen side vil man hos en stor del av pasienter med aggressiv periodontitt ikke finne denne spesielle varianten av Aa.
Spesielle diagnostiske tester
De metodene vi har i dag for å diagnostisere marginal periodontitt, forteller oss bare om tilstedeværelsen av inflammasjon og resultatet av tidligere sykdom, ikke om vi har en aktiv sykdom tilstede eller ikke. Det ville derfor være ønskelig å kunne si noe om sykdomsaktiviteten. I tillegg til bakterieprøver har man derfor blant annet sett på gingivalvæskens innhold av enzymer, inflammasjonsprodukter eller metabolske produkter. Et eksempel er aspartate aminotransferase, et enzym som finnes i alle celler og som frigjøres ved celledød. Økt innhold av dette enzymet kan fortelle om man har en nedbrytning tilstede eller ikke (32), og det er utviklet et enkelt testsystem til å bruke i klinikken. Andre enzymer man finner ved aktiv nedbrytning er beta-glucoronidase og neutrofil elastase. Det er nylig beskrevet et testsystem for å registrere collagenase-2 (matrix-metalloproteinase-8, MMP-8) i gingivalvæske (33). Det er vist at konsentrasjonen i gingivalvæsken av dette enzymet øker ved aktiv periodontal nedbrytning, i motsetning til hva man finner ved gingivitt og under friske forhold.
Tvillingstudier har vist at genetiske faktorer kan forklare en stor del av de forskjellene i sykdomsutvikling vi observerer hos våre pasienter (34). Det er individets respons på bakterieplaquet som vil variere. Cytokiner er fellesbetegnelsen på en rekke inflammasjonsmediatorer som er med på å styre de vevsreaksjonene man får ved inflammasjon. Opp til et visst nivå vil konsentrasjonen i vevet av disse mediatorene virke gunstig for verten. Økt produksjon av enkelte cytokiner kan føre til nedbrytning av periodontalt vev. Samtidig med dette får man også en økt konsentrasjon av cytokiner i gingivalvæsken. Interleukin-1, prostaglandin E2 og tumor nekrosefaktor er slike mediatorer, og det har vist seg at personer mottagelige for periodontal nedbrytning har hyperaktive monocytter som produserer store mengder av cytokiner når de påvirkes av bakterieplaque (35). Denne hyperreaksjonen kan være arvelig betinget, men kan også skyldes andre faktorer, som røyking og diabetes. Det er vist at personer med en spesiell genotype av interleukin-1 er spesielt mottagelig for å få marginal periodontitt (36), og det er utviklet metoder for enkelt å kunne undersøke dette i en praksissituasjon. Man må anta at polymorfisme av andre faktorer også kan forårsake at enkelte individer er spesielt mottagelige for å få sykdom.
Alle disse teknikkene må imidlertid sees på som et eventuelt supplement til hva vi tidligere har diskutert. Det er mulig at analyser av gingivalvæsken vil spille en større rolle for diagnosen og dermed også valg av behandling i fremtiden, men i dag er validiteten og den prediktive verdien av testene usikker.
Klassifisering av marginal periodontitt
Det har vært foreslått mange klassifiseringer av marginal periodontitt, og det avholdes jevnlig workshops for å gjennomgå og revidere klassifiseringen, sist i 1999 (37). Disse klassifiseringene baserer seg på et essensialistisk sykdomskonsept. Da marginal periodontitt er et resultat av mange faktorer som virker sammen, gjør dette at det er vanskelig å klassifisere periodontitt basert på etiologi (38). Dessuten vil ny viten kanskje også føre til at vårt syn på etiologien forandres, noe som igjen vil gjøre at klassifikasjonen må forandres. For å unngå mange av disse problemene har vi ved Det odontologiske fakultet i Oslo derfor nylig innført et nominalistisk diagnosesystem, forenklet og modifisert etter Van der Velden (39).
Diagnostisk system for marginal periodontitt
Definisjon av marginal periodontitt: Marginalt festetap kombinert med inflammasjon.
Systemet baserer seg på 3 hovedklassifiseringer: A: Utbredelse. B: Alvorlighetsgrad. C: Pasientens alder. I tillegg gis en beskrivelse av kliniske særtrekk hvis det er mulig (akutt, kronisk, hurtigforløpende, juvenil, prepubertal osv.). Eventuelle modererende tilstander medisinske tilstander angis.
Praktisk gjennomføring:
Klassifisering etter utbredelse:
1. Lokalisert (1 – 7 tenner)
2. Generalisert (>7 tenner)
Klassifisering etter alvorlighetsgrad:
1. Lett: Faller ikke inn under «Moderat» (2) eller «Alvorlig» (3).
2. Moderat: Minst 2 tenner med bentap >1/3, men <1/2 av rotlengden (rtg.) eller klinisk festetap >3 mm, men <5 mm.
3. Alvorlig: Minst 2 tenner med bentap >1/2 av rotlengden (rtg.) eller klinisk festetap > 5 mm.
Klassifisering etter alder (ved siste fødselsdag):
1. Ung: <= 30 år.
2. Voksen: > 30 år.
Dette vil gi 3 ledd som til sammen gir en diagnose, ofte med en tilleggsopplysning til å karakterisere tilfellet. Eksempler: GMV = generalisert, moderat, voksen (diabetiker). LAU = lokalisert, alvorlig, ung.
Sluttkommentarer
Det finnes ingen gullstandard når det gjelder diagnostikk av marginal periodontitt. Vi må derfor benytte oss av flere metoder samtidig. Kravene vi må sette til disse metodene vil variere med formålet. Basis for en kliniker vil være registrering av tradisjonelle tegn på inflammasjon, samt måling av lommedybder og festetap. I tillegg vil intraorale røntgenbilder være av nyttig diagnostisk verdi. Vi skal imidlertid være klar over at de tradisjonelle diagnostiske metodene ikke gir opplysninger om vi har en aktiv prosess tilstede eller ikke. Metodene tillater kun en retrospektiv diagnose av festetapet, og de kan ikke gi informasjon om fremtidig tap av feste. Det er mulig at vi i fremtiden vil komme frem til metoder som kan fortelle oss hvorvidt vi har en aktiv sykdomsprosess med nedbrytning av feste tilstede eller ikke. Mye interessant forskning gjøres i dag for å gi sikrere diagnoser av marginal periodontitt.
English summary
Diagnostics of periodontal diseases
Diagnosis of periodontal disease and planning of treatment require meticulous clinical and roentgenologic examination as well as proper data collection. In this article the most common periodontal diagnoses are described. Although gingivitis is commonly found in the adult population, only a few individuals experience advanced periodontal destruction affecting several teeth. Today we cannot distinguish a «dangerous» gingivitis from an «innocent» one. It is therefore of utmost importance to discover signs of destructive periodontal disease at an early stage, or to predict the risk for further destruction after treatment. The methods and parameters used for diagnosis of periodontal disease are explained, and the validity and predictive value of our registrations are discussed.
Hansen BF. Diagnostikk av periodontale sykdommer. Nor Tannlegeforen Tid. 2004;114:20–8. doi:10.56373/2004-1-6
Litteratur
1. Papapanou PN, Lindhe J. Epidemiology of periodontal diseases. In: Lindhe J, Karring K, Lang NP, editors. Clinical periodontology and implant dentistry. 4th ed., Oxford: Blackwell Munksgaard; 2003: p. 50 – 80.
2. Socransky SS, Haffajee AD, Goodson JM, Lindhe J. New concepts of destructive periodontal disease. J Clin Periodontol 1984; 11: 21 – 32.
3. Løe H, Theilade E, Jensen SB. Experimental gingivitis in man. J Periodontol 1965; 36: 177 – 87.
4. Løe H. The gingival index, the plaque index and the retention index systems. J Periodontol 1967; 38: 610 – 6.
5. Gjermo P, Moe S. Et forenklet system for registrering av gingivitt hos tenåringer. Erfaringer etter tre års bruk i Oppegård kommune. Nor Tannlegeforen Tid 1983; 93: 157 – 61.
6. Hugoson A. Gingivitis in pregnant women. A longitudinal clinical study. Odontologisk Revy 1971; 22: 65 – 84.
7. Tilakaratne A, Soory M, Ranasinghe AW, Corea SMX, Ekanayake SL, De Silva MA. Periodontal disease status during pregnancy and 3 months post-partum in a rural population of Sri-Lankan women. J Clin Periodontol 2000; 27: 787 – 92.
8. Mombelli M, Gusberti FA, van Oosten MAC, Lang NP. Gingival health and gingivitis development during puberty. A 4-year longitudinal study. J Clin Periodontol 1989; 16: 451 – 6.
9. Mariotti A. Dental plaque-induced gingival diseases. Ann Periodontol 1999; 4: 7 – 17.
10 Hall EE. Prevention and treatment considerations in patients with drug-induced gingival enlargements. Current Opinion. Periodontol 1997; 4: 59 – 63.
11. Skaare A. Herpes simplex-infeksjon (HSV-1) – virkningsmekanismer og kliniske aspekter. Nor Tannlegeforen Tid 1999; 109: 596 – 600.
12. Rateitsschak KH, Wolf H, Hassel T. Color atlas of dental medicine. vol. 1. Periodontology. 2nd ed. Stuttgart, New York: Thieme Verlag; 1989.
13. Lang NP, Nyman S, Senn C, Joss A. Bleeding on probing as it relates to probing force and gingival health. J Clin Periodontol 1991; 18: 257 – 61.
14. Armitage GC, Svanberg, GK Løe H. Microscopic evaluation of clinical measurements of tissue attachment levels. J Clin Periodontol 1977; 4: 173 – 90.
15. Haffajee AD, Socransky SS, Goodson JM. Comparison of different data analyses for detecting changes in attachment level. J Clin Periodontol 1983; 10: 298 – 310.
16. Garnick JJ, Silverstein L. Periodontal probing: Probe tip diameter. J Periodontol 2000; 71: 96 – 103.
17. Lang NP, Joss A, Orsanic T, Gusberti FA, Siegrist BE. Bleeding on probing. A predictor for the progression of periodontal disease? J Clin Periodontol 1986; 13: 590 – 6.
18. Claffey N, Egelberg J. Clinical indicators of probing attachment loss following initial periodontal treatment in advanced periodontitis patients. J Clin Periodontol 1995; 22: 690 – 6.
19. Claffey N, Nylund K, Kiger, R, Garrett S, Egelberg J. Diagnostic predictability of scores of plaque, bleeding suppuration and probing depth for probing attachment loss. 3 1/2 years of observation following initial periodontal therapy. J Clin Periodontol 1990; 17: 108 – 14.
20. Nyman S, Linhe J. Examination of patients with periodontal disease. In: Lindhe J, Karring T, Lang N, editors. Clinical periodontology and implant dentistry, 4ter ed. Oxford: Blackwell Munksgaard; 2003.
21. Miller PD. A classification of marginal tissue recession. Int J Periodontics and Rest Dent 1985; 2: 9 – 13.
22. Theilade J. An evaluation of the reliability of radiographs in the measurement of bone loss in periodontal disease. J Periodontol 1960; 31: 143 – 53.
23. Jeffcoat MK, Wang I-C, Reddy MS. Radiographic diagnosis in periodontics. Periodontol 2000 1995; 7: 54 – 68.
24. Greenstein G, Polson A, Iker H, Meitner S. Associations between crestal lamina dura and periodontal status. J Periodontol 1981; 52: 362 – 6.
25. Rams TE, Listgarten MA, Slots J. Utility of radiographic crestal lamina dura for predicting periodontitis disease-activity. J Clin Periodontol 1994; 21: 571 – 6.
26. Källestål C, Matsson L. Criteria for assessment of interproximal bone loss on bite-wing radiographs in adolescents. J Clin Periodontol 1989; 16: 300 – 4.
27. Hansen BF, Gjermo P, Bergwitz-Larsen KR. Periodontal bone loss in 15-year-old Norwegians. J Clin Periodontol 1984; 11: 125 – 31.
28. Aass AM, Albandar J, Aasenden R, Tollefsen T, Gjermo P. Variation in prevalence of radiographic alveolar bone loss in subgroups of 14-year-old schoolchildren in Oslo. J Clin Periodontol 1988; 15: 130 – 3.
29. Hansen BF, Gjermo P, Bellini HT, Ihanamaki K, Saxén L. Prevalence of radiographic alveolar bone loss in young adults. A multinational study. Int Dent J 1995; 45: 65 – 76.
30. Frandsen EVG, Larsen T, Dahlén G. Den parodontale infektion. In press Nor Tannlegeforen Tid 2004; 114: 30 – 5.
31. Mombelli A, Casagni F, Madianos PN. Can presence or absence of periodontal pathogens distinguish between subjects with chronic and aggressive periodontitis? A systematic review. J Clin Periodontol 2002; 29 suppl. 3: 10 – 21.
32. Chambers DA, Imrey PB, Cohen RS, Crawford JM, Alves MEAF, McSwiggin TA. A longitudinal study of aspartate aminotransferase in human gingival crevicular fluid. J Periodontal Res 1991; 26: 65 – 74.
33. Mäntylä P, Stenman M, Kinane DF, Tikanoja S, Luoto H, Salo T, et al. Gingival crevicular fluid collagenase-2 (MMP-8) test stick for chair-side monitoring of periodontitis. J Periodontal Res 2003; 38: 436 – 9.
34. Michalowics BS. Genetic and heritable risk factors in periodontal disease. J Periodontol 1994; 65: 479 – 88.
35. Champagne CME, Buchanan W, Reddy MS, Preisser JS, Beck JD, Offenbacher S. Potential for gingival crevice fluid measures as predictors of risk for periodontal diseases. Periodontol 2000 2003; 31: 167 – 80.
36. Kornman KS, Crane A, Wang H-Y, di Giovine FS, Newman MG, Pirk FW, et al.. The interleukin-1 genotype as a severity factor in adult periodontal disease. J Clin Periodontol 1997; 24: 72 – 7.
37. Armitage GC. Development of a classification system for periodontal diseases and conditions. Ann Periodontol 1999; 4: 1 – 6.
38. Baelum V, Lopez R. Defining and classifying periodontitis: need for a paradigm shift? Eur J Oral Sci 2003; 111: 2 – 6.
39. vander Velden U. Diagnosis of periodontitis (letter to the editor). J Clin Periodontol 2000; 27: 960 – 1.
Søkeord for nettversjon: www.tannlegetidende.no: Diagnose; Gingivitt; Periodontitt, marginal
Adresse: B. Frode Hansen, Avdeling for periodonti, IKO, postboks 1109 Blindern, N-0317 Oslo, Norge. E-post: frodeh@odont.uio.no
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Hansen BF. Diagnostikk av periodontale sykdommer. Nor Tannlegeforen Tid. 2004;114:20–8. doi:10.56373/2004-1-6