Utviklingen av periodontitt reguleres av sentralnervesystemet
Utviklingen av periodontitt ser ut til å skyldes en ubalanse mellom oppvekst av patogene mikroorganismer i plakket og immunsystemets motreaksjon. Det er nå dokumentert at reguleringen av immunsystemet, i likhet med mange andre komplekse kroppssystemer (slik som reguleringen av blodtrykk, kroppstemperatur og appetitt), er under overordnet kontroll av sentralnervesystemet. Det er nylig vist at dårlig tilpasset overordnet immunregulering, enten den er nedarvet eller et resultat av aldring og/eller miljøpåvirkning, kan påvirke mottakeligheten for en rekke sykdommer. Nyere forskning kan tyde på at dette også inkluderer periodontitt. Med bakgrunn i vitenskapelige studier og klinisk erfaring med systematisk plakkontroll presenteres en ny forklaring på hvordan periodontitt kan oppstå og utvikles. Denne forståelsen kan være med på å belyse hvordan aldring, arv og miljøfaktorer (slik som røyking, diabetes og sorg) øker mottakeligheten for periodontitt. I tillegg kan den gi ny forklaring på sammenhengen som er påvist mellom periodontitt og hjerte- og karsykdommer.
Inflammasjon i tannkjøttet, utløst av mikroorganismer i tannbelegg (plakk), fører hos de fleste personer over 35 – 40 år til at tennenes støttevev i større eller mindre grad blir ødelagt. Reduksjon av plakkmengden (plakkontroll) reduserer inflammasjonen i tannkjøttet og hemmer den periodontale vevsødeleggelsen. Sykdommen periodontitt er derfor blitt oppfattet som en enkel infeksjonssykdom fremkalt av plakkbakterier. Man har for eksempel antatt at dårlig plakkontroll ville føre til ødeleggelse av periodontale festefibre og alveolært beintap bare betennelsen ble stående lenge nok, og at god plakkontroll ville forhindre sykdomsutvikling. Klinisk erfaring med systematisk opplæring i plakkontroll og nyere vitenskapelige studier indikerer imidlertid at denne forståelsen kan skiftes ut med en ny forklaringsmodell.
Gingivitt fører ikke til periodontitt
Alvorlig periodontitt rammer kun en liten del (ca. 10 %) av enhver befolkning. Omtrent like mange er svært resistente og utvikler lite eller ingen periodontitt, selv med mye plakk og tannkjøttsbetennelse (gingivitt) gjennom et langt liv (1). Dette stemmer med en epidemiologisk studie vi nylig har utført. Der fant vi at det kun er 7 % i aldersgruppen 50 – 70 år og 12 % av 70- og 80-åringene som har alvorlig periodontitt (2). I denne studien ble periodontitt definert som alvorlig når det alveolære beintapet var større enn 2/3 av røttenes lengde på de fleste tenner. I den samme undersøkelsen fant vi at 38 % av 50-åringene, 32 % av 60-åringene, 12 % av 70-åringene og 6 % av 80-åringene ikke hadde periodontalt festetap.
Også unge mennesker kan plutselig begynne å utvikle alvorlig periodontitt. Hos personer med alvorlig og hurtig nedbrytende periodontitt (enten de er unge eller gamle) kan det i tillegg ofte være et stort klinisk problem å få kontroll over sykdomsutviklingen, selv etter adekvat profesjonell periodontalbehandling og opplæring av pasientene i god plakkontroll. Videre har røykere og personer som har tapt sin ektefelle ved dødsfall (enker og enkemenn), betydelig mer alvorlig periodontitt enn sammenlignbare grupper som ikke er enker/enkemenn (2). Dessuten fant vi i den samme studien at personer som takler eller mestrer negative opplevelser dårlig, har betydelig mer alvorlig periodontitt enn personer som takler slike opplevelser godt. Disse funnene tyder på at periodontitt kan ha svært sammensatte årsaker, og at sentralnervøse mekanismer kan spille en viktig rolle for sykdomsutviklingen.
Sentralnervesystemets betydning for periodontitt
I en eksperimentell dyremodell på rotter har vi nylig påvist at nedarvede immunregulerende mekanismer, som styres og reguleres av hjernen, spiller en sentral rolle for utvikling og progresjon av periodontitt (3 – 10). Vi fant også at én av disse mekanismene, kalt HPA-aksen, aktiveres ved periodontitt (4). HPA-aksen er en forkortelse for hypotalamus-hypofyse (pituitary)-binyre (adrenal)-aksen. Økt aktivering av HPA-aksen fører til økt utskillelse av glukokortikoid-hormoner fra binyrebarken. Disse hormonene har en rekke immunregulerende virkninger.
Måten HPA-aksen reagerer på, spiller en viktig rolle for periodontal sykdomsmottakelighet og resistens. Individer som reagerer på belastninger (enten de er immunologiske, psykiske eller fysiske) med svært kraftig utskillelse av glukokortikoid-hormoner, viser seg å være mottakelige for periodontitt, mens de som reagerer med svært lav utskillelse, er resistente (3 – 10). Denne sammenhengen har vi funnet når slike forskjeller i HPA-akserespons både var genetisk betinget, et resultat av aldring eller fremkalt av miljøpåvirkninger (3).
Det er interessant å merke seg at alle de kjente risikofaktorene for periodontitt er forbundet med HPA-aksehyperaktivitet (3). For eksempel har mange personer som har mistet sin ektefelle ved dødsfall, og som reagerer med såkalt melankolsk eller typisk depresjon, unormal høy utskillelse av glukokortikoid-hormoner ved belastning. Hos røykere binder nikotin seg til acetylkolin-reseptorer i hjernen og stimulerer HPA-aksen. Ved diabetes har insulinhormonet en antagonistisk virkning på glukokortikoid-hormoner, og dette fører til at HPA-aksen blir oppregulert (3, 11). Den økte forekomsten av periodontitt, som en ser hos enkelte røykere, diabetikere og hos personer i patologisk sorg eller depresjon, kan dermed til dels skyldes HPA-akse-hyperaktivitet. Skiller vi ut for mye glukokortikoidhormoner over lang tid, nedjusteres blant annet den delen av immunsystemet som er mest beskyttende mot oppvekst av patogene mikroorganismer (3).
Forskningen indikerer at den sentralnervøse reguleringsmekanismen kan spille en viktig rolle for sammenhengen mellom periodontitt og arv, alder og miljøfaktorer som tapsopplevelser, røyking og diabetes.
Mikrofloraens og immunsystemets betydning for periodontitt
En viktig oppdagelse i forståelsen av utviklingen av periodontitt er at den normale mikrofloraen i plakket, som vanligvis domineres av aerobe grampositive bakterier, forandres til en plakkflora som domineres av enkelte anaerobe gramnegative bakteriearter, mobile staver og spiroketer (12). Disse mikroorganismene (periodontopatogener) representerer en fare for organismen, fordi de kan ha evne til å trenge inn i tannkjøttet.
I motsetning til tidligere antatt, viser det seg nå at det ikke er selve bakteriene som skader tannkjøttet, men immunresponsen (13). For å forhindre infeksjon av patogene mikroorganismer, strømmer en rekke immunceller som tilhører det uspesifikke immunsystemet, til inflammasjonsområdet. Når disse immuncellene nedkjemper og kontrollerer oppvekst av inntrengerne, skiller de ut toksiske oksygenforbindelser (reaktive oksygen-metabolitter) og vevsødeleggende enzymer (slik som matrise-metallo-proteinaser), som i tillegg til å drepe mikroorganismene, også kan ødelegge det omliggende vevet (3). Særlig når denne vevsødeleggelsen ikke får anledning til å bli reparert, oppstår vedvarende skade.
Resorpsjonen av det underliggende alveolærbenet foregår derimot i god avstand fra betennelsesprosessen og ser ut til å være en sekundær prosess som kroppen setter i gang for å forhindre at benet blir infisert. Også benresorpsjonen er under kontroll av immunsystemet. Osteoklastene, består av klaser av spesialiserte hvite blodceller (i likhet med immuncellene) som slår seg sammen på benoverflater og danner osteoklaster når de får beskjed om det. Både signalstoffer (cytokiner) utskilt fra vevs- og immunceller, nervesignalstoffer (nevrotransmittere og nevropeptider) og hormoner deltar i reguleringen av osteoklastenes aktivitet. I tillegg kontrollerer immunsystemet oppvekst av patogene mikroorganismer i plakket og stimulerer vevsceller til å reparere vevsskader (3).
Tidligere trodde man at såkalt spesifikk antistoff- eller T-hjelper 2 (Th2)-mediert immunitet var mest beskyttende mot periodontitt. Jo mer antistoff, desto mer beskyttelse. I senere tid er man blitt klar over at såkalt spesifikk cellulær- eller T-hjelper 1 (Th1)-mediert immunitet er det mest beskyttende mot både oppvekst av intra- og ekstracellulære patogene mikroorganismer og reparasjon/tilheling av vevsskader fremkalt av betennelsesprosesser (3).
Denne forståelsen er blant annet bekreftet av eksperimentelle dyreforsøk. Rotter som reagerer med en for kraftig Th1-immunrespons og som har lett for å utvikle autoimmune sykdommer, er resistente mot periodontitt. På den annen side er rotter med svært lav Th1-mediert immunitet og med resistens mot disse autoimmune sykdommene, mottakelige for periodontitt (3 – 10). Dessuten har vi funnet at en vaksine som forskyver balansen mellom Th1- og Th2-mediert immunitet mot Th1-responser, reduserer utviklingen og progresjonen av periodontitt. Denne virkningen fant vi både når vaksinen ble gitt profylaktisk og når den ble gitt som behandling etter at sykdom var indusert eksperimentelt (14 – 16).
Fra å bli oppfattet som en enkel infeksjonssykdom fremkalt av plakkbakterier, der alle var like mottakelige og der dårlig munnhygiene var selve årsaken til periodontitt, blir sykdommen i dag sett på som en inflammasjonssykdom utløst av økt oppvekst av patogene mikroorganismer i plakket. Dessuten er det vist at oppveksten av disse patogene mikroorganismene øker ved aldring og miljøpåvirkninger, slik som røyking (17).
Et fundamentalt spørsmål ved forståelsen av sykdommen er hvordan disse faktorene kan påvirke oppveksten av patogene mikroorganismer og utviklingen av periodontitt.
Immun-til-hjerne-til-immun-regulering
Oppdagelsen av at reguleringen av immunsystemet er under overordnet kontroll av sentralnervesystemet er et viktig bidrag til å forstå disse komplekse sammenhengene (18 – 20). Forståelsen av disse immunregulerende mekanismene kan forklares slik:
I løpet av en immunrespons skiller vevs- og immunceller ut hormonlignende signalstoffer (slik som cytokiner) som informerer hjernen om kontakten med mikroorganismer. Hjernen informeres om inntrengerne både via nerver og blodbanen (Fig. 1). Dermed «vet» hjernen både hva immuncellene har oppdaget og hvor inflammasjonsprosessen foregår i kroppen. Blir denne innkomne informasjonen oppfattet som truende for organismen, aktiverer hjernen det autonome sympatiske nervesystemet og deler av nevroendokrin (hormon)- systemet, inklusive HPA-aksen. Denne aktiveringen regulerer eller finjusterer i neste omgang den lokale immunresponsen ved at det skilles ut nervesignalstoffer (nevrotransmittere og nevropeptider) fra nerveender og hormoner fra endokrine kjertler. Disse signalstoffene binder seg i neste omgang til immun- og vevsceller som er involvert i inflammasjonsprosessen (3). Glukokortikoider, som skilles ut fra binyrebarken når HPA-aksen aktiveres, binder seg for eksempel til spesifikke reseptorer i immuncellenes cytoplasma. Dette hormon-/reseptor-komplekset vandrer så inn i cellekjernen hvor det virker som en transkripsjonsfaktor (21). Det vil si at det regulerer avlesningen av gener som koder for forskjellige celleprodukter. På denne måten er glukokortikoid-hormonene med på å regulere en rekke celleaktiviteter, slik som cytokin-produksjonen, programmert celledød (apoptose) og tilstrømning av immunceller til inflammasjonsområdet (3, 21). Hjernen er således med på å regulere og finjustere de lokale immunresponser, slik at de sykdomsutløsende mikroorganismene blir nedkjempet og nøytralisert med minst mulig skade på eget vev.
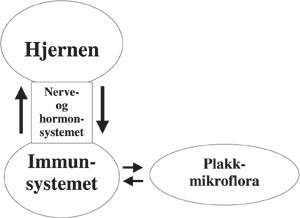
Fig. 1. Figuren illustrerer at hjernen og immunsystemet «snakker» sammen via nerve- og hormonsystemet, og at utfallet av denne toveiskommunikasjonen kan spille en viktig rolle for oppvekst av patogene mikroorganismer i tannplakket.. Økt oppvekst av patogene mikoorganismer kan utløse periodontitt. I en rottemodell er det nylig vist at forskjeller i et av de overordnede immunregulerende kontrollsystemene, kalt HPA-aksen, kan ha stor betydning for mottakeligheten for sykdommen. Denne sammenhengen ble påvist enten forskjellene i HPA-akserespons var nedarvede eller skyldes aldring og/eller miljøpåvirkninger.
Forandring av hjernens signalstoffer påvirker utviklingen av periodontitt
Denne forståelsen av at hjernen kan spille en viktig rolle for periodontitt er nå bekreftet av eksperimentelle studier, som viser at kjemiske stoffer som forandrer signalstoff (nevrotransmitter)-utskillelsen i hjernen også forandrer immunreaksjonene mot patogene mikroorganismer og mottagligheten for sykdommen (3).
For eksempel har vi funnet at injeksjon av hjernecellesignalstoffet glutamat til nyfødte rotter forandrer mottakeligheten for periodontitt (8). Også kirurgisk skade på hjernestrukturen kalt hippokampus (en eksperimentell metode som blir brukt i lærings- og hukommelsesstudier) viser seg å påvirke utviklingen og progresjonen av periodontitt i dyremodellen (9). I nylig utførte studier, som ennå ikke er publisert, har vi dessuten funnet at det trisykliske antidepressive medikamentet imipramin reduserer HPA-akseresponsen, forandrer immunresponser til gramnegative bakterier og reduserer mottakeligheten for periodontitt. Det viser seg også at det narkotiske stoffet Ecstasy og en antagonist til reseptorene som binder hjernesignalstoffet glutamat (MK-801) øker mottakeligheten for sykdommen. Både Ecstasy og MK-801 påvirker de overordnede immunregulerende mekanismene i hjernen og forandrer immunresponser overfor patogene mikroorganismer. Samlet indikerer disse forsøkene at forandringer av kontrollsystemer i hjernen kan forandre utskillingen av cytokiner fra immuncellene som respons på oppvekst av patogene bakterier og dermed mottakeligheten for periodontitt.
Infeksjonssykdommer og morsseparasjon kan påvirke mottakeligheten for periodontitt
Måten HPA-aksen reguleres på, er nedarvet, og dyrestudiene viser som nevnt at genetiske forskjeller i HPA-akserespons spiller en viktig rolle for mottakeligheten og progresjonen av periodontitt. Denne reguleringen kan imidlertid bli forandret av faktorer i miljøet. Særlig kan belastninger i tidlige levedager permanent forandre hvordan HPA-aksen vil reagere ved senere belastninger.
I eksperimentelle dyreforsøk har vi for eksempel funnet at sykdom, fremkalt av lipopolysakkarider (LPS) fra cellemembranen til gramnegative bakterier like etter fødselen, kan forandre HPA-akseresponsen og immunreaksjoner rettet mot patogene mikroorganismer permanent når dyrene ble voksne (10). Dessuten ble disse dyrene betydelig mer mottakelige for periodontitt. I tillegg fant vi ved hjelp av psykologiske belastningstester at dyrene også fikk permanent forandret atferd, slik som forandret angstatferd når de ble utsatt for nye og farlige situasjoner.
Også psykologisk belastning kan forandre HPA-akseresponsen permanent (23, 24). Vi har for eksempel nylig funnet i dyremodellen at mottakeligheten for periodontitt både kan reduseres og økes ved å manipulere nyfødte rotter i forhold til moren (25). Ved å manipulere kontakten mellom rottemor og rottebarna eller lengden av separasjonen, kan HPA-akseresponsen bli permanent både opp- eller nedregulert. En slik morsseparasjonsfremkalt forandring i HPA-akse-responsmønsteret viste seg å påvirke både atferd, immunresponser, smerteopplevelse og sykdomsmottakelighet for resten av livet. I tillegg til periodontitt har vi vist at dette også inkluderte mottakelighet for eksperimentell autoimmun-encefalomyelitt som etterligner multippel sklerose hos mennesker (26).
Periodontitt og seiglivede myter
Forestillinger om hvordan sykdom oppstår og utvikles, er som oftest basert på den til enhver tid rådende kunnskap. Blir imidlertid gamle forestillinger gjentatt ofte, og over lang tid, kan de utvikle seg til sannheter som kan være vanskelige å avlive. En slik seiglivet myte kan være at periodontitt er en infeksjonssykdom fremkalt av plakkbakterier. Mye plakk skulle føre til periodontitt, mens lite plakk (dvs. god munnhygiene) skulle forhindre sykdommen.
Siden denne forestillingen ikke alltid stemte med kliniske observasjoner, begynte man å lete etter andre årsaker, og oppdaget at mikrofloraen i plakket gradvis ble forandret fra en «ufarlig» og uspesifikk bakterieflora hos personer med gingivitt til en mer spesifikk og «farlig» flora hos personer med alvorlig og raskt nedbrytende periodontitt (12). Denne oppdagelsen resulterte i en ny og langvarig debatt om periodontitt skyldes den normale eller en patogen plakkflora. Som et tilsynelatende kompromiss er det i den senere tid blitt hevdet at svak og moderat periodontitt skyldes infeksjon av den normale plakkfloraen, mens alvorlig periodontitt skyldes infeksjon av patogene plakkbakterier.
En annen mye brukt forklaringsmodell i forståelsen av periodontitt er at sykdommen har en såkalt «multifaktoriell årsakssammenheng». Det vil si at det er mange faktorer som kan forårsake sykdommen. På mange måter er dette en befriende forklaring. Det er for eksempel enkelt å forestille seg at sammenhengen mellom periodontitt og arv kan skyldes feil ved en gen. Det hører imidlertid med til sjeldenheten at én enkelt gen forårsaker en inflammasjonssykdom.
Det er også lett å forestille seg at sammenhengen mellom periodontitt og immunsystemet skyldes mangler eller feil ved immunsystemet, slik som utskillelsen av signalsubstanser (cytokiner) fra immunceller. Det er imidlertid nå godt dokumentert at det ikke er utilstrekkelige, men heller upassende eller dårlig tilpassede immunresponser som resulterer i sykdom (27). Dessuten er det vist at eksperimentell reduksjon i utskillelsen av et signalstoff fra immunceller automatisk fører til opp- og nedjusteringer av andre signalstoffer, slik at likevekten i kroppen (homeostasen) gjenopprettes. En enkel immuncelle, slik som en makrofag, kan skille ut flere hundre forskjellige signalsubstanser.
På samme måte er det lett å forestille seg at den påviste sammenhengen mellom periodontitt og hjerte- og karsykdommer kan skyldes plakkbakterier som har kommet over i blodbanen. Heller ikke denne forklaringen virker særlig sannsynlig når vet vi at mengden patogene mikroorganismer som kan vokse opp i tannplakket kun er en liten brøkdel av det som kan vokse opp på slimhinner i tarm og urinveier.
Dessuten blir dette svært enkle forklaringsmodeller som ikke i tilstrekkelig grad tar høyde for dynamikken i og mellom de svært sammensatte systemene som er involvert i inflammasjonsprosessen, slik som immunsystemet og sentralnervesystemet. Den nå veletablerte kunnskapen om at deler av hjernen virker som et overordnet reguleringsnettverk for immunresponser som er rettet mot oppvekst av patogene mikroorganismer og andre antigene utfordringer, kan representere et slikt viktig bidrag. Disse mekanismene, som viser store genetiske forskjeller, kan også forandres ved aldring og av miljøfaktorer som truer organismen.
Utvikling av periodontitt
Med bakgrunn i de omtalte dyreforsøkene, epidemiologiske studier på mennesker, kliniske observasjoner og erfaring fra tannlegepraksis settes det herved frem en ny forklaring eller modell om hvordan periodontitt kan oppstå:
Periodontitt kan være et resultat av de skader som immuncellene forårsaker når de angriper og nedkjemper patogene mikroorganismer som har fått anledning til å vokse opp i plakket på grunn av en dårlig tilpasset overordnet immunregulering. Slik uhensiktsmessig sentralnervøs immunregulering kan være nedarvet, forårsaket av aldring og/eller av enkelte miljøpåvirkninger, slik som røyking og andre narkotiske stoffer som påvirker nevrotransmitter-balansen i hjernen, insulinmangel og patologisk sorg.
Det kan således tenkes at det ikke er mikroorganismene som primært utløser eller er årsak til sykdommen, men det kan heller være det overordnede immunregulerende systemet som ikke virker optimalt. Når det spesifikke immunsystemet ikke greier å kontrollere oppveksten av patogene mikroorganismer i plakket, må det uspesifikke immunsystemet tre i kraft for å forhindre infeksjon. Blir denne uspesifikke immunresponsen stående på for lenge, kan frisetting av vevsødeleggende stoffer fra immuncellene ødelegge tennenes støttevev og resultere i periodontitt (3).
Sammenhengen mellom periodontitt og hjerte- og karsykdommer
Dårlig tilpasset immunregulering kan med andre ord resultere i sykdom. Denne kunnskapen er nå også kommet inn i forståelsen av utvikling av hjerte- og karsykdommer (28). Det er her interessant å merke seg at pasienter med hjerte- og karsykdommer, type-2-diabetes og hjerneslag viser HPA-aksehyperaktivitet (28). Som vi har vist i dyremodellen, øker HPA-aksehyperaktivitet mottakeligheten for periodontitt. I tillegg deler periodontitt og hjerte- og karsykdommer mange, kanskje de samme, risikofaktorer, slik som arv, aldring og miljøfaktorer som røyking og depresjon (3). Høyt fettinntak, som lenge har vært kjent for å øke risikoen for hjerte- og karsykdommer, stimulerer HPA-aksen (29). Det kan dermed tenkes at høyt fettinntak også kan øke risikoen for å utvikle periodontitt. Mye kan således tyde på at både periodontitt og hjerte- og karsykdommer er et resultat av en dårlig tilpasset overordnet immunregulering der blant annet HPA-aksen spiller en sentral rolle.
Kliniske konsekvenser
Vi vil trolig oppnå bedre resultater i behandlingen av alvorlig periodontitt om vi retter oppmerksomheten mer mot kjente risikofaktorer. For eksempel kan den periodontale helsen bedres mer effektivt ved å gi pasientene hjelp til å komme seg ut av en alvorlig depresjon, enn ved å tilby sofistikert periodontalbehandling. På samme måte kan røykere med alvorlig og hurtig nedbrytende periodontitt få bedre kontroll med sin sykdom om de får hjelp til å slutte å røyke, eller at diabetikere får god kontroll med sin insulinmangel.
Vår forskning på dyremodellen viste at infeksjonssykdom og morsseparasjon like etter fødselen hadde stor betydning for hvordan de overordnede immunregulerende systemene (inklusive HPA-aksen) ville reagere når dyrene blir voksne, og for periodontal sykdomsmottakelighet og resistens (10,25). Det er interessant å merke seg at mange personer med diagnosen atypisk depresjon, fibromyalgi, kronisk tretthetssyndrom og posttraumatisk stresslidelse viser lav HPA-akseaktivitet (30), som vi igjen har funnet er forbundet med resistens mot periodontitt. Personer med diagnosen melankolsk eller typisk depresjon viser, som tidligere nevnt, HPA-akse høy eller hyperaktivitet (3, 30), som igjen er forbundet med økt mottakelighet for sykdommen i dyremodellen. Dette kan indikere at traumatiske opplevelser, da særlig i tidlig barndom, både kan gjøre oss mer mottakelige og mer resistente mot periodontitt.
Denne kunnskapen og forståelsen av periodontitt vil utvilsomt kunne forandre måten vi kommer til å forebygge og behandle periodontitt på i fremtiden. Tiden det vil ta før denne kunnskapen og forståelsen vil få betydning for våre pasienter vil blant annet avhenge av hvor lang tid det vil ta før det tverrfaglige forskningsfeltet hjerne-nerve-hormon-immun-regulering blir en del av tannlegeutdanningen. Det er først når kunnskapen om samspillet mellom disse komplekse reguleringssystemene er blitt en integrert del av odontologien at man kan ha forhåpning om at gamle forestillinger og behandlingsmetoder kan bli erstattet av nye.
English summary
Periodontal disease development is regulated by the central nervous system
During the development and progression of periodontal disease dental plaques are increasingly colonised by pathogenic micoorganisms capable of invading the gingival tissue and subsequently infecting the entire organism. Most of the periodontal tissue destruction apparently is caused by components from immune cells belonging to the innate immune system, released when fighting and destroying these so-called periodontopathogens. Severe periodontal disease is associated with ageing, genetics and environmental factors, including smoking, insulin deficiency (diabetes), poorly developed coping strategies to negative life experiences (such as the loss of a spouse by death), and severe depression. The mechanism by which these factors may increase the colonisation by dental plaque pathogens and the subsequent immune-induced tissue destruction is, however, poorly understood.
Based on experimental studies in an animal model, epidemiological studies in humans, as well as observations and experiences from a dental practise with emphasis on systematic plaque control, the author here describes a novel mechanism by which periodontal disease risk factors may increase disease development and progression. In this model an inappropriate brain-neuroendocrine-immune regulation, notably the hypothalamic-pituitary-adrenal (HPA) axis, may play a significant role for the overgrowth of periodontopathogens and the subsequent immune-induced tissue destruction. This suggestion is based on data showing that all the known periodontal risk factors are associated with HPA axis hyper-reactivity, which again has been found in the animal model to be associated with increased periodontal disease susceptibility.
Breivik TJ. Utviklingen av periodontitt reguleres av sentralnervesystemet. Nor Tannlegeforen Tid. 2003;113:178–82. doi:10.56373/2003-04-4
Referanser
2. Hugoson A, Ljungquist B, Breivik T. The relationship of some negative events and psychological factors to periodontal disease in an adult Swedish population 50 – 80 years of age. J Clin Periodontol 2002; 29: 247 – 53.
3. Breivik T, Thrane PS. Psychoneuroimmune interactions in periodontal disease. In: Ader R, Felten DL, Cohen N, editors. Psychoneuroimmunlogy. 3rd ed. San Diego, CA: Academic Press; 2000. Vol. 2, chapter 63, p. 627 – 44.
4. Breivik T, Thrane PS, Gjermo P, von Hörsten S. Hypothalamic-pituitary-adrenal axis activation by experimental periodontal disease in rats. J Periodontal Res 2001; 36: 295 – 300.
5. Breivik T, Opstad PK, Gjermo P, Thrane P. Effects of hypothalamic-pituitary-adrenal axis reactivity on periodontal tissue destruction in rats. Eur J Oral Sci 2000; 108: 115 – 22.
6. Breivik T, Sluyter F, Hof M, Cools A. Differential susceptibility to periodontitis in genetically selected Wistar rat lines that differ in their behavioral and endocrinological response to stressors. Behav Genet 2000; 30: 123 – 30.
7. Breivik T, Thrane PS, Gjermo P, Opstad PK. Glucocorticoid receptor antagonist RU-486 treatment reduces periodontitis in Fischer 344 rats. J Periodontal Res 2000; 35: 285 – 90.
8. Breivik T, Thrane PS, Gjermo P, Fonnum F. Postnatal glutamate-induced central nervous system lesions alter periodontal disease susceptibility in adult Wistar rats. J Clin Periodontol 2001; 28: 904 – 09.
9. Breivik T, Thrane PS, Gjermo P, Cools A, Myhrer T. Hippocampal lesioning aggrevates experimental periodontitis in Wistar rats. J Periodontal Res 2002; 37: 360 – 65.
10. Breivik T, Stephan M, Brabant GE, Straub RH, Pabst R, von Hörsten S. Postnatal lipopolysaccharide-induced illness predisposes to periodontal disease in adulthood. Brain Behav Immunol 2002; 16: 421 – 38.
14. Breivik T, Rook GAW. Prevaccination with SRL172 (heat-killed Mycobacterium vaccae) inhibits experimental periodontal disease in Wistar rats. Clin Exp Immunol 2000; 120: 463 – 7.
15. Breivik T, Rook GAW. Treatment with SRL172 (heat killed Mycobacterium vaccae) inhibits progression of established experimental periodontal disease in Wistar rats. J Periodontal Res 2002; 37: 210 – 14.
16. Breivik T, Rook GAW. Oral treatment with SRP299 (heat killed Mycobacterium vaccae) inhibits periodontal disease in Wistar rats. J Clin Periodontol 2003, in press.
17. Haffajee AD, Socransky SS. Relationship of sigarette smoking to the subgingival microbiota. J Clin Periodontol 2001; 28: 377 – 88.
22. Breivik T, Thrane PS, Murison R, Gjermo P. Emotional stress effects on immunity, gingivitis and periodontitis. Eur J Oral Sci 1996; 104: 327 – 34.
24. Liu D, Diorio J, Tannenbaum B, Caldji C, Francis D, Freedman A, et al. Maternal care, hippocampal glucocorticoid receptors, and hypothalamic-pituitary-adrenal responses to stress. Science 1997; 277: 1659 – 62.
25. Sluyter F, Breivik T, Cools A. Manipulation in the maternal environment reverse genetically predisposed periodontitis in rats. Clin Diagn Lab Immunol 2002; 4: 931 – 32.
26. Stephan M, Straub RH, Breivik T, Pabst R, von Hörsten S. Postnatal maternal deprivation aggravates experimental autoimmune encephalomyelitis in adult Lewis rats: reversal by chronic imipramine treatment. Int J Devel Neuroscience 2002; 20: 125 – 32.
28. Rosmond R, Bjortorp P. The hypothalamic-pituitary-adrenal axis activity as a predictor of cardiovascular disease, type 2 diabetes and stroke. J Intern Med 2000; 247: 188 – 97.
29. Tannenbaum BM, Brindley DN, Tannenbaum GS, Dallman MF, McArthur MD, Meany MJ. High-fat feeding alters both basal and stress-induced hypothalamic-pituitary-adrenal activity in the rat. Am J Physiol 1997; 273: 168 – 77.
30. Ehlert U, Gaab J, Heinrichs M. Psychoendocrinological contributions to the etiology of depression, posttraumatic stress disorder, and stress-related body disorders: the role of the hypothalamus-pituitary-adrenal axis. Biol Psychol 2001; 57: 141 – 52.
Fullstendig referanseliste kan fås ved henvendelse til forfatter
Søkeord for nettversjon: www.tannlegetidende.no: Helse; Immunologi; Infeksjon; Livskvalitet; Periodontitt, marginal
Adresse: Skaregt. 3, 6002 Ålesund.
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Breivik TJ. Utviklingen av periodontitt reguleres av sentralnervesystemet. Nor Tannlegeforen Tid. 2003;113:178–82. doi:10.56373/2003-04-4